加味柴胡桂姜湯介導(dǎo)乳腺癌細胞黏附分子PSGL-1改善炎癥-黏附-轉(zhuǎn)移作用研究
王 淼,陳麗華,李文卉,何美辰,方春平,胡晨霞
(廣州中醫(yī)藥大學(xué)中藥學(xué)院,廣東 廣州 510006)
乳腺癌是全球女性癌癥死亡的主要原因,嚴重危害著女性的生命安全及身心健康[1]。三陰性乳腺癌(triple-negative breast cancer,TNBC)轉(zhuǎn)移性強,預(yù)后差,死亡風(fēng)險高,是乳腺癌研究領(lǐng)域長期未曾突破的難題[2],其傳統(tǒng)治療方法主要為手術(shù)治療、化療、放療等。然而,原發(fā)腫瘤經(jīng)手術(shù)或放、化療等治療數(shù)月甚至數(shù)年后,一些播散于體內(nèi)的微轉(zhuǎn)移腫瘤細胞,被重新“喚醒”引起復(fù)發(fā)和轉(zhuǎn)移。
最新研究發(fā)現(xiàn),體內(nèi)炎癥部位往往成為腫瘤轉(zhuǎn)移灶的好發(fā)部位,轉(zhuǎn)移器官炎癥與臨床休眠期后癌癥復(fù)發(fā)高風(fēng)險密切相關(guān)[3-4]。因此,探索炎癥信號影響轉(zhuǎn)移微環(huán)境誘導(dǎo)腫瘤復(fù)發(fā)機制,尋求阻斷“炎癥-癌轉(zhuǎn)移”靶向藥物,對預(yù)防和控制腫瘤復(fù)發(fā)轉(zhuǎn)移,提高患者生存率意義重大。
中醫(yī)認為乳腺癌多因患者氣郁體質(zhì),加之七情內(nèi)傷、肝郁化火、憂思傷脾,導(dǎo)致痰阻、氣滯、瘀血相互凝結(jié)阻于乳絡(luò),日久成核成巖形成癌毒[5]。加味柴胡桂姜湯(Jiawei Chaihu Guijiang decoction,CGGD)由《傷寒論》柴胡桂枝干姜湯化裁而來,方中主藥柴胡疏肝理氣,桂枝、干姜辛行溫通、溫化痰飲,黃芩、白花蛇舌草清解熱毒、濕毒,全蝎攻毒散結(jié),全方共奏行氣活血、化痰解毒之效[6]。臨床實踐證明,應(yīng)用該方在乳腺癌術(shù)后腫瘤康復(fù)綜合治療方面,對改善患者氣郁體質(zhì),抑制殘存腫瘤細胞,緩解臨床癥狀,預(yù)防腫瘤復(fù)發(fā)轉(zhuǎn)移方面起到顯著療效[7-8]。
近期研究發(fā)現(xiàn),一些在腫瘤細胞及中性粒細胞上高表達的黏蛋白能夠與選擇素相互作用參與癌癥發(fā)展,成為預(yù)防或減輕癌癥的治療靶點。P-選擇素糖蛋白配體-1(P-selectin glycoprotein ligand-1,PSGL-1)是由糖基轉(zhuǎn)移酶對支架蛋白的翻譯后修飾形成的聚糖結(jié)構(gòu),是L/P/E-3種選擇素的最佳配體,在中性粒細胞遷移過程中發(fā)揮重要作用[9]。我們前期研究發(fā)現(xiàn)黏附分子PSGL-1在高轉(zhuǎn)移乳腺癌中異常表達,提示炎癥微環(huán)境下募集的中性粒細胞表面L-selectin與其配體PSGL-1結(jié)合可能是炎癥誘導(dǎo)癌轉(zhuǎn)移的關(guān)鍵路徑。
本實驗選擇高轉(zhuǎn)移人乳腺癌MDA-MB-231細胞株,研究炎癥微環(huán)境下PSGL-1異常表達對乳腺癌細胞增殖、黏附、侵襲遷移能力的影響及CGGD是否能夠通過靶向調(diào)控PSGL-1干預(yù)乳腺癌上皮細胞-間充質(zhì)細胞轉(zhuǎn)化 (epithelial-mesenchymal transition, EMT)進程從而抑制細胞侵襲及遷移作用,為揭示中醫(yī)經(jīng)典方劑柴胡桂枝干姜湯針對乳腺癌“痰瘀結(jié)毒”核心病機重塑微環(huán)境防治腫瘤轉(zhuǎn)移綜合效應(yīng)提供實驗依據(jù)。
1 材料
1.1 細胞人源乳腺癌細胞MDA-MB-231細胞購自上海中喬新舟公司。
1.2 動物無特定病原體 (specific pathogen free ,SPF) 級SD大鼠,體質(zhì)量(200±15)g,購自廣州中醫(yī)藥大學(xué)實驗動物中心,許可證號SCXK(粵)2018-0034,飼養(yǎng)于廣州中醫(yī)藥大學(xué)中藥學(xué)院動物房的SPF級屏障環(huán)境內(nèi)。
1.3 藥物及試劑CGGD藥材:柴胡、桂枝、干姜、天花粉、黃芩、牡蠣、炙甘草、白花蛇舌草、全蝎(廣州杏園春藥房有限責(zé)任公司);脂多糖 (lipopolysaccharide, LPS)、順鉑、結(jié)晶紫粉末(美國Sigma公司);PSGL-1中和抗體(美國Bioxcell公司);青霉素鏈霉素溶液、0.25%胰蛋白酶-EDTA、DMEM培養(yǎng)基(美國Gibco公司);PAN南美胎牛血清(德國PAN-Biotech GmbH公司)、CCK-8檢測試劑盒(美國Glpbio公司);BCA試劑盒(杭州弗德生物科技公司)。
1.4 儀器二氧化碳培養(yǎng)箱(上海力申有限公司);超凈工作臺(蘇州凈化科技有限公司);酶標儀(美國PerkinElmer公司);倒置顯微鏡(Motic公司);立式壓力蒸汽滅菌鍋(上海申安公司);恒溫搖床(上海知楚儀器有限公司);化學(xué)發(fā)光儀(上海天能科技有限公司);冷凍高速離心機(上海天美服務(wù)平臺)。
2 方法
2.1 制備CGGD含藥血清按原方比例稱取CGGD藥材各組分,10倍質(zhì)量純水浸泡1 h,微沸回流,收集藥液并濃縮。大鼠隨機分2組,給藥組大鼠灌胃3 mL藥物濃縮液,2次/ d,連續(xù)給藥7 d;空白對照組灌胃等體積純水。給藥最后1 d大鼠提前禁食,戊巴比妥麻醉,分離主動脈采血,室溫靜置4 h,高速離心取上清,56 ℃水浴30 min,恢復(fù)至室溫后-80 ℃冰箱保存。
2.2 乳腺癌黏附分子PSGL-1異常表達分析使用癌癥基因組圖譜TCGA (http://cancergenome.nih.gov/)數(shù)據(jù)庫,對不同類型乳腺癌腫瘤組織PSGL-1表達進行分析,預(yù)測PSGL-1與腫瘤生長、轉(zhuǎn)移之間的關(guān)系。
2.3 實驗分組及藥物處理將MDA-MB-231細胞分組:Control組(含10%大鼠空白血清)、Cisplatin組(含2.5 mg·L-1Cisplatin+10%大鼠空白血清)、CGGD低劑量組(CGGD-L:7.5%大鼠空白血清+2.5%含藥血清)、CGGD中劑量組(CGGD-M:5%大鼠空白血清+5%含藥血清)、CGGD高劑量組(CGGD-H:10%含藥血清),分組給藥進行實驗,篩選含藥血清最佳給藥濃度。
2.4 細胞增殖及黏附能力檢測處于對數(shù)生長期的MDA-MB-231細胞接種于96孔板中,每孔5.0×103個細胞,置于培養(yǎng)箱中培養(yǎng)24 h后分組給藥,采用CCK-8法在450 nm檢測細胞吸光度,測定各組細胞活性。制備明膠溶液,均勻鋪于24孔板,洗滌備用。細胞給藥后重懸,計數(shù),按照2×105個/孔接種于鋪好明膠的24孔板中,培養(yǎng)2 h后移除培養(yǎng)基,洗滌,固定,透化,染色,倒置顯微鏡觀察并拍照,ImageJ軟件分析計數(shù)。
2.5 細胞遷移能力檢測將細胞接種于6孔板中,7×105個/孔,待細胞密度達80%~90%,槍頭垂直刮擦形成劃痕,PBS洗滌后于倒置顯微鏡下拍照記錄0、12、24 h劃痕的區(qū)域大小,Image J軟件分析劃痕面積,計算劃痕愈合率。劃痕愈合率=[(0 h劃痕面積-觀察時間點劃痕面積)/ 0 h劃痕面積]×100%。
2.6 檢測細胞侵襲能力將基質(zhì)膠稀釋后均勻鋪于Transwell小室,培養(yǎng)箱凝膠1 h,細胞分組給藥后重懸,計數(shù),按照2×104個/孔接種于Transwell上室,下室加入含30% FBS的完全培養(yǎng)基,48 h后移除培養(yǎng)基,棉簽擦去未侵襲細胞,洗滌,固定,透化,洗滌后染色,倒置顯微鏡觀察并拍照,Image J軟件分析計數(shù)。
2.7 檢測MDA-MB-231細胞黏附分子轉(zhuǎn)錄水平表達細胞分組給藥后提取總RNA,逆轉(zhuǎn)錄成cDNA,進行PCR擴增,通過熒光強度變化對PCR反應(yīng)進行實時監(jiān)測,BioRadCFX Manager軟件分析擴增曲線和圖譜。
2.8 檢測MDA-MB-231細胞黏附分子及EMT基因蛋白水平表達細胞分組給藥后提取蛋白,BCA法測量蛋白濃度,加樣,SDS-PAGE電泳分離轉(zhuǎn)移至PVDF膜后,5%脫脂牛奶封閉3~4 h,TBST清洗3次,一抗4 ℃孵育過夜,二抗室溫孵育1 h,化學(xué)發(fā)光凝膠成像系統(tǒng)曝光,Image J軟件分析目的條帶灰度值,觀察各組蛋白表達。
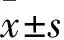
3 結(jié)果
3.1 CGGD含藥血清濃度篩選CCK-8實驗結(jié)果表明,CGGD處理細胞48 h和72 h后,藥物低、中、高劑量均能抑制MDA-MB-231細胞增殖,高劑量組最為明顯(P<0.05,Fig1A);細胞黏附實驗表明,CGGD-H組細胞黏附數(shù)較Control組降低(P<0.01,Fig1B-C);Transwell實驗及細胞劃痕實驗顯示,相比Control組,CGGD-H組細胞侵襲遷移數(shù)降低(P<0.01,Fig1D-G)。提示CGGD-H能夠抑制MDA-MB-231細胞增殖、黏附、侵襲及遷移能力。

Fig1 Effect of CGGD on cell biological behavior
3.2 乳腺癌黏附分子PSGL-1在乳腺癌組織及細胞中異常表達
3.2.1不同亞型乳腺癌腫瘤組織中PSGL-1表達 TCGA數(shù)據(jù)庫分析表明,不同亞型乳腺癌患者腫瘤組織PSGL-1表達均高于癌旁組織(P<0.01,Fig2A),原發(fā)性和轉(zhuǎn)移性乳腺癌腫瘤組織PSGL-1表達高于癌旁組織(P<0.01,Fig2B-C),差異均具有統(tǒng)計學(xué)意義。

Fig2 Abnormal expression of adhesion molecule PSGL-1 in breast cancer tissue and cells
3.2.2黏附分子PSGL-1在不同轉(zhuǎn)移能力乳腺癌細胞中的表達 qRT-PCR、Western blot實驗檢測中性粒細胞及不同轉(zhuǎn)移能力乳腺癌細胞中黏附分子PSGL-1的表達。結(jié)果顯示,高轉(zhuǎn)移乳腺癌MDA-MB-231及4T1細胞PSGL-1表達高于低轉(zhuǎn)移細胞MCF 7,差異具有統(tǒng)計學(xué)意義,(P<0.05,Fig2D-F)。
3.3 CGGD調(diào)控PSGL-1對乳腺癌細胞生物學(xué)行為的影響
3.3.1CGGD介導(dǎo)PSGL-1對細胞增殖及黏附能力的影響 收集MDA-MB-231對數(shù)生長期細胞,分為Control組(大鼠空白血清)、LPS模型組(LPS:大鼠空白血清+5 mg·L-1LPS)、PSGL-1中和抗體組(anti PSGL-1:大鼠空白血清+LPS+6 mg·L-1PSGL-1中和抗體)、CGGD高劑量組(CGGDH:10% CGGD+LPS)、聯(lián)合治療組(CGGDH+ anti PSGL-1)。實驗結(jié)果顯示,LPS刺激細胞后增殖能力無明顯變化(P>0.05),但是細胞黏附能力顯著增加(P<0.01,Fig3B-C);給藥24 h后,藥物組細胞增殖及黏附能力較LPS組明顯降低(P<0.01,Fig3A-C)。

Fig3 CGGDH regulated ability of PSGL-1 to affect cell biological behavior
3.3.2CGGD通過調(diào)控PSGL-1對細胞侵襲及遷移能力的影響 Transwell實驗結(jié)果表明,相比Control組,LPS組細胞侵襲數(shù)目增多;anti PSGL-1、CGGDH及聯(lián)合給藥組細胞侵襲數(shù)較LPS組減少;聯(lián)合給藥組細胞侵襲能力較單獨CGGDH組增強(P<0.01,Fig3D-E);細胞劃痕實驗表明,LPS刺激后細胞遷移能力較Control組增強;與LPS組比較,anti PSGL-1、CGGDH及聯(lián)合組細胞遷移能力降低;聯(lián)合給藥組遷移能力較單獨CGGDH組升高(P<0.01,Fig3F-G)。
3.4 CGGD對乳腺癌黏附分子mRNA水平表達的影響實驗結(jié)果顯示,LPS刺激后細胞PSGL-1、P-selectin、L-selectin在mRNA水平表達較Control組升高;anti PSGL-1、CGGDH組與LPS組比較,黏附分子表達降低;聯(lián)合治療組較CGGDH組表達升高(P<0.05,Fig4A-C)。

Fig4 Changes in transcription and protein expression of cell adhesion molecules and EMT related genes in breast cancer )
3.5 CGGD對乳腺癌黏附分子及EMT相關(guān)基蛋白水平表達的影響Western blot實驗結(jié)果顯示,LPS組細胞黏附分子及EMT相關(guān)基因表達較Control組升高(P<0.05);與LPS組相比,anti PSGL-1、CGGDH組蛋白表達降低(P<0.05,Fig4D-H)。表明LPS能夠促進腫瘤細胞PSGL-1表達及EMT進程,且能被CGGDH抑制,聯(lián)合給藥組能逆轉(zhuǎn)這種抑制作用(P<0.05),提示CGGDH的抑制作用可能是通過介導(dǎo)PSGL-1實現(xiàn)的。
4 討論
TNBC是最具有攻擊性的乳腺癌亞型,其特征是ER、PR和HER2的陰性表達,由于相關(guān)受體均不表達,無法從內(nèi)分泌治療及傳統(tǒng)抗HER-2靶向治療中獲益,復(fù)發(fā)轉(zhuǎn)移仍是TNBC術(shù)后患者的主要致死原因[10]。中醫(yī)藥在預(yù)防腫瘤復(fù)發(fā)轉(zhuǎn)移、延長生存期、改善生存質(zhì)量方面具有較強優(yōu)勢。
炎癥腫瘤微環(huán)境是由腫瘤細胞及周圍浸潤的炎細胞、基質(zhì)細胞、趨化因子、細胞因子等構(gòu)成。炎細胞一方面可以分泌大量細胞因子和毒性介質(zhì)以發(fā)揮抗腫瘤免疫效應(yīng),另一方面也可以誘導(dǎo)促炎因子、趨化因子以及蛋白酶的釋放,引起氧化損傷、DNA突變和微環(huán)境變化,影響組織代謝,促進細胞惡性轉(zhuǎn)化,在腫瘤的發(fā)生、存活、侵襲和轉(zhuǎn)移階段起著決定性作用[11]。研究發(fā)現(xiàn),腫瘤炎癥微環(huán)境中聚集大量炎癥因子、黏附分子等,為播散癌細胞提供適宜的轉(zhuǎn)移前生態(tài)位[12]。LPS是革蘭陰性菌外壁的成分,它由脂質(zhì)A、核心寡糖和O抗原構(gòu)成,可以通過促進免疫細胞浸潤,形成免疫抑制,誘導(dǎo)炎癥腫瘤微環(huán)境的形成,從而促進體內(nèi)外腫瘤細胞的增殖、遷移、侵襲和轉(zhuǎn)移過程[13]。本研究運用LPS作為炎癥誘導(dǎo)劑,刺激乳腺癌MDA-MB-231細胞形成腫瘤炎癥微環(huán)境,結(jié)果表明,LPS(5 mg·L-1)能夠增強乳腺癌細胞黏附、侵襲及遷移能力。
黏附分子(adhesion molecules ,AM)是介導(dǎo)細胞與細胞、細胞外基質(zhì)之間相互接觸和黏附的分子,它通過與其特異性配體結(jié)合,參與細胞辨識、活化、信號傳導(dǎo)、細胞增殖分化和移動且在維持正常組織結(jié)構(gòu)、胚胎發(fā)育和分化、炎癥與免疫應(yīng)答、凝血與血栓形成、傷口修復(fù)、以及腫瘤浸潤和轉(zhuǎn)移等多種生理、病理過程中發(fā)揮重要作用[14]。選擇素(selectin)是黏附分子家族中的一大類,分為L、P、E 3種。其中PSGL-1是3種選擇素的最佳配體,廣泛表達在中性粒細胞表面,介導(dǎo)中性粒細胞遷移[15]。最新臨床和實驗證據(jù)表明,一些轉(zhuǎn)移性較強的癌癥包括結(jié)腸癌、胃癌、胰腺癌和肺癌等,在癌癥進展期間,其糖基化蛋白質(zhì)上檢測到PSGL-1[16]。研究表明,腫瘤細胞轉(zhuǎn)移和傳播過程中,腫瘤細胞表達的PSGL-1可以與活化血小板P-selectin及中性粒細胞表面L-selectin結(jié)合,使腫瘤細胞、血小板、中性粒細胞組成獨特聚集體,提高腫瘤細胞對機體免疫細胞殺傷及血流剪切的抵抗力,并通過TGF-β和NF-κB途徑激活誘導(dǎo)EMT,增強腫瘤細胞聚集體的轉(zhuǎn)移性[17]。因此,阻斷選擇素及其特異性配體的結(jié)合可能是阻止癌癥轉(zhuǎn)移的重要環(huán)節(jié)。本實驗研究結(jié)果表明乳腺癌黏附分子PSGL-1在高轉(zhuǎn)移性乳腺癌組織及細胞中異常表達,且PSGL-1能夠促進乳腺癌細胞黏附、侵襲和遷移能力,提示PSGL-1與乳腺癌發(fā)展、侵襲及轉(zhuǎn)移密切相關(guān)。
腫瘤炎癥微環(huán)境大量炎性細胞浸潤、黏附及癌栓形成與乳腺癌“痰瘀結(jié)毒”核心病機具有高度相似性。臨床應(yīng)用CGGD針對乳腺癌患者,在改善氣郁體質(zhì)、緩解臨床癥狀、減輕放化療副作用及預(yù)防腫瘤復(fù)發(fā)轉(zhuǎn)移等術(shù)后康復(fù)治療方面療效較好[18]。前期我們研究發(fā)現(xiàn),CGGD能夠抑制小鼠乳腺癌移植瘤生長及肺轉(zhuǎn)移,可降低小鼠原發(fā)灶選擇素P-selectin及EMT標志物Vimentin、N-Cadherin表達。本實驗進一步探討其是否能夠通過介導(dǎo)選擇素配體改善腫瘤炎性微環(huán)境作用機制,結(jié)果表明CGGD能抑制由LPS誘導(dǎo)的乳腺癌細胞黏附、侵襲和遷移能力的增強,與PSGL-1中和抗體聯(lián)合治療組較CGGDH組抑制作用降低,提示PSGL-1可能是CGGD的靶點之一,其具體分子機制有待后續(xù)進一步應(yīng)用過表達PSGL-1穩(wěn)轉(zhuǎn)乳腺癌細胞株及小鼠動物模型開展研究。
- 中國藥理學(xué)通報的其它文章
- 重樓皂苷Ⅶ調(diào)控ROS誘導(dǎo)膀胱癌細胞凋亡和自噬
- 滋腎清熱利濕化瘀方治療多囊卵巢綜合征的網(wǎng)絡(luò)藥理學(xué)作用機制及實驗研究
- 基于TCGA數(shù)據(jù)挖掘及網(wǎng)絡(luò)藥理學(xué)探討鹵泛群治療膠質(zhì)母細胞瘤的潛在機制
- 基于TLR2/MyD88/NF-κB信號通路探討加味少腹逐瘀湯對寒濕瘀結(jié)證子宮內(nèi)膜異位癥痛經(jīng)小鼠腹腔炎癥微環(huán)境干預(yù)作用
- 黃連素下調(diào)NRAV和PI3K/AKT通路減輕RSV感染致HEp-2細胞的損傷
- 海馬G蛋白偶聯(lián)雌激素受體1參與癲癇調(diào)控的轉(zhuǎn)錄組學(xué)研究

