小麥根系構型及抗旱性研究進展
張余周,王一釗,高茹茜,劉逸凡
小麥根系構型及抗旱性研究進展
張余周,王一釗,高茹茜,劉逸凡
西北農林科技大學生命科學學院,陜西楊凌 712100
小麥是全球最重要的糧食作物之一,干旱是影響其生長發育最重要的非生物脅迫因子。根系作為作物獲取水分和養分的重要器官,直接決定了作物對土壤水分的利用效率。近年來,越來越多的研究表明,根系構型在植物干旱脅迫響應中發揮了重要功能。本文綜述了目前根系構型在調控小麥抗旱性方面的研究進展。首先概述了根向性生長,特別是根向重力性生長對植物根系結構的塑造作用,重點總結了目前挖掘到參與根系向重力性生長的相關基因及其分子調控機制,并闡述了根向性生長調控的根系構型是如何介導小麥對干旱脅迫的適應。除了根向性生長,根系的發育過程也參與了對植物根系構型的調控,并決定植物對干旱脅迫的適應能力,因此,本文進一步綜述了在干旱脅迫條件下小麥如何通過調控根系發育來改變根系形態,包括增加根長、調控側根數量和根毛密度等,來增強小麥對土壤水分的吸收和對干旱環境的適應;同時,系統總結了干旱脅迫條件下參與調控作物(尤其是小麥)根系發育的相關基因。此外,根系作為植物地下部分,其構型的解析一直是本領域研究難點,阻礙了對根系結構與植物耐旱性關系的進一步解析,因此,本文也歸納了目前可用于小麥根系二維結構和三維結構表型分析的技術。這些技術可測量和分析小麥根系的長度、密度、生長方向和形態等參數,為深入理解根系構型與小麥抗旱性關系提供技術支撐。最后,展望了改良根系結構在小麥抗旱育種中的應用前景,并對如何挖掘更多潛在的小麥根系構型調控基因,及解析相關基因的調控機理進行了討論。綜上所述,小麥根系結構與小麥抗旱性關系密切,隨著測序和分析技術的不斷發展,以及小麥根系結構調控機制研究的不斷深入,為未來培育抗旱小麥新品種提供了新的手段和策略。
小麥;根系結構;根系向性生長;根系發育;抗旱性;根系可視化
0 引言
小麥(L.)是我國最主要的糧食作物之一。在全球氣候變暖和水資源緊缺的背景下,干旱已成為制約植物農業生產最嚴重的自然災害類型之一。近年來,中國干旱受災面積約占全國自然災害影響面積的60%、占農作物播種面積的9.0%,因干旱缺水導致的作物減產已經超過其他非生物脅迫因素的總和,嚴重影響農業的可持續發展[1]。因此,探索植物對干旱脅迫的響應規律,以及改良作物對干旱脅迫的適應性一直是逆境生物學的研究熱點,相關研究可為保障全球和國家糧食安全提供重要的理論基礎。
陸生植物通常采用“開源節流”的策略來應對干旱脅迫的發生。長期以來,人們一直關注植物地上部分的“節流”策略,如在干旱條件下,植物葉片如何通過調節氣孔開閉來減緩蒸騰作用,從而減少水分流失來應對干旱脅迫的發生。相對于地上部分,植物“隱藏”的下半部分(即根系)如何幫助植物應對干旱脅迫發生的相關研究相對匱乏。根系作為植物吸收、固定和支持的重要器官,直接感受土壤環境中的水分、養分和機械阻力變化。作為“開源”策略最重要的組成部分,優良的根系構型(root system architecture,RSA)有助于植物從土壤中最大限度地獲取水分,并通過轉運輸送到地上部分,保證植物地上部分在干旱脅迫下正常生長[2]。根系構型是指植物根系在生長介質中的空間構造及分布,包括平面幾何構型和立體幾何構型[3-4]。由于植物根系具有極強的可塑性,所以在與土壤接觸過程中可整合環境中水分信號來調整根系的生長速度、方向和形態發生,提高根系對水資源的獲取效率。因此,解析小麥根系構型與生長環境的關系,可以為遺傳改良培育節水抗旱小麥新品種提供重要的理論基礎。本文擬綜述植物根系構型的決定因素、形成機理,以及與干旱脅迫的適應性關系,并總結已挖掘到的調控小麥、玉米和水稻等植物根系結構形成的相關基因,闡述它們在塑造小麥根系構型,以及調控小麥抗旱性中的作用機制和潛在應用價值。此外,雖然根系結構與植物抗旱性密切相關,但根系檢測難度大,這為根系構型研究帶來了極大的挑戰。基于此,本文也介紹了目前已開發的根系構型探測與重建方法。通過綜述以上各個方面研究進展,期望為改造小麥根系構型,實現小麥抗旱性遺傳改良提供理論依據和技術借鑒。
1 根向性生長決定的根系構型與小麥抗旱性關系
向性生長是指某一單方向環境信號(如光、水分、鹽分)刺激引發的植物定向運動,包括植物的向重力性生長、向水性生長和向光性生長等等。根據喬羅尼-文特(cholory-went)模型,植物根系的向性生長主要是由生長素調控,在外界環境信號刺激下,生長素會出現不對稱分布,從而導致根兩側生長速率產生差異,引發根的向重力方向彎曲[5]。根系構型主要由根的長度、直徑、分支、根毛和表面積等因素決定。根向性生長是決定植物根系構型的重要因素之一,特定的根系構型可以幫助植物適應干旱脅迫[2, 6]。本節將主要從根向重力性和向水性2種最重要的根向性生長類型入手,分別闡述這兩種向性生長是如何調控小麥根系構型來提高其抗旱能力。
1.1 根向重力性生長決定的根系構型與小麥對干旱脅迫適應性的關系
向重力性生長是根向性生長中最主要的類型,也是目前研究較為清楚的一類向性生長,其調控主要包括4個過程:(1)重力感知(物理作用力轉換為生物化學信號)。植物根尖的淀粉粒充當了平衡石的作用,在重力刺激下,淀粉粒會發生沉降作用,使得植物識別重力的方向。(2)重力信號轉導(生物化學信號的輸出)。當淀粉粒感知重力信號發生沉降后,細胞骨架可能會發生重排,并將刺激傳遞到內質網或細胞膜上,誘導離子通道的開啟,釋放Ca2+、InsP3、pH等信號分子作為第二信使[7]。(3)生長素不對稱分布的形成。淀粉粒的沉降作用致使胞漿Ca2+濃度增加和質子濃度降低,繼而在生長素轉運蛋白PIN介導下[8],生長素向下側流動,引起生長素在根中的不對稱分布,從而將重力信號轉化為生長素信號。(4)重力響應生長。生長素不對稱性流動引發的下側生長素積累,抑制下側細胞生長,而上側低濃度生長素促進上側細胞生長,導致根向重力方向歪曲[9-10]。
進化學研究表明,這種淀粉粒——生長素再分布機制引發的根向重力性快速應答機制只存在于種子植物中,而非種子植物如蕨類植物的根呈現弱向重力性應答反應,目前,這種弱向重力性生長機制尚不明確[11]。進一步研究表明,在植物登陸以后,這種根向重力性快速應答反應機制的進化產生在幫助種子植物適應干旱陸生環境中起重要作用[11]。
在模式植物擬南芥中,根向重力性生長可以塑造根系構型來影響其對特定生長環境尤其是干旱脅迫的適應。例如在北歐,冰雪覆蓋或消融造成的水澇環境使得擬南芥傾向于削弱根向重力性應答反應來促使其形成淺根系結構,幫助它們適應水澇造成的低氧環境[12]。同時,在半干旱地區,臨時性降水會造成大部分水分富集于表層土壤,生長于該生境中的擬南芥也傾向于通過減弱根向重力性生長來形成淺根系結構,促進植物對表層土壤水分的吸收來適應這種半干旱性氣候[13]。在禾本科作物水稻中,根向重力性生長也可決定其根系構型,從而影響水稻對特定環境的適應。從水稻中挖掘出的根系向重力性生長負調控基因()可通過控制水稻淺根系結構的形成來增強其對鹽堿環境的適應性[14];而從水稻中鑒定到的根向重力性生長正調控基因()可通過強化根系向重力性生長來促進水稻深根系結構的形成,這可顯著提升水稻對深層土壤水分的利用效率,增強其對干旱環境的適應能力[15-16]。除水稻外,近期研究表明,利用脫落酸(ABA)/干旱誘導啟動子驅動玉米的表達也可以在干旱條件下顯著促進玉米形成深根系結構,增強了玉米耐旱性,使其在干旱條件下可增產40%以上[17]。
目前,已有證據表明,根系向重力性生長也可決定小麥根系構型,并幫助小麥適應水澇和干旱脅迫環境。科學家對133份日本栽培種小麥進行分析,發現日本北部小麥的根向重力性反應顯著強于日本南部小麥品種,這種根向重力性生長的地理差異主要源于日本南部的小麥極易遭遇水澇脅迫,因此,它們傾向于減弱根向重力性應答來形成淺根系結構來適應水澇環境[18]。此外,對瑞士100年間的14種小麥根系構型研究發現,現代小麥品種更容易形成深根系結構,科學家猜測這可能與氣候變化造成的干旱現象加劇相關,推測現代小麥品種更趨向于通過增加根系生物量和增強根向重力性生長來加深根系深度,幫助小麥適應氣候變化帶來的干旱脅迫(圖1),從而維持干旱條件下小麥正常生長[19]。此外,對105年間的58個春小麥品種進行研究發現,1965年,綠色革命以后的小麥新品種更趨向于形成深根系結構特征,科學家猜測這種根系結構有利于小麥適應氣候變化造成的干旱脅迫。后期研究還發現這些深根系性狀的形成與環境對根系向重力性生長調控基因(如)的自然選擇呈現出明顯的正相關[19]。同時,數量性狀關聯分析發現控制小麥初生根角度的QTL大部分與小麥的深根系結構調控相關,并且這種初生根系生長角度的選擇影響了栽培種小麥對干旱環境的適應[20]。以上這一系列研究結果暗示小麥根系向重力性生長參與對小麥根系構型的塑造,這種根系構型的形成又與小麥抗旱性表型密切相關(圖1)。
與擬南芥和水稻相比,目前,小麥中已知調控根向重力性生長來決定小麥根系構型的基因知之甚少,這主要是由于小麥屬于六倍體,基因組大(17 Gb)、高度重復,以及其3套亞基因組存在同源基因的緩沖效應[21]。迄今為止,已明確通過影響根向重力性生長來決定小麥根系構型的基因共有3個,包括:(1)()。長期以來,的自然變異一直被認為是控制小麥從營養生長到繁殖生長轉變的主效基因[22-23]。但后期研究發現該基因也能夠通過正調控小麥根系的向重力性生長來決定各個階段小麥根分支夾角角度[24-25](圖2-A),進而影響小麥根系構型;(2)鑒定到的第二個基因是()。該基因最早是從大麥中鑒定獲得,大麥中丟失該基因會表現出根系向重力性生長顯著增強,根系結構更加緊湊。在小麥中敲除,會表現出與大麥相同的表型,即小麥根系向重力性增強,根生長角度更陡峭,形成緊湊的根系結構(圖2-B)。進一步研究還表明,對小麥根向重力性生長的調控可能不依賴于生長素信號通路,但具體的調控機制還有待進一步研究。同時,在四倍體小麥中,將A和B基因組拷貝中的同源基因同時突變,會導致小麥種子根生長角度更窄,這些結果表明,是改良小麥根系結構的優異目標基因[26]。(3)第三個小麥中鑒定得到的基因是()。該基因是從化學誘變得到的大麥突變體庫中篩選獲得的。大麥和小麥中的丟失都會增強根系向重力性應答反應,導致大麥和小麥根系夾角更加陡峭,有利于它們形成深根系結構(圖2-C)。原子力顯微鏡表明,主要通過增強皮層細胞的細胞壁硬度來抵消生長素介導的根向重力性生長應力,從而使植物根系與重力線產生更大的夾角,幫助小麥根系占據更大土壤面積來獲得更多養分[27]。進一步的生物信息分析表明,在小麥中存在自然等位變異位點,暗示利用可實現對小麥地下部分的性狀改良,這對維持干旱脅迫下小麥正常生長和發育具有廣泛的意義與價值[27]。目前,雖然在小麥中鑒定得到了、和3個參與根向重力性生長并決定小麥根系構型的重要基因(圖1),但是它們的自然變異是否介導了不同小麥耐旱性差異,還需后續試驗證據進一步闡明。

圖1 控制根系向性生長與根系發育兩類調控基因對土壤中作物根系結構的塑造作用
1.2 根向水性生長決定的根系構型與小麥對干旱環境適應性的關系
目前,相比于植物根系向重力性生長,其他根向性生長相關研究相對匱乏。根向水性生長與植物根系對土壤水分的吸收效率和植物避旱性有一定的關聯性。前期,在擬南芥中鑒定得到一個重要的參與根系向水性生長調控基因,缺失該基因會導致擬南芥根系向水性生長產生缺陷。由于該突變體對土壤水勢梯度不敏感導致其對土壤水分利用率下降,因此,與野生型擬南芥相比,突變體對干旱脅迫的耐受性降低[28-29]。同時,在玉米中,發現抗旱能力較好的玉米品系根系通常表現出較強的向水性生長能力,暗示根系的向水性生長與玉米對干旱脅迫的適應性具有一定正相關性[30]。在小麥中,由于小麥根系的原位檢測較為困難,根向水性研究相對較少。雖已有研究表明,不同品系小麥的根向水性生長存在差異,但是,這種向水性生長差異是否參與了小麥對干旱脅迫的適應性還存在爭議[31]。值得注意的是,植物根系向水性和向重力性生長表現出拮抗效應,暗示植物能夠同時通過調控向重力性和向水性生長來協同促進植物根系對土壤水分的吸收和對干旱脅迫的適應[28, 32-34]。
未來開發有效的小麥根系向水性生長研究系統,挖掘小麥向水性生長相關調控基因,并利用基因編輯技術敲除向水性生長調控基因,從遺傳學上厘清小麥根向水性生長與小麥根系構型及小麥耐旱性之間的關系,可以為培育節水抗旱小麥新品種提供重要的理論借鑒。
2 根系發育決定的小麥根系構型與小麥抗旱性關系
除了根向性生長,植物也可以整合各類逆境脅迫因子來調控根系發育,包括主根、側根以及根毛的生長發育,從而塑造根系構型,以幫助植物適應逆境脅迫。解析環境因子對植物根系結構的調控作用,可以幫助了解植物如何適應逆境脅迫。科學家在田間條件下比較了耐旱性野生二粒小麥基因滲入系(IL20)和干旱敏感栽培種小麥(Svevo)根系表型,發現IL20的根在干旱條件下表現出更強的生長活力,從而形成深根系結構促進對深層土壤水分的吸收(圖2-D),進而提升了小麥的耐旱性,實現了在干旱條件下小麥的增產。這暗示通過根系發育調控基因重塑小麥根系結構可作為未來小麥育種的方向,以此提升小麥對干旱脅迫的耐受性[35](圖1)。但到目前為止,調控禾谷類作物包括小麥根系性狀的潛在基因尚未得到充分挖掘,并且它們參與干旱脅迫適應機制也有待進一步闡明。
在干旱脅迫下鑒定到多個調控根系發育來決定小麥根系構型的基因,主要包括:(1)近期在小麥中發現了一簇單子葉植物特有的2-氧代光合色素二烯酸還原酶Ⅲ亞家族基因(;),這類基因在不同品系小麥中的表達差異決定了干旱條件下不同小麥品系根系結構的差異。敲除促進小麥形成更長的初生根,而過表達則會導致小麥初生根生長減緩、側根早熟發育,以及茉莉酸(JA和JA-Ile)的增加(圖2-E)。群體研究表明,表達水平差異引起的根系結構差異與小麥對干旱脅迫的適應有密切聯系,因此,利用該基因可幫助小麥在干旱情況下實現穩產的目標[36];(2)與類似,NAC家族轉錄因子在根系生長發育、根系結構形成和促進植物對干旱脅迫耐受性過程中發揮了重要作用。水稻NAC基因家族成員在棉花植株中過表達會促進棉花根系發育[37];過表達使水稻根徑增大,從而增強這些作物的抗旱能力,實現了水稻在干旱脅迫下的穩產、增產[38]。研究發現,在干旱脅迫下,小麥NAC家族基因成員通過在根中上調表達來維持根細胞的生理活性,促進小麥根系的生長和發育[39];(3)Expansins基因家族,包括α-expansin(EXPA)、β-expansin(EXPB)、expansin-like A和expansin-like B亞家族,參與了對植物根系發育的調控來促進植物抵御干旱脅迫。如在玉米中,以一種pH依賴性的方式松弛細胞外基質,從而在干旱脅迫下維持玉米初生根的生長,促進根系吸收水分來消除干旱影響[6]。同樣,水稻的上調表達能夠引起主根長度、側根和根毛數量的增加,提升水稻對干旱脅迫的適應能力[40]。目前,在小麥中也鑒定到多個EXPANSIN基因成員,過表達小麥可顯著增強小麥側根的生長發育,提高小麥根系生物量和對干旱脅迫的適應能力[41](圖2-F)。以上一系列現有成果,暗示了、NAC家族基因和EXPANSIN家族基因為改良小麥根系結構、提升小麥對干旱脅迫的適應能力提供了有力的切入點(圖1)。
側根是根系構型的主要決定因素之一,它賦予根系極強的可塑性,幫助植物識別并適應環境的變化。首先,側根在主根的起始位置影響了根系構型和根系對環境水分的利用效率。如在擬南芥中,側根發育起始的位置與主根接觸水分的情況密切相關,即主根接觸水分較多的一側更容易產生側根,而主根接觸干燥空氣面一側不易形成側根[42]。這種水分決定的側根發生機制,可以促進植物在水分較高一側形成更多的根系,幫助植物有效地從環境中吸收水分,避開干旱脅迫對植物生長的影響。研究還發現,這種水分介導的側根發生機制受生長素響應蛋白ARF7的介導,暗示生長素信號通路在調控植物側根起始過程中發揮了重要作用[42]。其次,除了側根起始位置,側根產生的數量差異也影響了植物根系構型和對干旱脅迫的適應性。如在玉米中,減少側根分枝密度,可以促進軸向側根的生長,有利于玉米形成深根系結構,從而有效地從干旱環境中獲取水分,提高玉米耐旱性。以上結果表明,少而長的側根表型可以作為改善玉米和其他谷物作物耐旱性的選擇性狀[43]。Wang等[44]通過對異源六倍體小麥進化分析鑒定到一個調控小麥側根數量的基因,過表達D基因組中的可增加小麥側根數量。最近,在小麥中鑒定到一個與擬南芥同源的側根密度調控基因(),進化分析表明,該基因是通過易位來源于小麥野生祖先長穗冰草的一段染色體片段。在長穗冰草中,干旱會導致顯著下調,來維持側根在缺水條件下的正常生長;但在小麥中該基因受到干旱脅迫后會顯著上調,從而抑制小麥根系生長,加劇干旱對小麥生長的抑制作用。通過在小麥中下調的表達可促進干旱脅迫下根系生長,增強小麥的耐旱性(圖2-G)。以上研究表明,側根調控基因的挖掘及其調控機制的解析,對未來改良小麥根系結構及提高小麥抗干旱脅迫能力都具有重要的科學價值[45]。
根毛是植物表皮細胞的管狀延伸部分,作為植物根系的重要組成單元,它能夠增加植物根系與土壤接觸面積,促進對土壤水分和養分的吸收。根毛與作物抗旱性有著密切聯系。研究人員曾連續2年在蘇格蘭不同氣候條件和不同土壤質地(即黏土壤土和沙壤土)地區進行實地試驗,發現5種不同基因型大麥的根毛長度和密度存在著明顯變異。在最適生長條件下,根毛與大麥的生長發育無明顯關聯性,但在土壤水分缺失條件下,根毛能顯著增強大麥抗旱性,從而促進大麥在干旱條件下的增產[46]。暗示改良根毛長度與密度表型可用于培育下一代耐旱性小麥新品種。
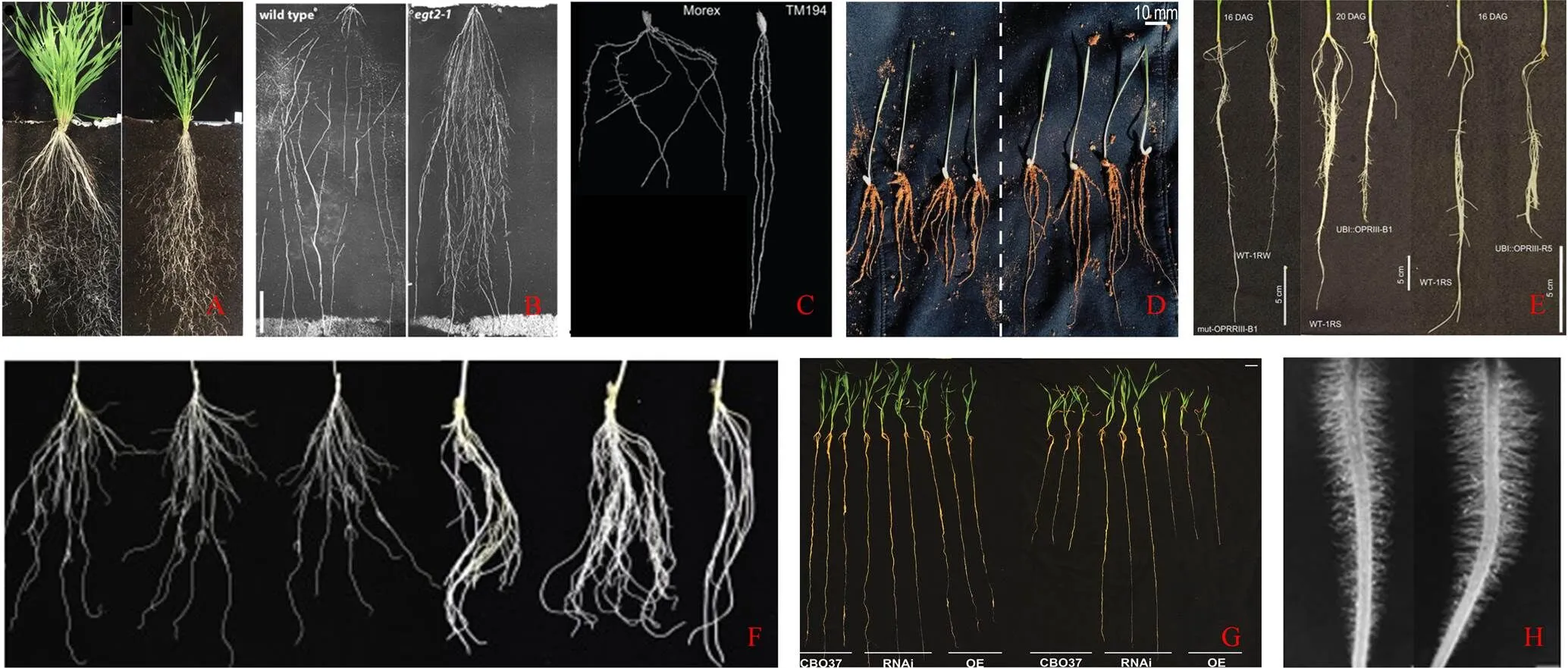
A:VRN1正調控小麥根向重力性生長來減小根系分支夾角角度[25]。B:EGT2負調控小麥根向重力性生長促進小麥形成陡峭的根系結構[26]。C:EGT1負調控小麥根向重力性生長來增加根系分支夾角角度[27]。D:耐旱性野生二粒小麥基因滲入系(IL20)比對干旱敏感的優質硬粒小麥品種(Svevo)表現出更強大的根系生長發育能力[35]。E:OPRIII負調控根系發育(小麥初生根和側根的生長發育)來調控小麥根系生物量[36]。F:TaEXPA2正調控小麥側根發育來提高小麥對干旱脅迫的適應[41]。G:LRD負調控根系發育促進干旱脅迫下小麥根系的發育和生物量增加[45]。H:TaRSL4-A促進小麥根毛發育來增加小麥根毛長度[49]
目前,在不同植物中鑒定到多個根毛調控發育基因。擬南芥中的根毛起始、伸長和分化受堿性螺旋-環-螺旋(bHLH)轉錄因子ROOT HAIR DEFECTIVE 6(RHD6)和ROOT HAIR DEFECTIVE6-LIKE 4(RSL4)等位基因的調控[47]。水稻()是一個重要的根毛發育基因,可調控水稻根毛的長度。在大麥中,鑒定到擴展蛋白EXPB基因家族成員可調控大麥根毛發育。在玉米中,鑒定到4個控制根毛長度的基因,命名為無根毛基因()。、和等位基因與根毛的發生和伸長相關,與根毛長度和密度相關[48]。小麥是擬南芥的直系同源基因,二倍體和四倍體基因型小麥根毛長度與表達量呈正相關。值得注意的是,A基因組上的轉錄豐度遠高于在其他基因組上該同源基因的轉錄水平。在土壤營養匱乏條件下,過表達可以增加小麥根毛長度和莖部生物量[49](圖2-H)。禾本科作物中調控根毛發育的基因可參與植物耐旱性調控,如在玉米中,全基因組關聯分析發現的自然變異與玉米幼苗耐旱性之間呈現顯著相關性。編碼S-酰化轉移酶,可正向調控植物根毛的發育,在擬南芥和玉米中,過表達可明顯增加根毛長度,并能提高它們的耐旱能力;相反,功能缺失玉米突變體表現出干旱不耐受表型[50]。目前,雖然已在小麥中鑒定到一些小麥根毛發育調控基因,如,但這些基因是否及如何參與小麥對干旱脅迫的耐受還需進一步研究。未來鑒定出更多小麥根毛發育相關調控基因,厘清根毛發育和小麥耐旱性關系,有助于后期對小麥開展定向遺傳改良,增強小麥對干旱脅迫的適應能力。
3 小麥根系結構的探測與重建方法研究
在小麥品種選育改良中,對根系構型的優化改良滯后于地上部分株型改良[51]。與地上部分不同,小麥根系隱匿于土壤,同時,由于土壤中根系結構的高度可塑性、性狀表達的復雜性,以及涉及與水、微生物和養分等各種環境因子的相互作用,致使其表型鑒定工作耗時耗力且準確率低,極大制約了對作物根系的深入研究,阻礙了基于根系性狀推動作物遺傳改良的進程[4]。根系性狀表型分析技術難點可分為兩部分:一是將作物根系從生長環境中分離出來;二是根系圖像的獲取與分析。
田間條件下,由于根系性狀的獲取成本高、時間長且勞動強度大,同時,也具有部分破壞性,所以為了解決這個問題,研究人員開發了無土表型分析方法來獲取作物根系性狀。無土表型分析方法的優點是可準確提取整個根部結構的參數,目前,根系無土培養的方法主要包括水培法、生長袋法和冷凝膠培養法等。生長袋法雖然可快速、高分辨率獲取根部信息,但缺點是限制了種子根的自然張開,所以無法獲取種子根的自然張開角度。冷凝膠培養法雖然可以獲取根的長度、角度和分支等參數,但在播種和根系生長過程中容易遭受細菌或真菌污染[52-53]。此外,無土表型分析沒有考慮土壤性質的影響和根系自然條件下生長所必需的其他環境條件,如根際微生物,另外,根系可能受到生長容器的影響,因此,在一定程度上不能完全反映根系結構在自然條件下的真實特征。
田間根系構型參數是作物根系的“真實寫照”,目前,田間根系表型鑒定主要分為破壞性探測法和原位探測法兩大類。破壞性探測法主要包括直接挖掘法、尼龍網法、土芯法和剖面法等,這些方法操作簡單,可以直觀、快速地獲取根部信息,但缺點是同時破壞了原有根系三維形態、耗時費力[54]。原位探測法是在不損傷根系和不破壞其生長環境的前提下對根系構型進行監測和數據獲取,主要包括安置裝置法(根箱法、微根管法)、地面穿透雷達法、三維數字化法和穿透射線成像法等,這些方法可實現對根系實時監測。微根管法屬于局部觀測,是目前大田根系動態生長監測的常用方法,該方法的重點指標是根數目[55]。地面穿透雷達法是通過高頻率的無線電波來檢測并獲取地面下的根系結構特征,其原理就是利用根和土壤的電磁特性不同來區分根和土壤,該技術已經被成功用于獲取冬小麥主要根系的生物量和直徑數據[56]。核磁共振成像(magnetic resonance imaging,MRI)和微X射線斷層掃描(X-ray computed tomography,X-ray CT)等技術可以對小麥根系的三維結構和根系周邊的特性進行拍照,并可描述細節。隨著掃描時間和儀器的不斷改進,可以不斷提高拍照的通量。雖然CT掃描技術獲取的根系質量較高,但是目前面臨的問題是該方法的獲取成本太高,應用不具有普遍性。未來,開發成本低,普適性好,可進行作物全生長期的根系構型三維探測方法和研制相關設備仍然是未來根系研究的技術重點[57-58]。
隨著表型鑒定方法、成像技術和數據分析平臺的快速發展,作物根系構型鑒定逐漸由根系二維形態檢測向三維根系構型參數拓展,分析方法也從傳統取樣觀測模式逐步向自動化圖像提取模式轉變[59-60]。目前,在作物根系表型參數提取上常用的二維分析軟件主要包括SmartRoot[61]、WinRhizo[62]、RootNav[63]和GT-RootS[64]等,其中,GT-RootS采用自動化分析根系構型,可通過批量處理圖像及量化分析來極大地提高根系構型量化效率。
獲取三維根系構型中圖像的像素、尺寸大小、顏色等級參數,及構建空間分布函數是軟件設計的瓶頸,同時,目前三維根系表型分析軟件不能完全消除根系自身重疊性和土壤中非根物質的影響,致使難以甚至無法提取完整根系表型參數[4]。目前,比較常用的三維根系表型分析軟件是RootReader3D[65]、RooTrak[66]和NMRooting[67];其中,RootReader3D軟件適用于分析背景單一的根系圖像,可以提取根體積、根角度和根表面積等27個量化參數,但不能消除圖像中非根物質的影響;RooTrak可用于復雜介質背景下獲取完整的三維根系構型,但該軟件分析用時較長且無法提取量化參數;NMRooting的優點是可將根系圖像進行量化分析處理。
4 展望與討論
干旱是影響小麥生長和生產的主要環境限制因素之一[68]。隨著全球氣候和降水模式的改變,干旱脅迫有日益加劇的趨勢,嚴重威脅著未來糧食安全。據世界銀行預測,隨著干旱發生的頻率不斷增加,到2050年,農業活動對淡水的需求將增加70%。因此,如何對作物進行遺傳改良,維持作物在干旱條件下的穩產和高產日益成為研究關注的焦點。根系是植物水分吸收最重要的部位,因此,改良根系結構是培育抗旱作物新品種最有效的手段之一。同時,目前,通過改良根系結構培育抗旱作物新品種被證明是完全可行的,例如基于深根系特性培育的抗旱水稻新品種PY84已經被印度東部的農民種植[69]。但基于根系結構改良而培育出的耐旱小麥新品種仍未見廣泛報道,這主要是由于鑒定到的通過調控根系結構參與小麥耐旱性的基因相對匱乏,同時,它們的調控機制不明確,這些都限制了利用分子育種技術開展對小麥根系結構的改良。
對于如何鑒定小麥中根系構型調控基因,主要可通過以下2種策略:(1)對收集或構建得到的小麥群體進行測序分析,并對它們的根系表型在正常和干旱條件下進行分別采集,然后,依據根系表型差異對小麥群體進行歸類,通過全基因組關聯分析(genome- wide association study,GWAS)來捕獲參與根系結構調控的特定區段或候選基因,最后,再利用基因編輯技術敲除或過表達相關候選基因,從遺傳學角度驗證它們在調控小麥根系構型及耐旱性中的功能(圖3)。目前,隨著收集到的小麥品系數量不斷增多、測序及分析技術的不斷進步、測序成本的持續下降,該策略未來可能越來越廣泛地被用于相關候選基因的挖掘。(2)除了小麥,在其他植物中,如前面提及的擬南芥、玉米、水稻和大麥等植物中,目前也鑒定得到大量調控根系結構及植物耐旱性相關基因,這些基因大部分在小麥中存在著同源基因。基于同源基因在開花植物尤其禾本科植物中功能進化上的保守性,利用基因編輯技術或過表達手段在小麥中敲除或上調這些小麥同源基因可驗證它們是否參與對小麥根系構型和耐旱性的調控。該策略可進一步豐富用于改良小麥根系構型的基因資源。
在機制上,改變根向性生長與根系發育2條途徑都可影響植物根系構型。為了解析上述2種策略挖掘到的小麥根系構型調控基因作用機制,下一步可通過對野生型和基因功能缺失及過表達突變體小麥的根向性生長進行分析,同時對這些小麥材料正常條件和干旱脅迫下根系的生長發育情況進行研究,從而判斷挖掘到的根系構型調控基因是通過控制根系向性生長還是根系發育來決定小麥根系結構并參與小麥對干旱脅迫的響應(圖3)。此外,植物激素在根系向性生長和發育過程中都扮演了重要角色,例如在水稻中發現生長素轉運蛋白突變體的側根數量和根毛長度都顯著減少[70],而擬南芥突變體表現出根向重力性生長缺失表型[71]。因此,探明這些挖掘到的候選基因與植物激素在調控根系構型中的相互作用,可從機制上進一步闡明這些挖掘到的候選基因如何調控根系構型來影響小麥耐旱性。
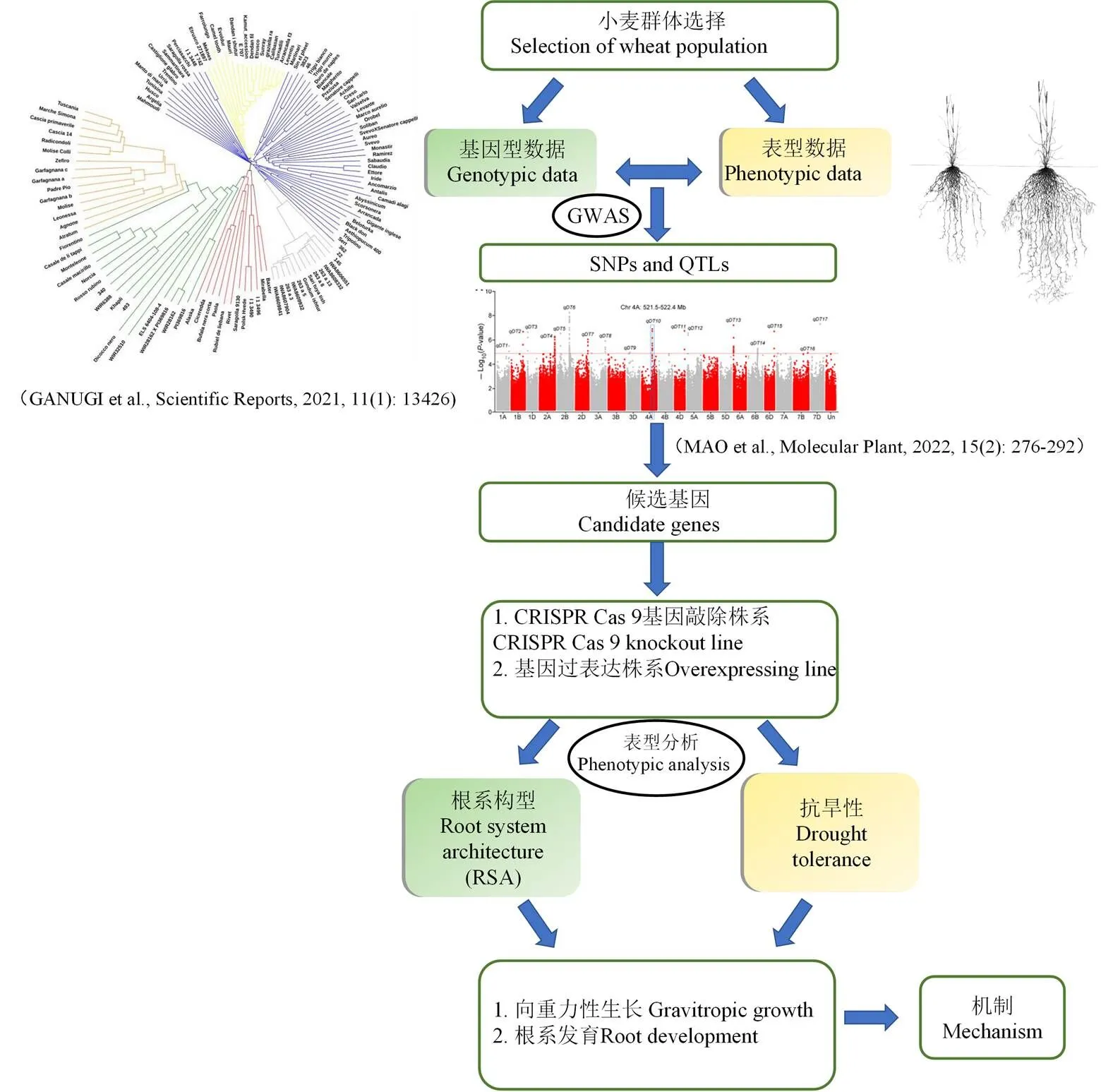
圖3 利用全基因組性狀關聯分析挖掘調控根系結構并參與小麥抗旱性候選基因及解析相關調控機制的策略
總之,通過挖掘小麥根系構型調控基因,闡明它們在調控根向性生長和根系發育中的作用機制,同時,解析根系構型與小麥對干旱脅迫適應性的關系,為最終通過分子育種培育高產、耐干旱脅迫小麥新品種提供了寶貴的基因資源和理論基礎[68]。相關的研究也為氣候變化帶來的全球糧食安全問題提供了可借鑒的解決策略。
[1] 趙海燕, 張文千, 鄒旭愷, 張強, 沈子琦, 梅平. 氣候變化背景下中國農業干旱時空變化特征分析. 中國農業氣象, 2021, 42(1): 69-79.
Zhao H Y, Zhang W Q, Zou X K, Zhang Q, Shen Z Q, Mei P. Temporal and spatial characteristics of drought in China under climate change. Chinese Journal of Agrometeorology, 2021, 42(1): 69-79. (in Chinese)
[2] XIAO G H, ZHANG Y Z. Adaptive growth: Shaping auxin-mediated root system architecture. Trends in Plant Science, 2020, 25(2): 121-123.
[3] 溫維亮, 郭新宇, 趙春江, 王傳宇, 肖伯祥. 作物根系構型三維探測與重建方法研究進展. 中國農業科學, 2015, 48(3): 436-448.doi: 10.3864/j.issn.0578-1752.2015.03.04.
WEN W L, GUO X Y, ZHAO C J, WANG C Y, XIAO B X. Crop roots configuration and visualization: A review. Scientia Agricultura Sinica, 2015, 48(3): 436-448. doi: 10.3864/j.issn.0578-1752.2015.03. 04. (in Chinese)
[4] 李龍, 李超男, 毛新國, 王景一, 景蕊蓮.作物根系表型鑒定評價方法的現狀與展望. 中國農業科學, 2022, 55(3): 425-437. doi: 10.3864/j.issn.0578-1752.2022.03.001.
LI L, LI C N, MAO X G, WANG J Y, JING R L. Advances and perspectives of approaches to phenotyping crop root system. Scientia Agricultura Sinica, 2022, 55(3): 425-437. doi: 10.3864/j.issn.0578-1752.
2022.03.001. (in Chinese)
[5] SATO E M, HIJAZI H, BENNETT M J, VISSENBERG K, SWARUP R. New insights into root gravitropic signalling.Journal of Experimental Botany, 2015, 66(8): 2155-2165.
[6] MAQBOOL S, HASSAN M A, XIA X C, YORK L M, RASHEED A, HE Z H. Root system architecture in cereals: Progress, challenges and perspective. The Plant Journal, 2022, 110(1): 23-42.
[7] ZHANG Y Z, HE P, MA X F, YANG Z R, PANG C Y, YU J N, WANG G D, FRIML J, XIAO G H. Auxin-mediated statolith production for root gravitropism. The New Phytologist, 2019, 224(2): 761-774.
[8] BABA A I, MIR M Y, RIYAZUDDIN R, CSéPL? á, RIGó G, FEHéR A. Plants in microgravity: molecular and technological perspectives. International Journal of Molecular Sciences, 2022, 23(18): 10548.
[9] MORITA M T, TASAKA M. Gravity sensing and signaling. Current Opinion in Plant Biology, 2004, 7(6): 712-718.
[10] SU S H, GIBBS N M, JANCEWICZ A L, MASSON P H. Molecular mechanisms of root gravitropism. Current Biology, 2017, 27(17): R964-R972.
[11] ZHANG Y Z, XIAO G H, WANG X J, ZHANG X X, FRIML J. Evolution of fast root gravitropism in seed plants. Nature Communications, 2019, 10: 3480.
[12] WAIDMANN S, RUIZ ROSQUETE M, SCH?LLER M, SARKEL E, LINDNER H, LARUE T, PET?íK I, DüNSER K, MARTOPAWIRO S, SASIDHARAN R, NOVAK O, WABNIK K, DINNENY J R, KLEINE-VEHN J. Cytokinin functions as an asymmetric and anti-gravitropic signal in lateral roots. Nature Communications, 2019, 10(1): 3540.
[13] OGURA T, GOESCHL C, FILIAULT D, MIREA M, SLOVAK R, WOLHRAB B, SATBHAI S B, BUSCH W. Root system depth inis shaped byvia the dynamic modulation of auxin transport. Cell, 2019, 178(2): 400-412, e16.
[14] KITOMI Y, HANZAWA E, KUYA N, INOUE H, HARA N, KAWAI S, KANNO N, ENDO M, SUGIMOTO K, YAMAZAKI T, SAKAMOTO S, SENTOKU N, WU J Z, KANNO H, MITSUDA N, TORIYAMA K, SATO T, UGA Y. Root angle modifications by thehomolog improve rice yields in saline paddy fields. Proceedings of the National Academy of Sciences of the United States of America, 2020, 117(35): 21242-21250.
[15] UGA Y, OKUNO K, YANO M., a major QTL involved in deep rooting of rice under upland field conditions. Journal of Experimental Botany, 2011, 62(8): 2485-2494.
[16] UGA Y, SUGIMOTO K, OGAWA S, RANE J, ISHITANI M, HARA N, KITOMI Y, INUKAI Y, ONO K, KANNO N, INOUE H, TAKEHISA H, MOTOYAMA R, NAGAMURA Y, WU J Z, MATSUMOTO T, TAKAI T, OKUNO K, YANO M. Control of root system architecture byincreases rice yield under drought conditions. Nature Genetics, 2013, 45(9): 1097-1102.
[17] FENG X J, JIA L, CAI Y T, GUAN H R, ZHENG D, ZHANG W X, XIONG H, ZHOU H M, WEN Y, HU Y, ZHANG X M, WANG Q J, WU F K, XU J, LU Y L. ABA-inducibleimproves adaptation of maize to water deficiency. Plant Biotechnology Journal, 2022, 20(11): 2077-2088.
[18] TAKEDA H, TSUKAYA H. Analysis of gravitropic response in 133 cultivars of Japanese wheat (L.). Plant and cell physiology, 2005, 46(2): 375-381.
[19] Friedli C N, Abiven S, Fossati D, Hund A. Modern wheat semi-dwarfs root deep on demand: response of rooting depth to drought in a set of Swiss era wheats covering 100 years of breeding. Euphytica, 2019, 215(4): 1-15.
[20] CHRISTOPHER J, CHRISTOPHER M, JENNINGS R, JONES S, FLETCHER S, BORRELL A, MANSCHADI A M, JORDAN D, MACE E, HAMMER G. QTL for root angle and number in a population developed from bread wheats () with contrasting adaptation to water-limited environments. Theoretical and Applied Genetics, 2013, 126(6): 1563-1574.
[21] BORRILL P, HARRINGTON S A, UAUY C. Applying the latest advances in genomics and phenomics for trait discovery in polyploid wheat. The Plant Journal, 2019, 97(1): 56-72.
[22] YAN L, LOUKOIANOV A, TRANQUILLI G, HELGUERA M, FAHIMA T, DUBCOVSKY J. Positional cloning of the wheat vernalization gene. Proceedings of the National Academy of Sciences of the United States of America, 2003, 100(10): 6263-6268.
[23] COCKRAM J, JONES H, LEIGH F J, O'SULLIVAN D, POWELL W, LAURIE D A, GREENLAND A J. Control of flowering time in temperate cereals: genes, domestication, and sustainable productivity. Journal of Experimental Botany, 2007, 58(6): 1231-1244.
[24] VOSS-FELS K P, SNOWDON R J, HICKEY L T. Designer roots for future crops. Trends in Plant Science, 2018, 23(11): 957-960.
[25] VOSS-FELS K P, ROBINSON H, MUDGE S R, RICHARD C, NEWMAN S, WITTKOP B, STAHL A, FRIEDT W, FRISCH M, GABUR I, MILLER-COOPER A, CAMPBELL B C, KELLY A, FOX G, CHRISTOPHER J, CHRISTOPHER M, CHENU K, FRANCKOWIAK J, MACE E S, BORRELL A K, EAGLES H, JORDAN D R, BOTELLA J R, HAMMER G, GODWIN I D, TREVASKIS B, SNOWDON R J, HICKEY L T.modulates root system architecture in wheat and barley. Molecular Plant, 2018, 11(1): 226-229.
[26] KIRSCHNER G K, ROSIGNOLI S, GUO L, VARDANEGA I, IMANI J, ALTMüLLER J, MILNER S G, BALZANO R, NAGEL K A, PFLUGFELDER D, FORESTAN C, BOVINA R, KOLLER R, ST?CKER T G, MASCHER M, SIMMONDS J, UAUY C, SCHOOF H, TUBEROSA R, SALVI S, HOCHHOLDINGER F.encodes a STERILE ALPHA MOTIF-containing protein that controls root growth angle in barley and wheat. Proceedings of the National Academy of Sciences of the United States of America, 2021, 118(35): e2101526118.
[27] FUSI R, ROSIGNOLI S, LOU H Y, SANGIORGI G, BOVINA R, PATTEM J K, BORKAR A N, LOMBARDI M, FORESTAN C, MILNER S G, DAVIS J L, LALE A, KIRSCHNER G K, SWARUP R, TASSINARI A, PANDEY B K, YORK L M, ATKINSON B S, STURROCK C J, MOONEY S J, HOCHHOLDINGER F, TUCKER M R, HIMMELBACH A, STEIN N, MASCHER M, NAGEL K A, DE GARA L, SIMMONDS J, UAUY C, TUBEROSA R, LYNCH J P, YAKUBOV G E, BENNETT M J, BHOSALE R, SALVI S. Root angle is controlled byin cereal crops employing an antigravitropic mechanism. Proceedings of the National Academy of Sciences of the United States of America, 2022, 119(31): e2201350119.
[28] TAKAHASHI N, YAMAZAKI Y, KOBAYASHI A, HIGASHITANI A, TAKAHASHI H. Hydrotropism interacts with gravitropism by degrading amyloplasts in seedling roots ofand radish. Plant Physiology, 2003, 132(2): 805-810.
[29] IWATA S, MIYAZAWA Y, FUJII N, TAKAHASHI H.-regulated hydrotropism functions in the growth and survival ofunder natural conditions. Annals of Botany, 2013, 112(1): 103-114.
[30] EAPEN D, MARTíNEZ-GUADARRAMA J, HERNáNDEZ-BRUNO O, FLORES L, NIETO-SOTELO J, CASSAB, G I. Synergy between root hydrotropic response and root biomass in maize (L.) enhances drought avoidance. Plant Science, 2017, 265: 87-99.
[31] OBER E S, ALAHMAD S, COCKRAM J, FORESTAN C, HICKEY L T, KANT J, MACCAFERRI M, MARR E, MILNER M, PINTO F, RAMBLA C, REYNOLDS M, SALVI S, SCIARA G, SNOWDON R J, THOMELIN P, TUBEROSA R, UAUY C, VOSS-FELS K P, WALLINGTON E, WATT M. Wheat root systems as a breeding target for climate resilience. Theoretical and Applied Genetics, 2021, 134(6): 1645-1662.
[32] OYANAGI A, TAKAHASHI H, SUGE H. Interactions between hydrotropism and gravitropism in the primary seminal roots ofL.. Annals of Botany, 1995, 75(3): 229-235.
[33] KOBAYASHI A, TAKAHASHI A, KAKIMOTO Y, MIYAZAWA Y, FUJII N, HIGASHITANI A, TAKAHASHI H. A gene essential for hydrotropism in roots. Proceedings of the National Academy of Sciences of the United States of America, 2007, 104(11): 4724-4729.
[34] LI Y, YUAN W, LI L C, DAI H, DANG X L, MIAO R, BALU?KA F, KRONZUCKER H J, LU C M, ZHANG J H, XU W F. Comparative analysis reveals gravity is involved in the-regulated root hydrotropism. Journal of Experimental Botany, 2020, 71(22): 7316-7330.
[35] BACHER H, MONTAGU A, HERRMANN I, WALIA H, SCHWARTZ N, PELEG Z. Stress-induced deeper rooting introgression enhances wheat yield under terminal drought. Journal of Experimental Botany, 2023: erad059.
[36] GABAY G, WANG H C, ZHANG J L, MORICONI J I, BURGUENER G F, GUALANO L D, HOWELL T, LUKASZEWSKI A, STASKAWICZ B, CHO M J, TANAKA J, FAHIMA T, KE H Y, DEHESH K, ZHANG G L, GOU J Y, HAMBERG M, SANTA-MARíA G E, DUBCOVSKY J. Dosage differences ingenes modulate wheat root growth.Nature Communications, 2023, 14(1): 539.
[37] LIU G Z, LI X L, JIN S X, LIU X Y, ZHU L F, NIE Y C, ZHANG X L. Overexpression of rice NAC geneimproves drought and salt tolerance by enhancing root development and reducing transpiration rate in transgenic cotton. PLoS One, 2014, 9(1): e86895.
[38]Jeong J S, Kim Y S, Redillas M C, Jang G, Jung H, Bang S W, Choi Y D, Ha S H, Reuzeau C, Kim J K.overexpression enlarges root diameter in rice plants leading to enhanced drought tolerance and increased grain yield in the field. Journal of Plant Biotechnology, 2013, 11(1): 101-114.
[39] XUE G P, BOWER N I, MCINTYRE C L, RIDING G A, KAZAN K, SHORTER R.from the NAC superfamily of transcription factors is up-regulated by abiotic stresses in wheat and recognises two consensus DNA-binding sequences. Functional Plant Biology, 2006, 33(1): 43-57.
[40] WANG Y, MA N N, QIU S C. ZOU H Y, ZANG G C, KANG Z H, WANG G X, HUANG J L. Regulation of the α-expansin geneexpression affects root system architecture in transgenic rice plants. Molecular Breeding, 2014, 34(1): 47-57.
[41] YANG J J, ZHANG G Q, AN J, LI Q X, CHEN Y H, ZHAO X Y, WU J J, WANG Y, HAO Q Q, WANG W Q, WANG W. Expansin genepositively regulates drought tolerance in transgenic wheat (L.). Plant Science, 2020, 298: 110596.
[42] OROSA-PUENTE B, LEFTLEY N, VON WANGENHEIM D, BANDA J, SRIVASTAVA A K, HILL K, TRUSKINA J, BHOSALE R, MORRIS E, SRIVASTAVA M, KüMPERS B, GOH T, FUKAKI H, VERMEER J E M, VERNOUX T, DINNENY J R, FRENCH A P, BISHOPP A, SADANANDOM A, BENNETT M J. Root branching toward water involves posttranslational modification of transcription factorScience, 2018, 362(6421): 1407-1410.
[43] ZHAN A, SCHNEIDER H, LYNCH J P. Reduced lateral root branching density improves drought tolerance in maize. Plant Physiology, 2015, 168(4): 1603-1615.
[44] WANG H F, HU Z R, HUANG K, HAN Y, ZHAO A J, HAN H M, SONG L, FAN C F, LI R, XIN M M, PENG H R, YAO Y Y, SUN Q X, NI Z F. Three genomes differentially contribute to the seedling lateral root number in allohexaploid wheat: evidence from phenotype evolution and gene expression. The Plant Journal, 2018, 95(6): 976-987.
[45] PLACIDO D F, SANDHU J, SATO S J, NERSESIAN N, QUACH T, CLEMENTE T E, STASWICK P E, WALIA H. The LATERAL ROOT DENSITY gene regulates root growth during water stress in wheat. Plant Biotechnology Journal, 2020, 18(9): 1955-1968.
[46] MARIN M, FEENEY D S, BROWN L K, NAVEED M, RUIZ S, KOEBERNICK N, BENGOUGH A G, HALLETT P D, ROOSE T, PUéRTOLAS J, DODD I C, GEORGE T S. Significance of root hairs for plant performance under contrasting field conditions and water deficit. Annals of Botany, 2021, 128(1): 1-16.
[47] DOLAN L. Root hair development in grasses and cereals (Poaceae). Current Opinion in Genetics and Development, 2017, 45: 76-81.
[48] HOCHHOLDINGER F, YU P, MARCON C. Genetic control of root system development in maize. Trends in Plant Science, 2018, 23(1): 79-88.
[49] HAN Y, XIN M M, HUANG K, XU Y Y, LIU Z S, HU Z R, YAO Y Y, PENG H R, NI Z F, SUN Q X. Altered expression ofgene by genome interplay shapes root hair length in allopolyploid wheat. The New Phytologist, 2016, 209(2): 721-732.
[50] ZHANG X M, MI Y, MAO H D, LIU S X, CHEN L M, QIN F. Genetic variation incontributes to root hair elongation and drought tolerance in maize. Plant Biotechnology Journal, 2020, 18(5): 1271-1283.
[51] LI L, PENG Z, MAO X G, WANG J Y, CHANG X P, REYNOLDS M, JING R L. Genome-wide association study reveals genomic regions controlling root and shoot traits at late growth stages in wheat. Annals of Botany, 2019, 124(6): 993-1006.
[52] LIU X L, LI R Z, CHANG X P, JING R L. Mapping QTLs for seedling root traits in a doubled haploid wheat population under different water regimes. Euphytica, 2013, 189(1): 51-66.
[53] WALLER S, WILDER S L, SCHUELLER M J, HOUSH A B, FERRIERI R A. Quantifying plant-borne carbon assimilation by root-associating bacteria. Microorganisms, 2020, 8(5): 700.
[54] 趙春江, 陸聲鏈, 郭新宇, 肖伯祥, 溫維亮. 數字植物及其技術體系探討. 中國農業科學, 2010, 43(10): 2023-2030. doi: 10.3864/j.issn. 0578-1752.2010.10.007.
ZHAO C J, LU S L, GUO X Y, XIAO B X, WEN W L. Exploration of digital plant and its technology system. Scientia Agricultura Sinica, 2010, 43(10): 2023-2030. doi: 10.3864/j.issn.0578-1752.2010.10.007. (in Chinese)
[55] MAJDI H. Root sampling methods - applications and limitations of the minirhizotron technique. Plant and Soil, 1996, 185(2): 255-258.
[56] 崔喜紅, 陳晉, 關琳琳. 探地雷達技術在植物根系探測研究中的應用. 地球科學進展, 2009, 24(6): 606-611.
CUI X H, CHEN J, GUAN L L. The application of ground penetrating radar to plant root system detection. Advances in Earth Science, 2009, 24(6): 606-611. (in Chinese)
[57] SCHULZ H, POSTMA J A, VAN DUSSCHOTEN D, SCHARR H, BEHNKE S. Plant root system analysis from MRI images. Communications in Computer and Information Science, 2013(359): 411-425.
[58] STINGACIU L, SCHULZ H, POHLMEIER A, BEHNKE S, ZILKEN H, JAVAUX M, VEREECKEN H.root system architecture extraction from magnetic resonance imaging for water uptake modeling. Vadose Zone Journal, 2013, 12(1): 1-9.
[59] BEKKERING C S, HUANG J, TIAN L. Image-based, organ-level plant phenotyping for wheat improvement. Agronomy, 2020, 10(9): 1287.
[60] TAKAHASHI H, PRADAL C. Root phenotyping: Important and minimum information required for root modeling in crop plants. Breeding Science, 2021, 71(1): 109-116.
[61] LOBET G, PAGèS L, DRAYE X. A novel image-analysis toolbox enabling quantitative analysis of root system architecture. Plant Physiology, 2011, 157(1): 29-39.
[62] PANG W, CROW W T, LUC J E, MCSORLEY R, GIBLIN-DAVIS R M, KENWORTHY K E, KRUSE J K. Comparison of water displacement and WINRHIZO software for plant root parameter assessment. Plant Disease, 2011, 95(10): 1308-1310.
[63] POUND M P, FRENCH A P, ATKINSON J A, WELLS D M, BENNETT M J, PRIDMORE T. RootNav: Navigating images of complex root architectures. Plant Physiology, 2013, 162(4): 1802-1814.
[64] BORIANNE P, SUBSOL G, FALLAVIER F, DARDOU A, AUDEBERT A. GT-RootS: An integrated software for automated root system measurement from high-throughput phenotyping platform images. Computers and Electronics in Agriculture, 2018, 150: 328-342.
[65] CLARK R T, MACCURDY R B, JUNG J K, SHAFF J E, MCCOUCH S R, ANESHANSLEY D J, KOCHIAN L V. Three- dimensional root phenotyping with a novel imaging and software platform. Plant Physiology, 2011, 156(2): 455-465.
[66] MAIRHOFER S, ZAPPALA S, TRACY S R, STURROCK C, BENNETT M, MOONEY S J, PRIDMORE T. RooTrak: Automated recovery of three-dimensional plant root architecture in soil from X-ray microcomputed tomography images using visual tracking. Plant Physiology, 2012, 158(2): 561-569.
[67] VAN DUSSCHOTEN D, METZNER R, KOCHS J, POSTMA J A, PFLUGFELDER D, BüEHLER J, SCHURR U, JAHNKE S. Quantitative 3D analysis of plant roots growing in soil using magnetic resonance imaging. Plant Physiology, 2016, 170(3): 1176-1188.
[68] Li C N, Li L, Reynolds M P, Wang J Y, Chang X P, Mao X G, Jing R L. Recognizing the hidden half in wheat: root system attributes associated with drought tolerance. Journal of Experimental Botany, 2021, 72(14): 5117-5133.
[69] STEELE K A, PRICE A H, WITCOMBE J R, SHRESTHA R, SINGH B N, GIBBONS J M, VIRK D S. QTLs associated with root traits increase yield in upland rice when transferred through marker-assisted selection. Theoretical and Applied Genetics, 2013, 126(1): 101-108.
[70] ZHAO H, MA T, WANG X, DENG Y, MA H, ZHANG R, ZHAO J.controls lateral root initiation in rice (L.). Plant Cell and Environment, 2015, 38(11): 2208-2222.
[71] BENNETT M J, MARCHANT A, GREEN H G, MAY S T, WARD S P, MILLNER P A, WALKER A R, SCHULZ B, FELDMANN K A.AUX1 gene: a permease-like regulator of root gravitropism. Science, 1996, 273(5277): 948-950.
Research progress on root system architecture and drought resistance in wheat
ZHANG YuZhou, WANG YiZhao, GAO RuXi, LIU YiFan
College of Life Sciences, Northwest A&F University, Yangling 712100, Shaanxi
Wheat is the most important cereal crop, and drought is the most significant abiotic stress factor that severely affects wheat growth and development. Plant root system, as a primary organ for crops to acquire water and nutrients, directly determines the efficiency of soil water utilization. In recent years, increasing evidence has shown that plant root system architecture (RSA) plays an important role in plant tolerance to drought stress. This review summarizes the current research progress on the regulation of wheat drought tolerance determined by RSA. First, we present how root tropism especially root gravitropism shapes the RSA, summarize the relevant genes and molecular regulatory mechanism involved in root gravitropic growth, and explain how the root tropism-regulated RSA is implicated in wheat adaptation to drought stress. In addition to root tropic growth, the root development also participates in the RSA formation and the plant adaptability to drought stress. Therefore, this review further summarizes how wheat regulates root development to alter its root system morphology (including increasing root length, modifying lateral root number and root hair density, etc.), thereby enhancing its water acqusition from the soil and its adaption to drought environment. The identified genes involved in wheat root development under drought stress conditions are also systematically summarized. Furthermore, as the underground part of plants, the revelation of RSA has always been a challenging task, which hinders our understanding of the relationship between RSA and plant drought tolerance. Therefore, this review also summarized the available techniques used to analyze the RSA at two- and three-dimension levels. These techniques can measure and analyze wheat root length, density, growth direction, and morphology parameters, laying technical support for an insightful understanding of the relationship between wheat RSA and drought resistance. Finally, we discuss the prospect of the improvement of RSA in breeding wheat drought-resistant varieties, as well as provide an outlook for how to identify genes regulating wheat RSA and pinpoint their regulatory mechanism. In summary, the relationship between wheat RSA and drought resistant is closely associated. The continuous development of sequencing techniques, along with the deepening research on the regulatory mechanism of wheat RSA, will provide new means and strategies for the further breeding of drought-tolerance wheat varieties.
wheat; root system architecture; root tropic growth; root system development; drought resistance; root system visualization

10.3864/j.issn.0578-1752.2024.09.002
2023-05-14;
2023-07-07
西北農林科技大學引進人才科研啟動基金(Z1090222001)
張余周(通信作者),E-mail:yuzhou.zhang@nwafu.edu.cn。王一釗,E-mail:yzwang2022@163.com。張余周和王一釗為同等貢獻作者
(責任編輯 李莉)

