基于“水的組成”探究實驗對阿伏伽德羅定律的教學思考
任圣穎
摘要: 基于阿伏伽德羅定律被認可的歷史考量,從描述方式一致性和證據推理的方法論角度,以電解水的探究實驗為基礎,引導學生深化認識阿伏伽德羅定律的內容和實質。分別在體積固定和體積可變的容器中呈現分子構建氣體體積的過程,展現阿伏伽德羅定律“不同氣體”的“不同分子尺寸”和“不同分子質量”的內涵,為學生完整地認識阿伏伽德羅定律提供可靠的途徑。
關鍵詞: 阿伏伽德羅定律; 電解水; 水的組成; 教學思考
文章編號: 1005-6629(2024)02-0092-06
中圖分類號: G633.8
文獻標識碼: B
1 阿伏伽德羅定律被認可的歷史考量
1.1 阿伏伽德羅假設的提出與接受
自從人類產生意識以來,對物質的探究便一直伴隨著人類。約公元前624~546年,古希臘哲學家泰勒斯自覺地從神話宗教世界觀中擺脫出來,提出“水是萬物的根源”,具有不可再分性。然而18世紀末至19世紀初的一些實驗否定了水的不可再分性,在這短短的幾十年內[1,2],英國科學家卡文迪許由氫氣和氧氣合成了水;英國化學家道爾頓發現1g氫氣與8g氧氣反應生成了9g水;法國化學家蓋·呂薩克發現2體積氫氣與1體積氧氣反應生成了2體積水蒸氣;英國化學家尼科爾森和卡萊爾發現電解水生成的氫氣和氧氣的體積比為2∶1。
道爾頓主要是從重量的角度探究氫氣和氧氣發生反應生成水的規律。基于倍比定律、同種電荷相斥理念以及具有猜測性的“最簡法則”,道爾頓認為水的組成為HO,并寫出了反應式:H+OHO。蓋·呂薩克則是從體積的角度來探究氫氣和氧氣發生反應生成水的規律。當蓋·呂薩克發現氫氣和氧氣反應的體積比也是簡單的整數時,結合其他具有相似規律的反應,便將這種現象與倍比定律聯系在了一起,并提出假設:同溫同壓下,相同體積的不同氣體含有相同數目的“原子”。蓋·呂薩克提出的假設也是根據猜測性的“最簡法則”:相同體積的不同氣體含有“相同”(而非其他關系)數目的“原子”即為最簡單的猜測。但這個假設遭到了道爾頓的強烈反對,道爾頓認為不同原子尺寸不同,必然占據不同的空間。而且,由于研究的都是同一個反應,依據蓋·呂薩克的理論,2體積氫氣與1體積氧氣反應生成2體積水蒸氣的反應應該寫為:
2H+O2HO。這將導致HO中的O是“半個原子”的矛盾。此時,依據重量的“最簡法則”與依據體積的“最簡法則”產生了矛盾。
1811年,阿伏伽德羅仔細考察了以上實驗,認為上述矛盾的產生來自于道爾頓原子論的不完善,并正式引入分子概念,提出了兩個假設。第一個假設:同溫同壓下,相同體積的不同氣體含有相同的分子數。第二個假設:一些基本氣體分子由兩個原子組成。阿伏伽德羅認為氫氣和氧氣各由兩個原子組成,水分子則由兩個氫原子和一個氧原子組成[3]。2體積氫氣與1體積氧氣反應生成2體積水蒸氣“數量上”可表示為:2N氫氣分子+N氧氣分子2N水分子。阿伏伽德羅假設有效地解決了“半個原子”的矛盾,但此假說并不被彼時的科學界所認可。
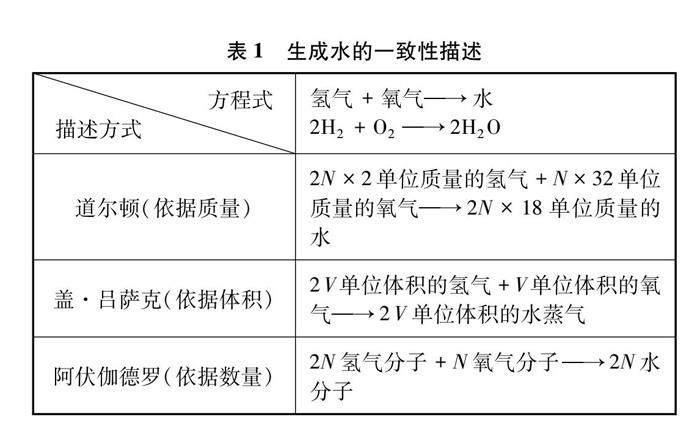
1858年,意大利化學家康尼查羅根據阿伏伽德羅假設,將氫氣和氧氣的分子式分別設定為H2和O2,并將氫原子的質量定為單位1,計算出氧原子的相對原子質量為16。康尼查羅敏銳地認識到如果認可阿伏伽德羅假設的內容,道爾頓、蓋·呂薩克、阿伏伽德羅三位科學家對氫氣和氧氣反應生成水的描述將會達到完美的一致性,“水的組成”爭議便會得到解決,如表1所示[4]。
1860康尼查羅在第一屆國際化學會議上介紹了阿伏伽德羅假設的價值,隨后阿伏伽德羅假設被科學家們所接受,阿伏伽德羅假設也變成了阿伏伽德羅定律。
1.2 阿伏伽德羅假設被接受的方法論思考
方法論是有關認識和改造世界方法的理論。在阿伏伽德羅假設被接受的過程中有以下兩點值得注意。
第一,事物描述方式的一致性。描述方式一致性是指不同的描述方式都可以描述同一個事物的本質特征。各種描述方式之間具有相通性,可以相互補充、印證和轉換,從而使人們能夠從不同的角度深入理解此事物。在認識的不成熟階段,各種描述方式之間往往會出現不一致性的現象。描述方式的不一致將推動著人們拋棄舊理論中的不合理因素,發展出新的理論以達到描述方式的一致性。“水的組成”被確定的過程正是如此。“水的組成”乃是規律世界的一部分,對生成水反應物的描述和電解水產物的描述都是對“水的組成”本質的描述,這些描述必然有著一致性。當蓋·呂薩克從“體積化合”的角度與道爾頓從“重量化合”的角度描述“水的組成”出現不一致的時候,阿伏伽德羅提出了新的假說,以使各種描述方式達到了一致性。
第二,證據推理的重要性。作為一個從實驗中總結出來的定律,阿伏伽德羅定律內容引起了科學家們極大的困惑。可以說,在某種程度上,當時的人們是通過證據(實驗現象)“被迫”接受了這一事實。感性的“不同的原子尺寸不同,必然占據著不同的空間”理解起來毫無困難,但卻不符合氣體存在的實驗現象。理性的“同溫同壓下,相同體積的不同氣體含有相同的分子數”符合氣體存在的實驗現象,卻不符合感性思維。雖然是“被迫”,人們終究還是接受了這個定律。這種“被迫”表現出了對實驗現象的尊重,體現出了證據推理的價值,這一點和當今人們對量子科學的態度頗為相似。
以上對阿伏伽德羅定律被認可過程中方法論方面的思考促使我們在教學中將描述一致性以及證據推理融入教學設計。
2 阿伏伽德羅定律教學問題
詳盡的分子動理論可以用來解釋阿伏伽德羅定律的內容[5],但問題是,這超出了高中生現有的認知范圍,而且我們也找不出有關類比對象使學生形象地理解這些內容。以上對阿伏伽德羅定律被認可的歷史考量表明,實驗現象在阿伏伽德羅定律“被迫”接受的過程中起到了關鍵作用。從這個角度來看待阿伏伽德羅定律教學,實驗現象必然有助于促使學生接受該定律以及發展學生“證據推理”核心素養。理想的阿伏伽德羅定律驗證實驗,應該在同一溫度和壓強下,“數出”相同體積的“不同氣體”的分子數是否相同,然而這一實驗至少在高中階段是不可能完成的。目前的教學,缺乏此種證據實驗,此為阿伏伽德羅定律教學的第一個問題。
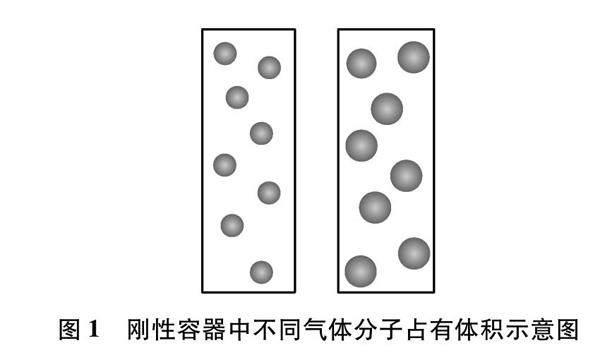
為了降低阿伏伽德羅定律內容的抽象性,人教版教材從物質固態、液態、氣態粒子間的距離入手,通過簡化的分子動理論來說明“當粒子數相同時,氣體的體積主要取決于氣體粒子之間的距離”[6]。然而,教學實踐表明,這種處理方式并不能有效降低該內容的抽象性。這是因為學生連最基本的“氣體粒子是如何占有體積”都沒有準確的把握,這將導致學生理解“粒子之間的距離”時失去思維根基。如圖1所示,在教學中我們總是傾向于設置一個“已經充滿氣體”的剛性容器來說明氣體粒子之間的距離與粒子尺寸的關系。然而阿伏伽德羅定律中的“不同氣體(或任何氣體)”實際上有著“不同分子尺寸”和“不同分子質量”兩方面內涵。剛性容器會將“不同氣體與占有體積的關系”窄化為“不同分子尺寸與占有體積的關系”,隱藏“不同分子質量與占有體積的關系”,從而導致學生不能全面認識和把握阿伏伽德羅定律。如果在一個體積可變的容器里考慮“不同氣體”占據空間,此時不僅要考慮氣體分子尺寸,還要考慮不同氣體分子具有的不同質量影響分子運動速率,進而影響分子占有體積。依據學生已有認知,同溫同壓下,不同質量的氣體分子,必然有著不同的運動速度。那么,考慮到氣體分子因運動而占有體積,同溫同壓下,相同數目、質量不同的氣體分子會占有相同的空間嗎?這個問題展現了“不同氣體”的“不同分子質量”一面。教學實踐表明,大多數學生都會給出否定的答案。那么,如何才能讓“不同氣體”展現出“不同分子質量”方面的內涵?此為阿伏伽德羅定律教學的第二個問題。
另外,在處理教材有關粒子間距離的表述信息時,如“粒子之間的距離”“平均距離”“距離等同”等,大腦傾向于在想象粒子靜止的狀態下進行“文字-圖像”心理成像聯結。此時會引發另一個問題,少部分學生會用氣體粒子運動的“瞬間”靜止狀態去理解有關“粒子之間的距離”的教材表述。由此這部分學生認為圖1兩個容器中除了球形之外的空白空間不是氣體粒子所占有的體積。并給出理由:這種剛性容器空間的維持和氣體分子沒有必然關系,即使沒有氣體,真空的空間也是一樣存在。
由于上述教學中存在的問題,阿伏伽德羅定律對學生造成的困惑不亞于19世紀阿伏伽德羅定律提出之初——阿伏伽德羅定律是公認的教學難點。
3 問題的解決
3.1 促使學生接受阿伏伽德羅定律的證據實驗
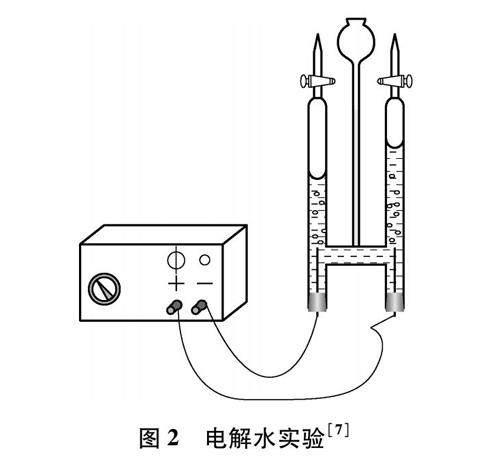
電解水實驗(見圖2)是人教版九年級化學課題3“水的組成”的主要內容之一。通過學習,學生已經知道電解水生成氫氣和氧氣的體積比為2∶1等知識點。依據描述一致性方法論,我們注意到電解水實驗能夠解決上文提出的阿伏伽德羅定律證據實驗缺乏的問題。康尼查羅基于阿伏伽德羅定律發現道爾頓、蓋·呂薩克、阿伏伽德羅三位科學家對氫氣和氧氣反應生成水具有描述一致性,確認了氫氣、氧氣、水分子分別以H2、 O2、 H2O存在。反過來,在學生已經知道氫氣、氧氣、水分子分別以H2、 O2、 H2O存在的情況下,依據描述一致性方法論,則可以通過電解水實驗來推出阿伏伽德羅定律內容(見下文簡要教學設計)。
3.2 促使學生接受阿伏伽德羅定律的簡要教學設計
[教師]帶領學生回顧圖2電解水實驗,提出問題:為什么電解水產生的氫氣與氧氣體積之比為2∶1?
[學生]對上述問題進行思考,討論。一般情況下,學生會將答案歸于“生成的氫氣與氧氣為2∶1”上,這種不嚴謹、來自直覺的答案已經暗含著阿伏伽德羅定律的萌芽。
[教師]在“生成的氫氣與氧氣為2∶1”的答案中,是指分子數量、分子質量,還是只有體積為2∶1?
[學生]從實驗現象來看,生成氫氣和氧氣的體積之比為2∶1;從化學方程式來看,生成氫氣和氧氣的分子數量之比是2∶1。
[教師]氫氣和氧氣的體積之比與分子數量之比都是2∶1,這是一種巧合,還是一種必然呢?請同學們填寫下列表格2,對電解36g水的電解產物進行質量、物質的量、數量及體積比的描述。
[教師]在填寫表2之前給予學生“描述方式一致性”的解釋和說明。
[學生]根據已有的知識,得出質量和數量(或物質的量)的描述方式具有一致性。但是按照體積的描述方式是否能夠納入這種一致性,即便在一些九年級的教學中已經有所補充[8],但大部分學生依然會有比較大的疑惑。這個疑惑正是指向了阿伏伽德羅定律內容。
[教師]結合表1,呈現圖3進行講解:電解36g水生成的氫氣和氧氣分子數量比為2∶1,體積比也是2∶1,將得到的氫氣體積設為2V,氧氣的體積設為V,接下來將氫氣體積平均分為V兩部分,那么V體積氫氣和V體積氧氣所含的分子數一樣多嗎?
[學生]得出答案:V體積氫氣和V體積氧氣所含的分子數一樣多。
[教師]V體積氫氣和V體積氧氣所含的分子數一樣多,是在同溫同壓的條件下嗎?
[學生]在同溫同壓的條件下。
[教師]科學家們做了大量的實驗,發現在相同的溫度和壓強下,不僅僅是氫氣和氧氣,而是相同體積的任何氣體都含有相同數目的粒子。這就是令人感到不可思議的阿伏伽德羅定律。
[學生]為什么相同的溫度和壓強下,相同體積的任何氣體都含有相同數目的粒子?不同的氣體分子大小不一,肯定占據著不同的體積。
[教師]雖然同學們感性上不能認同,但作為證據的實驗現象表明阿伏伽德羅定律內容是正確的,因此我們必須理性地接受這個定律。證據推理的價值之一就是幫助人們用理性戰勝感性。同學們在以后的學習中,必然也會遇到類似的情形,比如不可思議的量子理論,同學們必須先要根據實驗現象理性地接受此理論。同學們的疑惑將會在接下來的環節中得到解釋。
說明:在本教學環節中,從產物“一致性”描述為切入點引出阿伏伽德羅定律是必要的。描述方式的一致性將不同氣體的相同體積和相同分子數目“粘結”在了一起。這樣的教學活動圍繞著水的本質特征“水的組成為H2O”展開,有利于學生將阿伏伽德羅定律和已有認知產生聯系。另外,電解水實驗,僅為“任何氣體”中的一個實驗,教師可再呈現電解飽和食鹽水的實驗,從化學方程式中氫氣和氯氣物質的量之比和收集到的兩種氣體體積比都是1∶1來進一步驗證阿伏伽德羅定律。
3.3 思考氣體分子如何占有體積,解釋阿伏伽德羅定律
通過上述教學環節,學生認識到阿伏伽德羅定律的正確性有著證據的支撐,但是學生對這個定律的內容一定是感到“困惑不已”,再加上“不同氣體”展現出“不同分子尺寸”和“不同分子質量”兩方面內涵的教學需要,所以有必要結合教材呈現“氣體占有體積”的構建過程,本文建議從以下兩個步驟實施。
步驟一:呈現固定體積容器(剛性容器)內的氣體體積構建過程,展現“不同氣體”的“不同分子尺寸”方面內涵(如圖4所示)。在固體體積的容器內,兩種固態物質隨著溫度升高變成液態、氣態。雖然這種方法讓學生看到了分子從固態、液態到氣態如何構建體積的過程,但由于剛性容器已經限定了體積的原因,這種方法不能將“不同分子質量與占有體積關系”問題暴露出來,也不能完全消除“靜態”思考分子間距離的思維,少部分學生認為剛性容器本身就有空間,氣態粒子未必一定去占據,由此這部分學生認為圖4氣態容器空白處體積沒有被氣體分子所占據。
步驟二:呈現體積可變容器內的氣體體積構建過程,著重展現“不同氣體”的“不同分子質量”方面的內涵以及消除學生“靜態”思考分子間距離的思維。為了進一步降低抽象性,本研究以“蜜蜂分子”主動構建體積來說明此內容。選擇“蜜蜂分子”的主要原因是學生對蜜蜂的快速飛行有著感性認識,可以輔助學生理解氣體分子的運動,如圖5所示。
3.4 分子構建氣體體積的簡要教學設計
[教師]相信同學們對阿伏伽德羅定律一定是感到“困惑不已”。以氫氣和氧氣為例,就像同學們剛剛提出的問題,氫氣和氧氣的原子半徑大小不一,數目相同的它們怎么會占據相同的空間呢?我們用大小不同的球分別代表氫氣和氧氣分子。在一個固定體積V的容器里,請同學們來畫一下氣體分子如何占有空間。
[教師]利用學生所畫的“緊密堆積在一起,占據不同空間”或“松散堆積在一起,但依然占據不同空間”圖,結合圖4進行講解:如果將溫度降低到一定程度,氫氣和氧氣將會變成固態或液態,此時分子間距離小,相同分子數目氫氣和氧氣所占據的體積肯定是不同的。而在氣態下,氣體分子是不斷高速運動著的,彼此相互碰撞,氣體分子間距離很遠。請同學們結合教材表述,觀察圖4的右邊部分,想一想,同溫同壓下,相同數目的氫氣和氧氣所占據的體積相同嗎?
[學生]大部分學生認為相同,少部分學生認為圖4右半部分除了球形之外的空白空間不是氫氣和氧氣所占有的空間,氫氣和氧氣所占據的體積不相同。
[教師]呈現圖5,講解:設想在常溫常壓下,有多只從冷凍箱中取出的“凍僵的”蜜蜂分子,以4只為代表,放入一個體積可變的球形容器中。剛開始,“蜜蜂分子”由于凍僵了而保持靜止不動,此時由于外界大氣壓的原因,容器將緊緊包裹著“蜜蜂分子”,不會有多余的空隙。接下來由于外界溫度較高,能量通過容器壁傳遞給“蜜蜂分子”,“凍僵”的“蜜蜂分子”開始慢慢升溫。在剛開始階段,“蜜蜂分子”只能在被束縛的沒有多余空間的容器中相互間緩慢爬行,被束縛的容器形狀會因為“蜜蜂分子”爬動而變化,但由于外界大氣壓的原因,“蜜蜂分子”還是緊緊被束縛,但活動范圍肯定比“凍僵”的“蜜蜂分子”占有的空間大一些。最后,“蜜蜂分子”獲得了足夠的能量,“蜜蜂分子”開始飛起來。由于“蜜蜂分子”的飛速極快(400m/s),加上相互撞擊,此時“蜜蜂分子”將以“云”形式占據著一定體積V。雖然容器中只有4只“蜜蜂分子”,卻能占據比它們本身體積大的多的空間,這是因為“蜜蜂分子”能夠在極短時間內達到圖示空間任一位置。容器體積還來不及坍塌,即被“蜜蜂分子”迅速占據(灰色表示瞬間到達某一位置的“蜜蜂分子”)。顯然,“凍僵的蜜蜂分子”、“能夠爬動的蜜蜂分子”、“快速飛動的蜜蜂分子”分別相當于物質的固態、液態、氣態。請同學們根據以上講解,思考圖4右半部分除了球形之外的空白空間是否為氫氣和氧氣所占有?
說明:圖5能夠促使學生“動態”思考“氣體分子如何占有空間”。因為此時容器不再是剛性的,只要“蜜蜂分子”停止快速飛動,“蜜蜂分子”所占據的體積立即就會“塌陷”到固、液態,這就巧妙地實現了“動態”思考“粒子之間的距離”與“占有體積”關系,圖4氣態容器空白處體積是否被氣體分子所占據的問題也就被消解掉了:在氣態時,氣體分子將在極短時間內可以達到圖4剛性容器空間的任一位置。至此,學生就建立起來了氣體分子占有空間與分子間距離“動態”的聯系,扭轉了“靜態”的思考方式。
通常,在講解“蜜蜂分子”占據空間時,很多學生還會提出這樣一個問題(如果學生沒有提出,則需要教師提出):同溫同壓下,如果將“蜜蜂分子”換成相同數量的“蒼蠅分子”(大小、質量不一),“蒼蠅分子”所占據的空間與“蜜蜂分子”占據的空間會相同嗎?這一問題極具價值。首先這個問題再一次證明了阿伏伽德羅定律內容極具抽象性的特點。只要分別將“蜜蜂分子”和“蒼蠅分子”看成氧氣、氫氣,這個問題的答案就指向了阿伏伽德羅定律內容。因此教師需要再次用電解水的實驗現象(證據)促使學生接受此定律,即在同溫同壓下相同數量的氧氣和氫氣會占據相同的體積。如此,整個教學便可構造成為邏輯上可解釋的“閉環”。更為重要的是,學生的這個問題將“剛性容器”隱藏的“不同分子質量與占有體積關系”問題完全暴露了出來,通過對此問題的探討,學生將能全面、透徹地認識阿伏伽德羅定律的內容。這個問題探討之后,教師便可引導學生結合教材表述,總結出氣體體積與氣體粒子數量、大小、質量及粒子間距離的關系。
4 結語
阿伏伽德羅定律內容超越了學生已有的分子尺寸、分子質量與占有空間關系的直覺,成為了教學中一個難點。而且由于難以找到類比的對象以及不能詳盡介紹分子動理論,我們對于阿伏伽德羅定律的抽象性總有種無能為力之感。本研究利用電解水探究實驗,解決了阿伏伽德羅定律教學缺乏實驗證據的問題,讓學生體會到了證據推理在理性戰勝感性方面的價值;在體積可變的容器中呈現分子構建氣體體積的過程,將剛性容器隱藏的“分子質量與占有體積的關系”的問題暴露了出來,為學生完整地認識阿伏伽德羅定律提供了可靠途徑。
參考文獻:
[1][4]Sarikaya M. A view about the short histories of the mole and Avogadros number [J]. Foundations of Chemistry, 2013, 15(1): 79~91.
[2]Cerruti L. The Mole, Amedeo Avogadro and Others [J]. Metrologia, 1994, 31(3): 159~166.
[3]Murrell N J. Avogadro and His Constant [J]. Helvetica Chimica Acta, 2001, 84(6): 1314~1327.
[5]傅獻彩, 沈文霞, 姚天揚等. 物理化學(上冊)[M]. 北京: 高等教育出版社, 2006: 17.
[6]王晶, 鄭長龍主編. 普通高中教科書·化學(第一冊)[M]. 北京: 人民教育出版社, 2019: 52.
[7]姜跟華. 電解水實驗的再改進[J]. 化學教學, 2023, (3): 73~75.
[8]龐剛志, 楊玉琴. “教、學、評”一體化下的學案導學教學實踐——以人教版九年級《化學》“水的組成”為例[J]. 化學教學, 2021, (10): 53~59.

