植原體引起雪花木小葉病在中國的首次報道
宋曉兵 黃峰 湯亞飛 崔一平 凌金鋒 陳霞


摘要
2022年首次在廣州市發現園林植物雪花木小葉病病株,采用分子生物學技術對其進行植原體的種類鑒定。以雪花木葉片總DNA為模板,利用植原體16S?rRNA通用引物P1/P7進行PCR擴增,獲得廣東雪花木小葉病植原體(BLLGD2022)16S?rRNA基因片段(1?811?bp,GenBank登錄號為OQ625536)。16S?rRNA序列相似性顯示,BLLGD2022與16SrVI組植原體株系的相似性最高,為97.05%~99.83%,其中與隸屬于16SrVID亞組的10個植原體株系相似性為99.21%~99.83%。系統進化分析顯示,BLLGD2022與16SrVI組各植原體株系聚類在一個大分支,其中與16SrVID亞組成員聚類在一個小分支,親緣關系最近。基于16S?rRNA序列的iPhyClassifier限制性內切酶虛擬RFLP分析表明,BLLGD2022與16SrVID亞組的參考株系Brinjal?little?leaf?phytoplasma?(GenBank登錄號為X83431)的酶切圖譜一致,相似系數為1.00。基于上述研究結果,明確廣州市雪花木小葉病植原體隸屬16SrVID亞組成員。本研究首次在園林植物雪花木上檢測到植原體,通過16S?rRNA序列分析明確為16SrVID亞組成員,為開展16SrVID亞組植原體在蔬菜、花卉和園林植物的發生監測及病害防控提供科學依據。
關鍵詞
雪花木小葉病;?植原體;?16S?rRNA;?分子鑒定
中圖分類號:
S?436.85
文獻標識碼:?A
DOI:?10.16688/j.zwbh.2023159
First?report?of?little?leaf?disease?caused?by?phytoplasma?on?Breynia?disticha?in?China
SONG?Xiaobing*,?HUANG?Feng,?TANG?Yafei,?CUI?Yiping,?LING?Jinfeng,?CHEN?Xia
(Institute?of?Plant?Protection,?Guangdong?Academy?of?Agricultural?Sciences,?Key?Laboratory?of?Green?Prevention
and?Control?on?Fruits?and?Vegetables?in?South?China,?Ministry?of?Agriculture?and?Rural?Affairs,?Guangdong?Provincial
Key?Laboratory?of?High?Technology?for?Plant?Protection,?Guangzhou?510640,?China)
Abstract
In?2022,?the?garden?plant?Breynia?disticha?exhibiting?little?leaf?symptom?was?firstly?observed?in?Guangzhou.?The?related?phytoplasma?was?identified?using?molecular?technology.?The?16S?rRNA?fragment?(1?811?bp,?GenBank?accession?no.OQ625536)?of?phytoplasma?associated?with?Breynia?disticha?little?leaf?disease?in?Guangdong?province?(BLLGD2022)?was?amplified?from?total?DNA?of?diseased?plants?using?universal?primers?P1/P7.?Sequence?similarity?analysis?based?on?16S?rRNA?sequence?showed?that?BLLGD2022?shared?the?higher?similarity?with?16SrVI?group?phytoplasma?strains,?which?was?97.05%-99.83%,?and?the?highest?similarity?(99.21%?to?99.83%)?with?10?phytoplasma?strains?belonging?to?the?16SrVID?subgroup.?Phylogenetic?analyses?showed?that?BLLGD2022?clustered?with?the?16SrVI?group?phytoplasmas?in?a?large?branch?and?with?the?16SrVID?subgroup?phytoplasmas?in?a?small?branch.?This?result?revealed?that?BLLGD2022?had?the?closest?genetic?relationship?to?the?16SrVID?subgroup?phytoplasmas.?Based?on?the?16S?rRNA?sequence,?virtual?restriction?fragment?length?polymorphism?analysis?using?iPhyClassifier?revealed?that?BLLGD2022?and?the?reference?strain?Brinjal?little?leaf?phytoplasma?(GenBank?Registration?no.X83431)?of?the?16S?rVID?subgroup?were?consistent,?with?a?similarity?coefficient?of?1.00.?Based?on?the?above?results,?the?phytoplasma?of?Breynia?disticha?little?leaf?disease?in?Guangzhou?is?a?strain?of?16SrVID?subgroup.?Phytoplasma?was?detected?firstly?on?the?garden?plant?B.disticha,?and?BLLGD2022?was?identified?to?belong?to?the?16SrVID?subgroup.?The?result?provides?scientific?basis?for?monitoring?the?occurrence?and?disease?prevention?and?control?of?16SrVID?subgroup?phytoplasma?in?vegetables,?flowers?and?garden?plants.
Key?words
Breynia?disticha?little?leaf?disease;?phytoplasma;?16S?rRNA;?molecular?identification
植原體(phytoplasma)原稱類菌原體,為專性寄生于昆蟲和植物韌皮部細胞內的細菌[1]。植原體無細胞壁,屬細菌界Bacteria柔膜菌綱Mollicutes植原體暫定屬Candidatus?genus?Phytoplasma[2],主要通過取食韌皮部的刺吸式口器昆蟲以持續增殖的方式傳播。植原體在世界范圍內引起98科1?000多種植物發病[34],常引起植株表現叢枝、畸形、花變葉、小葉、黃化等典型癥狀,嚴重影響世界各地的農林業生產[57]。由于植原體迄今還不能在人工培養基上分離培養,目前主要依據其16S?rRNA序列差異,以及rp、secY等保守基因序列、媒介昆蟲、天然植物寄主等進行鑒定與分類[8]。植原體暫定屬下的分類單元有種(species)、組(group)和亞組(subgroup),截至2019年6月,已鑒定命名的植原體種共有52個,歸屬34個組[9]。
雪花木Breynia?disticha,為葉下珠科(原大戟科)黑面神屬Breynia常綠灌木,葉色鮮明,葉緣有白色斑點或乳白色斑紋,同一植株有綠白兩色葉,又稱彩葉山漆莖,起源于玻利維亞,喜高溫,能適應我國南方省市栽培。雪花木是一種常綠彩葉植物,具有較高的觀賞價值,在現代園林建設中越來越受到重視[1011],在我國嶺南地區作為園林植物廣泛栽培。2022年,在廣東省廣州市天河區市政綠化道發現表現為小葉、節間縮短、葉片聚生等癥狀的雪花木小葉病病株,疑似由植原體侵染所導致。本文采用分子生物學方法,對疑似病樣進行檢測,進一步對相關植原體的16S?rRNA進行克隆和序列分析,明確其分類地位,為防治該病害提供科學依據。
1?材料與方法
1.1?試驗材料和試劑
雪花木小葉病的病樣于2022年9月采集自廣東省廣州市天河區市政綠化道。植物基因組DNA提取試劑盒(Easypure?Plant?Genomic?DNA?Kit)和大腸桿菌Escherichia?coli?T1感受態細胞購自北京全式金生物技術有限公司;Premix?TaqTM、pMD?19T?Vector購自寶生物工程(大連)有限公司。
1.2?病樣總DNA的提取
取雪花木病樣約100?mg,利用植物DNA提取試劑盒提取其總DNA,具體步驟參照試劑盒說明書。所獲總DNA溶解于50?μL?ddH2O中,-20℃冰箱保存備用。
1.3?16S?rRNA基因的擴增
利用擴增植原體16S?rRNA的通用引物P1(5′AAGAGTTTGATCCTGGCTCAGGATT3′)/P7(5′CGTCCTTCATCGGCTCTT3′)[12],對疑似病樣總DNA進行PCR檢測,預期擴增目的片段大小為1.8?kb。反應體系30.0?μL:待測樣品總DNA?1.0?μL,?Ex?TaqTM?Premix?15.0?μL,引物P1/P7(10?μmol/L)各1.0?μL,ddH2O?12.0?μL。反應程序:95℃?預變性4?min;95℃?1?min,55℃?1?min,72℃?90?s,35個循環;72℃?延伸10?min。PCR產物進行1%瓊脂糖凝膠電泳檢測。
1.4?基因克隆與測序
將所獲目的片段進行純化,連接至pMD19T載體,采用熱激法將其轉化到大腸桿菌T1感受態細胞,吸取80?μL菌液涂布在含100?μg/mL?Amp、40?μL/mL?Xgal的LB固體培養基平板上,37℃倒置培養過夜;挑取陽性單菌落送至生工生物工程(上海)股份有限公司進行測序。
1.5?序列分析
利用DNAStar的SeqMan對序列拼接,將所獲得的完整序列在GenBank數據庫中進行BLASTn搜索,確定是否為植原體基因序列;利用在線分析工具MUSCLE?(https:∥www.ebi.ac.uk/Tools/msa/muscle/)將所獲得的16S?rRNA序列與已報道的相關序列進行相似性分析。采用MEGA?6.0的最大似然法(maximum?likelihood,ML)[13]構建基于16S?rRNA的系統進化樹,Bootstrap值設置為1?000。進一步將16S?rRNA序列通過植原體在線分類軟件iPhyClassifier(https:∥plantpathology.ba.ars.usda.gov/cgibin/resource/iphyclassifier.cgi)進行虛擬RFLP分析和計算相似系數,確定其分類地位[14]。
2?結果與分析
2.1?田間癥狀
雪花木小葉病病株主要表現為小葉、節間縮短、葉片聚生,多數葉片邊緣向內皺縮,與正常植株差異明顯(圖1)。該病害影響雪花木的光合作用,導致植株抗逆性逐步減弱,后期造成植株早衰,葉片易脫落。
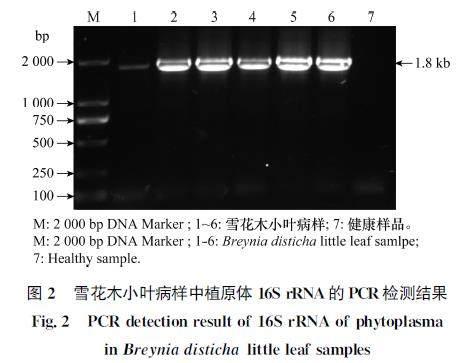
2.2?PCR檢測結果
利用擴增植原體16S?rRNA的引物P1/P7對6份雪花木小葉病病樣進行PCR檢測,電泳結果顯示(圖2),所有病樣中均擴增出約1.8?kb大小的條帶,而健康植株中未擴增出相應條帶。這一結果表明,所采集的6份雪花木疑似病樣中存在植原體,并命名為廣東雪花木小葉植原體(BLLGD2022)。
2.3?16S?rRNA序列分析
利用擴增植原體16S?rRNA序列的通用引物P1/P7,從廣東雪花木小葉病樣總DNA中PCR擴增獲得該基因片段,大小為1?811?bp?(GenBank登錄號為OQ625536),該片段包含16S?rRNA基因(1~1?530?nt)、含有rRNA?Ile的16S23S?rRNA間區(1?531~1?781?nt)和部分23S?rRNA基因序列(1?782~1?811?nt)。BLAST分析結果顯示,BLLGD2022與隸屬于16SrVI組(苜蓿增生植原體組,Clover?proliferation?group)植原體株系的相似性較高。進一步利用在線MUSCLE軟件對BLLGD2022與其他32個植原體相關序列進行核苷酸相似性分析,結果表明(表1),BLLGD2022與16SrVI組各植原體株系的相似性最高,為97.05%~99.83%,與其他組植原體的相似性較低,為89.19%~96.56%;其中與來自印度的隸屬于16SrVID亞組的木豆植原體clone?62株系以及茄子小葉植原體BLL25、LLB_MKS3、LLB_MKS5和LLB_MKS6株系相似性最高,均為99.83%;其次,與印度、孟加拉國和加拿大報道的16SrVID亞組的茄子植原體和茄子小葉植原體其他5個株系的16S?rRNA序列相似性為99.28%~99.82%;與中國報道的隸屬于16SrVI組的芥菜花變葉植原體OM1株系、芥菜叢枝植原體OM3株系相似性均為98.89%。
以柑橘黃龍病菌亞洲種(Candidatus?Liberibacter?asiaticus?isolate?B4)(MH368771)的16S?rRNA序列為外群,利用MEGA?6.0的最大似然法對BLLGD2022與32個植原體株系進行系統進化分析,結果顯示(圖3),BLLGD2022與隸屬16SrVI組的25個植原體株系聚類在一個大分支,親緣關系較近;進一步與隸屬16SrVID亞組的茄子小葉植原體8個株系及木豆、印楝樹植原體相關株系聚類在一個小分支,親緣關系更近;而與隸屬于16SrVII、16SrIX、16SrI、16SrII組的7個植原體株系親緣關系較遠。
2.4?16S?rRNA序列的iPhyClassifier在線分析
利用植原體在線分類軟件iPhyClassifier對BLLGD2022的16S?rRNA序列進行虛擬RFLP分析,結果顯示(圖4):基于Taq?I、Ssp?I、Rsa?I、Mse?I、Sau3A?I、Kpn?I、Hpa?II、Hpa?I、Hinf?I、Hha?I、Hae?III、EcoR?I、Dra?I、BstU?I、Bfa?I、BamH?I和Alu?I共17種限制性內切酶的虛擬RFLP圖譜,BLLGD2022與16SrVID亞組的參考株系Brinjal?little?leaf?phytoplasma(GenBank登錄號為X83431)的酶切圖譜一致,相似系數為1.00,表明BLLGD2022屬于16SrVID亞組成員。
3?結論與討論
植原體的分類鑒定是植原體研究和防控病害的基礎,植原體組和亞組的劃分標準基于17種限制性內切酶對16S?rRNA序列進行多態性對比分析。通過與所有已發表的植原體16S?rRNA序列比較,相似系數F>0.97,劃分為已有16Sr亞組的不同株系或變種;相似系數F介于0.85~0.97,劃分為一個新的16Sr亞組;相似系數F≤0.85,劃分為一個新的植原體16Sr組[1516]。截至2019年6月,已鑒定出植原體為52個暫定種、34個組和100多個亞組[9]。16SrVI組為苜蓿增生植原體組(clover?proliferation?group),于2004年被正式命名,包括引起苜蓿叢枝、甜菜綠化、茄子小葉、三葉草增生、馬鈴薯叢枝、馬鈴薯黃化、番茄巨芽、百香果叢枝、柳樹叢枝等癥狀的植原體[1719]。2022年,本團隊在廣東省廣州市首次發現了雪花木小葉病,PCR檢測表明該病樣感染了植原體,命名為廣東雪花木小葉植原體(BLLGD2022),通過16S?rRNA序列分析明確與廣東雪花木小葉病相關的植原體屬于16SrVID亞組。本研究首次在雪花木上檢測到植原體,并鑒定該株系為16SrVID亞組植原體,為研究植原體群體多樣性、病害監測以及防控提供了基礎數據。
據報道,16SrVID亞組植原體在印度廣泛侵染茄子、生菜、芹菜、甘藍、萵苣等蔬菜,尤其是茄子小葉病已造成了嚴重經濟損失[2021],在我國16SrVID亞組植原體病害尚未見報道。植原體大量存在于寄主植物的韌皮部篩管細胞中,自然條件下植原體大多依賴于通過取食韌皮部汁液的半翅目媒介昆蟲以持久性傳播的方式在其宿主間實現高效的傳播,主要植原體媒介昆蟲有葉蟬科、飛虱科和木虱科等植食性昆蟲[22]。例如茶樹小綠葉蟬Empoasca?flavescens傳播花生叢枝植原體[23],擬帕小綠葉蟬Empoasca?(Matsumurasca)?paraparvipenis傳播喜樹叢枝植原體[24],異沙葉蟬Psammotettix?alienus傳播小麥藍矮植原體[25]等。在感染茄子小葉病的菜場采集到已知的5種葉蟬,只有1種葉蟬Hishimonas?phycitis的唾液腺中檢測到16SrVID亞組植原體,表明其是16SrVID亞組植原體的重要媒介昆蟲[21]。16SrVID亞組植原體借助媒介昆蟲傳播的范圍更廣,具有更為廣泛的宿主范圍和傳播能力,因此對該亞組植原體株系的研究具有重要的流行病學意義。
廣東省地處熱帶和亞熱帶地區,常年高溫高濕,物種資源豐富,植物和介體昆蟲周年可生長與繁殖,為植原體引發的植物病害發生提供了有利條件[26]。本研究首次在雪花木上鑒定到16SrVID亞組植原體侵染引起的雪花木小葉病,該病害的病原與廣泛發生在印度的茄子小葉病的病原分類地位一致,均為16SrVID亞組植原體。據報道,16SrVID亞組植原體還侵染芝麻、多種觀賞植物和藥用植物等[2728],由此推測,該亞組植原體病害未來極有可能通過介體昆蟲在廣東地區蔓延,引起多種蔬菜、園林植物植原體病害,因此需要重點關注。由于目前還缺乏有效防治植原體病害的藥劑,防治傳病介體昆蟲對防控該類病害的擴散和發生至關重要。因此,下一步亟須開展傳菌介體昆蟲種類鑒定、介體昆蟲的帶菌情況監測等研究工作,為16SrVID亞組植原體病害的防控提供科學依據。
參考文獻
[1]?OSHIMA?K,?KAKIZAWA?S,?NISHIGAWA?H,?et?al.?Reductive?evolution?suggested?from?the?complete?genome?sequence?of?a?plant?pathogenic?phytoplasma?[J].?Nature?Genetics,?2004,?36(1):?2729.
[2]?RAZIN?S,?YOGEV?D,?NAOT?Y.?Molecular?biology?and?pathogenicity?of?mycoplasmas?[J].?Microbiology?Molecular?Biology?Reviews,?1998,?62(4):?10941156.
[3]?GASPARICH?G?E.?Spiroplasmas?and?phytoplasmas:?microbes?associated?with?plant?hosts?[J].?Biologicals,?2010,?38(2):?193203.
[4]?李繼東,?陳鵬,?倪靜,?等.植原體致病分子機理研究進展[J].?園藝學報,?2019,?46(9):?16911700.
[5]?楊毅,?車海彥,?曹學仁,?等.?植原體基因組學研究進展[J].?植物保護,?2014,?40(6):?16.
[6]?耿顯勝,?舒金平,?王浩杰,?等.?植原體病害的傳播、流行和防治研究進展[J].?中國農學通報,?2015,?31(25):?164170.
[7]?李豐,?賴剛剛,?趙志慧,?等.?新疆柳樹花變葉植原體分子鑒定[J].?西北農業學報,?2022,?31(10):?13741380.
[8]?盧恒宇,?魏輝,?楊廣.?植原體病害研究進展[J].?福建農業學報,?2016,?31(3):?326332.
[9]?楊毅,?姜蕾,?李世訪.?植原體分類鑒定研究進展[J].?植物檢疫,?2020,?34(5):?1320.
[10]黃阿鳳,?羅德超,?鄭濤,?等.?雪花木扦插繁殖試驗初報[J].?福建熱作科技,?2012,?37(4):?2627.
[11]魏燕雄.?珠三角地區現代植物墻的調查與分析[D].?廣州:?仲愷農業工程學院,?2017.
[12]GUNDERSEN?D?E,?LEE?I?M.?Ultrasensitive?detection?of?phytoplasmas?by?nestedPCR?assays?using?two?universal?primer?pairs?[J].?Phytopathologia?Mediterranea,?1996,?35(3):?144151.
[13]TAMURA?K,?STECHER?G,?PETERSON?D,?et?al.?MEGA6:?Molecular?evolutionary?genetics?analysis?version?6.0?[J].?Molecular?Biology?and?Evolution,?2013,?30(12):?27252729.

