離子液體萃取精餾分離甲醇-乙腈共沸體系
李麗 肖孟杰 李文秀 馬帥 張弢
摘 ?????要:使用離子液體1-己基-3-甲基咪唑六氟磷酸鹽([HMIM][PF6])作為分離甲醇和乙腈共沸物系的夾帶劑,在101.3?kPa下獲得了三元氣液相平衡(VLE)數據,用非隨機雙液(NRTL)模型關聯實驗數據,得到基于NRTL模型的二元交互作用參數,同時計算出離子液體打破共沸需要的最小摩爾分數為0.036?7。最后,用過量焓分析解釋分離機理。
關 ?鍵 ?詞:甲醇;乙腈;離子液體;NRTL;過量焓分析
中圖分類號:TQ028 ??????文獻標識碼: A ??????文章編號: 1004-0935(2024)05-0654-04
甲醇和乙腈是化學生產中重要的有機溶劑,廣泛應用于各個領域[1-2]。在以甲醇和乙腈為原料合成鹽酸乙脒[3]工業生產過程中會產生大量的甲醇和乙腈混合物,為了能夠回收甲醇和乙腈,必須選擇合適可行的方法分離甲醇和乙腈。近年來萃取精餾技術被廣泛地應用在共沸物分離上[4]。夾帶劑的選擇是萃取精餾的關鍵[5]。目前,離子液體由于其高穩定性、高選擇性等獨特的理化性質而備受關注[6]。
李青[7]等研究了[OMIM][BF4]和[EMIM][BF4]對甲醇-乙腈共沸體系產生的影響。結果表明,[OMIM][BF4]對甲醇的鹽析作用強于[EMIM][BF4]。朱久娟[8]等用NRTL模型對[HMIM][OTF]-甲醇-乙腈的三元氣液相平衡(VLE)數據進行了擬合,計算出其消除共沸最小摩爾分數為0.042。
利用COSMOthermX軟件對離子液體進行了篩選。選擇 [HMIM][PF6]作為分離甲醇和乙腈共沸物系的夾帶劑,獲得了甲醇+乙腈+離子液體的VLE數據,并用NRTL模型進行了關聯,得到了打破共沸的最小摩爾分數,并用過量焓分析解釋分離機理。
1 ?實驗部分
1.1 ?實驗藥品
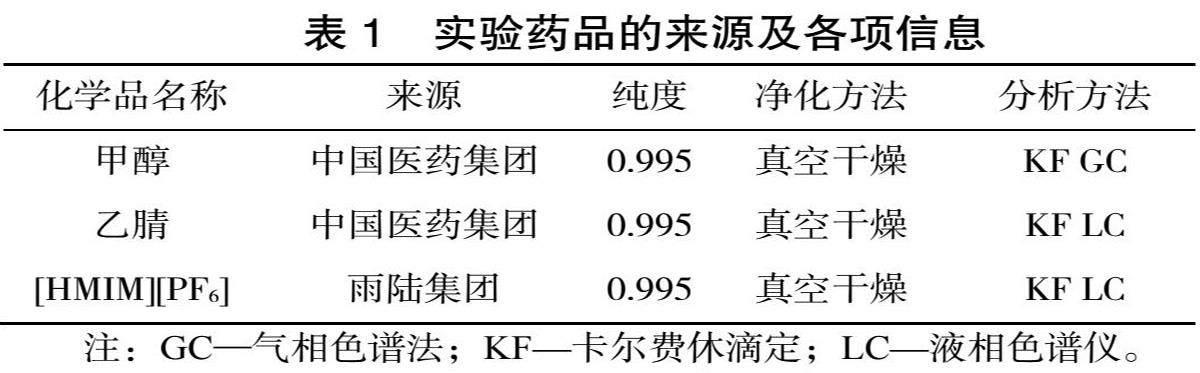
實驗藥品的來源等信息如表1所示。
注:GC—氣相色譜法;KF—卡爾費休滴定;LC—液相色譜儀。
1.2 ?實驗裝置及方法
實驗數據是在101.3 kPa下由全玻璃動態循環蒸餾器(NGW)測量所得,采用配有頂空進樣器的氣相色譜儀對氣液相試樣進行分析,檢測器為FID,進樣口及檢測器的溫度為473.15 K和453.15 K,柱箱溫度為315.15 K。配置好的液體二元或三元樣品在平衡釜中加熱至沸騰并測量溫度,直至溫度不變且保持30?min,記錄平衡溫度,并用微量取樣器分別取出氣相和液相試樣進行分析。由于離子液體的蒸氣壓可以忽略不計,因此可以通過稱量真空干燥后的液相試樣的質量變化得到離子液體的含量。
1.3 ?實驗裝置可靠性的驗證
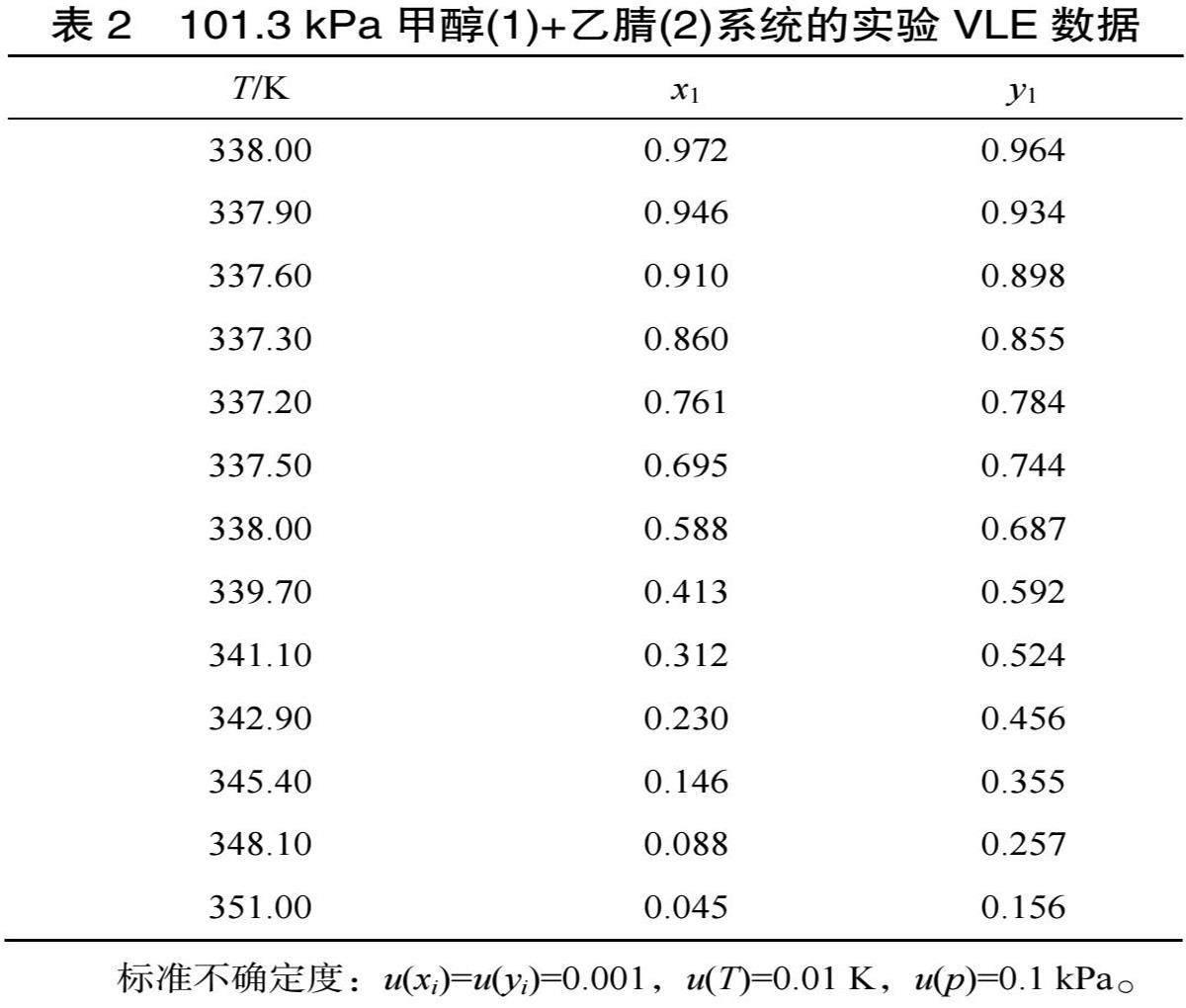
甲醇+乙腈混合物的二元VLE數據見表2。
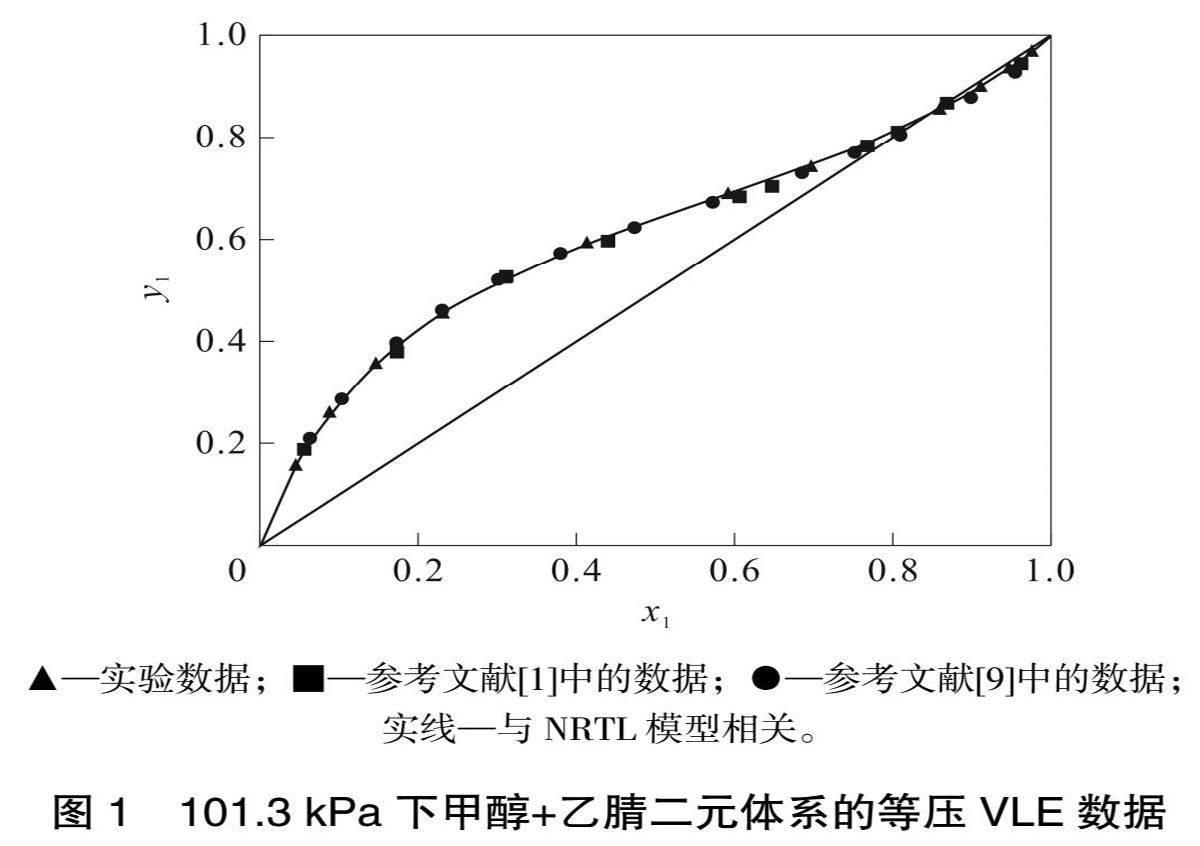
表2中T表示VLE溫度,x1、y1分別表示液相和氣相中甲醇的摩爾分數。為了驗證VLE裝置的可靠性,將實驗二元VLE數據與文獻數據進行了比較,實驗結果和文獻數據如圖1所示。
由圖1可知,實驗數據與文獻數據吻合較好。使用Wisniak的L-W方法和vanNess方法[9-10]來檢查實驗數據的熱力學一致性,實驗檢測結果為????F=2.36,?y=0.000?7,F<5且 ?y<0.01,表明二元數據符合熱力學標準,以上結果表明本工作中的裝置是可靠的。
2 ?結果和討論
2.1 ?三元VLE數據
三元實驗數據如表3所示,其中x3為離子液體的摩爾分數,x1為甲醇的摩爾分數,x1?為液相中不含離子液體的甲醇摩爾分數,y1為氣相甲醇摩爾分數,α12為甲醇對乙腈的相對揮發度,T表示三元體系平衡后的平衡溫度。
圖2為x1?-y1關系圖。由圖2可以清晰看出,離子液體的加入使共沸體系的共沸點上移,當離子液體到達一定摩爾分數時,共沸點消失。通過NRTL模型可以計算出[HMIM][PF6]打破共沸最小摩爾分數為0.036?7,略小于之前的文獻[8]。
相對揮發度(α12)是評價離子液體分離共沸混合物能力的一個非常重要的指標。相對揮發值越大,離子液體的分離效果越好[13]。
由表3可以看出,相對揮發性隨著離子液體摩爾分數的增加而增加。當[HMIM][PF6]的摩爾分數分別為0.05、0.037時相對揮發性自始至終大于1,則表明甲醇-乙腈系統的共沸點消失,與NRTL模型擬合結果相一致。
由于離子液體的極低揮發性,標準不確定度u(x1)=u(y1)=0.002,u(T)=0.01 K,u(p)=0.1 kPa,y3=0。
2.2 ?NRTL模型中的相關參數
非隨機雙液相模型(NRTL)是目前關聯含有離子液體的非理想液體數據的常用的關聯模型[11],在本實驗中,VLE數據由NRTL模型進行關聯,通過Levenberg-Marquardt方法[12]最小化目標函數(ARD)得到二元交互作用參數并列于表4。從較小的ARD結果可以看出,NRTL方程很好地擬合了實驗數據。
3 ?機理分析
在化學熱力學理論中,用溶液的過量焓(HE)描述了共沸體系的非理想化過程,過量焓由靜電配位(MF)、范德華力(vdW)和氫鍵(HB)組成。過量焓的值大于0代表反應過程為吸熱反應,反之則是放熱反應。在這項工作中,使用COSMOthermX 19.0軟件,在298.15?K下計算了離子液體[HMIM][PF6]與體系的過量焓[14]。特有摩爾分數的過量焓的計算結果如表5所示。
由表5可以看出,甲醇和離子液體之間的溶解過程是吸熱的,而乙腈和離子液體之間的溶解過程是放熱的。這表明離子液體更多地與乙腈結合,從而可以分離出甲醇。離子液體含量增加,放熱效應也增加。因此,可以判斷出對于甲醇-乙腈共沸體系,離子液體[HMIM][PF6]具有較強的破壞打破共沸?能力。
4 ?結 論
本實驗選擇離子液體[HMIM][PF6]作為夾帶劑分離甲醇-乙腈共沸系。在101.3?kPa下測定了[HMIM][PF6]-甲醇-乙腈三元體系的氣液相平衡數據,實驗結果表明,離子液體的加入可以使共沸點上升,直至打破共沸。根據過量焓分析,離子液體與乙腈的結合降低乙腈的活性,增加甲醇的相對揮發度,進而打破共沸,且離子液體的摩爾分數越大,打破共沸現象就越明顯。通過NRTL模型的擬合得出二元交互作用參數并計算出離子液體[HMIM][PF6]打破甲醇-乙腈共沸的最小摩爾分數為0.036?7,略小于之前的文獻。
參考文獻:
[1] LI Y, BAI P, ZHUANG?Q. Isobaric vapor-liquid equilibrium for binary system of methanol and acetonitrile[J].?Fluid Phase Equilibria, 2013, 340: 42-45.
[2] 崔佳,李知春,肖海成,等.乙腈-水萃取精餾及熱集成改進工藝多目標優化[J].石油學報(石油加工),2022,38(5):1135-1147.
[3] OGAWA S,?YOSHIMURA?E.?Comparison of methanol and acetonitrile eluents for the quantitation of chelators specific to soft-metal ions by HPLC[J].?J. Chromatogr. B Anal. Technol. Biomed. Life Sci., 2012,?909:?34-36.
[4] DONG Y, DAI C, LEI?Z. Separation of the?methanol-ethanol-water mixture using ionic liquid[J].?Industrial & Engineering Chemistry Research, 2018, 57(32): 11167-11177.
[5] ZHANG K, XU D, ZHOU?Y, et al. Isobaric vapor-liquid phase equilibrium measurements, correlation, and prediction for separation of the mixtures of cyclohexanone and alcohols[J].?Journal of Chemical & Engineering Data, 2018, 63(6): 2038-2045.
[6] PEREIRO A B, ARA?JO J M M, ESPERAN?A?J, et al. The application of ionic liquids in azeotropic system separation-a review[J].?Chinese Journal of Chemical Thermodynamics, 2012, 46: 2-28.
[7] LI?Q, ZHU?W,?LIU?B, et al. Measurement and correlation of the vapor-liquid equilibrium for methanol +acetonitrile + imidazolium-based ionic liquids at 101.3 kPa[J].?J. Chem.Thermodyn.,?2016, 101:25-30.
[8]?ZHU J,?FAN H, SUN?B, et al. Effect and mechanism of 1-hexyl-3-methylimidazolium-based ionic liquids on the isobaric vapor-liquid equilibria of methanol+ acetonitrile?at 101.3 kPa[J].?Journal of Chemical & Engineering Data, 2020, 65(11): 5405-5412.
[9] WISNIAKA?J,ORTEGAB?J,FERN?NDEZB?L. A fresh look at the thermodynamic consistency of vapour-liquid equilibria data[J].?J. Chem.?Thermodynamics,2016, 105:385-395.
[10] WISNIAK?J,?APELBLAT?A,?SEGURA?H. An assessment of thermos- dynamic consistency tests for vapor-liquid equilibrium data[J].?Phys. Chem. Liq.,1997, 35 (1):1-58.
[11] RENON?H,PRAUSNITZ?J?M. Local compositions in?thermodynamic excess functions for liquid mixtures[J].?AIChE J.,1968, 14:135-144.
[12] LEVENBERG K. A method for the solution of certain non-linear problems in least squares[J].?Quarterly of applied mathematics, 1944, 2(2): 164-168
[13] LI W, LI L, ZHANG?L, et al. Isobaric vapor-liquid equilibrium for 2-butanone + ethanol + phosphate-based ionic liquids at 101.3?kPa[J].?Fluid Phase Equilibria, 2017:57-64
[14] GARC?A-MIAJA G, TRONCOSO J,?ROMAN??L.?Excess properties for binary systems ionic liquid + ethanol: experimental results and theoretical description using the ERAS model[J].?Fluid Phase Equilib.,?2008,274:59-67.
Separation of Methanol-Acetonitrile Azeotrope System
by Ionic Liquid Extractive Distillation
LI Li,XIAO Mengjie, LI Wenxiu, MA Shuai, ZHANG Tao
(Shenyang University of Chemical Technology, Shenyang Liaoning 110142, China)
Abstract:?The ionic liquid 1-hexyl-3-methylimidazolium hexafluorophosphate ([HMIM][PF6]) was used as the entrainer for separating the azeotrope system of methanol and acetonitrile. The ternary vapor-liquid equilibrium (VLE) data were obtained at 101.3 kPa. The experimental data were correlated with the non-random dual-liquid (NRTL) model to obtain the binary interaction parameters. At the same time, the minimum mole fraction required to break the azeotrope was calculated to be 0.036 7. The separation mechanism was explained by excess enthalpy analysis.
Key words:??Methanol; Acetonitrile; Ionic liquid; NRTL;?Excess enthalpy analysis
基金項目:國家自然科學基金資助項目(項目編號:21576166)。
收稿日期:2023-03-21
作者簡介:李麗(1997-),女,遼寧省朝陽市人,在讀碩士研究生,研究方向:傳質與分離。
通信作者:張弢(1975-),男,副教授,博士,研究方向:化工分離技術。

