丹參酮ⅡA通過調節PI3K/AKT及MAPK信號通路保護癲癇大鼠神經元損傷的作用機制
韓衛南 石露露 韓博
摘要? 目的:探討丹參酮ⅡA保護癲癇模型大鼠神經元損傷的作用機制。方法:將126只成年雄性大鼠隨機分為假手術組(Sham組)、紅藻氨酸注射組(KA組)、假手術+丹參酮ⅡA組(Sham+TA組)、KA+丹參酮ⅡA組(KA+TA組)、KA+丹參酮ⅡA+二硫代氨基甲酸二乙酯(DDC)組(KA+TA+DDC組)、KA+50 mg/kg氯喹(CQ)組(KA-CQ組)。采用免疫熒光染色評價海馬CA3區中心區域內神經元染色反應,檢測大鼠腦組織中超氧化物歧化酶(SOD)活性。提取大鼠的海馬區組織,采用蛋白免疫印記(Western Blot)法檢測SOD1、SOD2、微管相關蛋白輕鏈Ⅰ/Ⅱ(LC3Ⅰ/Ⅱ)、磷脂酰肌醇3-激酶(PI3K)、蛋白激酶B(AKT)、絲裂原活化蛋白激酶(MAPK)和Beclin1蛋白的相對表達量。結果:免疫熒光檢測顯示,KA組NeuN+細胞的免疫反應水平明顯低于Sham組和Sham+TA組,尤其是在海馬CA3區;KA+TA組NeuN(+)細胞的免疫反應水平明顯高于KA組。雙染色結果發現,KA組大鼠海馬CA3區LC3Ⅰ/Ⅱ表達明顯增加,KA+TA組神經元LC3Ⅰ/Ⅱ表達水平降低。Western Blot檢測結果顯示,KA組SOD1和SOD2蛋白表在水平明顯低于Sham組,KA+TA組SOD1和SOD2蛋白水平高于KA組,Beclin1表達低于KA組。與Sham組相比,KA組和KA+TA+DDC組大鼠海馬CA3區NeuN(+)細胞較少。與Sham組相比,KA+TA+DDC組LC3Ⅰ/Ⅱ和Beclin1蛋白水平明顯高于Sham組和KA組。KA+TA組大鼠海馬區PI3K蛋白表達水平明顯高于KA組和KA+TA+DDC組,而KA+TA+DDC組大鼠海馬區PI3K蛋白表達水平低于KA組和KA+TA組。結論:丹參酮ⅡA預處理對KA誘導的大鼠顳葉癲癇模型神經元損傷具有保護作用,這可能是通過激活PI3K/AKT和MAPK通路調節自噬活性相關。
關鍵詞? 癲癇;丹參酮ⅡA;神經元損傷;紅藻氨酸;磷脂酰肌醇3-激酶;蛋白激酶B;絲裂原活化蛋白激酶;超氧化物歧化酶;實驗研究
doi:10.12102/j.issn.1672-1349.2024.11.008
癲癇是大腦神經元突發性異常放電導致短暫的大腦功能障礙的一種慢性疾病,其引起的神經毒性可導致海馬CA3區神經元損傷[1]。注射紅藻氨酸(kainic acid,KA)誘導的大鼠癲癇模型可導致類似于顳葉癲癇(temporal lobe epilepsy,TLE)病人的行為發作和神經病理損害。丹參酮ⅡA是從中藥丹參中提取出來的一種有效成分,具有清熱解毒、活血化瘀、散結的功效。有研究發現,丹參酮ⅡA對帕金森病、神經行為障礙、神經興奮劑毒性和腦缺血損傷等神經系統疾病具有潛在的治療,同時具有一定保護神經元損傷的作用[2]。癲癇的發病機制復雜,氧化應激在癲癇的誘導中發揮重要作用。在癲癇發作期間,大腦中活性氧(reactive oxygen species,ROS)的產生會明顯增加,ROS的大量積累可以直接破壞蛋白質等大分子,降解細胞結構,最終導致細胞凋亡[3]。自噬是一種分解代謝過程,通過細胞內溶酶體的作用降解物質,在神經元損傷中發揮關鍵作用[4],ROS廣泛參與了自噬的誘導,作為一
基金項目? 河北省中醫藥管理局科研計劃項目(No.2019539)
引用信息? 韓衛南,石露露,韓博.丹參酮ⅡA通過調節PI3K/AKT及MAPK信號通路保護癲癇大鼠神經元損傷的作用機制[J].中西醫結合心腦血管病雜志,2024,22(11):1967-1975.
種獨特的信號分子發揮作用,而丹參酮ⅡA具有一定的清除氧自由基的效應。在前期的研究中發現,丹參酮ⅡA可通過誘導正核因子-E2相關因子2(Nrf2)依賴的血紅素加氧酶-1(HO-1)活化來抑制氧化應激所致的神經元損傷,其神經保護作用是通過調節一氧化氮(NO)信號通路來實現的[5]。雖然丹參酮ⅡA具有抗癲癇損傷的神經保護作用,但其潛在的機制仍不清楚。因此,本研究探討丹參酮ⅡA對癲癇大鼠模型神經元損傷的潛在作用機制,以期為其臨床應用提供參考。
1? 材料與方法
1.1? 實驗動物及分組
126只8~10周成年雄性美國癌癥研究所(Institute of Cancer Research,ICR)大鼠購于河北省實驗動物中心,生產許可證號:SCXK(冀)2021-002,體質量(270±10)g,飼養環境溫度為(25±2)℃,光/暗周期為12 h。可自由獲得食物和水,適應性喂養1周后進行實驗。丹參酮ⅡA(純度≥98%)由上海源葉生物科技有限公司(中國上海)提供。紅藻氨酸(KA)、二硫代氨基甲酸二乙酯(DDC)和氯喹(CQ)由揚州科能生物科技有限公司(揚州)提供。將大鼠隨機分為6組:假手術組(Sham組)、KA注射組(KA組)、假手術+丹參酮ⅡA組(Sham+TA組)、KA+丹參酮ⅡA組(KA+TA組)、KA+丹參酮ⅡA+DDC組(KA+TA+DDC組)、KA+50 mg/kg CQ組(KA-CQ組)。Sham+TA組、KA+TA組和KA+TA+DDC組均于手術前給予50 mg/kg丹參酮ⅡA灌胃,連續灌胃3 d。KA+TA+DDC組于手術前7 d腹腔注射DDC 700 mg/kg。KA-CQ組于手術前7 d腹腔注射50 mg/kg的CQ。大鼠麻醉滿意后,拔除頭頂毛發,固定于定位器。對頭頂進行消毒,并對皮膚進行縱向或橫向切割,以定位前穹窿。然后定位Bregma點,用于將頭部固定螺釘定位在相對于Bregma 1.0 mm腹側0.22 mm、深度3.0 mm的位置。用微量注射器注射KA,把注射器放在定位器上,小心地將針放到頭蓋骨上洞下面3 mm的位置進行注射,之后將針固定在原地3 min,然后緩慢退出以確保KA的適當吸收。注射后,所有大鼠都被移到籠子里。30 min后評估大鼠癲癇發作的嚴重程度,按改進的Racine(1975)標準進行分級,0級:處于安靜和平狀態;1級:抽搐、眨眼、咀嚼、流涎;2級:有節律性點頭、似濕狗抖動;3級:單側前肢陣攣;4級:雙側前肢陣攣和站立;5級:全身強直痙攣、持續站立、墜落等;6級:奔騰、尖叫或死亡。24 h后處死動物。
1.2? 免疫組化染色
大鼠完全麻醉后,用磷酸緩沖鹽溶液(PBS)經心灌流15 min,再用4%多聚甲醛經心灌流15 min。用手術鉗取出腦組織,在4%多聚甲醛中后處理6 h,然后在30%蔗糖中浸泡過夜。最后,用低溫恒溫儀將大腦連續切成30 μm的冠狀切片,并將這些冠狀切片轉移到4 ℃含PBS的6孔板上。腦切片依次用0.3%過氧化氫在PBS中處理20 min,然后將切片與稀釋的兔抗神經元特異核蛋白(NeuN)在4 ℃下孵育過夜。第2天孵育二抗,通過在0.01 mol/L的PBS中加入3,3′-二氨基聯苯胺四鹽酸鹽進行顯色。為確定染色的特異性,用血清代替一抗進行了陰性對照試驗。陰性對照證實所有結構中均無免疫反應。用光密度(OD)評價NeuN的染色強度。
1.3? 免疫熒光染色
將腦切片在0.5%Triton X-100中浸泡10 min,然后在含有0.2%Triton X-100和5%BSA的PBS中浸泡1 h,然后分別與兔抗微管相關蛋白輕鏈Ⅰ/Ⅱ(LC3Ⅰ/Ⅱ)、鼠抗NeuN、鼠抗Beclin和兔超氧化物歧化酶(SOD)-2共同孵育12 h,而后分別與羊抗鼠抗體和異硫氰酸熒光素標記的羊抗兔抗體孵育2 h,在PBS中清洗兩次后密封。用AxioM1光學顯微鏡捕拍攝海馬體的熒光圖像,使用圖像分析系統(Optimas 6.5軟件)在靠近海馬CA3區中心的區域內觀察神經元染色反應。
1.4? SOD活性檢測
提取大鼠的海馬區組織,在4 ℃下保存過夜,然后將組織按1∶9的比例加入生理鹽水中,在3 000×g、4 ℃的條件下離心10 min,獲得上清。用黃嘌呤氧化酶法測定SOD活性,利用WST-1細胞增殖檢測試劑盒檢測SOD活性。
1.5? 蛋白免疫印跡法(Western Blot)檢測
從大鼠大腦中取出海馬體,組織勻漿后提取蛋白質,然后使用二喹啉甲酸(BCA)方法進行定量。用10%十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳法分離蛋白質,轉移到聚偏二氟乙烯(PVDF)膜上,與5%牛血清白蛋白孵育1 h。然后,將膜與兔SOD-1、SOD-2、磷脂酰肌醇3-激酶(PI3K)、蛋白激酶B(AKT)、絲裂原活化蛋白激酶(MAPK)、LC3Ⅰ/Ⅱ和Beclin1抗體在4 ℃下孵育過夜。用羊抗兔免疫球蛋白G(IgG)孵育2 h。Western Blot結果用Quantity One Analysis軟件(BioRad)進行分析,確定相對光密度(Rod),以百分比為單位校準Rod比率。通過計算目的蛋白灰度值與β-肌動蛋白灰度值的比值來評價目的蛋白的相對表達量。
1.6? 統計學處理
采用SPSS 20.0軟件進行統計分析。符合正態分布的定量資料用均數±標準差(x±s)表示,兩組間比較采用t檢驗,多組比較采用單因素方差分析(ANOVA)和Dunnett檢驗。以P<0.05為差異有統計學意義。
2? 結? 果
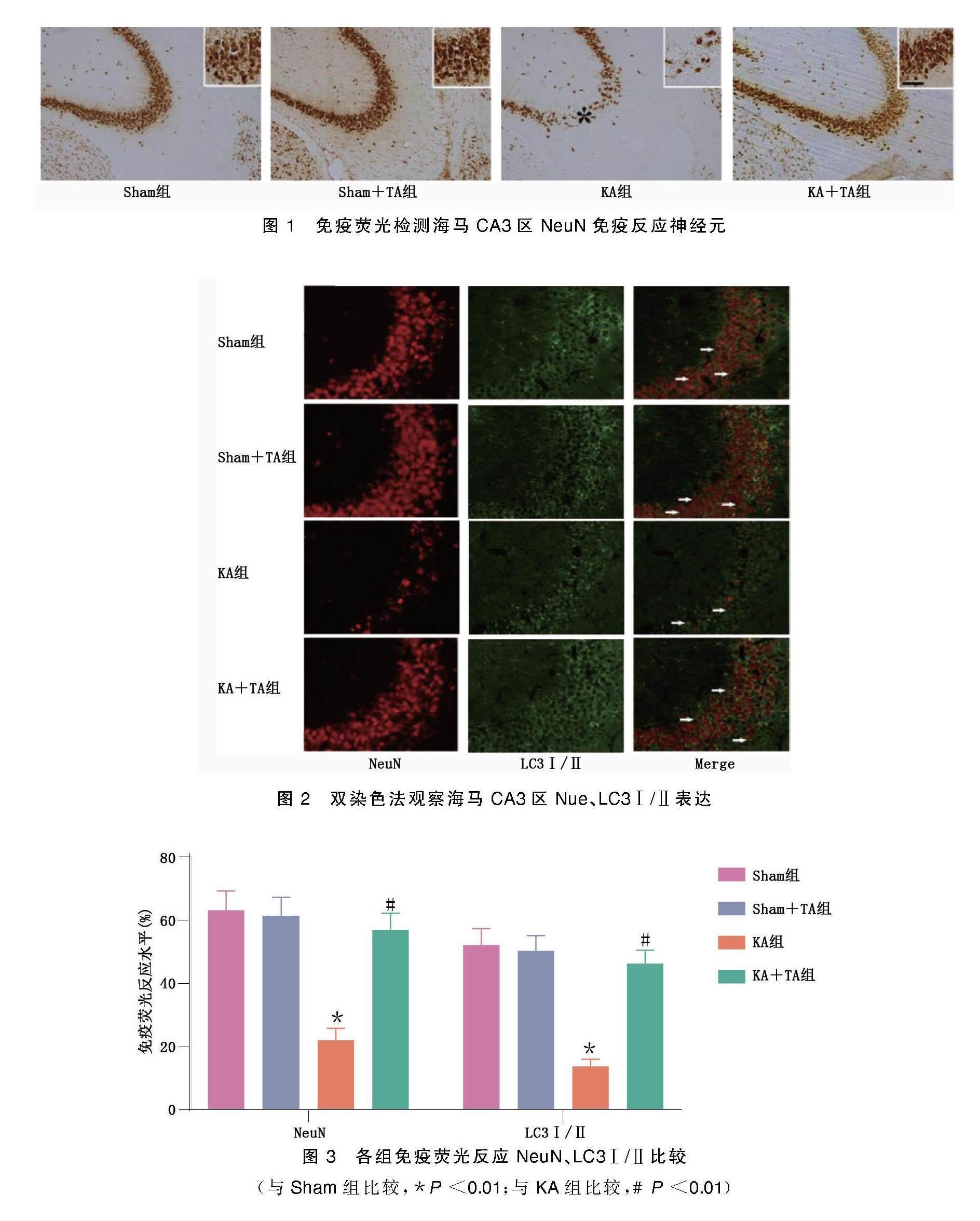
2.1? 海馬CA3區NeuN免疫反應神經元、NeuN、LC3Ⅰ/Ⅱ免疫熒光檢測
免疫熒光檢測顯示,KA組NeuN+細胞的免疫反應水平明顯低于Sham組和Sham+TA組,尤其是在海馬CA3區;KA+TA組NeuN(+)細胞的免疫反應水平明顯高于KA組。采用雙染色法觀察TA對海馬CA3區神經元內聚集的自噬小體數量的影響,結果發現,KA組大鼠海馬CA3區LC3Ⅰ/Ⅱ表達明顯增加,表明KA致癇后神經元LC3Ⅰ/Ⅱ表達百分率明顯增加;相反,與KA組相比,KA+TA組神經元的LC3Ⅰ/Ⅱ水平降低。表明50 mg/kg的TA預處理減輕了KA致癇后海馬CA3區神經元損傷,并伴有LC3Ⅰ/Ⅱ表達減少。詳見圖1~圖3。
(與Sham組比較,*P<0.01;與KA組比較,#P<0.01)
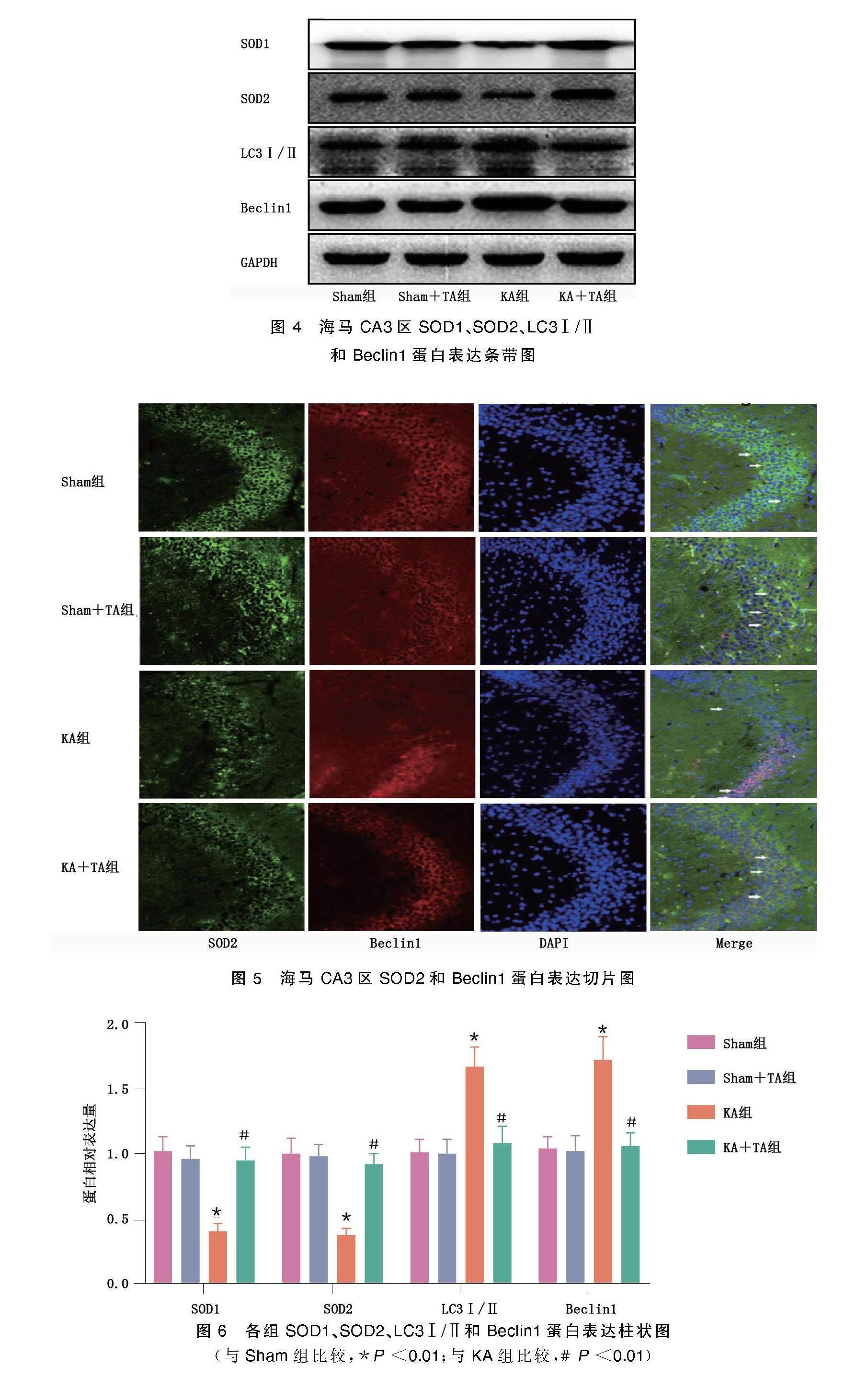
2.2? 海馬CA3區SOD1、SOD2、LC3Ⅰ/Ⅱ和Beclin1蛋白的表達
Western Blot檢測結果顯示,KA組SOD1和SOD2蛋白表達水平明顯低于Sham組(P<0.01),KA+TA組SOD1和SOD2蛋白水平高于KA組(P<0.01)。表明TA預處理提高了KA致癇神經元損傷后海馬區的抗氧化指標水平。KA組自噬相關蛋白C3Ⅰ/Ⅱ、Beclin1蛋白表達水平高于Sham組(P<0.01),而KA+TA組海馬區自噬相關蛋白C3Ⅰ/Ⅱ、Beclin1蛋白表達水平低于KA組(P<0.01)。表明TA預處理降低了KA致癇損傷后的自噬水平。詳見圖4~圖6。
(與Sham組比較,*P<0.01;與KA組比較,#P<0.01)
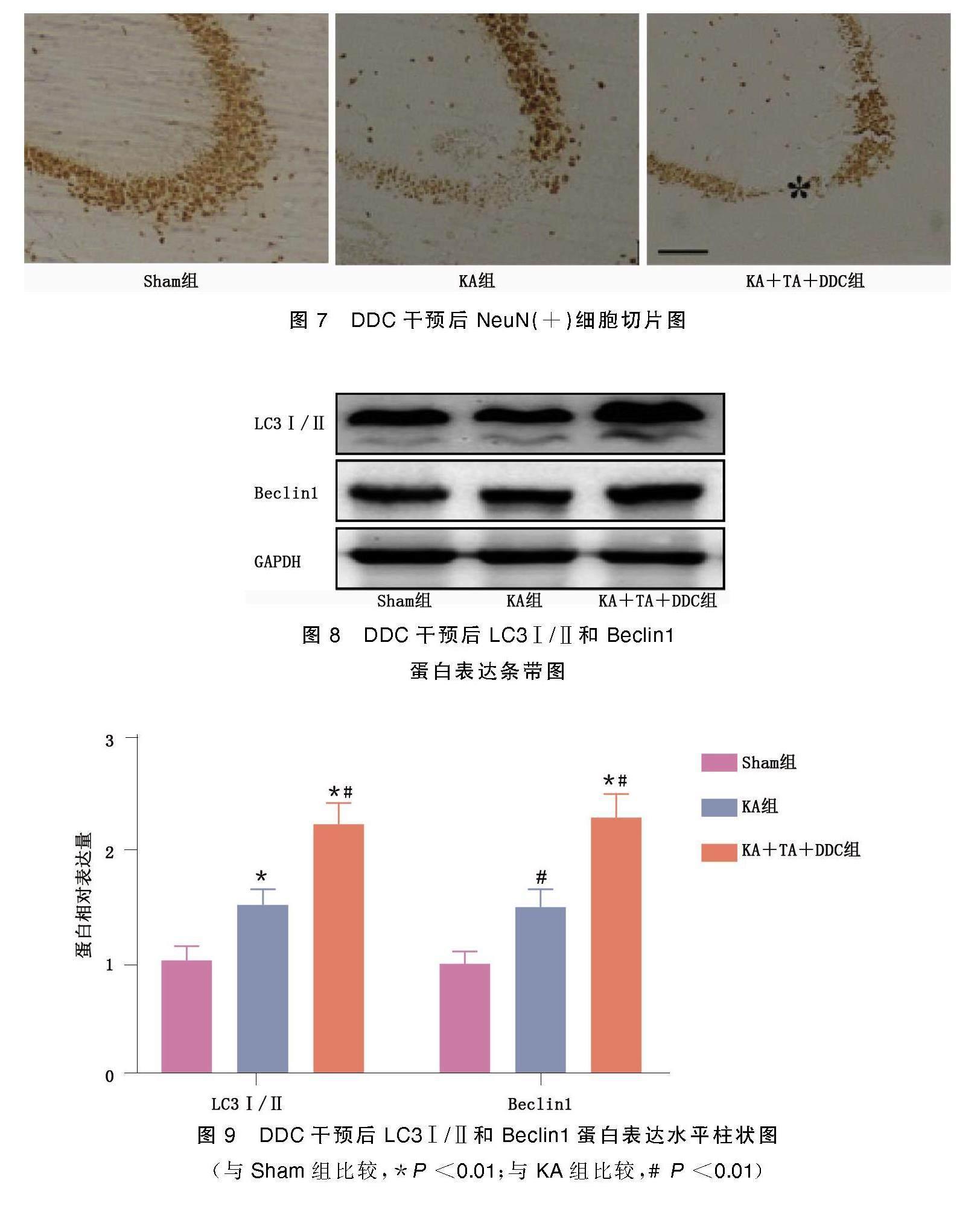
2.3? DDC干預后海馬區Neu免疫反應神經元及海馬CA3區LC3Ⅰ/Ⅱ和Beclin1蛋白表達水平
DDC是一種有效的SOD活性抑制劑。DDC干預后,與Sham組相比,KA組和KA+TA+DDC組大鼠海馬CA3區NeuN(+)細胞較少。此外,KA+TA+DDC組LC3Ⅰ/Ⅱ和Beclin1蛋白表達水平明顯高于Sham組和KA組(P<0.01)。表明TA對KA致癇神經元損傷的神經保護作用與抗氧化酶表達增強介導的自噬減弱密切相關。詳見圖7~圖9。
(與Sham組比較,*P<0.01;與KA組比較,#P<0.01)
2.4? DDC干預后海馬CA3區PI3K/AKT和MAPK通路相關蛋白表達
Western Blot檢測結果顯示,KA組PI3K蛋白表達、p-AKT/AKT、p-MAPK/MAPK比值均明顯低于Sham組(P<0.01);而KA+TA+DDC組大鼠海馬區PI3K蛋白表達、p-AKT/AKT、p-MAPK/MAPK比值低于KA組和KA+TA組(P<0.01),P-AKT/AKT和p-MAPK/MAPK蛋白比值與PI3K表達變化一致。表明TA對KA誘導的癲癇神經元損傷的保護作用與激活PI3K、AKT和MAPK通路有關。詳見圖10、圖11。
(與Sham組比較,*P<0.01;與KA組比較,#P<0.01;與KA+TA組比較,△P<0.01)
2.5? CQ干預后海馬CA3區Neu免疫反應神經元及LC3Ⅰ/Ⅱ和Beclin1蛋白水平
CQ是一種自噬小體-溶酶體融合抑制劑。與Sham組相比,KA組海馬CA3區NeuN(+)陽性細胞數量明顯減少;與KA組相比,KA+TA組和KA-CQ組NeuN(+)陽性細胞數量均明顯增加,LC3Ⅰ/Ⅱ和Beclin1蛋白水平均明顯降低(P<0.01)。表明TA對KA所致癲癇神經元損傷的神經保護作用與減少自噬有關。詳見圖12~圖14。
(與Sham組比較,*P<0.01;與KA組比較,#P<0.01)
3? 討? 論
本研究分析TA在KA誘導的癲癇大鼠模型中的干預效應。結果發現,50 mg/kg的TA對KA誘導的神經元損傷有明顯的保護作用。這與之前的研究發現TA保護神經元免受損傷和皮質神經元免受神經毒性的影響是一致的。本研究表明,50 mg/kg的TA可減輕KA誘導的顳葉癲癇模型中海馬區CA3區神經元損傷。小膠質細胞和星形膠質細胞等神經膠質細胞的激活與神經元死亡密切相關的細胞毒物質的釋放有關[6]。在癲癇的發病機制中,增殖的星形膠質細胞和小膠質細胞分泌過量的有害物質,可能損害神經元[5]。本研究發現,在KA誘導的癲癇大鼠模型中,星形膠質細胞和小膠質細胞被激活。TA可明顯抑制KA誘導的星形膠質細胞和小膠質細胞的激活。有研究發現,一些藥物包括利培酮和阿司匹林-氫楊醇復合物,可通過抑制星形膠質細胞和小膠質細胞的反應性增殖,在神經元中發揮神經保護作用[7]。本研究中,海馬CA3區小膠質細胞和星形膠質細胞的激活減弱可能與TA對KA所致癲癇神經元損傷的神經保護作用有關。癲癇引起的神經元損傷與腦組織中的ROS有關[8]。抗氧化劑作為一種潛在的治療藥物,減輕ROS引起的神經元損傷中發揮重要作用[9]。目前的結果表明,50 mg/kg的TA維持海馬區SOD1和SOD2蛋白表達水平。同樣,一些抗氧化劑,如2-環丙基亞氨基-3-甲基-1,3-噻唑啉鹽酸鹽,對神經元損傷具有神經保護作用。另一方面,先前的研究發現,SOD水平的下降明顯加速了沙土鼠海馬齒狀回神經元損傷[10]。在不同的SOD亞型中,SOD1存在于細胞質中,而SOD2存在于線粒體基質中。線粒體自噬在神經元存活中起關鍵作用,線粒體自噬的過度表達可以導致神經元死亡,這種死亡可以通過使用抗氧化應激療法來減輕,這有助于恢復自噬的保護作用[11]。因此,提高抗氧化劑水平和減少過度激活的自噬水平對神經元的生存至關重要。本研究結果表明TA可以通過提高SOD水平來抑制過度激活的線粒體自噬。因此,海馬CA3區SOD水平的升高可能與TA對癲癇所致神經元損傷的神經保護作用有關。
自噬通過清除細胞內的廢物來維持細胞的正常新陳代謝,這是細胞生存所必需的[12]。自噬標志物的水平升高,包括LC3和Beclin1,表明自噬被激活。自噬在細胞中扮演著兩個截然不同的角色,其效果嚴重依賴于疾病進展的不同階段、細胞微環境的變化和治療措施的不同[13]。在正常情況下,自噬在大多數細胞中發生的水平相對較低。外部因素的刺激可以啟動清除受損線粒體所需的自噬過程,從而保護細胞免受進一步損害。然而,自噬的過度激活也會導致細胞損傷。自噬參與了癲癇引起的神經元損傷過程,而自噬的缺失會導致神經元變性或死亡[14]。自噬過程的過度激活也可能導致神經元損傷。癲癇發作尤其是癲癇狀態對海馬神經元的損傷機制復雜多樣。自噬調節因子,包括微管相關蛋白1的輕鏈3(LC3)和Beclin1,可以促進大鼠腦神經元自發性癲癇的發生[15]。本研究發現,TA通過減少過度激活的自噬水平,對癲癇誘導的神經元損傷具有神經保護作用,因此,TA具有細胞保護作用,部分是通過維持氧化應激和自噬之間的平衡。先前的研究表明,ROS的積累可導致神經元的自噬。同時,癲癇損傷會導致ROS的過度積累,這可能會導致隨后誘導自噬,試圖清除受影響的細胞成分。包括SOD在內的抗氧化酶的增強和維持可以降低自噬水平,并保護神經元免受損傷。本研究發現,TA明顯增加海馬區SOD表達,而降低自噬相關蛋白如LC3Ⅰ/Ⅱ和Beclin1水平。而當DDC抑制SOD活性時,LC3Ⅰ/Ⅱ和Beclin1水平明顯升高。因此,本研究結果表明,TA對KA誘導的癲癇神經元損傷的神經保護作用與抗氧化酶生成增加而導致的自噬降低密切相關。
本研究還發現,與KA組相比,KA-CQ組NeuN(+)細胞數量急劇增加。表明通過給予自噬抑制劑CQ來抑制自噬,能夠提供類似于TA預處理后的保護作用,以對抗KA誘導的癲癇損傷,而抑制自噬可以保護神經元免受損傷。此外,增加抗氧化劑水平可以減少自噬引起的神經元損傷。因此,在KA誘導的大鼠顳葉癲癇模型中,抗氧化劑水平的增加和自噬水平的降低可能與TA的神經保護作用密切相關。PI3K/AKT和MAPK通路對癲癇損傷后神經元的存活至關重要[16]。AKT的激活可以抑制神經元的自噬,促進神經元的增殖和存活,有研究表明,PI3K/AKT信號通路的激活可以抑制神經元損傷[17]。在本研究中,預先給予50 mg/kg的TA可通過激活PI3K/AKT通路來保護神經元免受癲癇損傷和氧化應激。此外,MAPK通路被證實參與了有害的應激刺激(高滲透壓、氧化應激、低滲透壓),在ROS和自噬過程中發揮著關鍵作用。先前的研究表明,ROS介導的PI3K/AKT和MAPK通路的磷酸化上調抑制了自噬。本研究發現,TA預處理上調了PI3K/AKT和MAPK通路相關蛋白水平,而下調了自噬相關蛋白的表達。然而,在DDC干預后,TA對PI3K/AKT或MAPK通路相關蛋白水平都沒有影響。因此,TA通過激活PI3K/AKT和MAPK通路來抑制癲癇所致的神經元損傷。
綜上所述,TA預處理對KA誘導的大鼠顳葉癲癇模型神經元損傷具有保護作用。此外,TA的神經保護作用可能與通過激活PI3K/AKT和MAPK通路維持抗氧化水平和自噬密切相關。
參考文獻:
[1]? WU Q,YI X W.Down-regulation of long noncoding RNA MALAT1 protects hippocampal neurons against excessive autophagy and apoptosis via the PI3K/AKT signaling pathway in rats with epilepsy[J].Journal of Molecular Neuroscience,2018,65(2):234-245.
[2]? WANG L,SONG L F,CHEN X Y,et al.MiR-181b inhibits P38/JNK signaling pathway to attenuate autophagy and apoptosis in juvenile rats with kainic acid-induced epilepsy via targeting TLR4[J].CNS Neuroscience & Therapeutics,2019,25(1):112-122.
[3]? ATTIA G M,ELMANSY R A,ELSAED W M.Neuroprotective effect of nilotinib on pentylenetetrazol-induced epilepsy in adult rat hippocampus:involvement of oxidative stress,autophagy,inflammation,and apoptosis[J].Folia Neuropathologica,2019,57(2):146-160.
[4]? HOSSEINZADEH M,NIKSERESHT S,KHODAGHOLI F,et al.Cannabidiol post-treatment alleviates rat epileptic-related behaviors and activates hippocampal cell autophagy pathway along with antioxidant defense in chronic phase of pilocarpine-induced seizure[J].Journal of Molecular Neuroscience,2016,58(4):432-440.
[5]? PENG J T,WU S H,GUO C,et al.Effect of ibuprofen on autophagy of astrocytes during pentylenetetrazol-induced epilepsy and its significance:an experimental study[J].Neurochemical Research,2019,44(11):2566-2576.
[6]? DU T T,ZHU G Y,CHEN Y C,et al.Anterior thalamic nucleus stimulation protects hippocampal neurons by activating autophagy in epileptic monkeys[J].Aging,2020,12(7):6324-6339.
[7]? HUSSEIN A M,ADEL M,EL-MESERY M,et al.L-carnitine modulates epileptic seizures in pentylenetetrazole-kindled rats via suppression of apoptosis and autophagy and upregulation of Hsp70[J].Brain Sciences,2018,8(3):45.
[8]? XIE N C,LI Y J,WANG C,et al.FAM134B attenuates seizure-induced apoptosis and endoplasmic reticulum stress in hippocampal neurons by promoting autophagy[J].Cellular and Molecular Neurobiology,2020,40(8):1297-1305.
[9]? XIAO D,LV J D,ZHENG Z G,et al.Mechanisms of microRNA-142 in mitochondrial autophagy and hippocampal damage in a rat model of epilepsy[J].International Journal of Molecular Medicine,2021,47(6):98.
[10]? HAMDY M,ANTAR A,EL-MESERY M,et al.Curcumin offsets PTZ-induced epilepsy:involving inhibition of apoptosis,Wnt/β-catenin,and autophagy pathways[J].Egyptian Journal of Basic and Applied Sciences,2020,7(1):240-251.
[11]? WU Q,ZHANG M,LIU X Y,et al.CB2R orchestrates neuronal autophagy through regulation of the mTOR signaling pathway in the hippocampus of developing rats with status epilepticus[J].International Journal of Molecular Medicine,2020,45(2):475-484.
[12]? WU J M,CHEN L Q,WANG S,et al.Negative regulation of autophagy in activating nucleotide-binding oligomerization domain-like receptor family pyrin domain-containing 3 inflammasomes in the hippocampus of an epilepsy rat model[J].Nanoscience and Nanotechnology Letters,2019,11(7):947-959.
[13]? WANG J,LIU Y,LI X H,et al.Curcumin protects neuronal cells against status-epilepticus-induced hippocampal damage through induction of autophagy and inhibition of necroptosis[J].Canadian Journal of Physiology and Pharmacology,2017,95(5):501-509.
[14]? HU F,SHAO L,ZHANG J,et al.Knockdown of ZFAS1 inhibits hippocampal neurons apoptosis and autophagy by activating the PI3K/AKT pathway via up-regulating miR-421 in epilepsy[J].Neurochemical Research,2020,45(10):2433-2441.
[15]? WANG J,LI Y,HUANG W H,et al.The protective effect of aucubin from Eucommia ulmoides against status epilepticus by inducing autophagy and inhibiting necroptosis[J].The American Journal of Chinese Medicine,2017,45(3):557-573.
[16]? WEN X,HAN X R,WANG Y J,et al.MicroRNA-421 suppresses the apoptosis and autophagy of hippocampal neurons in epilepsy mice model by inhibition of the TLR/MYD88 pathway[J].Journal of Cellular Physiology,2018,233(9):7022-7034.
[17]? WU M Q,LIU X Y,CHI X S,et al.Mitophagy in refractory temporal lobe epilepsy patients with hippocampal sclerosis[J].Cellular and Molecular Neurobiology,2018,38(2):479-486.
(收稿日期:2022-11-07)
(本文編輯郭懷印)

