玉米木質素合成途徑基因ZmCCoAOMT1 功能研究及轉錄組分析
徐佳睿 王逸茹 趙紹賡 李坤 鄭軍
摘要:青貯玉米是一種優良的飼料作物,是畜牧業的優質粗飼料來源。咖啡酰輔酶A-O-甲基轉移酶(caffeoyl-CoA-O-methyltransferase, CCoAOMT)是木質素合成途徑中的關鍵甲基轉移酶。從玉米自交系B73的EMS突變體庫獲得了ZmCCoAOMT1 基因的單堿基突變體,通過表型分析、生理生化分析、基因表達分析驗證了ZmCCoAOMT1 的功能。研究發現,ZmCCoAOMT1 突變造成莖稈木質化程度降低、木質素含量顯著減少、G型木質素(guaiacyl lignin)和S型木質素(syringa lignin)含量下降、體外干物質消化率提高。此外,突變體莖稈中ZmCCoAOMT1 的表達量也顯著低于野生型。轉錄組分析表明,ZmCCoAOMT1 基因的突變可能調控苯丙烷代謝途徑中相關基因的表達,進而引起木質素含量和單體組成發生變化。因此,ZmCCoAOMT1 基因是培育高消化率優質青貯玉米品種的重要基因資源,研究結果為木質素合成代謝途徑遺傳機理研究提供了重要理論依據。
關鍵詞:青貯玉米;木質素;轉錄組分析;ZmCCoAOMT1
doi:10.13304/j.nykjdb.2024.0186
中圖分類號:S513,Q78 文獻標志碼:A 文章編號:10080864(2024)05003014
玉米(Zea mays L.)是我國主要糧食作物之一,也是重要的飼料來源。近年來,由于國內畜牧業的迅速擴張,導致人畜之間的糧食競爭愈加激烈[1],因此,培育高產優質的玉米品種至關重要。青貯玉米是指在籽粒乳熟末期至蠟熟前期收獲的地上全部綠色植株(包括果穗)經過青貯發酵后制作而成的青貯飼料,具有青綠多汁、產量高、適口性好、耐貯存等特點[2]。20世紀80年代之前,我國尚未培育出專用的青貯玉米品種,為了滿足青貯飼料的需求,許多地區采用籽粒玉米品種替代[3]。青貯玉米中木質素含量過高可能導致牲畜對飼料的消化利用效率下降,嚴重影響家畜的生產性能。
木質素是由苯丙烷基為基本結構單元組成的高分子材料,在植物體內占比約為15%~36%,具有緊湊的分子結構[4]。植物苯丙烷代謝途徑(phenylpropanoid metabolic pathway)主要分為3部分:首先是莽草酸途徑,通過糖的代謝過程將葡萄糖轉化為莽草酸,再轉化為色氨酸、酪氨酸和苯丙氨酸;其次是公共苯丙烷途徑,這個過程從苯丙氨酸出發,經多級酶聯反應,最終生成相應的輔酶A;最后是特異木質素合成途徑,將催化生成的中間產物輔酶A轉化為相應的木質素單體:對香豆醇(對羥苯基木質素,P-hydroxyphenyl lignin,H型木質素)、松柏醇(愈創木基木質素,guaiacyllignin,G型木質素)和芥子醇(紫丁香基木質素,syringa lignin,S 型木質素),進而參與木質素合成[5]。
CCoAOMT 屬于S- 腺苷-L- 甲硫氨酸(Sadenosylmethionine,SAM)甲基轉移酶,在苯丙烷代謝通路中存在于公共苯丙烷途徑,主要負責將咖啡酰輔酶A轉化為阿魏酰輔酶A,在木質素合成中起重要作用[6]。其最早在歐芹[7]中發現,之后在百日草[8] 中首次被證實參與木質素合成。CCoAOMT具備催化諸如黃酮類、生物堿等化合物生成甲基化酚類代謝產物的能力[9],其以咖啡酰輔酶A為底物,將S-腺苷甲硫氨酸中的甲基基團傳遞至木質素單體,從而促進G 型木質素的合成[10]。Chen 等[11]揭示了CCoAOMT 基因可以甲基化咖啡酰輔酶A的C3位,進一步催化生成木質素單體的前體阿魏酰輔酶A。在擬南芥中有2種類型的CCoAOMT:Ⅰ類包含CCoAOMT1,Ⅱ類則包含CCoAOMT2-7[12],CCoAOMT1 在CCoAOMT 家族基因中是最早被確認參與木質素合成的[13]。
目前,已從擬南芥、苜蓿、小麥、毛白楊等植物中克隆獲得CCoAOMT 基因。例如,在煙草中抑制CCoAOMT 基因的表達,導致植株明顯矮化,木質素含量下降22.3%,S型和G型木質素單體的比例(S/G)增加[14]。在苜蓿中,抑制CCoAOMT1 基因的表達,轉基因植株的G型木質素含量下降50%左右,而S型木質素的含量保持不變,因此S/G顯著上升,細胞壁的消化率顯著增加[15]。同時,CCoAOMT對生物和非生物脅迫有重要調控作用,例如在擬南芥中過量表達CCoAOMT1 可以提高其對丁香假單胞菌DC3000 的抗性[16];Chun 等[17]發現,AtCCoAOMT1 還可以通過ROS和ABA信號通路提高擬南芥的抗旱性,且在同等環境下擬南芥轉基因植株吸收鎘的能力是野生型的2倍,證明了CCoAOMT1 基因能夠降低重金屬對植株的影響,提高植物的修復能力[18]。
迄今,在玉米基因組中共發現4個CCoAOMT基因,分別是ZmCCoAOMT1、ZmCCoAOMT2、ZmCCoAOMT3、ZmCCoAOMT4。Fornalé 等[19] 對ZmCOMT2 和ZmCCoAOMT1 的突變體進行研究發現,當ZmCCoAOMT1下調表達時,莖稈中H型單體的含量有所上升,S型單體略有減少,木質素含量減少6.7%。Brenner 等[20] 通過分析40 份青貯玉米自交系發現,ZmCCoAOMT1 和ZmCCoAOMT2 均與秸稈細胞壁消化率高度關聯;Yang 等[21] 對ZmCCoAOMT2 的突變體進行研究發現,ZmCCoAOMT2 對小斑病和灰斑病具有顯著抗性。上述研究表明,ZmCCoAOMT 在控制木質素含量和不同單體組成以及植物抗逆性方面發揮重要作用。目前ZmCCoAOMT 基因在玉米中的研究仍然較少。本研究利用ZmCCoAOMT1 基因的單堿基突變體,結合表型分析、生理生化分析、基因表達分析和轉錄組分析來探究ZmCCoAOMT1 的遺傳機制,對于理解木質素合成及代謝途徑具有極其重要的參考價值。
1 材料與方法
1.1 材料和田間試驗
供試材料ZmCCoAOMT1(Zm00001d036293)基因EMS單堿基突變體(ems-0869cd,ccoaomt1)和同一世代分離的野生型(WT)來自B73玉米突變體庫(www.elabcaas.cn/memd/)。田間試驗在北京市中國農業科學院作物科學研究所順義基地完成,2022年夏季播種,行長4 m,行距0.6 m,株距0.25 m,每行20穴,每小區3行。收獲時每個小區隨機選取15株測定株高(plant height,PH)、穗位高(ear height,EH)等農藝性狀[22]。
1.2 基因組DNA、RNA 的提取以及cDNA 的制備
取2 葉1 心期的玉米幼苗第2 片葉,用植物DNA提取試劑盒(天根生化科技有限公司)提取DNA;分別在玉米拔節期(V9)和吐絲期取地上部第3 節莖部,RNA prep pure 植物總 RNA 提取試劑盒(Vazyme,南京)提取RNA并使用反轉錄試劑盒(Vazyme,南京)制備cDNA。
1.3 EMS 材料篩選與鑒定
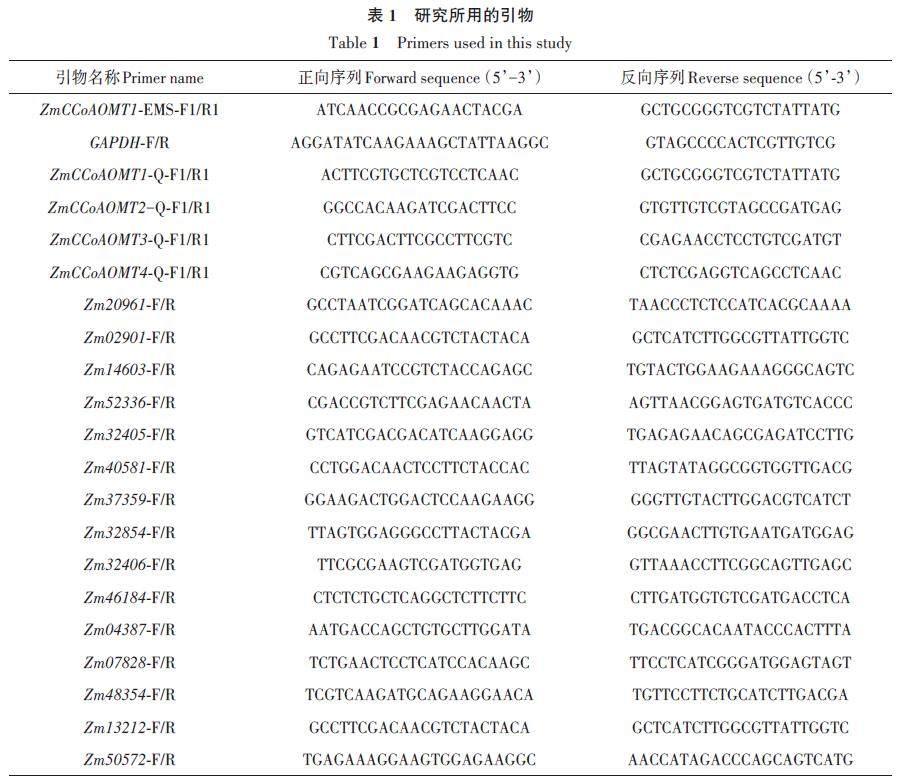
利用玉米基因組數據庫MaizeGDB(https://maizegdb.org)檢索ZmCCoAOMT1 基因(登錄號:Zm00001d036293)序列,設計引物ZmCCoAOMT1-EMS-F1/R1(表1)進行PCR。反應體系50 μL:Phanta Uc Super-Fidelity DNA Polymerase 1 μL、正反向引物各2 μL、dNTP Mix 1 μL、5 × Uc Bufferfor Library Amplification 10 μL、DNA 2 μL、ddH2O32 μL。反應程序:95 ℃預變性 3 min;95 ℃變性15 s,58 ℃退火 15 s,72 ℃延伸 60 s,30 個循環;72 ℃終延伸 5 min。將擴增產物送生工生物工程股份有限公司測序。
1.4 木質素染色
取成熟期的突變體和野生型地上部第3莖節節間,浸泡在FAA 固定液(70% 乙醇90 mL、38%甲醛5 mL、冰醋酸5 mL、甘油5 mL)中固定2 h后取出,用3% 瓊脂糖包埋,進而用震蕩切片機(LeicaVT1000s,德國)切片,厚度為45 μm。將切片平整展于載玻片上,加Wiesner試劑染色2 min[23],用體式顯微鏡(Leica M205 FA,德國)觀察拍照。
1.5 木質素相關性狀測定
在玉米授粉后30~40 d,選取8株長勢一致的植株,截取地上部倒數第3~4莖節,立即在105 ℃下殺青30 min,65 ℃烘干至恒重,用粉碎機粉碎,過40目網篩,再次烘干,粉末用于木質素總量、消化品質和單體組成測量。每次實驗進行3次生物學重復和3次技術重復。
1.5.1 木質素含量測定
取研磨好的玉米莖稈粉末2 mg,使用木質素含量測定試劑盒(科銘生物有限公司)進行處理,將木質素中的酚羥基乙酰化后生成乙酰木質素,使用Multiskan SkyHigh酶標儀(賽默飛世爾科技公司,美國)測定280 nm波長處的特征吸收峰,通過吸光值的變化定量木質素的含量。
1.5.2 木質素消化品質測定
將研磨好的玉米莖稈粉末裝滿于10 mL西林瓶中,放置在MPA近紅外光譜儀(布魯克科技有限公司,德國)的樣品旋轉池中,每個樣品重復3次,分別測定酸性洗滌木質素(acid detergent lignin,ADL)、酸性洗滌纖維(acid detergent fiber,ADF)、中性洗滌纖維(neutral detergent fiber,NDF)和體外干物質消化率(in vitro dry matter digestibility,IVDMD)[24]。
1.5.3 木質素單體測定
取研磨好的玉米莖稈粉末1 g,采用硫代酸解法對玉米莖稈粉末進行處理使木質素分子鏈上的β-O-4醚鍵斷裂,生成木質素單體,利用GCMS-TQ 8050 NX液相色譜-質譜聯用儀(SHIMADZU,日本)測定對羥基苯甲醛(H型)、丁香醛(S型)、香草醛(G型)3種木質素單體含量[25]。
1.6 基因表達量分析
qRT-PCR 用熒光定量試劑盒ChamQUniversal SYBR qPCR Master Mix(Vazyme,南京)檢測ZmCCoAOMT 基因在玉米不同生長時期的表達量,所用引物為ZmCCoAOMT1-Q-F1/R1、ZmCCoAOMT2-Q-F1/R1、ZmCCoAOMT3-Q-F1/R1、ZmCCoAOMT4-Q-F1/R1,內參基因選擇玉米三磷酸甘油醛脫氫酶基因GAPDH(表1)。反應體系20 μL:2 × AceQ qPCR SYBR Green Master Mix10 μL、正反向引物各0.4 μL、cDNA 2 μL、ddH2O7.2 μL。反應程序:95 ℃預變性 5 min;95 ℃變性10 s,60 ℃退火30 s,40 個循環。用2-ΔΔCT 法[26]計算基因的相對表達水平。
1.7 轉錄組分析
分別在突玉米拔節期(V9)和吐絲期取變體和野生型的的莖稈提取RNA,送安諾優達基因科技有限公司(北京)構建cDNA測序文庫。樣品分成Ⅰ(V9-WT)、Ⅱ(V9-ccoaomt1)、Ⅲ(吐絲-WT)和Ⅳ(吐絲-ccoaomt1)4個組,3次重復。對其文庫質量進行檢測,質量合格的cDNA文庫用Illumina 高通量測序平臺進行測序。用RSEM軟件對樣本中的基因豐度進行定量分析,用FPKM方法對各個樣本中的基因表達量進行計算,比較不同樣本間的數據篩選出差異表達基因,用 DESeq 進行差異基因分析,以FDR<0.05且|log2 FC|>1(FC為變異倍數,fold change)為標準篩差異表達基因(differentially expressed genes,DEGs)。
對差異表達基因(DEGs)進行GO[27](geneontology,http://www.geneontologyorg/)功能富集分析;以及利用KEGG[28](kyoto encyclopedia ofgenes and genomes,http://www.genome.jp/kegg/)進行通路(pathway)富集分析,以 KEGG 數據庫中通路為單位,以參考基因組背景為對照,將差異基因顯示于KEGG通路圖上。閾值設置為顯著性P<0.05,使用R 軟件中clusterProfiler 語言包對差異表達基因進行富集分析和可視化[29],并利用ggplot2語言包作圖。
為了驗證轉錄組測序(RNA-seq)的準確性,隨機挑選了15個在2個時期苯丙氨酸途徑的差異基因進行qRT-PCR驗證。
2 結果與分析
2.1 ZmCCoAOMT1 突變體的鑒定
為了探究ZmCCoAOMT1 基因的功能,從B73玉米突變體庫獲得了ZmCCoAOMT1 單堿基突變體ccoaomt1,突變類型為翻譯提前終止,CDS序列第558 位堿基由C 突變成T(圖1A~C),野生型為同一世代分離出的顯性純合體。對突變體和野生型進行qRT-PCR,結果表明,突變體中ZmCCoAOMT1 基因的表達量與野生型相比顯著降低(圖1D),說明該單堿基突變對ZmCCoAOMT1基因表達有顯著影響。
2.2 ZmCCoAOMT1 的進化樹分析
ZmCCoAOMT1 的開放閱讀框長度為792 bp,編碼258個氨基酸,通過Protein BLAST數據庫篩選出與ZmCCoAOMT家族編碼的同源性較高的物種,包括擬南芥(Arabidopsis thaliana)、小麥(Triticum aestivum)、稷(Panicum miliaceum)等。CCoAOMT氨基酸序列分為5類(圖2):Ⅰ類包括ZmCCoAOMT1和ZmCCoAOMT2和絕大部分高粱CCoAOMT 氨基酸序列,Ⅱ類包括ZmCCoAOMT3和大部分煙草CCoAOMT氨基酸序列,Ⅲ和Ⅳ為擬南芥CCoAOMT 的氨基酸序列,Ⅴ 類僅有ZmCCoAOMT4。結果表明,ZmCCoAOMT1 和ZmCCoAOMT2親緣關系最近,與ZmCCoAOMT3和ZmCCoAOMT4親緣關系較遠。
2.3 ZmCCoAOMT1 突變對株型的影響
對突變體和野生型農藝性狀進行分析發現,ccoaomt1 突變體的株高和穗位高與野生型相比略有增高,但不顯著,分別增加了1.4% 和6.9%(圖3A和B),說明ZmCCoAOMT1 單堿基突變未對玉米株高等株型性狀產生顯著正向作用。
2.4 ZmCCoAOMT1 突變對木質素合成代謝的影響
2.4.1 ZmCCoAOMT1 突變對木質素染色的影響
為了初步探究ZmCCoAOMT1 突變對木質素的影響,對野生型和突變體莖稈進行木質素染色,與野生型相比,突變體莖稈的染色變淺,木質化程度明顯降低,細胞中的維管束和厚壁組織有所減少,表明ZmCCoAOMT1 基因的單堿基突變影響植株的木質素含量(圖4)。
2.4.2 ZmCCoAOMT1 突變對木質素含量、組成及消化品質的影響
為了進一步探究ZmCCoAOMT1突變對木質素組分的影響,對突變體和野生型的ADL、ADF、NDF、IVDMD和木質素單體等關鍵成分進行比較,結果如圖5和表2所示。與野生型相比,突變體莖稈中木質素含量顯著降低,ADF和NDF略微下降,消化率提高了6.8%。木質素單體中G型含量下降4.9%,S型含量下降18.8%,H型因峰圖出現干擾而造成數據波動較大。上述結果表明,ZmCCoAOMT1 基因的突變會降低木質素含量并提高消化率,G型和S型木質素顯著下降。
2.5ZmCCoAOMT 基因表達量分析
為了探究ZmCCoAOMT1 基因突變是否會對該家族其他基因表達造成影響,在V9期和吐絲期利用qRT-PCR 檢測ZmCCoAOMT1、ZmCCoAOMT2、ZmCCoAOMT3、ZmCCoAOMT4 基因在莖中的表達量。結果(圖6)發現,在V9 期ccoaomt1 突變體中,ZmCCoAOMT1 表達量呈顯著下降,ZmCCoAOMT2 略微上升,ZmCCoAOMT3 略微下降,ZmCCoAOMT4 略微上升;在吐絲時期ccoaomt1突變體中,ZmCCoAOMT1 基因表達量呈極顯著下降,ZmCCoAOMT2 呈極顯著上升,ZmCCoAOMT3略微上升,ZmCCoAOMT4略微下降。上述結果說明ZmCCoAOMT2對ZmCCoAOMT1基因可能存在補償效應。
2.6 野生型和ccoaomt1 突變體在V9 時期和吐絲期的轉錄組分析
2.6.1 差異表達基因的qRT-PCR 驗證
為了驗證轉錄組分析中RNA-seq 結果的準確性,利用qRT-PCR對隨機挑選15個差異表達基因進行表達量分析驗證。結果表明,qRT-PCR的表達量結果與RNA-Seq的結果一致(圖7A),兩種方法檢測的結果之間相關系數(r)為0.934 9(圖7B),驗證了RNA-Seq分析結果的可靠性。
2.6.2 差異表達基因分析
對V9期和吐絲期的野生型和ccoaomt1 突變體進行轉錄組分析,經過測序數據質控和數據比對,結果發現在V9時期一共篩選出3 976 個DEGs,其中有1 637 個基因上調,2 339 個基因下調;在吐絲時期一共篩選出2 542個DEGs,其中有904個基因上調,1 638個基因下調。V9時期和吐絲時期共同表達的基因為682個,突變體中同時上調的基因為258個,同時下調的基因為424個(圖8)。
2.6.3 差異表達基因的GO富集分析和KEGG分析
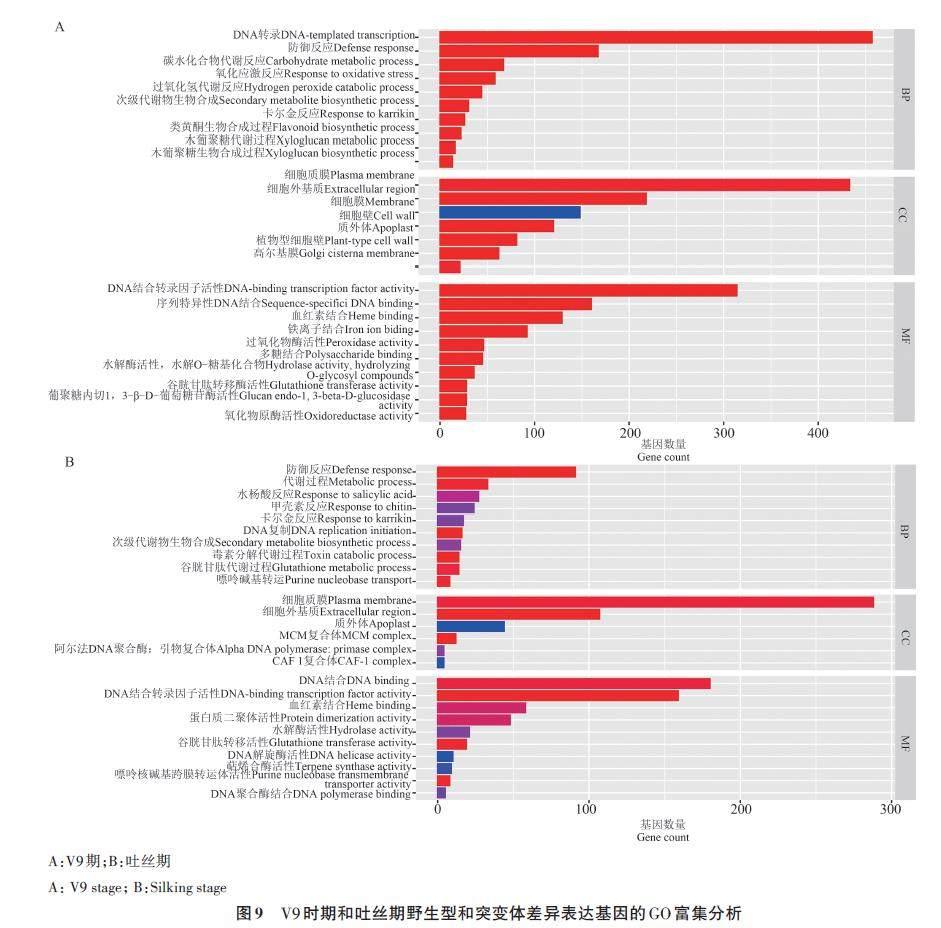
對顯著的差異表達基因進行GO分析,結果如圖9所示。在V9期,GO富集分析DEGs共106個條目,主要富集到脫氧核糖核酸轉錄(DNAtemplatedtranscription) 、細胞質膜(plasmamembrane)、DNA 結合轉錄因子活性(DNAbindingtranscription factor activity)等類別( 圖9A)。在吐絲期,GO富集分析DEGs共29個條目,主要富集到防御反應(defense response)、細胞質膜(plasma membrane)、DNA 結合(DNA binding)等類別(圖9B)。
2.6.4 差異表達基因的GO富集分析和KEGG分析
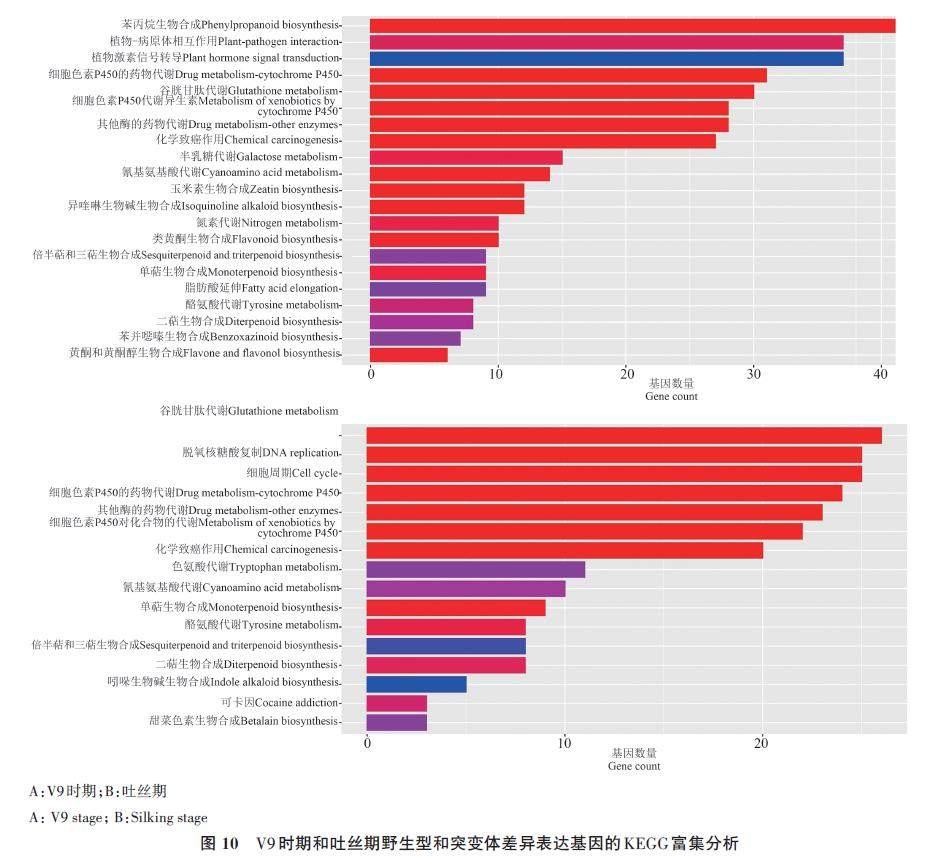
為了進一步分析DEGs的功能,對鑒定到的DEGs進行KEGG富集分析。結果(圖10)顯示,在V9 期主要被富集到苯丙烷生物合成(phenylpropanoid biosynthesis)、植物-病原體相互作用(plant?pathogen interaction)、植物激素信號轉導(plant hormone signal transduction)等相關的通路(圖10A);在吐絲期主要被富集到谷胱甘肽代謝(glutathione metabolism)、脫氧核糖核酸復制(DNA replication)等相關的通路(圖10B)。
2.6.5 木質素苯丙烷合成通路相關基因表達分析
根據KEGG分析結果,V9期差異表達基因主要富集到與木質素合成代謝通路相關的苯丙烷生物合成途徑。轉錄組分析發現,25個與木質素合成代謝有關的基因差異表達,其中4個基因表達量上調,均為編碼過氧化物酶(peroxidase,POD)基因;21個表達量下調基因,其中編碼過氧化物酶基因13個,以及CCR、HCT、CSE 等控制木質素合成的關鍵酶基因8個(表3)。
3 討論
3.1 ZmCCoAOMT1 基因突變影響玉米木質素合成和消化率
咖啡酸-O-甲基轉移酶(COMT)、咖啡醜輔酶A-O-甲基轉移酶(CCoAOMT)和阿魏酸5-羥基化酶(F5H)是參與調節植物木質素特異生物合成的3 類主要酶類。Fornalé 等[19]發現,ZmCCoAOMT1的突變會引起突變體的株高略微下降,但沒有引起顯著性差異,葉中脈未出現褐色顯色變化。本研究發現,和野生型相比,ccoaomt1 突變體株高和穗位高略微增加但并沒有發生顯著改變,葉中脈無褐色顯色反應,與上述結論一致。木質素是制約動物消化的關鍵因素,利用酸性間苯三酚(wiesner試劑)染色觀察莖部的木質化部位,莖部維管束染色略有降低,且靠近維管束內部紅色較深,維管束鞘顏色較淺,說明ZmCCoAOMT1基因的突變會造成莖稈中次生細胞壁的木質化程度降低。進一步分析發現,突變體中木質素總含量極顯著降低,G型和S型木質素單體含量都有下降趨勢,但未達到極顯著水平,且體外干物質消化率略有提高。木質素合成通路中,CCoAOMT 基因編碼的酶是主要控制向G型木質素單體轉化的關鍵甲基轉移酶,而本研究中G、S型木質素單體含量變化差異未達到極顯著水平,在Fornalé 等[19] 的研究中發現,ZmCCoAOMT1 基因的敲除對木質素總量和單體含量均未造成明顯改變,推測可能是由于ZmCCoAOMT 蛋白家族的其他成員在ZmCCoAOMT1 基因突變后維持了部分甲基轉移酶的豐度。
3.2 ZmCCoAOMT2 對ZmCCoAOMT1 基因表達存在補償效應
利用qRT-PCR 對突變體和野生型ZmCCoAOMT 家族4 個基因在V9 和吐絲期的表達量進行比較,發現V9 期和吐絲期突變體中ZmCCoAOMT1 表達量呈現下降趨勢,ZmCCoAOMT2 的表達量增加,ZmCCoAOMT3 和ZmCCoAOMT4 在2個時期之間變化趨勢不同,且均未達到顯著水平。RNA-seq 結果顯示,ZmCCoAOMT2 在V9 期和吐絲期的表達量增高,盡管表達量差異未達到顯著但趨勢與qRT-PCR結果相同。通過進化分析發現,在玉米ZmCCoAOMT 基因家族中ZmCCoAOMT1 與ZmCCoAOMT2 之間親緣關系更近,而ZmCCoAOMT3、ZmCCoAOMT4 與ZmCCoAOMT1之間關系較遠。從表達模式上可以推測ZmCCoAOMT2 對ZmCCoAOMT1 基因可能存在補償效應。
3.3 ZmCCoAOMT1 對木質素合成通路的影響
對突變體和野生型植株進行轉錄組分析發現,在V9和吐絲2個時期共同差異表達的基因共682 個,經過GO 富集分析顯示,在V9 期,ZmCCoAOMT1 表達量變化主要參與調節植物的轉錄、對環境脅迫的響應以及細胞膜類的組成等方面;在吐絲期,ZmCCoAOMT1 突變對生物過程(biological process,BP)影響減少,對細胞組分(cell composition, CC)影響增加。說明該基因在發育前期可能主要參與調控植物的轉錄激活及對外環境脅迫的響應,在后期主要通過調節植物的細胞組分(CC)來調控植物生長發育。
苯丙烷是包括類黃酮、木質素在內的一大類植物次級代謝產物的總稱,木質素合成途徑屬于苯丙烷代謝途徑的分支[30],KEGG分析顯示,在生育前期差異表達基因主要富集在苯丙烷代謝通路中, ZmCCoAOMT1 基因的突變可能導致了苯丙烷代謝途徑中若干基因表達量的變化進而引起木質素含量甚至單體組成發生了改變。對比V9期野生型和突變體,富集在苯丙烷代謝途徑中的差異表達基因中絕大多數都為下調表達,與突變體中ZmCCoAOMT1 基因的表達量變化一致,符合預期。在苯丙烷代謝途徑中差異表達基因主要包括若干過氧化物酶基因,其編碼木質素生物合成最后一步反應的酶,將木質素單體催化脫氫后聚合產生大分子木質素[31]。由于植物細胞壁中過氧化物酶存在多種同工酶,其在木質素合成過程中具有的多樣化作用對木質素合成調控作用也因單體不同而造成差異[32]。本研究中過氧化物酶基因的下調表達可能對突變體中木質素總含量和單體含量下降發揮了作用。除此之外,突變體中位于CCoAOMT 基因上下游的HCT、CSE、CCR 等基因的表達量也顯著降低,是由于ZmCCoAoMT1 基因的下調表達引起產物阿魏酸輔酶A減少后對上下游酶產生的反饋調節[33]。這些結果為進一步理解木質素合成與代謝提供參考,但還需要進一步分子生物學論證。
參考文獻
[1] 李海燕,魏建民,安小虎,等.青貯玉米的發展現狀及栽培技術[J].畜牧與飼料科學, 2011, 32(6): 27,43.
[2] 戴忠民,高鳳菊,王友平,等.青貯玉米的育種及發展趨勢[J].玉米科學,2004, 12(4): 9-11.
DAI Z M, GAO F J, WANG Y P, et al .. Silage maize breedingand its development trend [J]. J. Maize Sci., 2004, 12(4): 9-11.
[3] 王東軍. 青貯玉米育種目標與育種方法分析[J]. 新農業,2020, 1(15): 14-15.
[4] ZHONG R, MORRISON W H, HIMMELSBACH D S, et al ..Essential role ofcaffeoyl coenzyme A-O-methyltransferase inlignin biosynthesis in woody poplar plants [J]. Plant Physiol.,2000, 124(2): 563-578.
[5] 薛永常,李金花,盧孟柱,等.木質素單體生物合成途徑[J].林業科學, 2003, 39(6): 146-153.
XUE Y C, LI J H, LU M Z, et al .. The lignin subunitsbiosynthesis pathway and its rewriting [J]. Sci. Silvae Sin.,2003, 39(6): 146-153.
[6] KUMAR M, CAMPBELL L, TURNER S. Secondary cell walls:biosynthesis and manipulation [J]. J. Exp. Bot., 2016, 67(2):515-531.
[7] SCHMITT D, PAKUSCH A E, MATERN U. Molecular cloninginduction and taxonomic distribution of caffeoyl-CoA 3-Omethyltransferase,an enzyme involved in disease resistance [J]. J.Biol. Chem., 1991, 266(26): 17416-17420.
[8] YE Z H, KNEUSEL R E, MATERN U, et al .. An alternativemethylation pathway in lignin biosynthesis in Zinnia [J]. PlantCell, 1994, 6(10): 1427-1439.
[9] YE Z H. Association of caffeoyl coenzyme A 3-Omethyltransferaseexpression with lignifying tissues in severaldicot plans [J]. Plant Physiol., 1997, 115(4): 1341-1350.
[10] 王華美,于延沖,付春祥,等.木質素合成關鍵酶咖啡酰輔酶A 氧甲基轉移酶的研究進展[J]. 基因組學與應用生物學,2014, 33(2): 458-466.
WANG H M, YU Y C, FU C X, et al .. Progress of a keyEnzyme-Caffeoyl-CoA 3-O-methyltransferase in lignin biosynthesis[J]. Genom. Appl. Biol., 2014,33(2): 458-466.
[11] CHEN C, MEYERMANS H, BURGGRAEVE B, et al .. Cellspecificand conditional expression of caffeoyl-coenzyme A-3-O-methyltransferase in poplar [J]. Plant Physiol., 2000, 123(3):853-868.
[12] RAES J, ROHDE A, CHRISTENSEN J H, et al .. Genome-widecharacterization of the lignification toolbox in Arabidopsis [J].Plant Physiol., 2003, 133(3): 1051-1071.
[13] DO C T, POLLET B, TH?VENIN J, et al .. Both caffeoylCoenzyme A 3-O-methyltransferase 1 and caffeic acid Omethyltransferase1 are involved in redundant functions forlignin, flavonoids and sinapoyl malate biosynthesis inArabidopsis [J]. Planta, 2007, 226(5): 1117-1129.
[14] PIN?ON G, MAURY S, HOFFMANN L, et al .. Repression ofO-methyltransferase genes in transgenic tobacco affects ligninsynthesis and plant growth [J]. Phytochemistry, 2001, 57(7):1167-1176.
[15] GUO D, CEN F, INOUE K, et al .. Downregulation of cafeicacid 3-O-methyltransferase and cafeoyl CoA 3-O-methyltransferasein transgenic alfalfa: impacts on lignin structure and implicationsfor the biosynthesis of G and S lignin [J]. Plant Cell, 2001, 13(1):73-88.
[16] KWON H, CHO D J, LEE H, et al.. CCOAOMT1, a candidatecargo secreted via VAMP721/722 secretory vesicles in Arabidopsis[J]. Biochem. Biophys. Res. Commun., 2020, 524(4): 977-982.
[17] CHUN H J, LIM L H, CHEONG M S, et al .. ArabidopsisCCoAOMT1 plays a role in drought stress response via ROSandABA-dependent manners [J/OL]. Plants, 2021, 10(5): 831[2024-04-02]. https://doi.org/10.3390/plants10050831.
[18] XIA Y, LIU J, WANG Y, et al .. Ectopic expression of Viciasativa Caffeoyl-CoA-O -methyltransferase (VsCCoAOMT) increasesthe uptake and tolerance of cadmium in Arabidopsis [J]. Environ.Exp. Bot., 2018, 145(1): 47-53.
[19] FORNAL? S, RENCORET J, GARC?A C L, et al .. Changes incell wall polymers and degradability in maize mutants lacking3- and 5-O-methyltransferases involved in ligninbiosynthesis [J]. Plant Cell Physiol., 2017, 58(2): 240-255.
[20] BRENNER E A, ZEIN I, CHEN Y, et al .. Polymorphisms in Omethyltransferasegenes are associated with stover cell walldigestibility in European maize (Zea mays L.) [J/OL]. BMCPlant Biol., 2010, 10:27 [2024-04-02]. https://doi.org/10.1186/1471-2229-10-27.
[21] YANG Q, HE Y J, KABAHUMA M, et al .. A gene encodingmaize caffeoyl-CoA O-methyltransferase confers quantitativeresistance to multiple pathogens [J]. Nat. Genet., 2017, 49(9):1364-1372.
[22] 劉玄,王梅,李玉龍,等.玉米主要農藝性狀相關性分析[J].安徽農學通報, 2021, 27(24): 39-41,79.
[23] GEIGER H, FUGGERERA H. ?ber den chemismus derwiesner-reaktion auf lignin on the chemistry of the wiesnerreaction on lignin [J]. Zeitschrift Fur Naturforschung B, 1979,34: 1471-1472.
[24] 馬飛前.玉米莖稈纖維性狀QTL定位[D].北京:中國農業科學院, 2014.
MA F Q. Mapping of quantitative trait loci (QTL) for stalk fibertraits in maize [D]. Beijing:Chinese Academy of AgriculturalSciences, 2014.
[25] HARMAN-WARE A E, FOSTER C, HAPPS R M, et al .. Athioacidolysis method tailored for higher-throughput quantitativeanalysis of lignin monomers [J]. Biotechnol. J., 2016, 11(10):1268-1273.
[26] LIVAK K J, SCHMITTGEN T D. Analysis of relative geneexpression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) method [J]. Methods, 2001, 25(4): 402-408.
[27] CHALMEL F, LARDENOIS A, THOMPSON J D, et al ..GOAnno: GO annotation based on multiple alignment [J].Bioinformatics, 2005, 21(9): 2095-2096.
[28] KANEHISA M, GOTO S. KEGG: kyoto encyclopedia of genesand genomes [J]. Nucleic. Acids. Res., 2000, 28(1): 27-30.
[29] YU G C, WANG L G, HAN Y Y, et al .. ClusterProfiler: an Rpackage comparing biological themes among gene clusters [J].OMICS, 2012,16(5): 284-287.
[30] ZAKZESKI J, BRUIJNINCX P C A, JONGERIUS A L, et al .. Thecatalytic valorization of lignin for the production of renewablechemicals [J]. Chem. Rev., 2010, 110(6): 3552-3599.
[31] 龍國輝,武鵬雨,付嘉智,等.過氧化物酶調控木質素合成研究進展[J].現代農業科技, 2021(23): 47-49,54.
LONG G H, WU P Y, FU J Z, et al .. Research progress onregulation of peroxidase on lignin synthesis [J]. Modern Agric.Sci. Technol., 2021(23): 47-49.
[32] DIXON R A, BARROS J. Lignin biosynthesis: old roadsrevisited and new roads explored [J/OL]. Open Biol., 2019,9(12):190215 [2024-04-02].https://doi.org/10.1098/rsob.190215.
[33] VANHOLME R, CESARINO I, RATAJ K, et al .. Caffeoylshikimate esterase (CSE) is an enzyme in the ligninbiosynthetic pathway in Arabidopsis [J]. Science, 2013, 341(6150): 1103-1106.
(責任編輯:溫小杰)
基金項目:國家重點研發計劃項目(2023YFD1200500)。

