香樟黑斑病病原菌鑒定及其拮抗菌B505的生防效果
鄭愛芳 張名雪 周姝珂 高曄 蘇子艷 張建冬 張郝宇 宋曉賀

摘 要 為明確引起香樟黑斑病的病原菌,發掘防治該病害的生防細菌資源,根據科赫法則,采用組織分離法對引起香樟黑斑病的病原菌進行分離純化。依據形態特征及ITS、? Alta1、gdp基因對病原菌進行分類鑒定;測定不同培養基、溫度、pH等因素對病原菌生長的影響;采用平板對峙法篩選香樟黑斑病拮抗細菌,并對其進行抑菌活性試驗。結果表明,引起香樟黑斑病的病原菌為互隔交鏈孢菌Alternaria? alternata,其最佳生長溫度為25 ℃,最適pH為6.5,最適培養基為PDA培養基。篩選獲得1株對香樟黑斑病有較強抑制作用的菌株B505,鑒定為貝萊斯芽胞桿菌Bacillus velezensis,該菌株可強烈抑制香樟黑斑病病原菌的菌絲生長和孢子萌發,對香樟離體葉片黑斑病的抑制率為55.6%,以上結果為生物防治香樟葉部病害提供了新的思路。
關鍵詞 香樟黑斑病;真菌病害;分離鑒定;貝萊斯芽胞桿菌;拮抗菌
香樟(Cinnamomum camphora)是一種常綠喬木,樹冠較大,夏天濃蔭遍地,植株能夠耐受短期水淹,對有害氣體有一定的抗性,且有驅蟲效果,是中國長江流域及以南地區如杭州、義烏、馬鞍山、宜賓、南充、長沙市等多個城市的重要園林綠化植物[1]。香樟的葉子和果實能提取多種具有生理活性的物質,具有抗腫瘤、抗炎癥等作用[2-3],此外,香樟具有抗有毒氣體和耐煙塵能力,能夠凈化空氣[4-5]。然而香樟葉部易遭受病原微生物的侵襲,導致炭疽病、白粉病、潰瘍病等真菌病害的發生和流行,造成葉片發生病變,嚴重時導致葉片脫落、植株矮小,嚴重降低道路綠地景觀的觀賞價值[6-7]。同時,香樟葉片真菌病害流行產生的一些病原菌產物會造成部分敏感人群的過敏反應,引發呼吸道疾病[8-9]。
化學農藥防治植物真菌病害仍然是常用的手段,但容易造成病原菌抗藥性的產生和環境的污染,危害人類的身體健康[10],開發低毒、對環境友好的微生物源殺菌劑替代化學藥物成為當前的研究熱點[11],目前已商業化使用的生物防治劑有芽胞桿菌[12]、假單胞菌[13]、木霉[14]等,微生物防治具有良好的應用前景[15]。生防菌能否在植物表面或內部定殖成為影響生防效果的關鍵因素[16-17],在健康植物的組織和表面存在大量微生物,有益微生物可以直接與病原菌發生作用,通過在葉片上定殖,改變微生物群落結構來控制植物病害[18-20],從根際、葉際分離的有益土著微生物具有定殖能力強,對植物細胞無害,抗菌效果較好等特點,在植物真菌病害防治方面有良好的效果[21-23]。
本研究采用組織分離法,分離純化香樟黑斑病病原菌,通過科赫法則、形態學和分子生物學鑒定,明確病原菌的致病性和分類地位,從香樟葉部和根際土壤分離拮抗細菌,并初步研究其對香樟黑斑病的生防特性,以期為生物防治香樟葉部病害提供新的思路。
1 材料與方法
1.1 樣本的采集
從安慶市區公園的香樟樹上采集典型的發病葉片,裝入滅菌紙袋中,帶回實驗室,4? ℃冰箱保存,備用。
1.2 香樟黑斑病病原菌的分離純化
將病葉病健交界處病斑隨機剪成0.5 mm的組織塊,用無菌水沖洗干凈,用75%乙醇漂洗1 min,無菌水沖洗3次;0.1%升汞消毒30 s,無菌水沖洗3次,放入PDA(含氯霉素)培養基中? 25 ℃恒溫培養。發現組織周圍有菌長出,及時轉接到PDA培養基上進一步分離純化。
1.3 香樟黑斑病病原菌致病性測定
菌絲接種法:用打孔器取新鮮菌餅(d = 5 mm),將菌絲面朝下置于無菌的健康葉片上,以接種空白PDA菌餅為對照,25 ℃恒溫培養。孢子接種法:從PDA平板上刮取新鮮的子實體,放入裝有30 mL無菌生理鹽水的三角瓶中,150?? r/min搖床震蕩15 min,然后用無菌脫脂棉過濾收集孢子,用血球計數板計算孢子濃度,調整孢子懸液濃度為1×106 CFU/mL,取20? μL孢子懸液滴在無菌的葉片上,以滴加相同體積無菌水的葉片為對照,葉片根部用含水無菌脫脂棉保持濕潤,25? ℃恒溫培養[24]。
1.4 香樟黑斑病病原菌鑒定
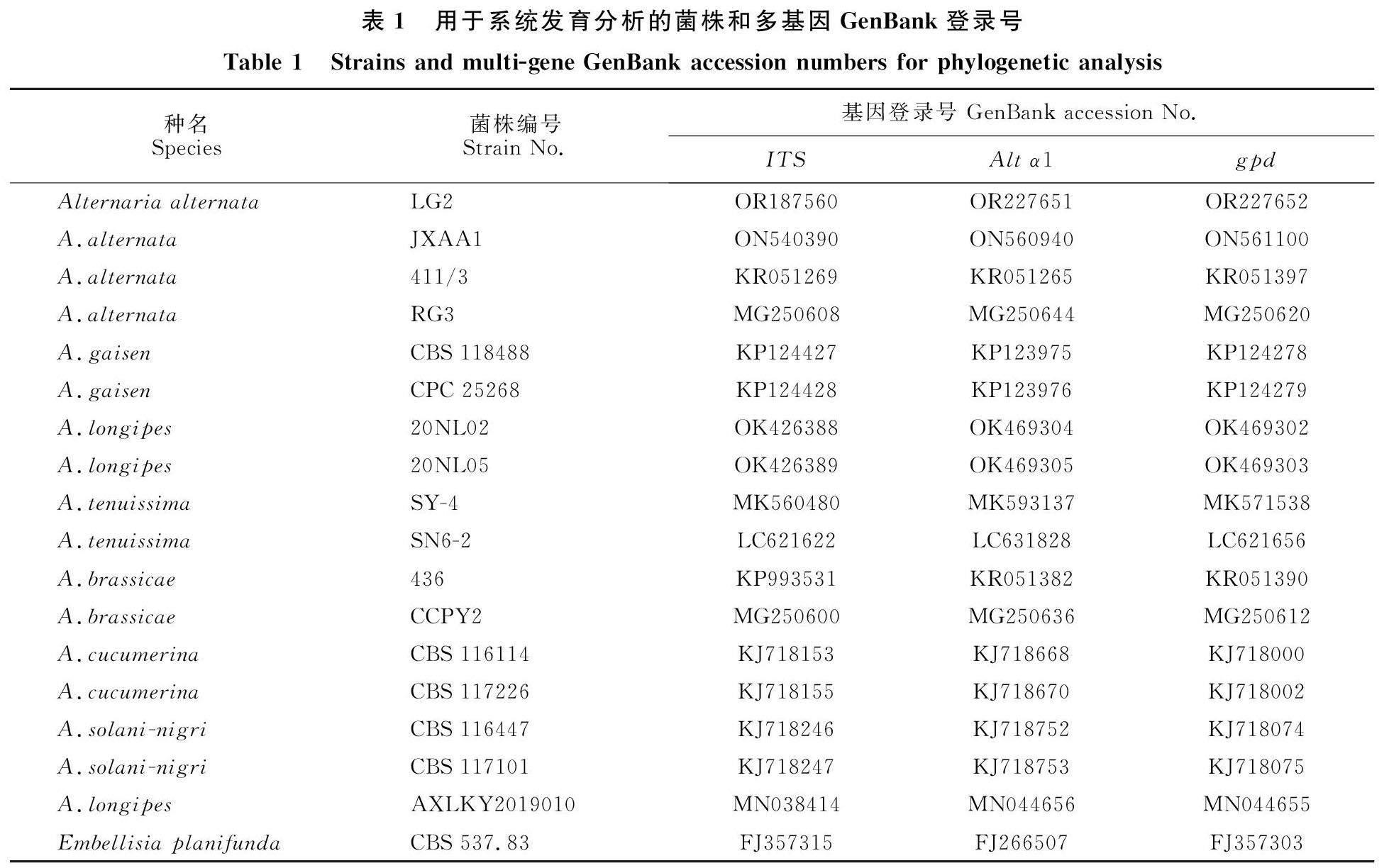
根據菌落的形態、顏色、性狀及生長情況等特征,參考《中國真菌志鏈格孢屬》[25]的描述初步對菌株進行形態分類學鑒定。收集菌株菌絲體,參照UNIQ-10柱式真菌基因組抽提試劑盒(上海生物工程有限公司)操作說明,提取菌株基因組DNA。以純化的香樟黑斑病病原菌LG2的DNA為模板,分別對核糖體RNA內轉錄間隔區基因ITS(ITS1:TCCGTAGGTGAACAYCCTGCGG,ITS4:TCCTCCGCTTATTGATATGC); 鏈格孢過敏原基因Alt α1(Altα1-F:ATGCAGTTCACCACCATCGC,Altα1-R:ACGAGGGTGAYGTAGGCGTC);3-磷酸甘油醛脫氫酶基因gpd (gpd-F:GCCGTCAACGACCCCTTCATTGA,gpd-R:GGGTGGAGTCGTACTTGAGCATGT)進行PCR擴增。PCR反應體系為:Phusion Master Mix(2×)15? μL、正反向引物? (5? μmol/L)各2? μL、gDNA(10 ng/μL) 2? μL? (10~20 ng),補水至總體積30? μL。PCR反應程序:94 ℃ 預變性1 min;94 ℃變性 30 s,50 ℃退火? 45 s,72 ℃延伸 30 s,30個循環;72 ℃ 10 min,4 ℃保存,PCR產物用15 g/L瓊脂糖凝膠電泳檢測樣品質量[26],PCR產物測序由通用生物(安徽)股份有限公司完成。將測得的序列提交至NCBI,獲得登錄號,并下載近緣菌株的上述3個基因序列,比對的菌株及相關基因登錄號等信息如表1所示。在Phylosuite軟件中,通過MAFFT進行序列比對、Gblock修剪、Concatenation串聯,用 ModelFinder對優化的數據選擇最優模型,采用MrBayes法構建系統發育樹。
1.5 香樟黑斑病病原菌的生物學特性研究
1.5.1 培養基 玉米粉瓊脂脫水培養基(CMA):青島海博生物技術有限公司;虎紅瓊脂(RBA)脫水培養基:青島海博生物技術有限公司。土豆培養基(PDA,含氯霉素,用于分離病原真菌),青島海博生物技術有限公司。PDA培養基(活化培養真菌):馬鈴薯200 g、蔗糖20 g、瓊脂20 g、水1 000 mL。NA培養基(培養細菌):牛肉膏3 g、蛋白陳10 g、NaCl 10 g、瓊脂15~20 g、水1? 000 mL、pH 7.0。改良NA培養基(可培養細菌和真菌):牛肉膏3 g、酵母膏1 g、蛋白陳5 g、葡萄糖10 g、瓊脂15~20 g、水1 000 mL、pH?? 7.0[27-28]。
1.5.2 不同培養基對病原菌菌絲體生長的影響 將5 mm的病原菌菌餅菌絲面朝下分別接種于PDA、CMA、RBA、NA、改良NA培養基中央,每組3個重復,25 ℃培養5 d,十字交叉法測量菌落直徑。
1.5.3 不同pH對病原菌菌絲體生長的影響 將改良NA培養基pH調整為4.0、4.5、5.0、? 5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0共11個梯度,將新鮮的菌餅菌絲面朝下接種于培養基中央,每組3個重復,25 ℃培養5 d,十字交叉法測量菌落直徑。
1.5.4 不同溫度對病原菌菌絲體生長的影響 將新鮮的菌餅菌絲面朝下接種于改良NA平板中央,分別在10、15、20、25、30、35、40 ℃條件下培養5 d,每組3個重復,十字交叉法測量菌落直徑。
1.6 香樟黑斑病菌拮抗菌株的篩選及鑒定
土壤拮抗菌分離法:取香樟樹冠下距地面深5~20 cm處土壤,稱取10 g,加入到裝無菌玻璃珠和90 mL無菌水的三角瓶中,搖床150 r/min震蕩20 min后,靜置沉淀之后取上清液涂布到NA平板上。葉片內生及葉際拮抗微生物分離法:選取香樟健康葉片,不經消毒,剪成0.5 mm的組織塊,1個葉片選3個組織塊,接種到NA培養基上,將兩種方法制備的平板置于37 ℃恒溫培養,觀察并分離純化細菌菌落,可初步利用土壤和葉片中豐富的微生物作為指示菌,觀察分離菌的拮抗作用。參考細菌基因組DNA提取試劑盒(廣州捷倍斯生物科技有限公司)操作說明,提取菌液基因組DNA。細菌采用16s rRNA通用引物:上游引物(27F): 5′-AGAGTTTGATCCTGGCTCAG - 3′和下游引物(1492R): 5′ - TACGGYTACCTTGTTACGACTT - 3′進行PCR擴增,產物由上海凌恩生物科技有限公司完成測序。通過BLAST分析,將所得菌株序列與Genbank核酸數據庫中已知種的16s rRNA序列比對,確定菌株類別[29]。
1.7 抗菌細菌抑制香樟黑斑病菌菌絲生長的顯微形態觀察
用打孔器取新鮮的香樟黑斑病菌菌餅(d=? 5 mm),接種在改良的NA培養基平板中央,同時在中央菌餅十字線上距離其約為2 cm的地方(共4 處)接種抗菌菌株,以不接抗菌菌株的平板為對照,每組5個重復,25 ℃恒溫培養,待對照組病原菌長滿平板后,十字交叉法測量菌落直徑,并計算抑菌率[30]。抑菌率=(對照病原菌直徑―處理病原菌直徑)/(對照病原菌直徑―5)×100%。用解剖刀取平板上抑菌帶邊緣的受抑制的香樟黑斑病菌菌絲體,置于載玻片上,用蓋玻片輕輕按壓,置于顯微鏡下觀察菌絲的形態。
1.8 拮抗細菌對香樟黑斑病菌孢子萌發的抑制效果
用無菌生理鹽水將香樟黑斑病菌的孢子懸浮液濃度調整為1.0×103、1.0×104、1.0×105 CFU/mL,拮抗菌株在NA中培養36 h后,調整濃度為1.0×107 CFU/mL。取3支15 mL試管,分別加入2 mL不同濃度的病菌孢子懸浮液,然后依次加入2 mL拮抗菌液和2 mL NB培養基,以加入相同體積的無菌水為對照,設3個重復,? 28 ℃恒溫培養24 h,光學顯微鏡觀察孢子的形態,并計算孢子萌發抑制率。
孢子萌發抑制率 = (對照組孢子萌發率―處理組孢子萌發率)/對照組孢子萌發率×100%
1.9 拮抗細菌抑制香樟黑斑病菌菌的離體葉片試驗
將香樟葉片進行表面消毒,在無菌葉片上滴加10? μL濃度為1.0×104 CFU /mL香樟黑斑病病原菌孢子懸浮液,待葉片晾干后,噴灑20? μL濃度為1.0×107 CFU/mL的拮抗菌發酵液,以滴加無菌水為對照,葉柄處用含有無菌水的無菌脫脂棉包裹,置于25℃光照培養箱中培養,每組10個葉片,3次重復。分別培養3 d、7 d、11 d觀察葉片發病情況。
香樟葉片發病嚴重度=發病面積/葉片總面積×100%
防治效果=(對照組發病嚴重度-處理組發病嚴重度)/對照組發病嚴重度×100%
2 結果與分析
2.1 香樟黑斑病病原菌的分離鑒定
2.1.1 香樟黑斑病田間癥狀 香樟黑斑病危害香樟葉片,老葉和幼嫩的新葉均可發病,主要危害新葉,病斑黑褐色,連成一片,邊緣卷曲(圖1-A和圖1-B),嚴重時葉片枯萎下垂,新梢枯死。
2.1.2 香樟黑斑病病原菌形態特征 從患病葉片中分離得到2種真菌和1種細菌。其中一種真菌屬于青霉屬,一種真菌是灰綠色的霉菌,命名為LG2;經致病性檢測,灰綠色的霉菌LG2具有致病性,其他分離株無致病性。菌落在PDA培養基上,25? ℃培養6 d,長滿整個平板。正面灰綠色(圖1-E),背面黑色(圖1-F),氣生菌絲密集。菌絲黑色,有隔膜,分生孢子黑褐色,棒槌狀,有2~7個橫隔膜,0~4個縱隔膜(圖1-G),大小為? (4~6)? μm×(13~20)μm。分生孢子鏈狀排列(圖1-H)。根據病原菌的培養特征和形態學特點,將該病原菌初步鑒定為鏈格孢屬真菌A. sp.。
2.1.3 香樟黑斑病病原菌致病性測定 香樟黑斑病菌孢子懸浮液接種5 d,幼嫩葉片上出現點狀病斑,淺褐色。接種后11 d,病斑顏色加深,呈黑褐色,病斑連成一片(圖1-C)。病原菌菌餅接種? 5 d,病斑呈黑褐色,病斑表面長滿灰色菌絲(圖1-D)。兩種接種方法接種,發病癥狀均與香樟樹上葉片發病癥狀相同。分別從發病的葉片上重新分離病原菌,其菌落特征與香樟樹上發病葉片上分離純化的菌落一致。
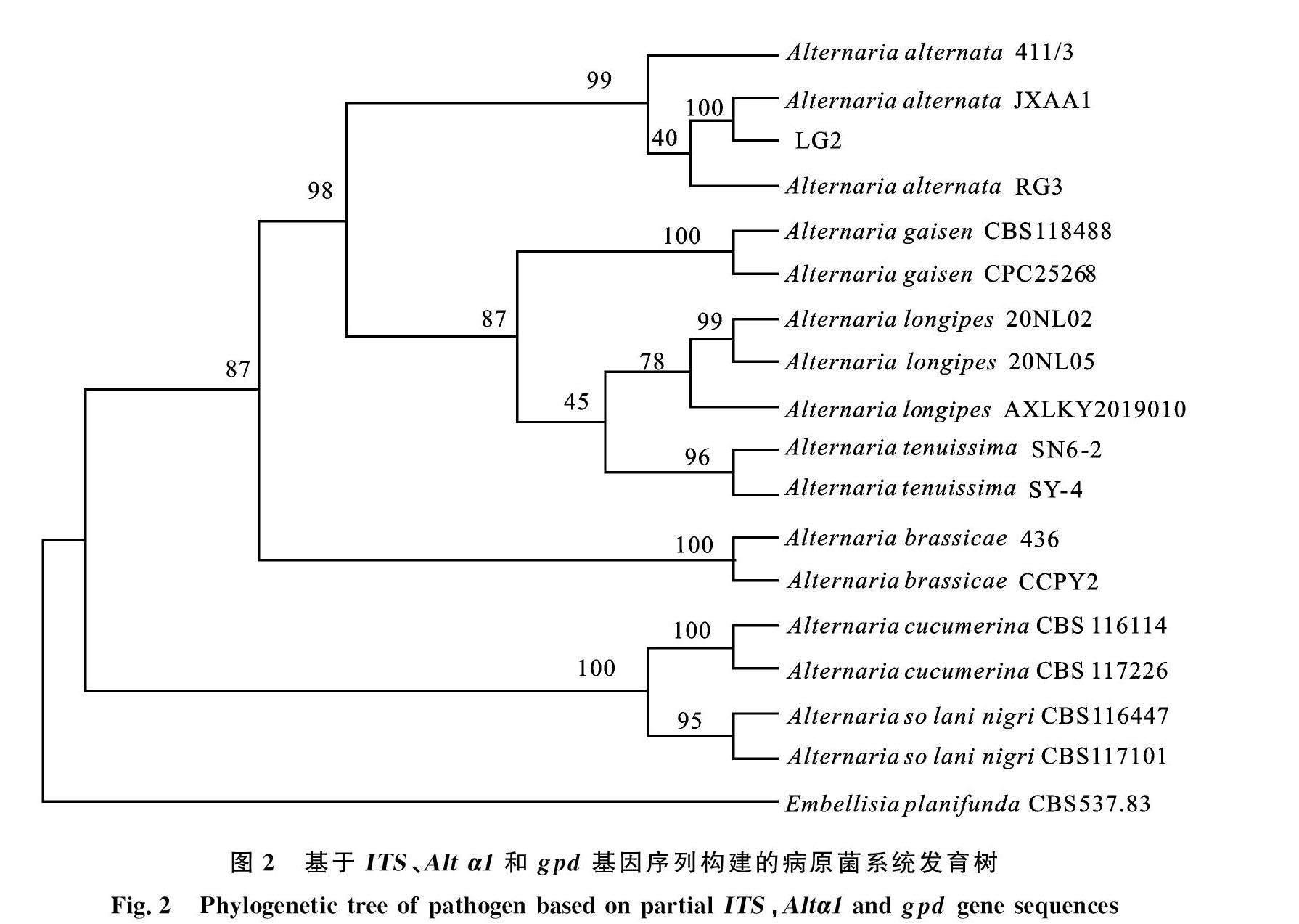
2.1.4 香樟黑斑病病原菌分子鑒定 通過 ITS、 Alta1和gdp 基因序列擴增與測序,獲得大小分別為539、485和177 bp的基因片段,提交至NCBI,登錄號分別為:OR187560 、OR227651和OR227652。通過與近源菌株比對,以E.planifunda為外群構建發育樹,結果顯示香樟黑斑病病菌菌株LG2與A.alternata JXAA1聚在同一分支上。結合形態學特征和分子生物學特性,將該菌株鑒定為互生鏈格孢A .alternata,如圖2。
2.2 香樟黑斑病病原菌生物學特性研究
2.2.1 不同培養基對病原菌菌絲生長的影響 由表1可知,病菌LG2在PDA、NA、改良NA、玉米粉瓊脂培養基和虎紅瓊脂培養基5種培養基上均能正常生長,其中在PDA培養基和改良的NA培養基生長得最好,菌落直徑分別為8.63 cm和8.52 cm,差異不顯著(P>0.05),菌絲體生長比較濃密旺盛;在玉米粉瓊脂培養基、虎紅瓊脂培養基上生長略差,菌絲較為稀疏;在NA培養基上生長得菌落較小,菌絲稀疏,生長較差(表2)。
2.2.2 不同pH及溫度對病原菌菌絲體生長的影響 由圖3-A可知,病原菌菌絲在pH為? 4.0~9.0均能生長,其中pH為6.0~8.0時生長較好,最適pH為6.5(圖3-A)。病原菌菌絲在溫度為10 ℃~40 ℃均能生長,25 ℃生長最好,為最適溫度,超過35 ℃菌絲生長緩慢(圖3-B)。研究還發現,病菌在4 ℃時也能緩慢生長,具有耐低溫能力。
2.3 香樟黑斑病拮抗細菌生防特性研究
2.3.1 香樟葉片拮抗細菌的分離鑒定 葉片組織在NA培養基上培養48 h,發現6個組織塊周圍均有相似的細菌檢出,對分布在其周圍的其他雜菌有明顯的抑制作用;土壤中分離得到的1株細菌對平板上周圍的霉菌也有抑制作用。平板對峙試驗表明土壤和葉片上分離得到的細菌對香樟葉片病原菌都有抑制效果,其中通過葉片組織分離得到的菌株B505對病原菌的抑菌圈最大,且對植物葉片沒有致病作用,因此將菌株B505作為拮抗菌進行后續研究。菌株B505在改良NA培養基上呈乳白色,表面有褶皺凸起,直徑3~6 mm,菌落邊緣不規則(圖4-A)。革蘭氏陽性細菌(圖4-B),桿狀,大小為(0.5~0.6) μm ×(2.5~3.0) μm,有芽胞。經PCR擴增、測序和BLAST比對,菌株B505 16S rDNA序列長度為1 450 bp,與菌株Bacillus velezensis CBMB205(NR116240)同源性為99.65%。結合菌落形態和分子生物學鑒定,將菌株B505命名為貝萊斯芽胞桿菌? B.velezensis,Genbank登錄號為ON834320。
2.3.2 拮抗細菌B505抑制香樟黑斑病菌菌絲生長的顯微形態觀察 菌株B505對香樟黑斑病菌的對峙效果如圖4-D所示,圖4-C為對照組病原菌菌落,對峙培養6 d,病菌的生長受到明顯抑制,抑菌帶寬度為8.0 mm,抑菌率為71%。顯微鏡觀察菌絲的形態特征,正常菌絲呈竹節狀、細胞不膨大(圖4-E),受抑制的香樟黑斑病菌有隔菌絲呈藕節狀,細胞畸形、膨大(圖4-F)。
2.3.3 拮抗細菌B505對香樟黑斑病菌孢子萌發的抑制作用 由表3可知,菌株B505(濃度為1.0×107 CFU/mL)與香樟黑斑病菌孢子在液體培養基中共培養,香樟黑斑病菌孢子懸浮液的濃度為1.0×103~1.0×105 CFU/mL,其抑制率為60%~98%,且隨著病菌孢子懸浮液濃度的增加,抑菌率降低。當B505和香樟黑斑病菌孢子比例為10 000∶1時,共培養時香樟黑斑病菌孢子萌發抑制作用最強,其抑制率高達98%。在鏈格孢懸浮液的濃度為1.0×103時與B505共培養,顯微鏡觀察發現,多數分生孢子不萌發,部分僅形成短小的芽管,有的畸形甚至被裂解(圖5-A,箭頭所示)。對照組孢子正常萌發,一個孢子可以萌發形成多個菌絲,菌絲較長,無膨大現象(圖5-B、5-C)。
2.3.4 離體葉片法測定B505對香樟黑斑病的防治效果 如圖6所示,培養3 d,噴灑B505發酵液的試驗組葉片形成小型的離散病斑(圖6-A),接種香樟黑斑病菌孢子懸浮液(1.0×103?? CFU/mL)的對照組,葉片形成黑色病斑(圖6-D);培養7 d,試驗組離散型病斑略有擴展(圖6-B),而對照組病斑進一步擴大,顏色加深,病斑表面產生病癥(絨毛狀菌絲,鏡檢發現有鏈格孢菌孢子形成)(圖6-E);培養11 d,處理組葉片病斑大小穩定,基本沒有變化,病斑數量沒有增加和擴展,葉片病變面積為10%(圖6-C),對照組葉片離散的病斑大量增加,中心病斑進一步增大,葉片病變面積為22%(圖6-F),拮抗菌B505對香樟葉片黑斑病的防治效果顯著,抑菌率為55.6%。
3 討? 論
香樟在生長過程中易受真菌侵染引起葉部病害。目前,已經報道的香樟葉部真菌病害種類較多,主要有:由膠孢炭疽菌Colletotrichum gloeosporioides引起的炭疽病[31],由囊孢殼菌大莖點霉菌Macrophoma sp.引起的潰瘍病[32],由白粉菌Erysiphaceae引起的白粉病[33],由煤炱目的煤炱菌Capnodium sp.引起的煤污病[34]等。本研究從香樟幼嫩葉片中分離獲得1株鏈格孢屬黑斑病菌,經鑒定命名為互隔交鏈孢菌Alternaria alternata。目前未有該病原菌引起香樟黑斑病的報道。病原菌菌絲和孢子懸浮液對香樟葉片的接種試驗表明,幼嫩的葉片極易感染,但老葉因有較厚蠟質層保護感染能力較差。因此,應當在春季香樟嫩葉大量生長的時期進行香樟黑斑病的防治工作。
香樟葉部真菌病害的防治主要是通過噴施化學農藥,化學防治會增加環境污染的風險,影響人類的健康[35]。生物防治可減少環境污染,促進植物生長,在植物病蟲害防治中越來越受到人們的重視。生防細菌芽胞桿菌抗逆性極強,不污染環境,對植物病原真菌具有良好的抑制效果。貝萊斯芽胞桿菌是芽胞桿菌屬的一個新種[36],研究表明貝萊斯芽胞桿菌對炭疽菌Colletotrichum spp.、葡萄座腔菌Botryosphaeria dothidea、鏈格孢菌Alternaria spp.、新擬盤多毛孢Neopestalotiopsis spp.和擬莖點霉菌Phomopsis sp.均具有拮抗效果[36],對蘋果炭疽病[37]、稻瘟病[38]、草莓灰霉病[39]等也具有良好的生防效果。本研究中分離獲得的貝萊斯芽胞桿菌B505對香樟黑斑病菌抑制效果顯著。除此之外,對3種病原霉菌赤葉枯刺盤孢菌Colletotrichum gloeosporoides、小孢擬盤多毛孢Pestalotiopsis microspora、青霉菌Penicillium,1種致病細菌大腸桿菌Escherichia coli和1種生防菌球孢白僵菌Beauveria bassiana、2種大型真菌白耙齒菌Irpex lacleus、裂褶菌Schizophyllum commune 等均具有明顯的抑制作用(未發表)。梁巧蘭等[40]研究表明裂褶菌能引起花椒樹腐朽病。白耙齒菌是白腐菌,容易造成木材的腐朽,分離的拮抗菌B505對白耙齒菌Irpex lacleus和裂褶菌Schizophyllum commune Franch有明顯的抑制作用,因此未來可將該拮抗菌用于相關領域的病害防治。貝萊斯芽胞桿菌B505對球孢白僵菌有抑制作用,如果將該生防菌用于防治作物病害時,應避免與生防菌白僵菌、綠僵菌同時使用。
貝萊斯芽胞桿菌在生長和繁殖的過程中會產生一些具有抑菌活性的代謝產物[41]。Huang等[42]發現貝萊斯芽胞桿菌HYEB5-6代謝產物可能通過蛋白酶和葡聚糖酶來抑制病原真菌分生孢子萌發、芽管生長。本研究B505與香樟黑斑病菌對峙試驗產生較寬的抑菌帶,說明B505在生長的過程中可能在培養基表面或者內部分泌具有抑菌活性的代謝產物,從而抑制了香樟黑斑病菌菌絲的生長。B505發酵液可抑制香樟黑斑病菌孢子萌發和芽管的生長,降低香樟黑斑病的發病嚴重程度,進一步說明B505在生長繁殖過程中可能產生了抑菌次生代謝產物。下一步的研究工作將會采用基因組和代謝組學技術,篩選抑菌代謝產物,為進一步利用貝萊斯芽胞桿菌奠定基礎。與此同時,本研究只在室內實驗室條件下測定貝萊斯芽胞桿菌對香樟黑斑病具有拮抗效果,對香樟黑斑病田間防治效果尚未進一步研究,后續將會進一步測定B505對其田間的防病效應。
參考文獻 Reference:
[1] ZHOU Y,YAN W.Conservation and applications of camphor tree(Cinnamomum camphora) in China:ethnobotany and genetic resources[J].Genetic Resources and Crop Evolution,2016,63:1049-1061.
[2] HYE JL,EUN A H,WEON J Y,et al.In vitro anti-inflammatory and anti-oxidative effect of Cinnammomum camphora extracts[J].Journal of Ethnopharmacology,2006,103:208-216.
[3] 褚衍亮,王 娜.樟樹果紅色素的穩定性及抗氧化活性研究[J].北方園藝,2010(12):44-47.
CHU Y L,WANG N.Study on stability and antioxidative activity of red pigment in fruit of Camphor tree[J].Northern Horticulture,2010(12):44-47.
[4] 郝臨雨.紫蘇籽及香樟精油的提取及活性研究[D].上海:? 上海應用技術大學,2021.
HAO L Y.Study on extraction and activity of perilla seed and Cinnamomum camphora essential oils.[M.D.Dissertation].Shanghai:Shanghai Institute of Technology,2021.
[5] CHEN? J,TANG C,ZHANG R,et al.Metabolomics analysis to evaluate the antibacterial activity of the essential oil from the leaves of Cinnamomum camphora(Linn.) Presl[J].Journal of Ethnopharmacology,2020,253:112652.
[6] 徐明珠,羅 歡,周志雄,等.香樟葉斑病病原菌的分離與鑒定[J].中國森林病蟲,2017,36(4):21-25,28.
XU M ZH,LUO H,ZHOU ZH X,et al .Isolation and identification of the pathogen from the leaf spot disease on Cinnamomum camphora[J].Forest Pest and Disease,2017,? 36(4):21-25,28.
[7] 孫玉萍.淺談香樟常見病蟲害及其防治技術要點[J].南方農業,2021,15(27):23-24.
SUN Y P.Common pests and diseases of? Camphor and its control technical points[J].South China Agriculture,2021,15(27):23-24.
[8] 曹 晨,姚晶晶,李 婕,等.鏈格孢菌在支氣管哮喘兒童中致敏特點分析[J].國際呼吸雜志,2022,42(16):1237-1241.
CAO CH,YAO J J,LI J,et al.Analysis of sensitization characteristics of A.alternata in children with bronchial asthma[J].International Journal of Respiration,2022,? 42(16):1237-1241.
[9] LSERS,GREGORY L G,ZHANG Y,et al.Pulmonary ORMDL3 is critical for induction of Alternaria- induced allergic airways disease[J].The Journal of Allergy and Clinical Immunology,2017,139(5):1496.
[10] HATAMLEH A A,DANISH M,AL-DOSARY M A,? et al.Physiological and oxidative stress responses of Solanum lycopersicum(L.)(tomato)when exposed to different chemical pesticides[J].RSC Advances,2022,?? 12(12):7237-7252.
[11] TALIBI I,ASKARNE L,BOUBAKER H,et al.Antifungal activity of? Moroccan medicinal plants against citrus sour rot agent Geotrichum candidum[J].Letters? in Applied Microbiology,2012,55(2):155-161.
[12] MILJAKOVID,MARINKOVI J,BALEEVI-TUBI S.The significance of Bacillus spp.in disease suppression and growth promotion of field and vegetable crops[J].Microorganisms,2020,8(7):1037.
[13] IMRANM,ABO-ELYOUSR K,MOUSA M,et al.A study on the synergetic effect of Bacillus amyloliquefaciens and dipotassium phosphate on A.solani causing early blight disease of tomato[J].European Journal of Plant Pathology,2022,162(1):63-77.
[14] MLLERT,BEHRENDT U.Exploiting the biocontrol potential of plant-associated pseudomonads- A step towards pesticide-free agriculture?[J].Biological Control,2021,155(1/2):104538.
[15] CHA J Y,HAN S,HONG H? J,et al.Microbial and biochemical basis of a Fusarium wilt-suppressive soil[J].ISME Journal,2016,10(1):119-129.
[16] 李 穎,龍長梅,蔣 標,等.兩株PGPR菌株的花生定殖及對根際細菌群落結構的影響[J].生物技術通報,2022,38(9):237-247.
LI Y,LONG CH M,JIANG B,et al.Colonization on the peanuts of two plant-growth promoting rhizobacteria strains and effects on the bacterial community structure of rhizosphere[J].Biotechnology Bulletin,2022,38(9):237-247.
[17] LINDOW S E,BRANDL M T.Microbiology of the Phyllosphere[J].Applied and Environmental Microbiology,2003,69(4):1875-1883.
[18] GU L K,BAI Z H,JIN B,et al.Assessing the impact of fungicide enostroburin application on bacterial community in wheat phyllosphere[J].Journal of Environmental Sciences,2010,22(1):134-141.
[19] ATTIA M S,EL-SAYYAD G S,ELKODOUS M A,et al.The effective antagonistic potential of plant growth-promoting rhizobacteria against Alternaria solani-causing early blight disease in tomato plant[J].Scientia Horticulturae,2020,266:1-14.
[20] JAYAKUMARA,KRISHNA A,MOHAN M,et al.Plant growth enhancement,disease resistance,and elemental modulatory effects of plant probiotic endophytic Bacillus sp.Fcl1[J].Probiotics Antimicrob Proteins,2019,? 11(2):526-534.
[21] RABBEEMF,ALI MS,CHOI J,et al.Bacillus velezensis:A valuable member of bioactive molecules within plant microbiomes[J].Molecules,2019,24(6):1046.
[22] 胡黨振,徐嬡媛,于夢怡,等.芽胞桿菌處理對柑桔苗木黃龍病抑制效果[J].中國農業大學學報,2021,26(8):72-83.
HU D ZH,XU Y Y,YU M Y,et al.Inhibitory effect of Bacillus treatment on citrus Huanglongbing disease in nursery growth plants[J].Journal of China Agriculture University,2021,26(8):72-83.
[23] 穆文強,康慎敏,李平蘭.根際促生菌對植物的生長促進作用及機制研究進展[J].生命科學,2022,34(2) :118-127.
MU W Q,KANG SH M,LI P L.Advances in rhizosphere growth-promoting bacteriafunction on plant growth facilitation and their mechanisms[J].Chinese Bulletin of Life Science ,2022,34(2):118-127.
[24] 于靜亞,董立坤,王志華,等.石楠葉霉病病原鑒定及對藥物敏感性測定[J].植物病理學報,2017,47(4):440-447.
YU J Y,DONG L K,WANG ZH H,et al.Identification of pathogen for leaf spot disease of Photinia serrulata Lindl.and determination of its sensitivity to fungicides[J].Acta Phytopathologica Sinica,2017,47(4):440-447.
[25] 張天宇.中國真菌志(第16卷):鏈格孢屬[M].北京:科學出版社,2003.
ZHANG T Y.Chinese fungi(Vol.16):Alternaria.[M].Beijing:Science Press,2003.
[26] 張宗斌,岳正波,吳景行,等.1株海洋產電菌 Shewanella XMS-1 的特性分析[J].環境工程.2021,39(1):33-39.
ZHANG Z B,YUE ZH B,WU J X,et al.Characterization of one strain of marine electrogenic? Shewanella XMS-1[J].Environmental Engineering,2021,39(1):33-39.
[27] 嚴占勇,肖崇剛,易 龍,等. 防治辣椒疫病的芽胞菌株的篩選及其抑菌效果的測定[J].中國蔬菜,2005(6):18-20.
YAN ZH? Y,XIAO CH G,YI L,et al.Screening test and inhibiting effect of spore bacterio to Phytophthora capsici[J].China Vegetables,2005(6):18-20.
[28] 劉思怡,楊春琳,曾 倩,等.雷竹叢枝病病原生物學特性及藥劑防效試驗[J].菌物學報,2022,41(11):1867-1888.
LIU S Y,YANG CH L,ZENG Q,et al.Biological characteristics and fungicidal control efficacy of the pathogens causing witches broom of Phyllostachys violascens[J].Mycosystema,2022,41(11):1867-188.
[29] 王彩霞,李興紅,魏艷敏,等.引起葡萄葉斑病的鏈格孢種類的初步鑒定[J].植物保護學報,2019,46(1):175-183.
WANG C X,LI X H,WEI Y M,et al.Identification of? Alternaria species causing leaf spots in grapes[J].Journal of Plant Protection,2019,46(1):175-183.
[30] 郝衛寧,李 輝,胡美英,等.柑桔綠霉病拮抗細菌的篩選、鑒定及其抑制效果[J].中國生物防治學報,2011,27(2):284-288.
HAO W N,LI H,HU M Y,et al.Selection of antagonistic bacteria against citrus green mold and its inhibition activity on shatang mandarin fruit[J].Chinese Journal of Biological Control,2011,27(2):284-288.
[31] 王麗貞.芳香樟炭疽病的研究[D].福州:福建農林大學,2007.
WANG L ZH.Study on the anthracnose of Cinnamomum camphora var.linaloolifera Fujian[D].Fuzhou:Fujian Agriculture and Forestry University.2007.
[32] 宋結根.潛水河濕地公園香樟潰瘍病調查及防治對策[J].吉林農業,2019(24):94-95.
SONG J G.Investigation and control countermeasures of camphor canker disease in Shuihe Wetland Park[J].Agricultureof Jilin,2019(24):94-95.
[33] KIRSCHNER R,LIU W A.Two new hosts of anamorphic Erysiphe quercicola:Cinnamomum camphora and Murraya paniculata Science? Direct[J].Mycoscience,2014,? 55(3):190-195.
[34] 徐勤明,何志堃.無錫市香樟煤污病和日本壺鏈蚧的危害情況分析[J].江蘇林業科技,2017,44(5):32-34.
XU Q M,HE ZH K.Analysis on the harm of Camphor coal stain in Wuxi city and Asterococcus muratae Kuwana [J].Journal of Jiangsu Forestry Science & Technology,2017,44(5):32-34.
[35] 郭立勇.園林植物保護存在的問題及對策[J].現代園藝,2018(4):68.
GUO L Y.Problems and countermeasures of garden plant protection[J].Contemporary Horticulture,2018(4):68.
[36] 王 迪,高 巖,吳小雙,等.兩株貝萊斯芽胞桿菌鑒定及其對薄殼山核桃黑斑病病原菌的拮抗效果[J].中國生物防治學報,2022,38(6):1572-1581.
WANG D,GAO Y,WU X SH,et al.Identification of two strains of Bacillus velezensis isolated from Carya illinoensis leaf and their antagonistic effects on pecan black spot pathogen[J].Chinese Journal of Biological Control,2022,38(6):1572-1581.
[37] KIM Y S,LEE Y,CHEON W,et al.Characterization of Bacillus velezensis AK-0 as a biocontrol agent against apple bitter rot caused by Colletotrichum gloeosporioides[J].Scientific Reports,2021,11(1):626.
[38] 沙月霞,王 琦,李 燕.稻瘟病生防芽胞桿菌的篩選及防治效果[J].中國生物防治學報,2016,32(4):474-484.
SHA Y X,WANG Q,LI Y.Screening and prevention of Bacillus biocontrol against rice blast[J].Chinese Journal of Biological Contro,2016,32(4):474-484.
[39] 關一鳴,潘曉曦,王 瑩,等.哈茨木霉菌、枯草芽孢桿菌對人參灰霉病和根腐病病原菌的拮抗作用[J].江蘇農業科學,2014,42(5):123-124.
GUAN Y M,PAN X X,WANG Y,et al.Antagonistic effects of Trichoderma harziaum and Bacillus subtitis on pathogens of Botrytis cinerea and root rot of ginseng[J].Jiangsu Agricultural Sciences,2014,42(5):123-124.
[40] 梁巧蘭,魏列新,徐秉良,等.花椒樹腐朽病病原菌鑒定及其生防菌劑篩選[J].西北農業學報,2022,31(9):1211-1221.
LIANG Q L,WEI L X,XU B L,et al.Identification on pathogens of Zanthoxylum bungeanum decay disease and screening of its biocontrol fungicides[J].Acta Agriculturae Boreali-occidentalis Sinica,2022,31(9):1211-1221.
[41] TORAL L,RODRíGUEZ M,BéJAR V,et al.Crop protection against Botrytis cinerea by rhizhosphere biological control agent Bacillus velezensis XT1[J].Microorganisms,2020,8(7):992.
[42] HUANG L,LI Q C,HOU Y,et al.Bacillus velezensis strain HYEB5-6 as a potential biocontrol agent against anthracnose on Euonymus japonicus[J].Biocontrol Science and Technology,2017,27(5):636-653.
Isolation and Identification of Pathogen Causing Camphor
Black Spot Disease and? Biocontrol Characteristics of Antagonistic Bacillus velezensis B505
ZHENG Aifang1,2,3,ZHANG Mingxue1,ZHOU Shuke1,GAO Ye1,SU Ziyan1 ,ZHANG Jiandong1,ZHANG Haoyu1 and SONG Xiaohe1,3
(1.College of Life Science,Anqing?? Normal University,Anqing Anhui 246133,China;2.Key Laboratory of
Biodiversity and? Ecology Conservation in Southwest Anhui,Anqing Anhui 246133,China;
3.Research Center? of Aquatic Organism Conservation and Water Ecosystem Restoration
in Anhui Province,Anqing Normal University,Anqing Anhui 246133,China)
Abstract This study aimed to identify the pathogen causing the black spot disease on Cinnamomum camphora and to investigate the potential biocontrol bacteria resources for the preventation and control of this disease.The pathogen was isolated and purified using the tissue isolation method.The pathogen was identified through the integration of colony,micromorphology,and ribosomal rDNA-ITS testing.This study also explored effects of physical and chemical factors,such as the medium,temperature,and pH on its growth.Bacteria with antagonistic properties against camphor black spots were screened using the plate confrontation method,and their antibacterial activity was tested.The results showed that the pathogen causing camphor black spots was Alternaria alternata.The optimum growth temperature,pH,and medium were 25 ℃,6.5,and potato dextrose agar,respectively.The Bacillus velezensis strain B505 was screened for its strong inhibitory effects on camphor black spots,? achieved? by suppressing both pathogen mycelial growth and spore germination.In vitro testing revealed a leaf black spot inhibition rate of 55.6% on Cinnamomum camphora,the above results provide a novel approach to the biological control of camphor leaf diseases.
Key words Camphor black spot disease; Fungal diseases; Isolation and identification; Bacillus velezensis; Antagonistic bacteria
Received? 2023-03-16??? Returned 2023-07-13
Foundation item Natural Science Research Project? of Anhui University(No.KJ2019A0551); the Natural Science Foundation of Anhui Province(No.2008085MC105);Undergraduate Innovation and Entrepreneurship Training Program? of Anhui Province(No.S202310372085);Open Fund of Key Laboratory of Biodiversity Ecology Conservation in Southwest Anhui(No.Wxn202308).
First author ZHENG Aifang,female,master,associate professor.Research? area:environmental biology.E-mail:aifangzheng@126.com
Corresponding?? author SONG Xiaohe,female,Ph.D,associate professor,master supervisor.Research area:microbial resource development and utilization.E-mail:sxhapril@163.com
(責任編輯:史亞歌 Responsible editor:SHI Yage)

