基于納米技術的藥物遞送系統在肝細胞癌治療中的研究進展
楊森林 向楊 楊毅軍

摘要:原發性肝癌是消化系統最常見的惡性腫瘤之一,其中肝細胞癌(HCC)占90%以上。早期HCC以手術切除為主,且預后較好,然而因HCC起病隱匿,絕大多數患者確診時已進展至中晚期,手術治療效果較差,而非手術治療方式因為普遍存在不良反應大,腫瘤選擇性低等問題,療效也不理想,所以目前中晚期HCC治療仍是臨床工作的難點。納米粒(NP)尺寸小、比表面積大,具有多種獨特的理化性質,成為輸送藥物、基因及細胞活性因子等治療劑的潛在載體。納米遞送系統以NP為載體,通過功能化修飾,從時間、空間及劑量上調控藥物、基因及細胞活性因子等在體內的代謝及轉化,在HCC治療中展現出巨大的潛力。本文主要介紹了幾種常見納米遞送系統,包括有機納米載體、無機納米載體、外泌體等在HCC治療中的現狀和優勢,總結了基于NP的納米載體治療HCC的機制,為新型納米遞送系統的研發提供參考。
關鍵詞:肝細胞癌;納米技術;藥物/基因遞送系統;靶向治療
中圖分類號: R735.7? 文獻標識碼: A? 文章編號:1000-503X(2024)03-0384-09
DOI:10.3881/j.issn.1000-503X.15669
Advances in Nanotechnology-Based Drug Delivery Systems in the Treatment of Hepatocellular Carcinoma
YANG Senlin,XIANG Yang,YANG Yijun
Department of Hepatobiliary Surgery,Haikou Affiliated Hospital of Central South University Xiangya School of Medicine,Haikou 570208,China
Corresponding author:XIANG Yang Tel:18876163917,E-mail:xiangyang200611@126.com
ABSTRACT:Primary liver cancer is one of the most common malignant tumors of the digestive system,of which hepatocellular carcinoma (HCC) accounts for more than 90% of the total cases.The patients with early HCC treated by surgical resection generally demonstrate good prognosis.However,due to the insidious onset,HCC in the vast majority of patients has progressed to the mid-to-late stage when being diagnosed.As a result,surgical treatment has unsatisfactory effects,and non-surgical treatment methods generally have severe side effects and low tumor selectivity.Nanoparticles (NP) with small sizes,large specific surface areas,and unique physical and chemical properties have become potential carriers for the delivery of therapeutic agents such as drugs,genes,and cytokines.The nano-delivery systems with NP as the carrier can regulate the metabolism and transformation of drugs,genes,and cytokines in vivo from time,space,and dose via functional modification,showing great potential in the treatment of HCC.This paper introduces the current status and advantages of several common nano-delivery systems,including organic nano-carriers,inorganic nano-carriers,and exosomes,in the treatment of HCC.Furthermore,this paper summarizes the mechanisms of NP-based nano-carriers in treating HCC and provides reference for the development of new nano-delivery systems.
Key words:hepatocellular carcinoma;nanotechnology;drug/gene-delivery system;targeted therapy
Acta Acad Med Sin,2024,46(3):384-392
原發性肝癌是消化系統最常見的惡性腫瘤之一,其中肝細胞癌(hepatocellular carcinoma,HCC)占90%以上,死亡率約為8.3%[1]。HCC的發病與多種因素相關,如酒精性肝硬化、糖尿病、乙型和丙型肝炎、吸煙、鐵超載等[2]。目前HCC的治療方法主要有手術治療(肝切除和肝移植)和非手術治療(化療栓塞、放療、微波消融和系統治療)。早期HCC以手術切除為主,預后較好;然而由于HCC起病隱匿,確診病例多為中晚期,單純手術治療效果較差。系統治療(如分子靶向藥物治療、免疫治療、化療、基因治療等)是目前治療中晚期HCC的主要方式,可以控制疾病的進展,延長患者的生存時間,但系統治療的特異性仍較低,在體內非選擇性分布,不良反應大,且易耐藥,因此迫切需要探索HCC新療法以滿足臨床需求。
納米載體具有以下主要優勢:(1)納米載體通過表面改性或功能化可以促進藥物/基因直接靶向運輸至HCC組織并穿透細胞膜屏障,減少非特異性毒性;(2)納米載體可以實現藥物、基因及細胞活性因子等多種治療劑的共遞送,有效增強HCC治療效果,緩解耐藥;(3)一些納米載體本身的治療性質和物理特性能夠實現藥物/基因聯合光熱治療等,進一步提高HCC治療效率[3-5]。近年來,納米醫學在HCC中的研究不斷進展,有望成為解決HCC治療難題的有效手段。
本文主要介紹了基于納米技術的藥物遞送系統在HCC治療中的現狀,并總結了幾種常見的納米載體(表1),如有機納米載體、無機納米載體、外泌體等在HCC治療中的應用進展,為新型納米遞送系統的研發提供參考。
1 納米遞送系統
納米粒(nanoparticles,NP)是由天然或合成的無機或有機高分子材料制成的、粒徑在納米尺度范圍的固態微粒,具有尺寸小、比表面積大等特點和多種獨特的物理化學特性(如膠體、電磁和光熱等)[6]。納米遞送系統以NP為載體,通過功能化修飾,可以從時間、空間及劑量上調控藥物、基因及細胞活性因子等在體內的代謝和轉化,在HCC治療中展現出巨大的價值。
脂質體和膠束等是常見的有機NP,可以增加藥物溶解度、增強藥物滲透和生物利用度,抑制網狀內皮系統的攝取并增強HCC細胞的內化作用,提高HCC治療效果[7]。攜帶基因/藥物的納米遞送系統可以特異性識別腫瘤部位,在腫瘤微環境中(低pH和還原性等)響應性釋放基因/藥物,從而實現HCC的協同治療[8-9]。此外,一些常見的無機NP,如金NP、氧化鐵、石墨烯、硒及黑磷等,不僅可以作為納米遞送載體,而且由于其表面等離子體效應,還可以作為光熱劑或放療增敏劑,增強HCC治療效果或提升HCC協同治療水平[10–12]。
2 用于HCC治療的常見納米遞送系統
2.1 有機納米遞送系統
有機材料具有高度生物相容性和可生物降解性,但由于其元素多樣性較低,缺乏多功能性,大多數有機納米材料僅可用作治療劑遞送載體。盡管有機納米遞送系統應用范圍有限,但在體外和體內治療HCC的研究中,其有效性還是得到了證實。
2.1.1 聚合物
高分子聚合物由多種簡單的結構單元通過共價鍵重復連接而成,可分為天然高聚物和合成高聚物兩大類。常見的高分子聚合物包括聚乙二醇(polyethylene glycol,PEG)、聚乳酸、聚乳酸-乙醇酸、多糖等。聚合物生物相容性好、易于制備及改性,具有良好的生物降解性,因此目前作為納米載體也已廣泛用于各類腫瘤治療研究[13]。
PEG可以涂覆在NP表面以增加體內循環穩定性,通過化學修飾后可用于治療劑遞送[14]。Tang等[15]開發了一種以PEG為載體、索拉非尼為治療劑、磷脂酰肌醇蛋白聚糖3(glypican 3,GPC 3)為靶向配體的納米遞送系統,研究發現這種納米遞送系統可以顯著抑制肝癌細胞株HepG2(以下簡稱HepG2)異種移植瘤在裸鼠體內的生長,且無明顯不良反應。聚乳酸-乙醇酸具有良好的生物相容性和可控降解性,而d-α-生育酚PEG1000琥珀酸酯的親水性和乳化作用可增強藥物吸收,提高載體穩定性。Dong等[16]通過化學交聯法將兩者與N-乙酰半乳糖胺結合,合成了一種N-乙酰半乳糖胺-聚乳酸-乙醇酸-d-α-生育酚PEG1000琥珀酸酯NP(以下簡稱EGPTN),并將具有潛在抗腫瘤作用的大黃素負載于EGPTN上,體外實驗結果顯示EGPTN具有高細胞毒性和細胞凋亡率,并且在HCC小鼠模型的體內抗腫瘤作用也優于其他組。
Cavallaro等[17]合成了一種基于α,β-聚(N-2-羥乙基)-D,L-天冬氨酰胺的新型陽離子聚合物(以下簡稱PHEA),能有效遞送針對轉錄因子E2F1的siRNA(以下簡稱siE2F1),用于HCC的靶向給藥。他們將PHEA與二乙三胺(以下簡稱DETA)和含有半乳糖的PEG衍生物(以下簡稱PEG-GAL)進行后續衍生化反應,得到聚合物載體PHEA-DETA-PEG-GAL,其中半乳糖作為配體可以靶向高表達去唾液酸糖蛋白受體的HCC細胞。在這些細胞中,PHEA-DETA-PEG-GAL/siE2F1聚合物可誘導轉錄因子E2F1和其調控基因的表達水平降低,從而抑制細胞增殖。另一項研究[18]合成了一種聚[N-(丙-2-烯酰基)-β-D-乙酰半乳糖胺]-b-聚(N-異丙基丙烯酰胺)的二嵌段共聚物,用于負載阿霉素(Doxorubicin,DOX),這種共聚物組成的NP尺寸均勻、包封率高、粒徑可控,并且可在低pH環境中迅速釋放DOX,發揮持久有效的抗腫瘤作用。
多糖是由單糖通過糖苷鍵連接而成的天然聚合物,如殼聚糖、果膠、海藻酸鹽、纖維素、淀粉等,作為輔料在制藥工程和臨床上應用已久,具有無毒、無反應性、良好的生物相容性和易大規模獲得及價格相對較低等優勢,還可以增加藥物的穩定性和生物利用度[19]。Zhan等[20]將四臂PEG苯甲醛和N-羧乙基殼聚糖結合制備了一種可注射水凝膠,可通過pH調控該水凝膠在不同環境下的溶脹和降解,起到藥物緩釋作用;此外,負載DOX的水凝膠對HepG2細胞的生長有很強的抑制作用,體內抗腫瘤模型實驗也表明其在5d內即可顯著抑制HCC生長。
聚合物納米遞送系統是生物技術的前沿和熱點,然而如何提高靶向藥物的包封率、體內穩定性和治療靈敏度等,仍需進一步研究,目前研究者正致力于通過表面修飾改性、優化載體的合成方式等技術來提高藥物靶向性和腫瘤治療效率(表1)。
2.1.2 脂質體
脂質體是具有類脂質雙分子層的微囊泡,主要成分為磷脂和膽固醇,具有生物相容性好、生物可降解和非免疫原性等特點,已廣泛用于遞送小分子藥物和核酸,是一種理想的納米載體[21]。研究者通過對脂質體進行化學修飾,可實現治療劑的靶向遞送,從而提高HCC的治療效率。
Li等[22]制備了一種甘草次酸和花生凝集素雙配體修飾的DOX脂質體靶向遞送系統,用于增強肝腫瘤的靶向性和療效。實驗發現甘草次酸可與HCC細胞膜表面高表達的甘草次酸受體結合,同時HCC細胞膜中的MUC1黏蛋白可以特異性結合花生凝集素,進一步提高了人肝癌SMMC-7721細胞對載體的攝取和積蓄,使該系統能更好地靶向HCC,減少DOX對正常細胞的損傷。靶向配體的穩定性和靶向能力是影響癌癥治療效率中的重要因素,LT7是一種對腫瘤細胞過度表達的轉鐵蛋白受體,且也是具有高親和力的多肽。為了提高LT7的穩定性和靶向性,Tang等[23]設計了一種LT7的逆轉錄類似物(DT7),作為脂質體NP的HCC靶向配體,這種負載多西他賽的脂質體NP,在體內外實驗中表現出更強的穩定性和靶向性,同時其抗腫瘤作用也更明顯。
非編碼RNA在腫瘤的發生發展中具有重要作用,miRNA可以調控HCC生長[24]。研究者利用脂質體將DOX和miR-101共遞送至HCC細胞,一方面增強了HCC靶向治療的敏感性和抗腫瘤活性,另一方面可以通過靶向相關基因調節HCC的增殖、凋亡、遷移/侵襲、耐藥和干性等生物學行為;該研究結果顯示這種聯合治療在體內外均可產生顯著的協同抗腫瘤效應,提高了多重耐藥HCC的療效[25]。為了減少化療藥物的毒性,Zhou等[26]合成了一種3-半乳糖苷酶-3-O-硬脂酰脫氧甘草次酸配體,并用其修飾的脂質體包裹斑蝥素,這種新型靶向載體對HepG2細胞具有更強的細胞毒性和遷移抑制作用。
脂質體作為藥物遞送載體具有諸多優勢,但仍存在包封率低、儲存穩定性差、釋放控制不良等問題,研究者可通過表面修飾,改善穩定性差、藥物緩釋不可控等缺點后,開發出真正有效的HCC靶向載體[27](表1)。
2.1.3 其他有機納米遞送系統
Varshney等[28]使用二肽(精氨酸、α,β-脫氫苯丙氨酸)自組裝NP遞送系統,并通過裝配靶向分子乳糖酸,實現抑癌基因miR-199a-3p的有效遞送,使其在Huh7細胞內的水平顯著增加,進而抑制了細胞增殖和遷移,并在體外誘導了細胞凋亡和靶基因雷帕霉素靶蛋白的下調,同時在HCC荷瘤裸鼠中也表現出顯著的抗腫瘤效果。較大的生物分子(如牛血清白蛋白)也已被用來設計納米遞送系統,并成功地遞送姜黃素、DOX和紫杉醇等藥物[29]。這些系統的優點是使用常見的蛋白質可以增加該系統在體內的循環時間。此外,Ishiguro等[30]使用了更大的生物結構,從牛奶中分離出100~200 nm的囊泡,并成功用其遞送siRNA來治療HCC。
2.2 無機納米遞送系統
無機納米遞送系統的制備主要包括金屬材料及其氧化物、介孔二氧化硅、磁性NP、氧化石墨烯、黑磷等。無機NP不僅尺寸、形態可控性好,比表面積大,而且其光、電、磁等特性有利于實現藥物靶向輸送、光熱協同治療、體內成像等功能,在腫瘤靶向給藥、藥物緩釋、協同治療等顯示出廣闊的應用前景。
2.2.1 金屬及其氧化物
金NP具有小尺寸和典型的陰離子電荷,是研究最多的NP之一[31]。金NP不僅可以作為將藥物/基因遞送到靶向部位的載體,而且由于其表面等離子體效應,也可以作為光熱劑或放療增敏劑[32-33]。
Cai等[34]構建了一種抗miR-221的金NP,用于評價抗miR-221金NP與索拉非尼對肝癌細胞的協同作用。結果表明金NP可通過抑制miR-221/p27/DNMT1信號通路發揮抗腫瘤作用,而且抗miR-221金NP對索拉非尼具有化療增敏作用,因此金NP可能成為HCC治療的新選擇。此外,銀NP也被用于HCC治療研究,Benyettou等[35]將DOX負載于阿侖膦酸鈉包被的銀NP,發現DOX負載于阿侖膦酸鈉包被的銀NP后,在體外的抗腫瘤活性明顯高于單獨使用DOX。這種銀NP還可以容納其他靶向藥物,構成一個通用的納米遞送系統,可明顯提高治療HCC的靶向藥物療效。
金屬氧化物NP不僅廣泛應用于傳感和催化等領域,在生物醫學領域也展現出獨特且廣泛的應用潛力。金屬氧化物NP既能充當治療劑直接參與疾病治療,又能作為MRI造影劑,從而促進診斷的準確性和治療的有效性。作為治療劑,金屬氧化物NP可以通過多種機制發揮作用,如某些金屬氧化物NP能夠通過負載藥物并可控釋放,實現對病灶區域的靶向治療,減少對健康組織的損害。此外,金屬氧化物NP還能作為光熱療法或光動力療法的媒介,吸收特定波長的光能后產生熱效應或活性氧,殺死腫瘤細胞,如二氧化鈦在光照下可以產生自由基,具有殺菌和抗癌作用。在MRI應用上,超順磁性氧化鐵NP由于其優異的磁學性質,能夠在外部磁場的作用下改變周圍的水分子運動,從而影響MRI信號強度,實現對特定組織或病灶的高對比度成像,對于早期診斷、疾病監測及治療效果評估具有重要意義[36]。Tang等[37]通過電噴霧技術,制備了DOX-超順磁性氧化鐵-硫酸軟骨素/殼聚糖微粒作為HCC治療的藥物遞送系統,結果表明其不僅對HCC細胞具有明顯的毒性作用,而且還能實現藥物緩釋。
2.2.2 其他無機納米遞送系統
介孔二氧化硅NP不僅生物相容性好、易于合成,而且還具有高比表面積和大孔率,對小分子藥物、蛋白質和基因等有較高的負載量[38]。Ji等[39]將聚多巴胺和兩性離子聚合物附載于介孔二氧化硅NP表面組成納米遞送系統,研究表明該納米遞送系統具有較高的載藥量和良好的膠體穩定性,經由人肝癌HepG2細胞特異性攝取后,能夠在低pH環境中實現藥物緩釋,顯示出優異的HCC治療能力。此外,氧化石墨烯、黑磷納米片、硒等具有優異光熱轉換性能的無機納米材料可以實現多模式協同治療,進一步提高HCC治療效率,如Yin等[40]制備的具有靶向性的多功能氧化石墨烯納米片,在近紅外光照射下可實現基因光熱協同治療,增強腫瘤療效。
無機NP作為藥物/基因遞送載體在腫瘤靶向治療中的作用已在很多研究中證實。通過控制粒子的尺寸和形態,能有效搭載各種治療藥物和抑癌基因;而在附載多種功能化合物后,還可實現藥物控釋,提高藥物利用率,實現診療一體化和多模式聯合治療,提高HCC的診斷和治療效率(表1)。
2.3 外泌體遞送系統
外泌體是一類具有脂質雙分子層,直徑為30~100 nm的細胞外囊泡,廣泛分布于人體的各種體液中,可以在特定條件下釋放信號分子,介導細胞通訊,調節細胞修復、生長和分化[41]。外泌體具有雙層膜結構、低免疫原性和腫瘤歸巢能力,成為用于腫瘤治療的天然載體,在藥物/基因遞送系統研究中得到了快速發展[42]。
Liang等[43]利用骨髓間充質干細胞來源的外泌體包裹抗腫瘤藥物去甲斑蝥素組成納米遞送系統,結果顯示其在小鼠HCC模型中表現出歸巢效應,對腫瘤細胞的靶向和抑制作用明顯,同時該納米遞送系統還可通過增加細胞增殖和抑制細胞氧化應激來修復受損的肝組織。也有研究者利用骨髓間充質干細胞來源的外泌體作為載體,將siGRP78(針對伴侶蛋白GRP78的siRNA)運送到HCC細胞,抑制其體外生長和侵襲[44]。Mahati等[45]設計了一種負載miR-26a的抗GPC 3單鏈抗體修飾的外泌體,可以有效地將miR-26a遞送至GPC 3表達陽性的HCC細胞,通過調節miR-26a下游靶基因的表達來抑制細胞增殖和遷移,在體內顯示出良好的抗腫瘤效果。Li等[46]將透明質酸修飾于負載DOX的外泌體,使其可以選擇性地到達CD44高表達的腫瘤細胞,誘導腫瘤細胞凋亡。
外泌體作為蛋白質和功能性RNA的天然載體,具有許多優異的特性,如穩定性、生物相容性、生物屏障通透性、低毒性和低免疫原性等,這些使其成為腫瘤治療劑遞送的有力載體。然而,如何大規模生產純度高、質量可控的外泌體仍是目前面臨的最大難題,且外泌體的提取、純化、鑒定、儲存等也無統一標準,因此,研究者需要進一步開發和改進基于外泌體的納米遞送系統,制定一套科學、全面且實用的外泌體提取、純化、鑒定和儲存的標準流程,以實現其臨床轉化和大規模應用(表1)。
3 基于納米遞送系統的HCC靶向治療機制
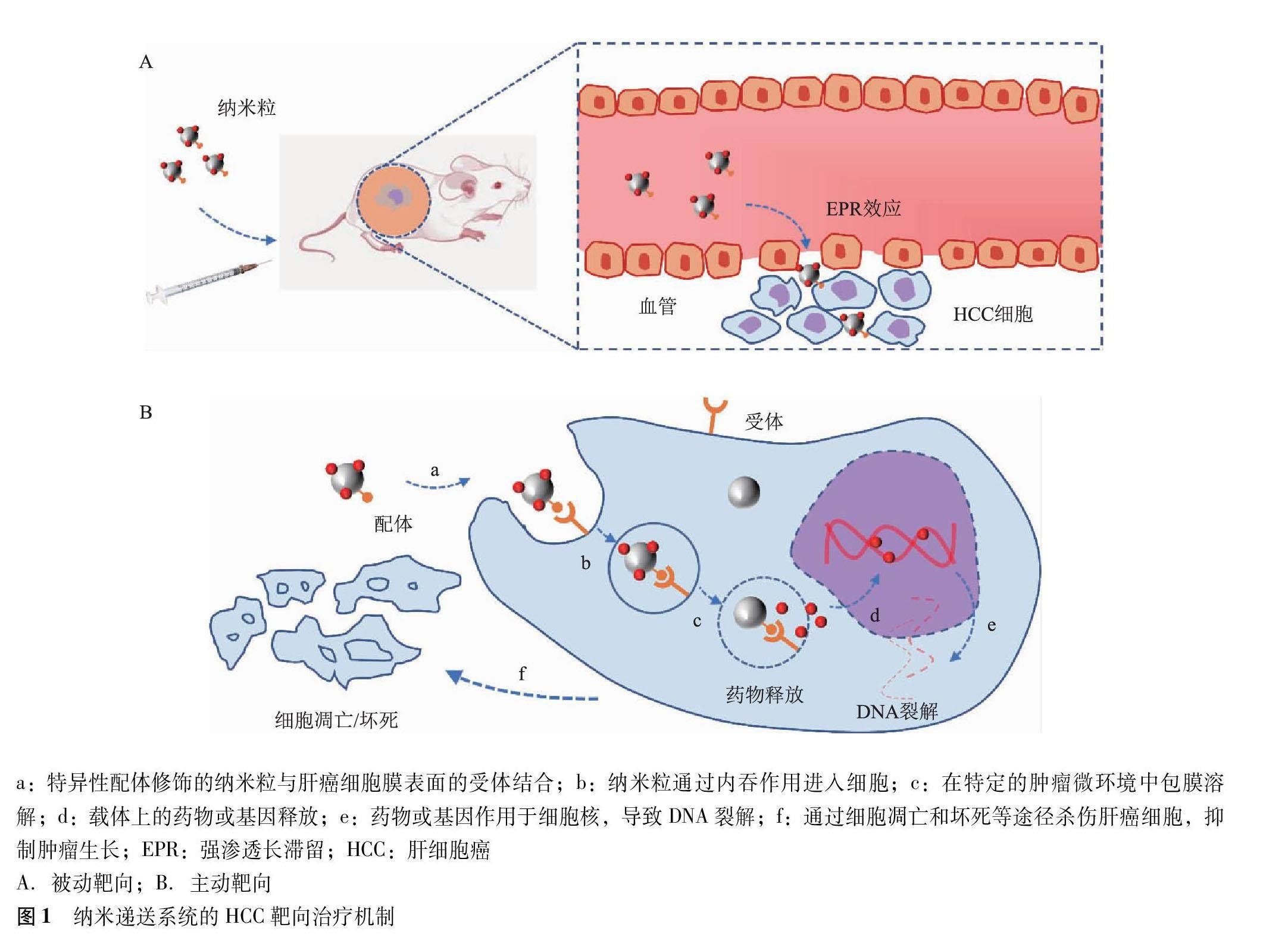
納米遞送系統的靶向方式主要包括被動靶向和主動靶向。被動靶向是一種基于腫瘤內血管滲透的藥物聚集方式,影響其效率的因素主要有NP粒徑、形態、表面電荷及疏水性等[47]。其主要機制為高通透性和滯留效應,即由于腫瘤組織血管內皮間隙較正常組織寬,NP更容易通過滲透在腫瘤部位聚集[48-50]。
主動靶向是納米載體進入細胞的主要方式,主要機制是將配體與納米載體結合,利用其對細胞的親和作用,通過優先識別或與腫瘤微環境中過度表達或特異性表達的受體結合來實現靶向作用[51]。NP進入機體后,首先通過被動靶向的高通透性和滯留效應在HCC細胞外基質中積聚,再由粒子表面的標志物或配體與靶細胞上的特異性受體結合,刺激細胞膜上的蛋白構象發生變化,隨后納米載體通過內吞作用進入腫瘤細胞,并在特定的腫瘤微環境下釋放藥物或基因,殺滅腫瘤細胞[52](圖1)。這種特異性配體-受體介導的細胞內遞送可以突破機體生物膜屏障,提高NP的輸送效率[53]。
HCC細胞表達諸多特異性受體,如去唾液酸糖蛋白受體、GPC 3、葉酸受體等,這些高表達的特異性受體提供了新的靶向結合位點,因此構建具有特異性配體的藥物/基因載體成為開發靶向HCC的新型納米遞送系統的關鍵[54-55]。Pranatharthiharan等[56]制備了一種普魯蘭多糖與DOX負載復合NP遞送系統,可與HepG2細胞上去唾液酸糖蛋白受體特異性結合,普魯蘭多糖通過影響腫瘤細胞外基質中膠原蛋白的數量和結構,改善NP對腫瘤細胞的滲透性,同時通過內質網應激介導細胞凋亡,抑制腫瘤生長,實驗證明該系統在小鼠HCC模型中顯示出良好的減瘤效果。Feng等[57]將一種GPC 3特異性結合肽和索拉非尼負載于納米載體,結果表明該載體可以改善索拉非尼的水溶性,增加載藥量,延長血漿半衰期,實現緩釋,具有良好的細胞攝取和抑制腫瘤生長的作用。此外,還有研究利用葉酸修飾的聚氧乙烯聚氧丙烯醚三嵌段共聚物(F127,美國食品藥品管理局已批準的一種用于制藥的非離子型表面活性劑)負載疏水性的抗腫瘤藥物水飛薊賓,制備了一種靶向納米膠束,結果表明該膠束可與HCC細胞上的葉酸受體特異性結合,顯著提高了水飛薊賓的治療效果[58]。
4 結語
基于NP的納米遞送系統一方面可以攜帶多種藥物、基因及細胞活性因子,靶向遞送至腫瘤部位,發揮抗腫瘤作用;另一方面還可作為顯像劑、光熱劑及放療劑,通過光熱聯合治療,提高腫瘤治療效果。大部分與納米遞送系統相關的研究仍處于實驗階段,臨床應用依然面臨諸多問題:(1)納米載體的理化性質、穩定性、生物相容性、可降解性等特性需要進一步優化;(2)還需深入探索腫瘤微環境下HCC與NP之間的相互作用機制,以尋找新的特異性治療靶點和更敏感的腫瘤響應方式。因此,設計出一種生物相容性好、穩定性高、毒性低的納米載藥體系,準確地將治療藥物/基因高效釋放到HCC細胞,仍是未來HCC治療研究的主要方向,此外研究者還需要進一步探究納米遞送系統進入體內后的有效性和安全性,才能更好地促進其臨床轉化。
利益沖突 所有作者聲明無利益沖突
作者貢獻聲明 所有作者都參與文章選題、設計;楊森林:文獻搜集、篩選工作;楊森林、楊毅軍:起草論文,按編輯部的修改意見進行核修,對學術問題進行解答;楊森林、向楊:論文修訂、終審和定稿,并同意對研究工作誠信負責
參 考 文 獻
[1]Sung H,Ferlay J,Siegel RL,et al.Global cancer statistics 2020:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J].CA Cancer J Clin,202 71(3):209-249.DOI:10.3322/caac.21660.
[2]Parikh S,Hyman D.Hepatocellular cancer:a guide for the internist[J].Am J Med,2007,120(3):194-202.DOI:10.1016/j.amjmed.2006.11.020.
[3]Bertrand N,Wu J,Xu X,et al.Cancer nanotechnology:the impact of passive and active targeting in the era of modern cancer biology[J].Adv Drug Deliv Rev,2014,66:2-25.DOI:10.1016/j.addr.2013.11.009.
[4]Huang W,Chen L,Kang L,et al.Nanomedicine-based combination anticancer therapy between nucleic acids and small-molecular drugs[J].Adv Drug Deliv Rev,2017,115:82-97.DOI:10.1016/j.addr.2017.06.004.
[5]Hu JJ,Cheng YJ,Zhang XZ.Recent advances in nanomaterials for enhanced photothermal therapy of tumors[J].Nanoscale,2018,10(48):22657-22672.DOI:10.1039/c8nr07627h.
[6]Auffan M,Rose J,Bottero JY,et al.Towards a definition of inorganic nanoparticles from an environmental,health and safety perspective[J].Nat Nanotechnol,2009,4(10):634-641.DOI:10.1038/nnano.2009.242.
[7]Thakor AS,Gambhir SS.Nanooncology:the future of cancer diagnosis and therapy[J].CA Cancer J Clin,2013,63(6):395-418.DOI:10.3322/caac.21199.
[8]Zhang JM,Li JJ,Shi Z,et al.pH-sensitive polymeric nanoparticles for co-delivery of doxorubicin and curcumin to treat cancer via enhanced pro-apoptotic and anti-angiogenic activities[J].Acta Biomater,2017,58:349-364.DOI:10.1016/j.actbio.2017.04.029.
[9]Hu QD,Wang K,Sun X,et al.A redox-sensitive,oligopeptide-guided,self-assembling,and efficiency-enhanced (ROSE) system for functional delivery of microRNA therapeutics for treatment of hepatocellular carcinoma[J].Biomaterials,2016,104:192-200.DOI:10.1016/j.biomaterials.2016.07.016.
[10]Chen XY,Zhang Q,Li JL,et al.Rattle-structured rough nanocapsules with in-situ-formed gold nanorod cores for complementary gene/chemo/photothermal therapy[J].ACS nano,2018,12(6):5646-5656.DOI:10.1021/acsnano.8b01440.
[11]Yang XM,Xiao JM,Jiang LY,et al.A multifunctional vanadium-iron-oxide nanoparticle eradicates hepatocellular carcinoma via targeting tumor and endothelial cells[J].ACS Appl Mater Interfaces,2022,14(25):28514-28526.DOI:10.1021/acsami.2c03474.
[12]Li JC,Wang SQ,Fontana F,et al.Nanoparticles-based phototherapy systems for cancer treatment:current status and clinical potential[J].Bioact Mater,2023,23:471-507.DOI:10.1016/j.bioactmat.2022.11.013.
[13]Karlsson J,Vaughan HJ,Green JJ.Biodegradable polymeric nanoparticles for therapeutic cancer treatments[J].Annu Rev Chem Biomol Eng,2018,9:105-127.DOI:10.1146/annurev-chembioeng-060817-084055.
[14]Suk JS,Xu QG,Kim N,et al.PEGylation as a strategy for improving nanoparticle-based drug and gene delivery[J].Adv Drug Deliv Rev,2016,99(Pt A):28-51.DOI:10.1016/j.addr.2015.09.012.
[15]Tang X,Chen L,Li A,et al.Anti-GPC3 antibody-modified sorafenib-loaded nanoparticles significantly inhibited HepG2 hepatocellular carcinoma[J].Drug Deliv,2018,25(1):1484-1494.DOI:10.1080/10717544.2018.1477859.
[16]Dong H,Wu GY,Xu H,et al.N-acetylaminogalactosyl-decorated biodegradable PLGA-TPGS copolymer nanoparticles containing emodin for the active targeting therapy of liver cancer[J].Artif Cells Nanomed Biotechnol,2018,46(sup2):260-272.DOI:10.1080/21691401.2018.1455055.
[17]Cavallaro G,Farra R,Craparo EF,et al.Galactosylated polyaspartamide copolymers for siRNA targeted delivery to hepatocellular carcinoma cells[J].Int J Pharm,2017,525(2):397-406.DOI:10.1016/j.ijpharm.2017.01.034.
[18]Li JH,Zhang Y,Cai C,et al.Collaborative assembly of doxorubicin and galactosyl diblock glycopolymers for targeted drug delivery of hepatocellular carcinoma[J].Biomater Sci,2020,8(1):189-200.DOI:10.1039/c9bm01604j.
[19]Swierczewska M,Han HS,Kim K,et al.Polysaccharide-based nanoparticles for theranostic nanomedicine[J].Adv Drug Deliv Rev,2016,99(Pt A):70-84.DOI:10.1016/j.addr.2015.11.015.
[20]Zhan JH,Wu YJ,Wang HH,et al.An injectable hydrogel with pH-sensitive and self-healing properties based on 4armPEGDA and N-carboxyethyl chitosan for local treatment of hepatocellular carcinoma[J].Int J Biol Macromol,2020,163:1208-1222.DOI:10.1016/j.ijbiomac.2020.07.008.
[21]Bozzuto G,Molinari A.Liposomes as nanomedical devices[J].Int J Nanomedicine,2015,10:975-999.DOI:10.2147/IJN.S68861.
[22]Li XC,Diao WB,Xue HT,et al.Improved efficacy of doxorubicin delivery by a novel dual-ligand-modified liposome in hepatocellular carcinoma[J].Cancer Lett,2020,489:163-173.DOI:10.1016/j.canlet.2020.06.017.
[23]Tang JJ,Wang QT,Yu QW,et al.A stabilized retro-inverso peptide ligand of transferrin receptor for enhanced liposome-based hepatocellular carcinoma-targeted drug delivery[J].Acta Biomater,2019,83:379-389.DOI:10.1016/j.actbio.2018.11.002.
[24]Lim J,Wong SYS,Huang FY,et al.Roles and regulation of long noncoding RNAs in hepatocellular carcinoma[J].Cancer Res,2019,79(20):5131-5139.DOI:10.1158/0008-5472.CAN-19-0255.
[25]Xiao L,Hou Y,He HM,et al.A novel targeted delivery system for drug-resistant hepatocellular carcinoma therapy[J].Nanoscale,2020,12(32):17029-17044.DOI:10.1039/d0nr01908a.
[26]Zhou LL,Zou MS,Zhu K,et al.Development of 11-DGA-3-O-Gal-modified cantharidin liposomes for treatment of hepatocellular carcinoma[J].Molecules,2019,24(17):3080.DOI:10.3390/molecules24173080.
[27]Ashrafizadeh M,Delfi M,Zarrabi A,et al.Stimuli-responsive liposomal nanoformulations in cancer therapy:pre-clinical & clinical approaches[J].J Control Release,2022,351:50-80.DOI:10.1016/j.jconrel.2022.08.001.
[28]Varshney A,Panda JJ,Singh AK,et al.Targeted delivery of microRNA-199a-3p using self-assembled dipeptide nanoparticles efficiently reduces hepatocellular carcinoma in mice[J].Hepatology,2018,67(4):1392-1407.DOI:10.1002/hep.29643.
[29]Huang YK,Hu L,Huang S,et al.Curcumin-loaded galactosylated BSA nanoparticles as targeted drug delivery carriers inhibit hepatocellular carcinoma cell proliferation and migration[J].Int J Nanomedicine,2018,13:8309-8323.DOI:10.2147/IJN.S184379.
[30]Ishiguro K,Yan IK,Lewis-Tuffin L,et al.Targeting liver cancer stem cells using engineered biological nanoparticles for the treatment of hepatocellular cancer[J].Hepatol Commun,2020,4(2):298-313.DOI:10.1002/hep4.1462.
[31]Elahi N,Kamali M,Baghersad MH.Recent biomedical applications of gold nanoparticles:a review[J].Talanta,2018,184:537-556.DOI:10.1016/j.talanta.2018.02.088.
[32]Norouzi H,Khoshgard K,Akbarzadeh F.In vitro outlook of gold nanoparticles in photo-thermal therapy:a literature review[J].Lasers Med Sci,2018,33(4):917-926.DOI:10.1007/s10103-018-2467-z.
[33]Haume K,Rosa S,Grellet S,et al.Gold nanoparticles for cancer radiotherapy:a review[J].Cancer Nanotechnol,2016,7(1):8.DOI:10.1186/s12645-016-0021-x.
[34]Cai HQ,Yang Y,Peng FH,et al.Gold nanoparticles-loaded anti-miR221 enhances antitumor effect of sorafenib in hepatocellular carcinoma cells[J].Int J Med Sci,2019,16(12):1541-1548.DOI:10.7150/ijms.37427.
[35]Benyettou F,Rezgui R,Ravaux F,et al.Synthesis of silver nanoparticles for the dual delivery of doxorubicin and alendronate to cancer cells[J].J Mater Chem B,2015,3(36):7237-7245.DOI:10.1039/c5tb00994d.
[36]Zhao SZ,Yu XJ,Qian YN,et al.Multifunctional magnetic iron oxide nanoparticles:an advanced platform for cancer theranostics[J].Theranostics,2020,10(14):6278-6309.DOI:10.7150/thno.42564.
[37]Tang SL,Bai MY,Wang JY,et al.Development and application of micro-polysaccharide drug carriers incorporating doxorubicin and superparamagnetic iron oxide for bimodality treatment of hepatocellular carcinoma[J].Colloids Surf B Biointerfaces,2017,151:304-313.DOI:10.1016/j.colsurfb.2016.12.036.
[38]Noureddine A,Maestas-Olguin A,Tang L,et al.Future of mesoporous silica nanoparticles in nanomedicine:protocol for reproducible synthesis,characterization,lipid coating,and loading of therapeutics (chemotherapeutic,proteins,siRNA and mRNA)[J].ACS Nano,2023,17(17):16308-16325.DOI:10.1021/acsnano.3c07621.
[39]Ji F,Sun H,Qin ZH,et al.Engineering polyzwitterion and polydopamine decorated doxorubicin-loaded mesoporous silica nanoparticles as a pH-sensitive drug delivery[J].Polymers (Basel),2018,10(3):326.DOI:10.3390/polym10030326.
[40]Yin F,Hu K,Chen YZ,et al.SiRNA delivery with PEGylated graphene oxide nanosheets for combined photothermal and genetherapy for pancreatic cancer[J].Theranostics,2017,7(5):1133-1148.DOI:10.7150/thno.17841.
[41]Barile L,Vassalli G.Exosomes:therapy delivery tools and biomarkers of diseases[J].Pharmacol Ther,2017,174:63-78.DOI:10.1016/j.pharmthera.2017.02.020.
[42]Chinnappan M,Srivastava A,Amreddy N,et al.Exosomes as drug delivery vehicle and contributor of resistance to anticancer drugs[J].Cancer Lett,2020,486:18-28.DOI:10.1016/j.canlet.2020.05.004.
[43]Liang LY,Zhao L,Wang Y,et al.Treatment for hepatocellular carcinoma is enhanced when norcantharidin is encapsulated in exosomes derived from bone marrow mesenchymal stem cells[J].Mol Pharm,202 18(3):1003-1013.DOI:10.1021/acs.molpharmaceut.0c00976.
[44]Li HD,Yang C,Shi YJ,et al.Exosomes derived from siRNA against GRP78 modified bone-marrow-derived mesenchymal stem cells suppress sorafenib resistance in hepatocellular carcinoma[J].J Nanobiotechnology,2018,16(1):103-115.DOI:10.1186/s12951-018-0429-z.
[45]Mahati S,Fu XJ,Ma XX,et al.Delivery of miR-26a using an exosomes-based nanosystem inhibited proliferation of hepatocellular carcinoma[J].Front Mol Biosci,202 8:738219.DOI:10.3389/fmolb.2021.738219.
[46]Li D,Yao SR,Zhou ZF,et al.Hyaluronan decoration of milk exosomes directs tumor-specific delivery of doxorubicin[J].Carbohydr Res,2020,493:108032.DOI:10.1016/j.carres.2020.108032.
[47]Perry JL,Reuter KG,Luft JC,et al.Mediating passive tumor accumulation through particle size,tumor type,and location[J].Nano Lett,2017,17(5):2879-2886.DOI:10.1021/acs.nanolett.7b00021.
[48]Maeda H,Wu J,Sawa T,et al.Tumor vascular permeability and the EPR effect in macromolecular therapeutics:a review[J].J Control Release,2000,65(1-2):271-284.DOI:10.1016/s0168-3659(99)00248-5.
[49]Acharya S,Sahoo SK.PLGA nanoparticles containing various anticancer agents and tumour delivery by EPR effect[J].Adv Drug Deliv Rev,201 63(3):170-183.DOI:10.1016/j.addr.2010.10.008.
[50]Carmeliet P,Jain RK.Principles and mechanisms of vessel normalization for cancer and other angiogenic diseases[J].Nat Rev Drug Discov,201 10(6):417-427.DOI:10.1038/nrd3455.
[51]Gabizon AA,de Rosales RTM,La-Beck NM.Translational considerations in nanomedicine:the oncology perspective[J].Adv Drug Deliv Rev,2020,158:140-157.DOI:10.1016/j.addr.2020.05.012.
[52]Zhong YN,Meng FH,Deng C,et al.Ligand-directed active tumor-targeting polymeric nanoparticles for cancer chemotherapy[J].Biomacromolecules,2014,15(6):1955-1969.DOI:10.1021/bm5003009.
[53]Li M,Zhang WY,Wang BR,et al.Ligand-based targeted therapy:a novel strategy for hepatocellular carcinoma[J].Int J Nanomedicine,2016,11:5645-5669.DOI:10.2147/IJN.S115727.
[54]Elnaggar MH,Abushouk AI,Hassan AHE,et al.Nanomedicine as a putative approach for active targeting of hepatocellular carcinoma[J].Semin Cancer Biol,202 69:91-99.DOI:10.1016/j.semcancer.2019.08.016.
[55]Bakrania A,Zheng G,Bhat M.Nanomedicine in hepatocellular carcinoma:a new frontier in targeted cancer treatment[J].Pharmaceutics,202 14(1):41.DOI:10.3390/pharmaceutics14010041.
[56]Pranatharthiharan S,Patel MD,Malshe VC,et al.Asialoglycoprotein receptor targeted delivery of doxorubicin nanoparticles for hepatocellular carcinoma[J].Drug Deliv,2017,24(1):20-29.DOI:10.1080/10717544.2016.1225856.
[57]Feng S,Zhou J,Li Z,et al.Sorafenib encapsulated in nanocarrier functionalized with glypican-3 specific peptide for targeted therapy of hepatocellular carcinoma[J].Colloids Surf B Biointerfaces,2019,184:110498.DOI:10.1016/j.colsurfb.2019.110498.
[58]Vahab G,Meysam S,Alireza F,et al.Folate-targeted nanomicelles containing silibinin as an active drug delivery system for liver cancer therapy[J].J Drug Deliv Sci Technol,202 61:102157.DOI:10.1016/j.jddst.2020.102157.
(收稿日期:2023-05-09)

