不同濃度下二元弱酸酸式鹽中微粒濃度的大小比較




摘要: 在二元弱酸的酸式鹽溶液中,存在多個可逆過程。通常狀況下,平衡常數大的反應主宰了體系的主要性質,因為HA-質子自遞反應平衡常數最大,所以可以主宰整個體系的性質,但隨著鹽溶液濃度的降低,HA-離子濃度的迅速降低,HA-質子自遞反應對體系的影響會逐漸降到HA-的水解或電離、甚至是水的電離相同的程度或之下,從而造成了在各個階段,二元弱酸的酸式鹽溶液中微粒濃度的大小排序的不同。通過對各可逆過程平衡常數的分析,結合守恒關系,定量分析出各階段分界線的標志性濃度。
關鍵詞: 二元弱酸酸式鹽溶液; HA-質子自遞反應; 多平衡競爭; 溶液濃度; 微粒濃度大小
文章編號: 1005-6629(2024)06-0093-05 中圖分類號: G633.8 文獻標識碼: B
關于二元弱酸的酸式鹽中,各微粒的濃度大小比較問題,已有不少著作加以論述,均提到不能忽略HA-的質子自遞反應;HCO-3+HCO-3
H2CO3+CO2-3 K=Ka2/Ka1=1.04×10-4。否則,會對酸式鹽中各微粒的濃度大小產生誤判[1]。
但在這些文章中,并沒有對酸式鹽溶液中存在的平衡過程以及平衡常數進行系統分析,沒有確定在稀釋過程中各平衡過程對體系的貢獻程度會出現怎樣的改變,以及為什么會出現這樣的改變。
本文以碳酸氫鈉與亞硫酸氫鈉為代表,全面分析二元弱酸酸式鹽溶液中存在的各種平衡過程和這些過程的平衡常數,分析各平衡過程在不同濃度范圍內對體系造成的不同影響,進而對各微粒濃度的大小以及大小排序的變化情況進行科學的分析,得出有科學依據的答案。
1 碳酸氫鈉溶液中各離子濃度大小的探究
1.1 碳酸氫鈉溶液中存在的平衡過程以及對體系的影響
我們發現,在四個可逆過程中,正向進行程度最大的是碳酸氫根的質子自遞反應,然后是碳酸氫根的水解過程,第三為碳酸氫根的電離過程,最后是水的電離過程。
眾所周知,平衡常數最大的那個反應的產物就是這個體系中量最大的物質,而碳酸氫根的質子自遞反應,在所有的平衡過程中具有最大的平衡常數,其量級幾乎是排第二位的碳酸氫根水解反應的5000倍。所以,可以肯定地說,在濃度不算太低的情況下,體系中的H2CO3與CO2-3是優勢產物。
碳酸氫鈉溶液在濃度逐漸降低過程中各微粒濃度的大小排序不同恰恰是因為在不同濃度下,碳酸氫根的質子自遞反應在整個反應體系中所占的比重不斷降低,也是在濃度降低過程中,剩余的三個平衡過程對體系的影響程度逐漸趨同所共同造就的結果(見圖1)。
1.2 碳酸氫鈉稀釋過程對溶液中的四大平衡過程會造成不同的影響
在溫度不變的條件下,四個反應的平衡常數不變,那么體系中的總平衡常數也應該不變,由于碳酸氫根初始濃度的不同,導致其余的四種微粒的平衡濃度也會
發生相應的改變,從而保證平衡常數不發生變化。通過對四個反應的平衡常數表達式與平衡常數的大小研究可知,K碳酸氫根質子自遞=c(H2CO3)·c(CO2-3)c2(HCO-3),此平衡常數最大,在公式中,要對碳酸氫根的濃度值取平方,所以,隨著碳酸氫根在溶液中的初始濃度的逐漸降低,此反應的產物在整個體系中的占比將會顯著降低,質子自遞反應對整個體系的貢獻會逐漸降到碳酸氫根的水解反應、電離反應之后。
而碳酸氫根的水解與電離反應,由于一個是與水的反應,一個是單分子反應,碳酸氫根濃度的降低不會造成像其質子自遞反應那么嚴重的影響,但隨著其濃度的降低,兩者對整個體系的貢獻程度會逐漸接近,甚至有趨同的可能性。當然,此時的碳酸氫根濃度也將降低到可忽略不計的地步,失去了討論的實際意義。
1.3 碳酸氫鈉稀釋過程中的五個階段以及各階段的分界線
從平衡常數可以看出,碳酸氫根的質子自遞反應的平衡常數最大,對于整個體系的各物質濃度起到決定性的作用,由此反應產生的H2CO3與CO2-3占據絕對的優勢地位,結合碳酸氫根的水解大于電離的情況,才會出現以下排序:c(HCO-3)>c(H2CO3)>c(CO2-3)>c(OH-)>c(H+)。
但隨著碳酸氫根濃度的逐漸降低,碳酸氫根質子自遞反應的產物會越來越少。因為水的濃度基本不變,所以碳酸氫根水解的產物占據的比重會越來越高,在這個轉化過程中,存在一個兩個平衡對體系的影響各占約50%的點,標志是c(CO2-3)=c(OH-)。我們為什么說“約”呢?因為,碳酸氫根的電離產生的CO2-3應該大于水電離時產生的OH-,但由于兩電離的平衡常數太小,此階段,可以忽略這兩個電離過程的影響。故此時,溶液中各微粒的濃度排序為:c(HCO-3)>c(H2CO3)>c(OH-)=c(CO2-3)>c(H+)。
但碳酸氫鈉的水解過程占據主導地位后(依然忽略碳酸氫根與水的電離),c(OH-)>c(CO2-3),此時碳酸氫根的質子自遞過程與水解過程都產生碳酸,所以碳酸濃度依然大于氫氧根,溶液中各微粒的濃度排序為:c(HCO-3)>c(H2CO3)>c(OH-)>c(CO2-3)>c(H+)。
因為碳酸氫根的電離平衡常數大于水的電離平衡常數,所以,碳酸氫根的質子自遞反應對整個系統的影響會先降到與碳酸氫根電離相同的程度,也就是說,碳酸氫根的電離與碳酸氫根的質子自遞各貢獻了50%的CO2-3。碳酸氫根的水解,因平衡常數大,居于主導地位,此過程的產物也占優勢。此時,溶液中各微粒的濃度排序依然為:c(HCO-3)>c(H2CO3)>c(OH-)>c(CO2-3)>c(H+)。
當進一步降低碳酸氫鈉溶液的濃度后,碳酸氫根的水解與電離逐漸居于主導地位,此時,碳酸氫根的質子自遞反應對整個系統的影響逐漸降低到與水的電離過程相同的程度。由水電離產生的H+與碳酸氫根質子自遞反應產生的CO2-3濃度相等,此時,溶液中的c(H+)=c(CO2-3),根據質子守恒,可得
當碳酸氫鈉溶液的濃度極稀后,碳酸氫根的水解過程與電離過程對體系的影響會逐漸趨同,由于水解平衡常數大于電離平衡常數,所以水解過程始終大于電離過程;但碳酸氫根的電離結合水的電離,兩個弱過程產生的粒子數目會等于一個強過程產生的粒子數,導致出現c(H2CO3)=c(H+)的情況,此時,溶液中各微粒的濃度排序為:c(HCO-3)>c(OH-)>c(H2CO3)=c(H+)>c(CO2-3)。
若濃度繼續降低,各平衡對體系的影響逐漸趨同,使水電離造成的結果的比重在體系中進一步增大,就會出現碳酸氫根與水的電離共同造成的結果大于碳酸氫根的水解過程造成的結果,那么,此時,溶液中各微粒的濃度排序為:c(HCO-3)>c(OH-)>c(H+)>c(H2CO3)>c(CO2-3)。而在這個排序的最后兩項為H2CO3與CO2-3,這已然說明碳酸氫根對體系的影響弱于水的電離過程。
1.4 碳酸氫鈉溶液稀釋過程中五個階段的四個分界線與三個臨界點的關系
1.5 各臨界點、各階段碳酸氫鈉溶液中各微粒濃度的計算方法
根據NaHA酸式鹽的質子守恒可得出以下公式:
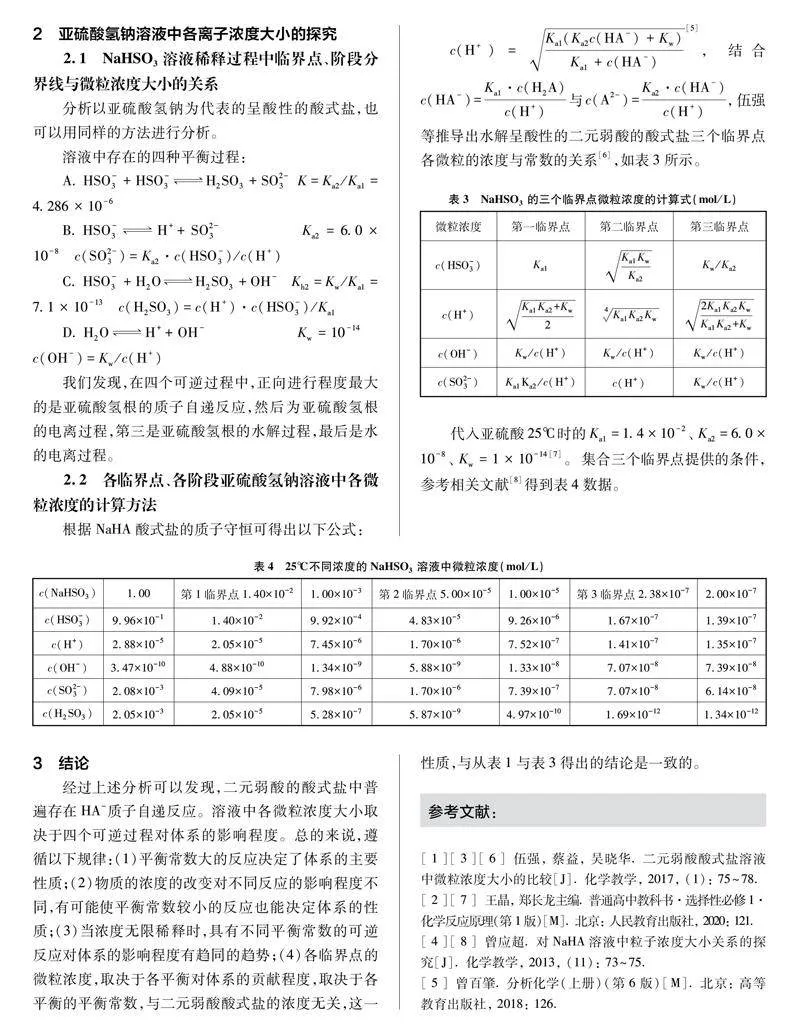
c(H+)=Ka1(Ka2c(HA-)+Kw)Ka1+c(HA-),結合c(HA-)=Ka1·c(H2A)c(H+)與c(A2-)=Ka2·c(HA-)c(H+),參考伍強等根據此三個公式,結合臨界點的條件得出的公式,可以推導出水解呈堿性的二元弱酸的酸式鹽三個臨界點各微粒的濃度與常數的關系[3],如表1所示。
2 亞硫酸氫鈉溶液中各離子濃度大小的探究
2.1 NaHSO3溶液稀釋過程中臨界點、階段分界線與微粒濃度大小的關系
分析以亞硫酸氫鈉為代表的呈酸性的酸式鹽,也可以用同樣的方法進行分析。
我們發現,在四個可逆過程中,正向進行程度最大的是亞硫酸氫根的質子自遞反應,然后為亞硫酸氫根的電離過程,第三是亞硫酸氫根的水解過程,最后是水的電離過程。
2.2 各臨界點、各階段亞硫酸氫鈉溶液中各微粒濃度的計算方法
3 結論
經過上述分析可以發現,二元弱酸的酸式鹽中普遍存在HA-質子自遞反應。溶液中各微粒濃度大小取決于四個可逆過程對體系的影響程度。總的來說,遵循以下規律:(1)平衡常數大的反應決定了體系的主要性質;
(2)物質的濃度的改變對不同反應的影響程度不同,有可能使平衡常數較小的反應也能決定體系的性質;
(3)當濃度無限稀釋時,具有不同平衡常數的可逆反應對體系的影響程度有趨同的趨勢;
(4)各臨界點的微粒濃度,取決于各平衡對體系的貢獻程度,取決于各平衡的平衡常數,與二元弱酸酸式鹽的濃度無關,這一性質,與從表1與表3得出的結論是一致的。
參考文獻:
[1][3][6]伍強, 蔡益, 吳曉華. 二元弱酸酸式鹽溶液中微粒濃度大小的比較[J]. 化學教學, 2017, (1): 75~78.
[2][7]王晶, 鄭長龍主編. 普通高中教科書·選擇性必修1·化學反應原理(第1版)[M]. 北京: 人民教育出版社, 2020: 121.
[4][8]曾應超. 對NaHA溶液中粒子濃度大小關系的探究[J]. 化學教學, 2013, (11): 73~75.
[5]曾百肇. 分析化學(上冊)(第6版)[M]. 北京: 高等教育出版社, 2018: 126.

