促進大概念建構的單元復習課設計與實踐



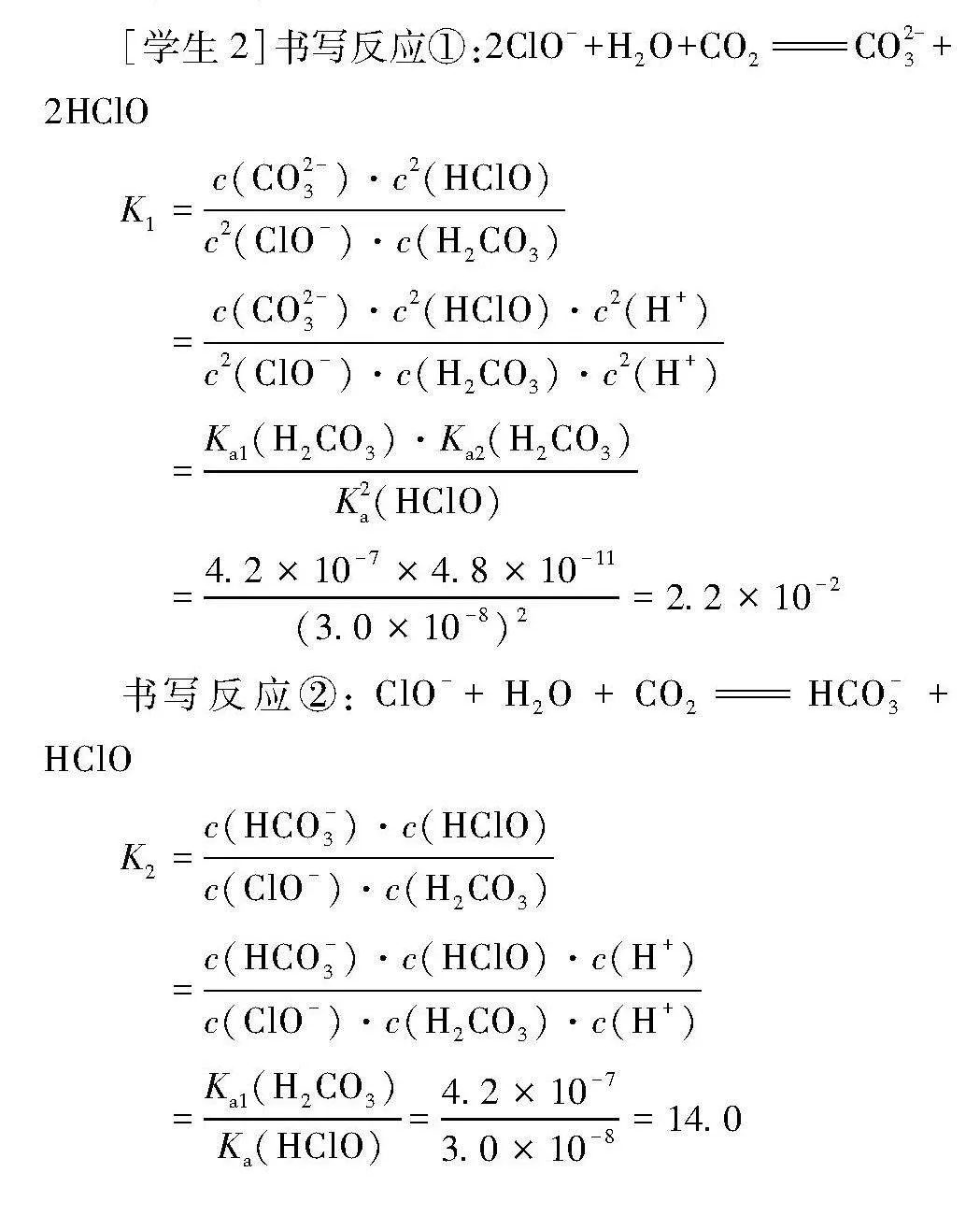






摘 要: 以“水溶液中的離子反應與平衡”為例,在單元教學結尾開設大概念建構課。以“從平衡視角認識離子反應”的大概念為引領,創設“廢水處理中反應原理的探究”的真實問題情境,通過進階式活動設計,讓學生經歷“形成→完善→應用”大概念的完整學習過程,幫助學生建構結構化知識,形成解決水溶液中相關問題的認識視角,發展學科核心素養。
關鍵詞: 大概念; 離子反應; 離子平衡; 單元復習課
文章編號: 10056629(2024)08004208
中圖分類號: G633.8
文獻標識碼: B
華東師范大學“國培計劃”中小學名師領航首期基地班立項課題“化學學科核心素養視域下的中學化學教學設計的理論與實踐”(編號2018GP01M13)的階段性研究成果。
1 問題提出
大概念是指能夠反映學科本質,具有抽象性、概括性、統攝性和廣泛遷移價值的學科思想和觀念[1]。正確把握大概念,能夠幫助學生將多而散的知識整合聯結,形成結構化的學科知識體系;能夠加深對學科本質的認識和理解,提升思維的深度與廣度;能夠形成認識化學問題的一般思路與方法,從而習得可遷移的學科核心素養。
“水溶液中的離子反應與平衡”是高中化學課程的重要內容,是對化學平衡知識的鞏固與拓展,對促進學生“宏觀辨識與微觀探析”“變化觀念與平衡思想”“證據推理與模型認知”等學科核心素養的發展具有重要價值。由于內容多、理論性強,這部分內容也是高中化學學習的難點之一。在該單元測試中,發現有如下兩個問題:
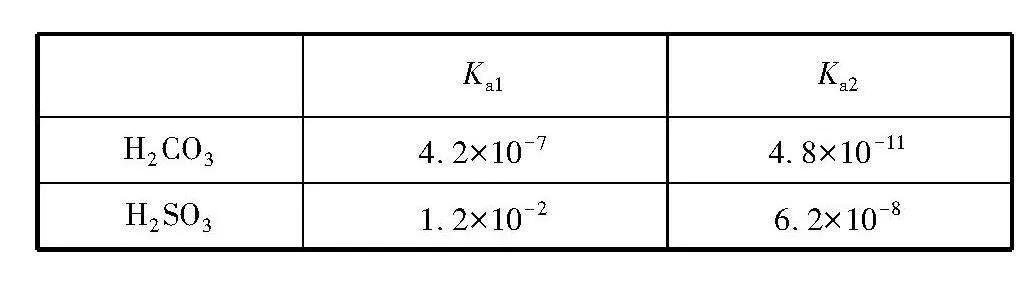
例1 碳酸和亞硫酸的電離平衡常數(25℃)如下表所示:向Na2CO3溶液中加入足量的NaHSO3溶液,寫出發生反應的離子方程式。
例2 碳酸鈣沉淀能溶于鹽酸,運用平衡移動原理解釋其原因。
Ka1Ka2
H2CO34.2×10-74.8×10-11
H2SO31.2×10-26.2×10-8
例1和例2分別考察弱電解質的電離平衡、難溶強電解質的沉淀溶解平衡,屬于“水溶液中的離子反應與平衡”的典型問題。
對上海市某實驗性示范性高中(中考錄取分數線排位全市約15%)136名選考化學的學生進行測試,結果顯示:例1和例2的得分率分別為41.5%和33.3%。例1中大多數學生認為亞硫酸酸性強于碳酸,兩者反應生成二氧化碳;例2中大部分學生雖能寫出離子方程式,卻無法分析和解釋沉淀溶解的原因。通過與學生訪談并結合測試表現,反映出學生學習中存在以下問題:(1)能分析單一弱電解質的平衡,如外界條件變化對平衡的影響,但對于存在多重平衡的復雜體系,仍未掌握分析的學科方法;(2)對離子反應較熟悉,但尚未形成從動態平衡的角度進行分析、表征溶液中復雜反應的學科能力;(3)面對新情境時,尚未形成運用所學原理來解決實際問題的學科素養。上述問題表明:在學完該主題后,大多數學生未能把握水溶液知識的內在本質和相互關聯,尚未形成認識問題的特定視角和思路。
當前的大概念教學實踐一般集中于大概念統攝下的大單元教學設計或高三大單元復習課設計[2,3],尚未有通過專題提升課引導學生建構大概念的實踐研究的報道。本文以滬科版《普通高中教科書·化學·選擇性必修1·化學反應原理》第三章“水溶液中的離子反應與平衡”為例[4],嘗試通過專題提升課引導學生構建主題大概念,形成認識和解決該主題問題的特定思路與方法。
2 設計思路
2.1 分析課標和教材,凝練大概念
《普通高中化學課程標準(2017年版2020年修訂)》[5]規定的水溶液主題內容包含兩部分:必修課程主題2“常見的無機物及其應用”的“電離與離子反應”和選擇性必修課程模塊1“化學反應原理”的主題3“水溶液中的離子反應與平衡”。必修內容要求學生“認識酸、堿、鹽等電解質在水溶液中或熔融狀態下能發生電離。通過實驗事實認識離子反應及其發生條件,了解常見離子的檢驗方法”;選擇性必修課程則要求學生能夠從電離、離子反應和化學平衡角度認識電解質水溶液的組成、性質與反應,能綜合運用離子反應、化學平衡原理分析和解決生產、生活中的實際問題。
在內容編排上,滬科版教材將“電離與離子反應”放在必修第2章“海洋中的鹵素資源”第2節“氧化還原反應和離子反應”[6],其包含三部分內容;“水溶液中的離子反應與平衡”在選擇性必修1的第3章,其包含四節內容,具體如圖1所示。
在完成選擇性必修的學習后,學生應對離子反應的發生條件有更深入的理解:生成“沉淀”為生成“更難溶(Ksp更小)的物質”,即沉淀的生成與轉化;生成“弱電解質”為生成“更難電離(Ki更小)的物質”,也就是通常說的較強酸制較弱酸,較強堿制較弱堿,即電離平衡的移動與轉化。因此,可以凝練出“從平衡視角認識離子反應”的大概念(如圖2所示)。大概念將電離平衡、溶解平衡和水解平衡(水解實質是弱酸根離子或弱堿正離子與水的反應,是水電離平衡的移動)有機統攝起來,幫助學生把握水溶液中平衡的內在關聯,實現知
識的結構化;引導學生從平衡移動與轉化的角度認識離子反應,加深對反應本質的理解,實現認知的結構化,提升解決實際問題的學科素養。
基于此,制定指向大概念建構的教學目標如下:
(1) 把握離子反應的本質和規律,形成基于平衡移動定性分析和平衡常數定量認識離子反應的視角。
(2) 學會分析條件變化對離子反應方向的影響。
(3) 能夠利用“從平衡視角認識離子反應”的大概念來解決生產、生活中與水溶液相關的實際問題。
2.2 創設真實問題情境,承載大概念
促進大概念建構的專題提升課,必須創設能夠承載大概念生成、發展的真實情境[7],學生在完成真實情境的學習任務中,經歷概念理解、思維模型和認識路徑的建構,真正將知識轉化為解決問題的能力。
創設“廢水處理中反應原理的探究”情境,一方面,它源于工業實際,體現離子反應與平衡知識在水處理領域的廣泛應用;另一方面,它包含電離平衡、水解平衡、沉淀溶解平衡等核心知識和可結構化的認識路徑,為大概念的建構提供載體。
該情境統領三個教學環節:①廢水中銅離子的去除;②廢水中細菌的去除;③硫化氫在廢水處理中的應用。分別對應于沉淀溶解平衡、電離平衡的移動與轉化以及多重平衡的相互轉化。情境在不同階段承載不同的教學任務,在大概念建構的關鍵點有邏輯地展開,形成一個完整的學習鏈,推動課堂教學不斷走向深入,使學生對“從平衡視角認識離子反應”的大概念的理解逐漸明晰。
2.3 設計進階式學習任務,建構大概念
學習任務的設計要具有合理的邏輯性和階梯性,既要符合大概念的生成與發展進程,也要考慮學生的認識發展規律和知識本身的難易程度。本節課的教學流程的設計如圖3所示。
在大概念建構方面,按照“形成→完善→應用”大概念的線索設計學習任務,使認識視角顯性化、結構化。通過對銅離子去除機理的探究,初步形成大概念;在細菌去除環節,拓展大概念的應用范圍,打通不同平衡之間的內在聯結路徑,促進對水溶液中離子反應與平衡的整體認知;最后發揮大概念的遷移應用價值,解決陌生情境的問題。
在內容層面,相比電離平衡,溶解平衡對學生來說更易于理解,且知識本身蘊含著重要的學科思想和觀念,具有大概念的抽提價值。在廢水中細菌去除機理的探究中,分析對象較為復雜,包含對碳酸的一級和二級電離平衡的分析,碳酸根離子、碳酸氫根離子和次氯酸根離子結合氫離子能力大小的比較。考慮學生的認知發展,將溶解平衡的轉化作為大概念建構的起點,將電離平衡的轉化作為大概念發展的重要節點,最后通過多重平衡的學習任務,實現建構大概念的閉環。
為拓展學習時空,設計了一項開放性作業,針對不同碳酸鹽的制備方案進行探究,學生需要綜合運用電離平衡、水解平衡和沉淀溶解平衡的知識來解決復雜問題,深刻領悟大概念的實質,發展學科核心素養。
3 教學過程
3.1 環節一:廢水中Cu2+的去除
3.1.1 氫氧化鎂去除銅離子的機理探究
[教師]展示Mg(OH)2處理含銅廢水的文獻[8],表明Mg(OH)2是一種有效的沉淀銅離子的試劑,本身也是一種難溶物,它能去除銅離子嗎?
[學生實驗]向相同體積的CuSO4溶液和蒸餾水中分別加入相同質量的Mg(OH)2固體。
[學生觀察]加入Mg(OH)2固體的CuSO4溶液顏色變淺,白色Mg(OH)2固體減少,轉化為藍色沉淀。
[教師]請寫出反應的離子方程式,并從平衡移動的角度解釋該現象。
[學生]Mg(OH)2固體存在溶解平衡:Mg(OH)2(s)Mg2+(aq)+2OH-(aq), Ksp[Cu(OH)2]更小,Cu2+和OH-結合生成更難溶的Cu(OH)2,使c(OH-)減小,平衡正向移動,轉化為Cu(OH)2。
[教師]這個反應的實質是離子之間的競爭,能看出是哪些離子在競爭嗎?對,是Cu2+和Mg2+在競爭OH-。是否可以從理論上定量證明這個過程的可行性?
[學生]我們在學習化學反應的方向與限度時知道,化學平衡常數可以體現反應進行的限度,可用平衡常數判斷。
[教師]展示平衡常數與反應進行程度的關系:K>105,完全轉化;K<10-5,基本不反應;10-5<K<105,部分轉化。請寫出平衡常數表達式并進行計算。
[學生]Mg(OH)2(s)+Cu2+(aq)Mg2+(aq)+Cu(OH)2(s),
K=c(Mg2+)c(Cu2+)=c(Mg2+)·c2(OH-)c(Cu2+)·c2(OH-)
=Ksp[Mg(OH)2]Ksp[Cu(OH)2]=5.6×10-122.2×10-20=2.5×108
25℃條件下,反應的平衡常數為2.5×108,Mg(OH)2可完全轉化為Cu(OH)2。
[教師]展示銅離子排放的國家標準。經Mg(OH)2處理后的Cu2+是否達到了國家一級排放標準呢?假設廢水中的Cu2+為0.1mol/L,請進行計算[10]。
[學生]反應的K=2.5×108, c(Mg2+)=0.1mol/L,可得c(Cu2+)=3.9×10-10mol/L,達到了排放標準。
[教師]通過對Mg(OH)2沉淀Cu2+的分析,大家對離子反應是否有了新的認識?
[學生1]Mg(OH)2處理含銅廢水,實際上是Mg2+和Cu2+競爭OH-, Ksp[Cu(OH)2]更小,Cu2+更易結合OH-,使Mg(OH)2的溶解平衡正向移動,最終轉化為Cu(OH)2。離子反應的實質是舊平衡被破壞而發生移動,并建立新平衡的過程。
[學生2]Mg(OH)2能轉化為Cu(OH)2,取決于兩者Ksp的相對大小,Cu(OH)2的Ksp遠小于Mg(OH)2,沉淀轉化反應的平衡常數大,可完全反應。因此,可用平衡常數判斷離子反應的發生。
[教師]離子反應是平衡移動和轉化的結果,可用平衡移動原理來定性分析離子反應的過程,而舊平衡是否會被打破,新平衡能否最終建立,由平衡常數(在這里是指Ksp)決定,故可用平衡常數定量判斷反應的程度。
3.1.2 可溶性鋇鹽的制備原理探究
[教師]Ksp較大物質向Ksp較小物質轉化時,反應的平衡常數大,更易發生。一定條件下,朝著Ksp較大方向進行的反應能否發生呢?我國重晶石含量豐富,可溶性鋇鹽的制備方法是將不溶于酸的BaSO4轉化成BaCO3,再加酸溶解。常溫下,Ksp(BaSO4)=1.1×10-10, Ksp(BaCO3)=2.6×10-9,該反應的K=4.23×10-2,反應可逆且進行程度小,如何控制條件實現最大程度的轉化?
[學生]可以通過增大Na2CO3溶液的濃度,比如使用飽和Na2CO3溶液,使平衡不斷正向移動,實現轉化。
[教師]具體該如何操作?
[學生]向BaSO4固體中加入飽和Na2CO3溶液,充分反應后靜置,棄去上層清液后繼續加入飽和Na2CO3溶液,重復多次。
[教師]展示BaSO4向BaCO3轉化的實驗視頻。是否都能通過控制條件實現向Ksp大的物質轉化?
[學生]不是,如果Ksp相差過大,難以得到滿足條件的飽和溶液,不能實現轉化。
[教師]我們不僅可運用平衡移動原理分析離子反應,還可以調控反應的方向。
3.2 環節二:廢水中細菌的去除
[教師]廢水可以用NaClO來殺菌,利用HClO的強氧化性,采取哪些措施可以提高NaClO的殺菌效果?
[學生]加入比HClO酸性更強的酸,將NaClO轉化為HClO。
[教師]已知H2CO3和HClO的電離平衡常數,請從理論上推算在空氣中放置一段時間,是否可以增強NaClO的殺菌效果,若可以,用離子方程式表示其原理。
[學生1]書寫反應2ClO-+H2O+CO2CO2-3+2HClO,無法從理論上論證。
[學生2]書寫反應①:2ClO-+H2O+CO2CO2-3+2HClO
K1=c(CO2-3)·c2(HClO)c2(ClO-)·c(H2CO3)
=c(CO2-3)·c2(HClO)·c2(H+)c2(ClO-)·c(H2CO3)·c2(H+)
=Ka1(H2CO3)·Ka2(H2CO3)K2a(HClO)
=4.2×10-7×4.8×10-11(3.0×10-8)2=2.2×10-2
書寫反應②:ClO-+H2O+CO2HCO-3+HClO
K2=c(HCO-3)·c(HClO)c(ClO-)·c(H2CO3)
=c(HCO-3)·c(HClO)·c(H+)c(ClO-)·c(H2CO3)·c(H+)
=Ka1(H2CO3)Ka(HClO)=4.2×10-73.0×10-8=14.0
由于K1遠小于K2,發生反應②,且反應②有一定的可逆性。
[學生3]書寫反應①:ClO-+H2O+CO2HCO-3+HClO
K1=c(HCO-3)·c(HClO)c(ClO-)·c(H2CO3)
=c(HCO-3)·c(HClO)·c(H+)c(ClO-)·c(H2CO3)·c(H+)
=Ka1(H2CO3)Ka(HClO)=4.2×10-73.0×10-8=14.0
書寫反應②:ClO-+HCO-3CO2-3+HClO
K2=c(CO2-3)·c(HClO)c(ClO-)·c(HCO-3)
=c(CO2-3)·c(HClO)·c(H+)c(ClO-)·c(HCO-3)·c(H+)
=Ka2(H2CO3)Ka(HClO)=4.8×10-113.0×10-8=1.6×10-3
由于K1遠大于K2,發生反應①。
[教師]通過計算,H2CO3與ClO-反應主要生成HCO-3和HClO,而不是CO2-3和HClO,結合電離平衡常數,說明離子反應易向電離平衡常數小的方向進行,即生成Ki更小、更難電離的物質。
[教師]如何利用平衡移動原理分析反應的產物?
[學生]酸性:H2CO3>HClO>HCO-3,結合H+能力:HCO-3<ClO-<CO2-3。一級電離H2CO3H++HCO-3,電離出的H+被ClO-結合生成更弱的HClO,使c(H+)減小,平衡正向移動,生成HCO-3和HClO;二級電離HCO-3H++CO2-3, ClO-結合H+能力弱于CO2-3, H+不能被ClO-結合,平衡不移動。
[教師]也可以借助實驗數據來驗證H2CO3和NaClO的反應。
[學生實驗1]分別向集氣瓶中加入相同體積的蒸餾水和NaClO溶液,用二氧化碳傳感器檢測含量變化(見圖4)。
[學生實驗2]將在NaClO溶液中浸過的紅色紙條分別放置在空氣和CO2中,相同時間(5分鐘)后觀察紙條顏色變化(見圖5)。
[學生]實驗1中CO2的含量不斷下降,說明CO2參與了反應;實驗2中放置在CO2中的NaClO能夠使紅色紙條更快褪色,說明兩者反應生成了HClO。
[教師]通過對H2CO3與NaClO反應的分析,大家對離子反應的認識是否更深入了?
[學生]NaClO與H2CO3反應,實質是酸根離子在競爭H+,較弱酸的酸根離子結合較強酸電離出的H+,生成更弱的酸,使較強酸的電離平衡正向移動,再次表明離子反應的實質是平衡的移動與轉化。
[教師]離子反應通常是向著生成更難溶解(Ksp更小)、更難電離(Ki更小)的物質的方向進行。在一定條件下,我們也可以通過改變條件調控離子反應的方向(見圖6)。
3.3 環節三:H2S對廢水中重金屬離子的去除
[教師]H2S也常用來除去廢水中的銅離子,這是一個典型的弱酸制強酸的反應,請根據信息解釋反應能發生的原因。
[學生]從平衡常數角度:Cu2++H2SCuS+2H+的K=7.7×1016,反應完全進行。
從平衡移動角度:Cu2+結合S2-能力更強,結合H2S電離出的S2-,使c(S2-)減小,H2S的電離平衡正向移動,轉化為CuS。
[教師]廢水中的Fe2+,能用H2S除去嗎?
[學生]從平衡常數角度:Fe2++H2SFeS+2H+的K=1.6×10-2,K很小,正反應進行程度很小;逆反應K大,逆反應進行程度大,實驗室可利用FeS固體和稀硫酸或稀鹽酸反應制備H2S氣體。
3.4 環節四:作業布置
某化學興趣小組對碳酸鹽的制備進行研究,得出如下結論,請從理論或結合實驗進行解釋:
(1) 向BaCl2或CaCl2溶液中通入CO2得不到碳酸鹽沉淀,從理論上進行解釋。
(2) 向MgSO4或CuSO4溶液中加入Na2CO3溶液,會得到堿式碳酸鹽或氫氧化物沉淀。
(3) NaHCO3或NH4HCO3常用來制備金屬碳酸鹽,如MgCO3、 ZnCO3、 MnCO3等。請以CaCl2和NaHCO3為例,探究該方法的可行性并解釋。
4 教學反思
4.1 教學效果分析
在課后練習中,仿照前面測試的問題,設計了兩道反饋練習:
問題1 碳酸和亞硫酸的電離平衡常數(25℃)如下表所示,寫出下列反應的離子方程式并說明理由。
Ka1Ka2
H2CO34.2×10-74.8×10-11
H2SO31.2×10-26.2×10-8
① 向NaHCO3溶液中通入少量SO2氣體。
② 向Na2CO3溶液中通入少量SO2氣體。
③ 向Na2CO3溶液中通入足量SO2氣體。
問題2 工業上可用FeS固體除去廢水中的Cu2+,請運用平衡移動原理解釋其原因。
問題1保持測試背景不變,仍然利用碳酸和亞硫酸的多重平衡體系設問,按照由簡單到復雜的順序,考查學生是否能夠利用主題大概念分析離子反應的發生情況。教學班共35名學生,第①問全都能準確寫出離子方程式,并提供充分的證據推理;第②③問有27名學生能準確書寫離子方程式并從定性或定量角度進行分析,有5名學生能準確書寫方程式卻無法進行合理解釋,其余學生則不能準確書寫離子方程式及合理分析。問題2則要求學生基于大概念判斷平衡的移動與轉化。有33名學生能夠找準平衡體系并分析,2名學生在尋找平衡時出現了偏差。這反映出促進大概念建構的單元復習課在幫助學生形成認識思路、培養解決問題能力方面具有積極作用。
在對環節四開放式作業“探究碳酸鹽的制備”第一個問題的解釋中,沒有出現“因為弱酸不能制備強酸”這樣淺表的答案,學生均從不同角度深入分析:有學生回答“因為H2CO3的酸性太弱,溶液中c(CO2-3)太小,c(CO2-3)·c(Ca2+)<Ksp(CaCO3),不能形成CaCO3沉淀”;也有學生遷移應用課堂上H2S與Cu2+生成CuS沉淀的事實進行分析“根據CaCO3的Ksp和H2CO3的電離平衡常數,可見Ca2+結合CO2-3的能力弱于H+,故不能使H2CO3的電離平衡正向移動,發生轉化生成CaCO3”;還有學生通過計算該反應的平衡常數論證反應不能發生。學生的上述表現,反映出指向大概念建構的復習課有助于學生加深對知識本質的理解,拓寬分析和解決問題的視角,促進高階思維的形成。
4.2 教學過程反思
本節課通過進階式學習任務,讓學生經歷“形成→完善→應用”大概念的過程。教學中發現進入第二環節“廢水中細菌的去除”時,直接討論碳酸增強次氯酸鈉殺菌效果的作用機理,由于碳酸存在二級電離,對部分學生來說過于復雜,自我探索受阻,需要在教師的引導下才能完成。后續教學中可以考慮先讓學生分析醋酸與次氯酸鈉的作用,再遞進到二元酸的討論,為學生搭建好探究的“腳手架”,讓學生在自主學習中增進對大概念的理解,提升問題解決能力。
在單元末尾階段的整理與提升環節開設的大概念建構課,能夠準確把握學生在本單元學習的“痛點”,從學生的學習困惑出發,凝練解決該類問題的大概念,通過真實情境的學習任務,引導學生在探究中深化對知識的理解,使認識視角顯性化和多樣化,將學科知識轉化為學科素養。另外,促進大概念建構的教學,也需要教師提高自身專業素養,把握知識的本質內涵及所蘊含的素養培育價值,提升學科理解能力。
參考文獻:
[1]溫·哈倫.韋鈺譯.以大概念理念進行科學教育[M].北京: 科學普及出版社, 2016: 1~12.
[2]王春, 李艷.學科大概念統攝下的化學單元整體教學設計——以“醛酮和糖類”教學為例[J].化學教學, 2022, (3): 48~52.
[3]劉臣, 何彩霞.基于化學學科大概念的單元整體教學設計——以選擇性必修1“化學反應與電能”為例[J].化學教學, 2023, (11): 34~38.
[4]麻生明, 陳寅主編.普通高中教科書·化學·選擇性必修1·化學反應原理[M].上海: 上海科學技術出版社, 2023: 58~82.
[5]中華人民共和國教育部制定.普通高中化學課程標準(2017年版2020年修訂)[S].北京: 人民教育出版社, 2020: 33.
[6]麻生明, 陳寅主編.普通高中教科書·化學·必修第一冊[M].上海: 上海科學技術出版社, 2021: 56~62.
[7]楊玉琴, 陸海燕, 呂榮冠.學科大概念: 從課標到教材到教學的轉化[J].化學教學, 2022, (10): 3~9.
[8]Wang Shu-Yu, Li Guang-Ming, Xu Wei, et al.. Facile Preparation and Application of Magnesium Hydroxide Assembly Spheres [J]. Research on Chemical Intermediates, 2016, 42(3): 2661~2668.
[9]杜博, 沈子稚, 肖艷.基于“證據推理”素養的沉淀溶解平衡教學設計[J].化學教學, 2021,(6): 61~65.

