點(diǎn)擊“化合價(jià)的判斷技巧及應(yīng)用”


高中化學(xué)氧化還原反應(yīng)、電化學(xué)、結(jié)構(gòu)化學(xué)、有機(jī)化學(xué)中很多問題涉及“化合價(jià)”.這一基礎(chǔ)化學(xué)知識(shí)看似很簡(jiǎn)單,但很容易出錯(cuò).若化合價(jià)判斷錯(cuò)了,后面的推導(dǎo)和計(jì)算無法進(jìn)行.下面筆者將結(jié)合典例談?wù)勂渑袛嗉记杉皯?yīng)用,以幫助學(xué)生落實(shí)基礎(chǔ),提高判斷化合價(jià)的速度和準(zhǔn)確率.
1.2 利用“代數(shù)和”確定化合價(jià)
化合物化合價(jià)代數(shù)和為0,若僅有一種元素的化合價(jià)未知,可用“代數(shù)和”來確定.
例2 判斷下列物質(zhì)中某元素的化合價(jià).
(1)Na2S2O8 中氧元素的化合價(jià).
(2)[Co(NH3)5Cl]Cl2 中Co元素的化合價(jià).
(3)羥基(OH)中氧元素的化合價(jià).
解析
(1)硫元素最高價(jià)為+6價(jià),不可能為+7價(jià),Na2S2O8 含-1價(jià)、-2價(jià)2種氧,設(shè)-1價(jià)氧有x 個(gè),則代數(shù)和為2+6×2-x-2(8-x)=0,得x=2,即Na2S2O8 中有2個(gè)氧為-1價(jià)、6個(gè)氧為-2價(jià).
(2)Cl為-1價(jià)、NH3 為0價(jià),由于化合物化合價(jià)代數(shù)和為0,故Co為+3價(jià),注意內(nèi)界、外界的Cl均不可漏掉.
(3)H 為+1價(jià),由于自由基化合價(jià)代數(shù)和為0,故O 為-1價(jià),不能誤認(rèn)為是-2價(jià).
1.3 利用“整體法”確定化合價(jià)
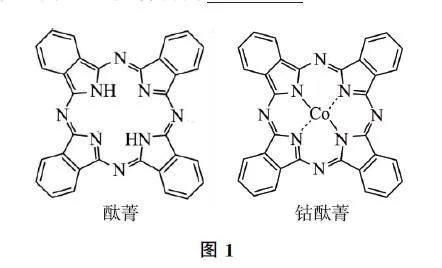
例3 酞菁與鈷酞菁的結(jié)構(gòu)如圖1所示,鈷酞菁分子中鈷離子的化合價(jià)為______.
解析
把酞菁當(dāng)作一個(gè)整體,鈷酞菁分子比前者少2個(gè)+1價(jià)H、多1個(gè)鈷離子,所以鈷離子的化合價(jià)為+2價(jià).
例4 RCH2OH→RCHO→RCOOH 的轉(zhuǎn)化中,化合價(jià)如何變化?
解析
把“RCHO”當(dāng)作一個(gè)整體,除含“RCHO”原子團(tuán)外,醇中還有2個(gè)+1價(jià)H、酸中還有1個(gè)-2價(jià)O,則“RCHO”原子團(tuán)在醇中顯-2價(jià)、醛中顯0 價(jià)、酸中顯+2 價(jià),故RCH2OH → RCHO、RCHO→RCOOH均升高2價(jià).值得注意的是,有機(jī)物若減少2個(gè)H 或增加1個(gè)O,化合價(jià)升高2價(jià),反之則降低2價(jià).
1.4 利用“斷鍵法”確定化合價(jià)
ABn 型配合物中心離子或原子化合價(jià)的判斷方法:先將金屬原子A 與配體B之間的配位鍵斷開,若ABn 型配合物中心離子或原子化合價(jià)的判斷方法:先將金屬原子A 與配體B之間的配位鍵斷開,若
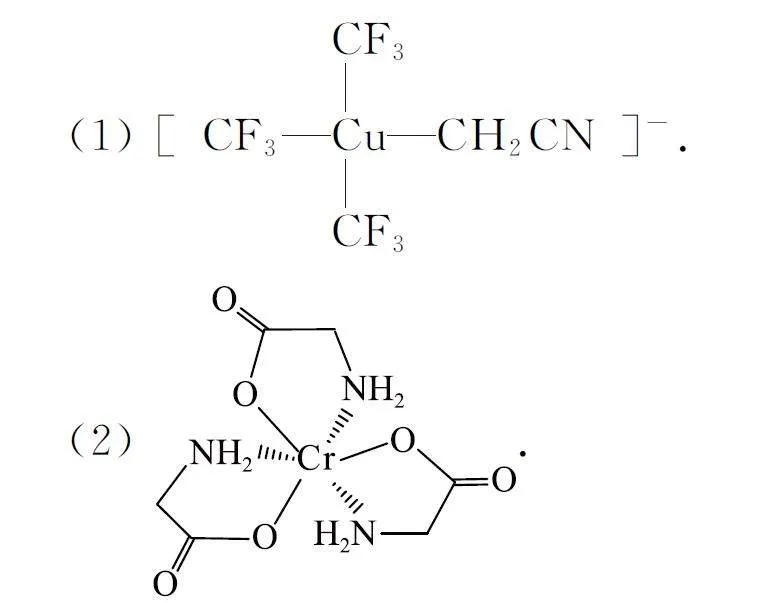
例5 請(qǐng)判斷下列物質(zhì)中中心離子的化合價(jià).
解析
(1)先將Cu與C 之間配位鍵斷開,配原子“C”僅有3個(gè)σ鍵,不滿足8電子結(jié)構(gòu),則均需要補(bǔ)上1個(gè)負(fù)電荷,而整體帶1個(gè)單位的負(fù)電荷,故Cu為+3價(jià).
(2)先將Cr與O、N 之間配位鍵斷開,配原子“N”連有3個(gè)σ鍵、還有1對(duì)孤電子對(duì),滿足8電子結(jié)構(gòu),不需要補(bǔ)上負(fù)電荷;而“O”僅有1個(gè)σ鍵,不滿足8電子結(jié)構(gòu),則3個(gè)“O”均需要補(bǔ)上1個(gè)負(fù)電荷,而整體是中性的,故Cr為+3價(jià).
2 應(yīng)用
2.1 判斷反應(yīng)類型
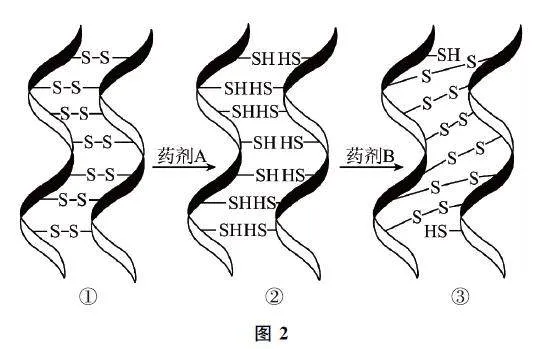
例6 化學(xué)燙發(fā)巧妙利用了頭發(fā)中蛋白質(zhì)發(fā)生化學(xué)反應(yīng)實(shí)現(xiàn)對(duì)頭發(fā)的“定型”,其變化過程如圖2所示,①→②屬于______反應(yīng),藥劑A 具有______性,藥劑B具有______性(填“氧化”或“還原”).
解析
由“整體法”分析.將①中原子當(dāng)作一個(gè)整體,②在① 的基礎(chǔ)上增加若干個(gè)+1 價(jià)H,故①→②化合價(jià)降低,屬于還原反應(yīng),藥劑A 具有還原性;反之藥劑B具有氧化性.

