突破反應熱的計算類試題
反應熱是化學反應中能量的轉移或轉化形式之一,對于理解化學反應的本質以及預測和控制反應過程具有重要意義.與反應熱相關的試題不僅是熱力學知識的具體應用,更是對考生邏輯思維和計算能力的全面考查.要想在高考中輕松應對反應熱的計算問題,不僅需要深入理解反應熱的基本原理,還需要掌握一系列實用的計算方法.
1 掌握蓋斯定律
蓋斯定律被稱為反應熱的加法性原理,它告訴我們,一個化學反應無論是一步完成還是多步完成,其反應熱效應總是相同的.這一原理不僅簡化了復雜反應熱的計算過程,還為我們提供了一種全新的視角來審視化學反應中的能量變化.
例1 (2023年全國乙卷,節選)硫酸亞鐵在工農業生產中有許多用途,如可用作農藥防治小麥黑穗病,制造磁性氧化鐵、鐵催化劑等.已知下列熱化學方程式:
FeSO4·7H2O(s)=FeSO4(s)+7H2O(g) ΔH1=a kJ·mol-1, ①
FeSO4·xH2O(s)=FeSO4(s)+xH2O(g) ΔH2=bkJ·mol-1, ②
FeSO4·yH2O(s)=FeSO4(s)+yH2O(g) ΔH3=ckJ·mol-1, ③
則FeSO4 ·7H2O (s)+ FeSO4 ·yH2O (s)=2(FeSO4·xH2O)(s)的ΔH =____ kJ·mol-1.
解析
根據蓋斯定律,由①+③-2×②可得目標反應FeSO4·7H2O(s)+FeSO4·yH2O(s)=2(FeSO4·xH2O)(s),所以ΔH = (a +c -2b )kJ·mol-1.
蓋斯定律不僅是反應熱計算中的一把利器,更是我們理解化學反應機理的重要工具.通過掌握蓋斯定律,我們不僅可以更加準確地計算反應熱,還能夠深入理解化學反應中的能量變化.因此,我們應該深入學習并熟練掌握蓋斯定律的相關內容,以便更好地應用它來解決實際問題.
2 利用反應物和生成物的能量計算
反應熱等于生成物的總能量減去反應物的總能量.因此,如果知道反應物和生成物的能量,可以直接計算反應熱,這是一種既直接又有效的方法.這種方法不僅能夠幫助考生快速準確地解決問題,還能夠培養考生的邏輯思維能力和問題解決能力.
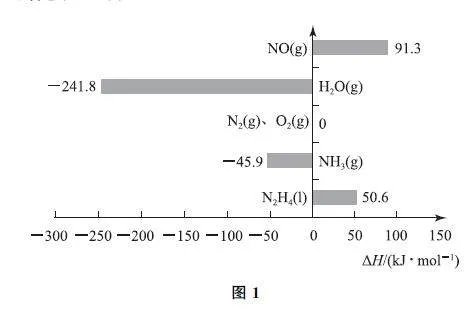
例2 已知:在標準壓強(100kPa)、298K 下,由最穩定的單質合成1mol物質B的反應焓變,叫作物質B的標準摩爾生成焓,用ΔH (kJ·mol-1)表示.有關物質的ΔH 有如圖1所示關系.下列有關判斷正確的是( ).
A.H2O(l)的ΔH >-241.8kJ·mol-1
B.NH3(g)比N2H4(l)穩定
C.N2H4(l)標準燃燒熱為534.2kJ·mol-1
D.NO(g)的鍵能大于N2 (g)與O2 (g)的鍵能之和
解析
H2O(g)的能量高于H2O(l),則H2O(l)的ΔH < -241.8kJ·mol-1,選項A 錯誤.N2H4(l)的標準摩爾生成焓為+50.6kJ·mol-1,NH3(g)的標準摩爾生成焓為-45.9kJ·mol-1,由能量越低越穩定的原理可知,NH3 比N2H4(l)穩定,選項B 正確.N2H4 (l)的標準摩爾生成焓為+50.6kJ·mol-1,則N2(g)+2H2(g)?N2H4(l) ΔH =+50.6kJ·mol-1, ①H2O(g)的標準摩爾生成焓為-241.8kJ·mol-1,則2H2(g)+O2(g)=2H2O(g) ΔH =-483.6kJ·mol-1. ②
根據蓋斯定律,由②-①可得反應N2H4 (l)+O2(g)=N2(g)+2H2O(g),但標準燃燒熱是指生成液態水,無法根據題中數據計算,選項C錯誤.NO 的標準摩爾生成焓為+91.3kJ·mol-1,則N2 (g)+O2(g)=2NO(g)的ΔH >0,故NO(g)的鍵能小于N2(g)與O2(g)的鍵能之和,選項D錯誤.答案為B.
解答反應熱相關問題時,需要考生對化學反應的基本概念和能量變化有深入的理解.利用反應物和生成物的能量進行計算.因此,在日常學習中,考生應該注重基礎知識的積累和實踐能力的提升,以便在高考中取得優異的成績.
3 利用燃燒熱計算
在化學反應中,燃燒熱是一個特定的、重要的能量值,表示單位物質的量的物質完全燃燒時放出的熱量.利用燃燒熱計算反應熱是一種非常實用的方法,尤其在處理涉及多個步驟的復雜反應時.當我們要計算一個復雜反應的反應熱時,可以將這個反應拆分成若干個簡單的反應,根據蓋斯定律,通過各個步驟反應熱的簡單相加或相減得到整個復雜反應的反應熱.
此外,利用燃燒熱計算反應熱時,還需要注意一些細節.例如,要確保所有物質都是在標準狀態下進行反應的,因為非標準狀態下的反應熱可能會有所不同.另外,還要注意反應物和生成物的狀態,因為固態、液態和氣態的物質所放出的熱量是不同的.
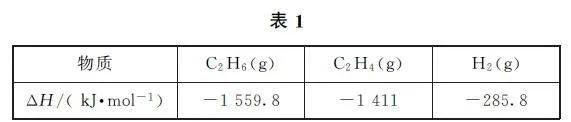
例3 (2023年海南卷)各相關物質的燃燒熱數據如表1所示.下列熱化學方程式正確的是( ).
A.C2H4(g)+3O2(g)=2CO2(g)+2H2O(g) ΔH =-1411kJ·mol-1
B.C2H6(g)=C2H4(g)+H2(g) ΔH =-137kJ·mol-1
C.H2O(l)=O2(g)+H2(g) ΔH =+285.8kJ·mol-1
D.C2H6(g)+7/2O2(g)=2CO2(g)+3H2O(l) ΔH =-1559.8kJ·mol-1
解析
當1mol純物質完全燃燒生成指定產物時,所放出的熱量為燃燒熱.在利用熱化學方程式表示燃燒熱時,方程式中的可燃物必須為1mol,產物為穩定產物.H2O 為氣態時,不是穩定的氧化物,選項A 錯誤.由表1數據可得C2H6(g)+7/2O2(g)=2CO2(g)+3H2O(l) ΔH =-1559.8kJ·mol-1, ①C2H4(g)+3O2(g)=2CO2(g)+2H2O (l) ΔH =-1411kJ·mol-1, ②1/2O2(g)+H2(g)=H2O (l) ΔH =-285.8kJ·mol-1, ③依據蓋斯定律,由①-②-③可得反應C2H6(g)=C2H4(g)+H2(g),ΔH =+137kJ·mol-1,選項B錯誤.由H2 的燃燒熱為-285.8kJ·mol-1可得,1/2O2(g)+H2(g)=H2O(l)ΔH =-285.8kJ·mol-1,則H2O(l)=1/2O2(g)+H2(g)ΔH =+285.8kJ·mol-1,選項C錯誤.由C2H6 的燃燒熱為-1559.8kJ·mol-1可得,C2H6(g)+7/2O2(g)=2CO2(g)+3H2O(l)的ΔH =-1559.8kJ·mol-1,選項D正確.答案為D.
利用燃燒熱計算反應熱是一種非常實用的方法.通過明確燃燒熱的概念,將復雜反應拆分成簡單的步驟,并利用蓋斯定律進行計算,我們可以準確地得到整個反應的反應熱.這種方法不僅簡化了計算過程,還提高了計算的準確性,是高考化學中不可或缺的一部分.
綜 上所述,高考中反應熱的計算不僅要求考生具備扎實的理論基礎,還需要靈活運用各種計算方法和策略.通過不斷練習和總結經驗,相信每位考生都可以在高考化學科目中展現出自己的實力,取得優異的成績.
(完)

