偽狂犬病病毒熒光標簽毒株構建及其在抗病毒藥物篩選中的初步應用
摘 要: 為篩選針對偽狂犬病病毒(pseudorabies virus,PRV)的有效抗病毒藥物,本研究以PRV人源分離毒株hSD-1/2019和經典豬源流行毒株Ea為親本病毒,采用同源重組技術將mCherry報告基因插入到PRV的UL35基因終止子之前位點,構建了表達紅色熒光蛋白mCherry的熒光標簽毒株PRV-mCherry。基于構建的熒光標簽病毒,以熒光強度為指標,建立高通量藥物篩選平臺,對天然產物庫中1 621種化合物進行抗病毒藥物篩選,并初步探索藥物特性。結果表明,mCherry標簽插入位置正確且穩定遺傳,熒光標簽毒株PRV-mCherry與親本毒株在PK-15細胞上的增殖曲線趨勢一致,且熒光強度可反映病毒增殖情況。使用PRV-mCherry從天然產物庫中成功篩選出3種可在體外有效抑制PRV增殖的藥物,根據測定的50%細胞毒性濃度和50%抑制濃度,計算出3種藥物的選擇指數范圍為203.63~564.58 μmol·L-1,表明其具有良好的成藥性。本研究為臨床防治PRV感染的抗病毒藥物發掘提供了新的策略和思路。
關鍵詞: 偽狂犬病病毒;人源分離株;熒光標簽毒株;抗病毒藥物
中圖分類號: S852.659.1
文獻標志碼:A
文章編號:0366-6964(2024)08-3600-12
收稿日期:2023-11-17
基金項目:國家自然科學基金(32122086)
作者簡介:咼會會(1989-),女,湖北公安人,博士生,主要從事動物抗病毒藥物篩選研究,E-mail: guohuihui@webmail.hzau.edu.cn,Tel:027-87286608
通信作者:王湘如,主要從事動物源性人獸共患病和動物重大疫病的病原學、致病機制和診斷防控研究,E-mail:wangxr228@mail.hzau.edu.cn;劉青蕓,主要從事動物重大疫病流行病學與病原學、致病機制、疫苗研制等研究,E-mail:LIUQY@mail.hzau.edu.cn
Construction of Fluorescently Labelled Pseudorabies Viruses and Their Preliminary Application
in Antiviral Drug Screening
GUO" Huihui1, ZHAGN" Hao1, YANG" Dan1, KUANG" Yan1, LI" Yafei1, LIU" Shaomeng1, LIU" Qingyun1*, WANG" Xiangru1,2*
(1.The Cooperative Innovation Center for Sustainable Pig Production, College of Veterinary Medicine,
Huazhong Agricultural University, Wuhan 430070," China;
2.National Key Laboratory of Agricultural
Microbiology, Wuhan 430070," China)
Abstract:" In order to screen effective antiviral drugs against pseudorabies virus (PRV), we here constructed the recombinant strains PRV-mCherry expressing red fluorescent protein mCherry based on the human-originated isolate hSD-1/2019 and classical strain Ea. Specifically, mCherry reporter gene was inserted into the site before the terminator of PRV UL35 through homologous recombination technique. Based on the constructed recombinant fluorescent viruses, a high-throughput drug screening platform indicated by fluorescence intensity was established and applied for testing 1 621 drugs in the natural product library for screening effective antiviral drugs. Properties of the drugs were preliminarily explored. The results showed that mCherry was inserted in the correct position and was stably inherited. The fluorescence intensity of the recombinant strain PRV-mCherry was representative of the viral proliferation. The strains PRV-mCherry showed similar proliferation curves as the parental strains, supporting the usability of the PRV-mCherry strains in drug screening. Three drugs that could effectively inhibit PRV proliferation in vitro were screened out from the natural product library by using PRV-mCherry. Based on the determined 50% cytotoxic concentration and 50% inhibitory concentration, the selection indices of the three drugs were calculated to be 203.63-564.58 μmol·L-1, indicating that they had good drug-forming properties. The research provided new ideas in antiviral drugs for the treatment of PRV infection.
Key words: pseudorabies virus; human-originated isolate; fluorescently labeled strains; antiviral drugs
*Corresponding authors:" WANG Xiangru, E-mail: wangxr228@mail.hzau.edu.cn; LIU Qingyun, E-mail: LIUQY@mail.hzau.edu.cn
偽狂犬病病毒(pseudorabies virus,PRV)屬于皰疹病毒科,α皰疹病毒亞科,水痘病毒屬。PRV能夠感染大部分哺乳動物,豬是其天然宿主[1]。偽狂犬病(pseudorabies,PR)是一種由PRV感染導致的急性、熱性傳染病。新生仔豬及其它動物感染PRV后會表現出致命的中樞神經系統損傷,出現嚴重的呼吸道癥狀,最終死亡;種豬感染PRV會引起繁殖障礙,懷孕母豬產死胎和流產,公豬精液質量下降;PRV感染保育豬或育肥豬主要引起呼吸道癥狀,死亡率低。PRV可在感染豬的神經系統中建立潛伏感染,使豬終生帶毒。潛伏感染的病毒在一些因素刺激下可發生再活化,導致二次感染和流行[2]。
一直以來,PRV被認為對人沒有致病性。然而2017年至今,中國已報道了31例確診感染PRV的臨床病例,患者被確診為病毒性腦炎,表現出發燒、頭疼、癲癇、驚厥、意識障礙、智力損傷;其中50%患者同時存在嚴重的眼部損傷,造成急性視網膜壞死、玻璃體混濁和失明等癥狀。這些病例提示,PRV具有可跨物種感染人的潛在風險。在PRV感染患者的治療過程中,使用傳統抗皰疹病毒藥物(如:阿昔洛韋)治療后,患者病情進展有所延緩,但未能完全阻斷病毒感染造成的組織損傷,且出院后仍留有嚴重的神經后遺癥,包括死亡5例(5/31),氣管切開插管出院4例(4/31),昏迷、植物人狀態2例(2/31),最低意識狀態3例(3/31),失明6例(6/31),視力損傷8例(8/31),癲癇1例(1/31),輕度意識障礙2例(2/31)。因此,亟需開發更加有效的抗病毒藥物用于人偽狂犬病腦炎的臨床治療[3]。
據記載,有藥用價值的植物、動物以及其他微生物成分等天然產物可用于傳染病的治療。其中,藥用植物是占比最大的天然產物來源,研究者已經從不同的植物中分離出多種天然來源的活性化學物質,包括香豆素、類黃酮、萜類化合物、有機硫化合物、木脂素、多酚、皂苷等[4]。這些活性化學物質主要通過影響細胞功能、細胞膜通透性和抑制病毒復制等方式發揮抗病作用[5]。天然產物的抗病毒效果給傳染病防治帶來很多新思路,因此備受研究者關注。
作者本實驗室前期從感染PRV的患者腦脊液中成功分離了一株PRV,命名為hSD-1/2019。為了篩選能更加有效治療PRV感染患者的藥物,本研究將hSD-1/2019毒株改造為熒光標簽毒株,從天然產物庫中開展了抗PRV藥物的篩選,極大地增加了抗病毒藥物篩選的效率。該研究為抗PRV藥物的篩選與發掘提供了新的思路。
1 材料與方法
1.1 病毒、細胞、菌株和載體
PRV人源分離毒株hSD-1/2019、豬源經典流行毒株Ea均由本實驗室分離和保存;PK-15(豬腎細胞)、SK-N-SH(人神經母細胞瘤細胞)、ARPE-19(人視網膜上皮細胞)、HBMEC (人腦微血管內皮細胞)、SH-SY5Y(人神經母細胞瘤細胞)、真核表達質粒pcDNA3.1 (+)均由本實驗室保存;E. coli DH5ɑ菌株購自北京全式金公司。
1.2 主要試劑和儀器
本研究用于抗病毒藥物篩選的天然產物庫購買自Selleck公司;DNA聚合酶(Prime STAR Max DNA Polymerase)、連接酶DNA Ligation Kit Ver.2.1及限制性內切酶購自TaKaRa公司;轉染試劑Lipofectamine 2000 Reagent購自Thermo Fisher公司,DMEM培養基購自Gibco公司;胎牛血清購自GEMINI公司;病毒DNA提取試劑盒購于TIANGEN公司;去內毒素質粒小提試劑盒、PCR產物純化試劑盒、膠回收試劑盒購于Omega公司;倒置熒光顯微鏡IX53購自OLYMPUS公司;活細胞工作站FL Auto購自Thermo Fisher公司;PCR儀購于BIO-RAD公司等。
1.3 同源重組供體質粒構建
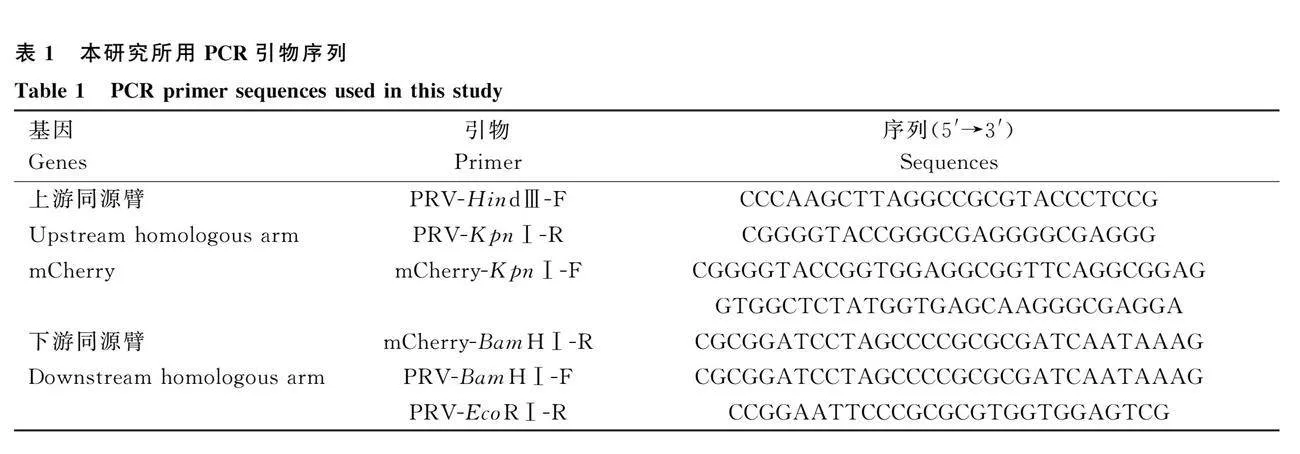
有文獻報道,在PRV的UL35基因后插入熒光標簽對病毒復制影響較小[6],因此本研究擬在 ""UL35基因終止子之前的位置插入mCherry熒光報告基因。利用病毒DNA提取試劑盒提取hSD-1/2019和Ea毒株的DNA作為模板,通過PCR擴增獲得同源臂,同時擴增mCherry基因。并在mCherry上游擴增引物中加入柔性linker,堿基序列為GGTGGAGGCGGTTCAGGCGGAGGTGGCT-CT。采用酶切連接方法依次將上下游同源臂和目的基因插入到pcDNA3.1(+)載體中,對構建的重組質粒進行測序分析。PCR驗證使用上游同源臂上游引物PRV-HindⅢ-F及下游同源臂下游引物PRV-EcoRⅠ-R,擴增的PCR目的片段長度為2 024 bp。所使用的引物如表1所示。
1.4 熒光標簽毒株的構建及PCR鑒定
從同源重組供體質粒中,擴增同源臂及mCherry組合片段,純化后使用轉染試劑Lipofectamine 2000 Reagent將純化片段轉染至PK-15細胞中。
轉染后4 h,分別感染0.001 MOI hSD-1/2019和Ea。37 ℃、5% CO2條件下培養1~2 d后觀察是否出現帶紅色熒光的細胞。待出現80%細胞病變時,置于-80℃冰箱反復凍融3次,收集病毒液。將收集的病毒液接種到PK-15單層細胞上,并在表面覆蓋含有0.8%低熔點瓊脂糖的無酚紅MEM培養液,培養36 h后挑選含有紅色熒光的病毒噬斑。按照上述噬斑純化方法,反復挑斑純化7代,得到熒光標簽毒株hSD-mCherry和Ea-mCherry,并進行PCR檢測。
1.5 半數組織細胞感染量(TCID50)測定
將收獲的病毒液用無血清DMEM作10倍倍比稀釋,取稀釋至10-5~10-8區間的病毒液,將每個稀釋度的病毒液接種至96孔細胞板的1縱列(8孔),每孔100 μL,每個樣品做3次重復。制備PK-15細胞懸液,將細胞懸液接種到已經加入病毒液的96孔細胞培養板中,每孔100 μL(約1×104個細胞)。將96孔板置于CO2細胞培養箱中培養7 d,每天觀察并標記出現細胞病變(cytopathic effect,CPE)的孔。第7天按照Reed-Muench方法計算病毒的TCID50。
1.6 噬斑大小測定
在6孔板中接種PK-15細胞,待細胞融合至單層,棄掉培養基,以0.01 MOI劑量接種病毒,每個毒株設置3孔重復。將6孔板在37℃孵育2 h后棄掉病毒上清,補加含3% FBS、0.8%低熔點瓊脂糖的無酚紅MEM。在CO2細胞培養箱中培養48 h后,熒光顯微鏡拍照,并用Mshot Image Analysis System軟件分析熒光噬斑的面積。
1.7 熒光標簽毒株的遺傳穩定性測試
將熒光標簽毒株以0.01 MOI劑量感染單層PK-15細胞,并連續傳代至20代。每代感染至完全病變時,進行熒光顯微鏡拍照并收集病毒液。測定第8代、12 代、16代和20代熒光標簽毒株的TCID50。
1.8 熒光標簽毒株的生長動力學曲線測定
將PK-15細胞鋪入直徑3.5 cm細胞培養皿中,待細胞融合度達到80%,進行感染試驗。hSD-mCherry、hSD-1/2019、Ea-mCherry和Ea以0.01 MOI劑量感染PK-15細胞,37℃孵育2 h后棄掉上清,補加含3% FBS的DMEM培養基,在37℃、5% CO2條件下培養。培養期間每隔4 h收取一次全細胞樣品。將收取的樣品在-80℃冰箱反復凍融3次,收集病毒液,測定樣品TCID50。
1.9 基于天然產物庫的抗PRV藥物篩選
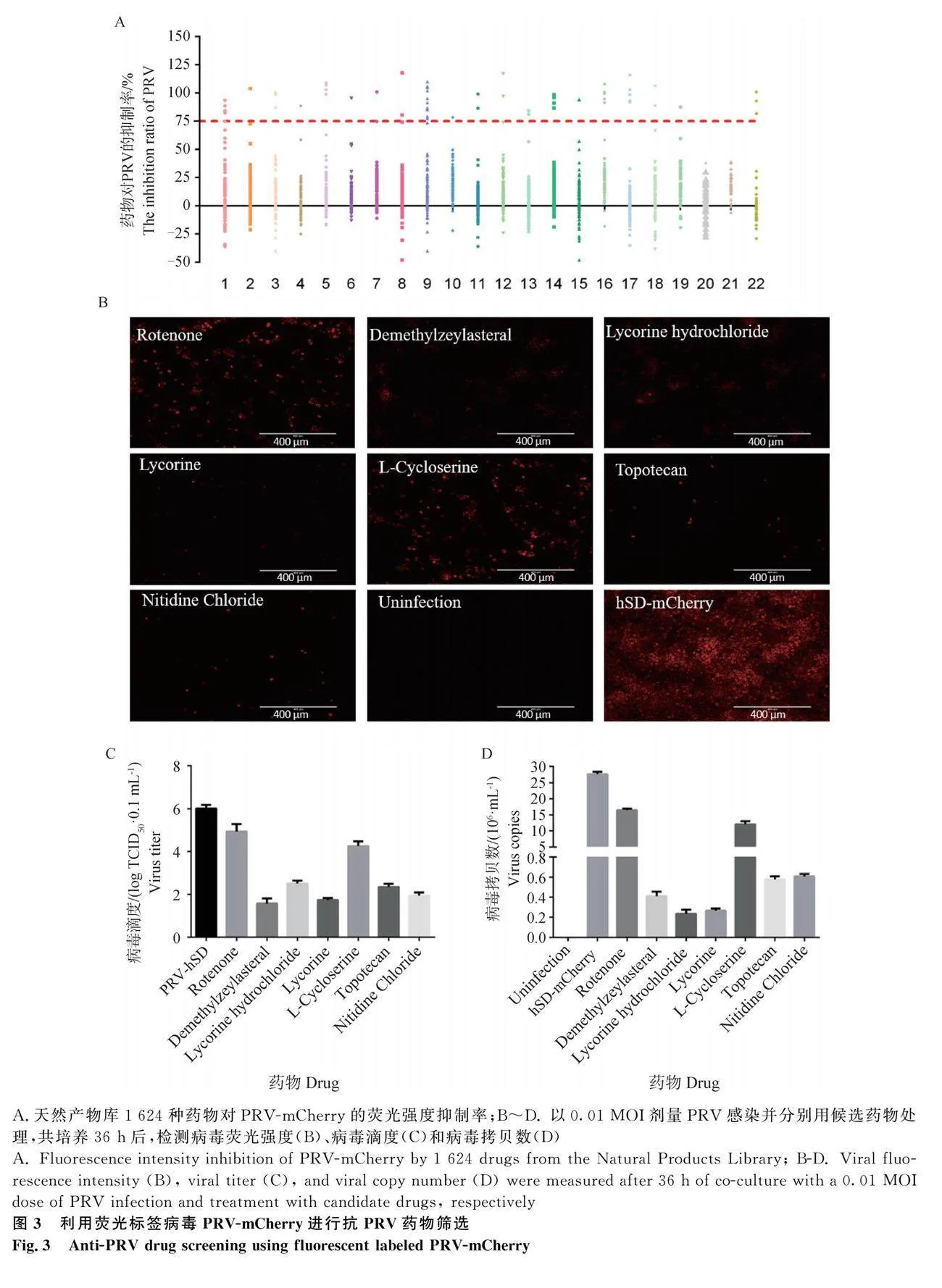
用構建的PRV熒光標簽毒株對天然產物庫中1 621種藥物進行高通量篩選。前期研究發現,隨著PRV-mCherry感染劑量的增加,被感染細胞中的熒光強度和病毒滴度呈現出相同的上升趨勢,說明PRV-mCherry的熒光強度可以反映病毒的增殖滴度。當96孔板中PK-15細胞融合度達到80%時,以0.01 MOI劑量接種熒光標簽毒株,同時加入終濃度為10 μmol·L-1的天然產物。培養36 h后利用多功能酶標儀檢測紅色熒光蛋白的表達水平,使用mCherry最大激發光587 nm和發射光610 nm進行檢測,檢測結果為熒光強度數值,再根據熒光強度數值計算抑制率。抑制率=(病毒感染對照組-試驗組)/(病毒感染對照組-細胞陰性對照組)×100%。選擇抑制率大于75%的藥物作為初篩有效藥物。
1.10 藥物細胞毒性測定
使用CCK-8試劑盒檢測藥物對PK-15細胞的細胞毒性。將藥物分別稀釋至320、160、80、40、20和10 μmol·L-1,分別加入到96孔板中80%融合度的PK-15細胞單層中,每個稀釋度設6個重復孔。細胞對照不進行藥物處理。在37℃和5% CO2 條件下培養36 h后,每孔加入10 μL CCK-8試劑,加入試劑后再培養1 h。按以下公式計算經藥物處理的細胞活力:平均吸光度值(經藥物處理的細胞)/平均吸光度值(細胞對照)。然后使用 GraphPad Prism進行非線性回歸(曲線擬合)分析,得出藥物對半數細胞產生毒性的濃度。
1.11 統計分析
對所有試驗都至少重復3次。數據以“x-±s”表示。使用GraphPad Prism版本6.0軟件(GraphPad,La Jolla,California)進行統計分析。組間差異的顯著性采用Student′s t檢驗或雙因素方差分析,當0.01lt;Plt;0.05 (*)、Plt;0.01 (**)和Plt;0.001 (***)時,差異有統計學意義;ns代表差異不顯著。使用 Image J 對圖像中噬斑大小進行分析。
2 結 果
2.1 成功構建mCherry熒光標簽毒株
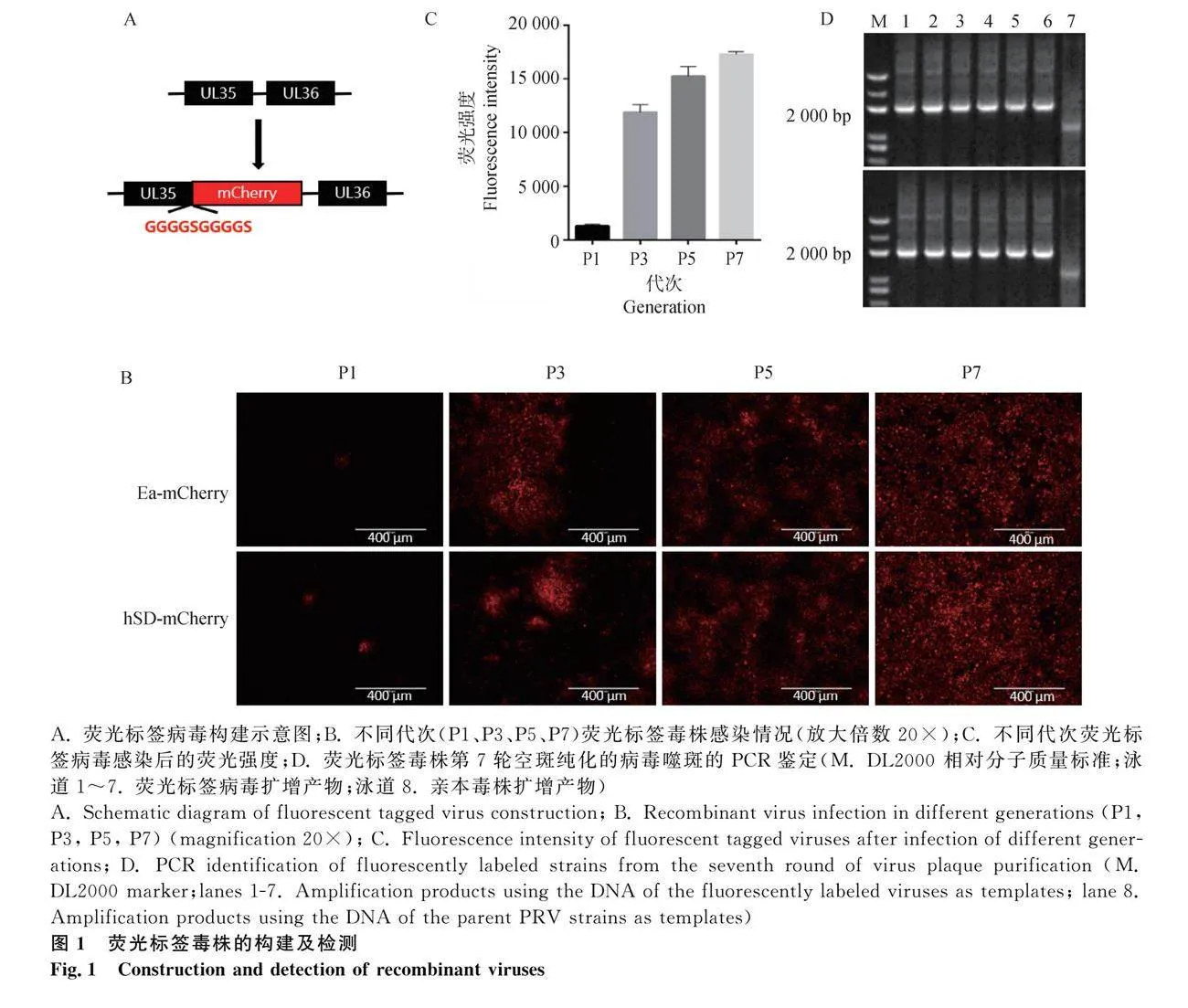
在PRV的UL35終止子前插入mCherry熒光標簽,經7輪噬斑純化得到熒光標簽毒株hSD-mCherry和Ea-mCherry(圖1 A、B和C)。在第7輪空斑純化時,每株熒光標簽病毒隨機選取7個病毒噬斑,提取DNA并進行PCR鑒定,目的片段為上下游同源臂與mCherry組合片段,共計2 024 bp。結果顯示,熒光標簽毒株所有病毒噬斑的擴增條帶均單一,大小與目的片段一致(圖1 D)。PCR產物測序結果表明,PCR產物序列與目的片段100%相同。表明mCherry基因已正確插入到親本病毒基因組中,熒光標簽毒株構建成功且無親本病毒污染。
2.2 熒光標簽毒株的增殖特性與穩定遺傳性分析
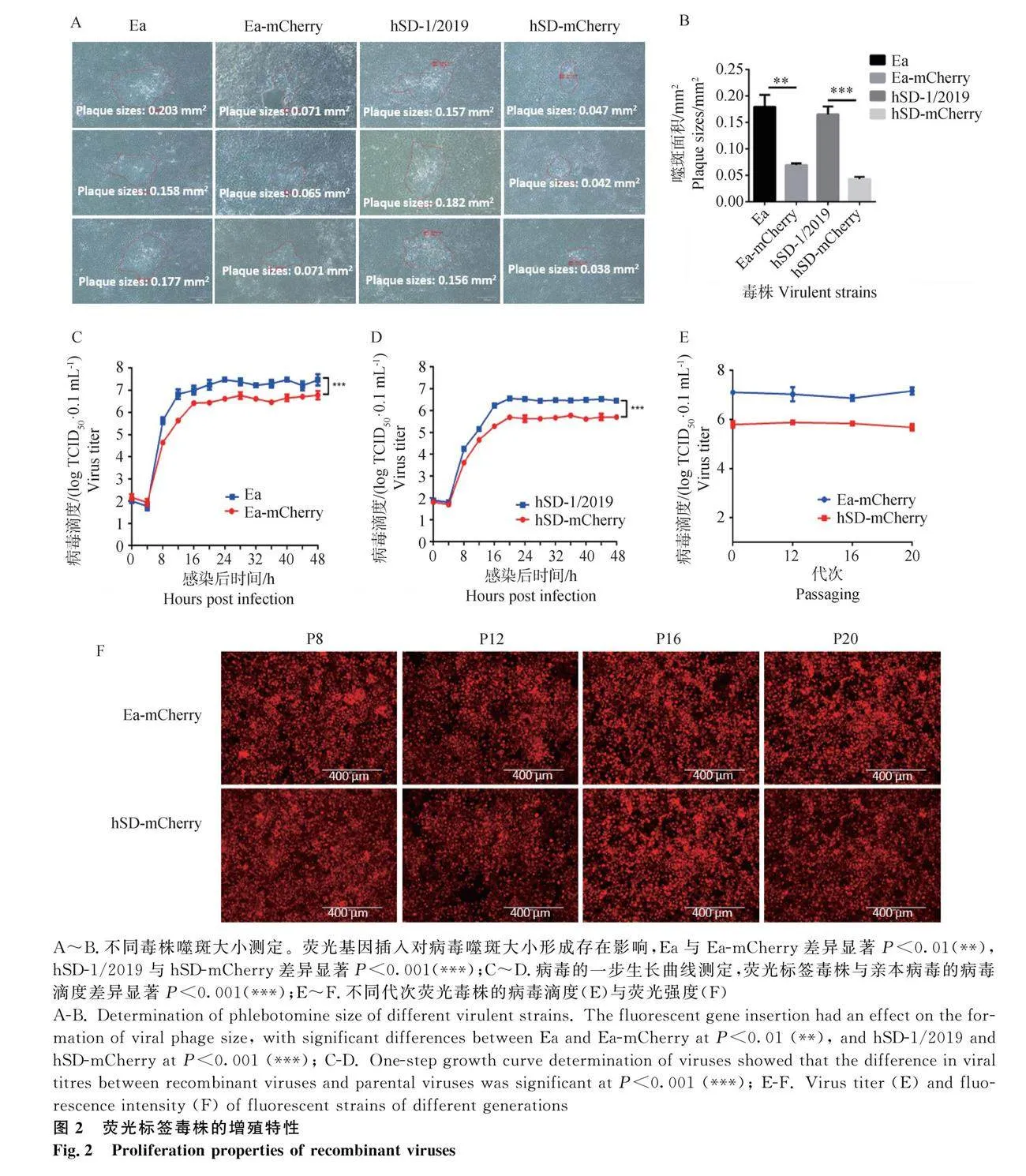
分別將熒光標簽毒株和親本病毒以0.01 MOI的劑量感染PK-15細胞,48 h后測量噬斑大小。結果顯示熒光標簽毒株的噬斑面積顯著小于親本毒株噬斑面積(圖2A、B)。測定不同毒株在PK-15細胞中的一步生長曲線,發現熒光標簽毒株與親本病毒生長曲線趨勢一致,但最終增殖滴度有一定的差異(圖2C、D)。以上結果表明mCherry的插入使PRV毒株的增殖滴度稍有降低,但增殖曲線趨勢不變。
將熒光標簽毒株在PK-15細胞上連續傳代,分別測定熒光標簽毒株第8、12、16和20代的TCID50及mCherry基因表達情況。結果顯示,同一種熒光標簽毒株的不同代次之間的TCID50無明顯差異(圖2E),感染細胞后的熒光強度穩定(圖2F),表明熒光標簽毒株在細胞傳代過程中能保持遺傳穩定,可用于后續藥物篩選。
2.3 基于熒光病毒的抗PRV天然產物篩選
大量研究數據表明,一些天然產物具有良好的抗病毒作用。本研究中,我們采用了前期購買保存的天然產物庫(包含1 621種化合物),利用構建的Ea-mCherry毒株開展潛在抗PRV化合物的篩選。試
驗結果顯示,有部分藥物對Ea-mCherry熒光強度的抑制率達到75%(圖3A),結合CPE抑制效果顯著、對細胞形態沒有明顯影響等顯微鏡觀察結果,最終選擇魚藤酮(rotenone)、去甲澤拉木醛(demethylzeylasteral)、鹽酸石蒜堿(lycorine hydrochloride)、石蒜堿(lycorine)、L-環絲氨酸(L-cycloserine)、托泊替康(topotecan)和氯化兩面針堿(nitidine chloride)等7種藥物進入下一步研究。
針對上述候選藥物,使用hSD-mCherry毒株進行第二輪篩選。結果顯示,相比于無藥物處理的陽性感染組,7種藥物均能顯著抑制病毒感染過程中的熒光強度,其中,去甲澤拉木醛、鹽酸石蒜堿、石蒜堿、托泊替康(和氯化兩面針堿對hSD-mCherry熒光強度的抑制能力更好,魚藤酮和L-環絲氨酸的抑制能力次之(圖3B)。為了進一步驗證以上藥物對病毒增殖的抑制效果,分別檢測了藥物處理后的病毒滴度與病毒拷貝數,前者檢測具有感染活性的病毒粒子,后者檢測活病毒與死病毒粒子的gE基因拷貝數。結果顯示,與對照組、魚藤酮和L-環絲氨酸處理組相比,去甲澤拉木醛、鹽酸石蒜堿、石蒜堿、托泊替康、氯化兩面針堿等5種藥物處理后均能更大程度地降低病毒滴度與病毒拷貝數,這與熒光強度測定結果趨勢一致。其中,以上5種藥物處理后,病毒在PK-15細胞上的增殖滴度從106.01 TCID50·0.1 mL-1下降至102.51 TCID50·0.1 mL-1以下,去甲澤拉木醛藥物處理組的病毒滴度最低,為101.57 TCID50·0.1 mL-1(圖3C);藥物處理后的病毒拷貝數也從27.72×106 copies·mL-1下降至0.61×106 copies·mL-1以下,其中鹽酸石蒜堿藥物處理組的病毒拷貝數最低,為0.23×106 copies·mL-1(圖3D)。
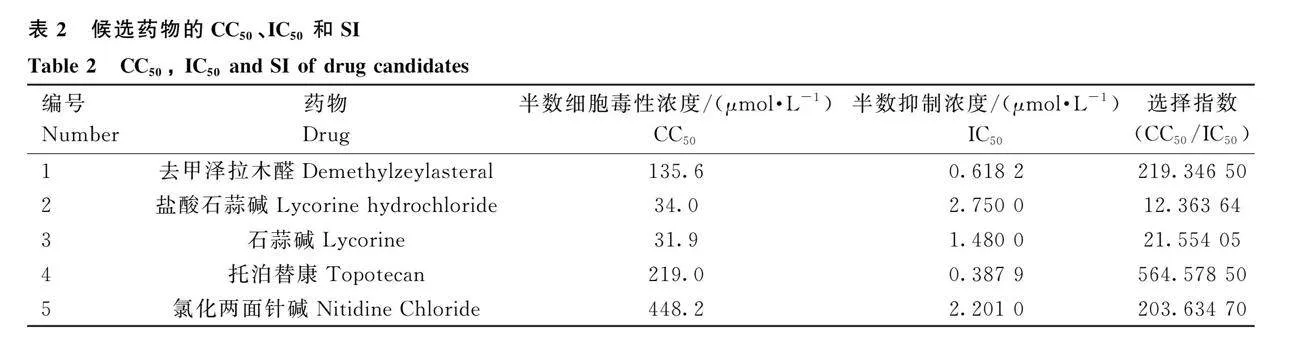
2.4 候選藥物的特性評估
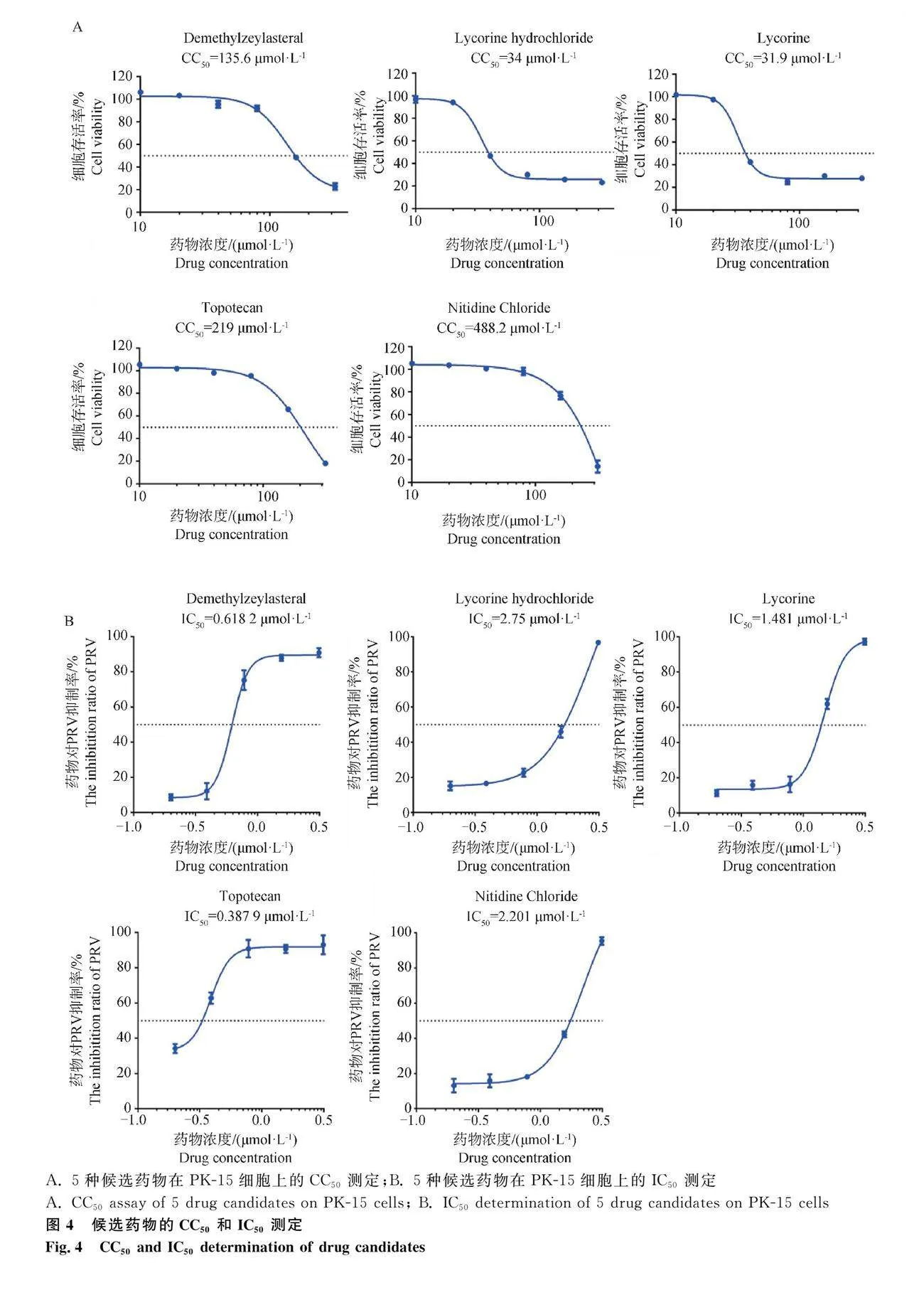
本研究進一步在PK-15細胞上使用hSD-mCherry毒株對上述篩選到的5種抗PRV藥物進行成藥性的初步分析。通過CCK-8方法測定5種化合物對PK-15細胞的半數細胞毒性濃度(CC50)范圍為34.0~448.2 μmol·L-1(圖4A),化合物對病毒的半數抑制濃度(IC50)范圍為0.6182~2.75 μmol·L-1(圖4B)。通過計算藥物選擇指數SI(SI=CC50/IC50)發現,鹽酸石蒜堿和石蒜堿的選擇指數較小,分別為12.36與21.55,表明這兩種藥物在PK-15細胞上的有效性和安全性有待進一步探究。而去甲澤拉木醛、托泊替康和氯化兩面針堿這3種化合物的選擇指數較高,分別為219.34、564.58及203.63,提示這3種候選化合物在細胞水平上均具有良好的抑制PRV潛力,有較好的成藥可能性(表2)。
3 討 論
目前,PRV感染主要集中在亞洲、南美和歐洲等豬群密度較大的地區,部分國家已經在家豬中成功凈化或消滅了PRV。中國作為生豬養殖和豬肉消費大國,豬偽狂犬病仍大范圍流行,嚴重威脅養豬業健康發展[7-8]。近5年,中國24個省份的豬偽狂犬病血清陽性率超過35%[9]。PRV是一種多種動物共患病原,除豬以外還可以感染許多其他種類的動物,包括各種農場動物、伴侶動物、試驗動物和野生動物等[10],非天然宿主感染后的表現以瘙癢和神經癥狀等臨床特征為主,死亡率100%[11]。
一直以來,人類能否感染PRV具有爭議。大部分研究人員認為PRV不能感染人。有報道對455名志愿者進行血清抗體調查,結果顯示PRV特異性中和抗體均呈陰性;對部分志愿者進行PRV皮內(104 TCID50)或皮下(106 TCID50)接種,受試者均沒有表現出任何癥狀[12]。但PRV感染人的疑似病例也多有報道,最早可追溯到1914年;1986年,歐洲也報道了3例疑似病例[13];此后世界各地又陸續報道了12例疑似人感染PRV的病例。但這些疑似病例都缺乏病原學依據[14]。
2017年至今,中國累計出現31例人感染PRV病例,均以宏基因組測序(mNGS)發現患者組織中出現PRV特異性序列為診斷依據,有研究將其命名為人偽狂犬病腦炎[15-24]。所有病例都表現出嚴重的腦炎癥狀,如發燒、頭疼、癲癇、驚厥、意識障礙、智力損傷;其中50%患者同時存在嚴重的眼部損傷,包括急性視網膜壞死、玻璃體混濁和失明等。共有5例患者死亡,其余患者大多伴有嚴重的神經系統后遺癥[25]。流行病學調查發現,患者均有與病豬或豬肉的接觸史,且存在傷口或黏膜暴露,提示PRV跨物種感染人的潛在風險。因此,在有效控制豬群PRV感染的同時,還應強化生豬養殖及屠宰等行業人員對偽狂犬病的防控意識[26-28]。
在報道的人偽狂犬病腦炎病例中,患者在疾病初期均接受了經驗性抗病毒治療及其他對癥和支持治療,部分患者還接受了免疫球蛋白和糖皮質激素聯合用藥。經驗性抗病毒治療使用的藥物包括阿昔洛韋、膦甲酸、更昔洛韋和噴昔洛韋等。然而,大多數患者治療預后較差,出院后留下較嚴重的后遺癥,其中5例死亡、2例植物人狀態、2例呼吸機維持最低生命體征、3例昏迷狀態、6例失明、5例視力損傷、7例意識行動受限。這些臨床預后提示,現有的抗病毒藥物對人偽狂犬病腦炎的治療效果有限,并不能發揮較好的抗病毒效應。因此,我們作者基于此問題,開展了抗PRV藥物的高通量篩選,期望能發現一些新的抗PRV化合物,為人偽狂犬病腦炎的臨床治療提供更多藥物選擇。
在過去的幾十年中,許多不同的靶向病毒DNA聚合酶的抗病毒藥物被批準用于治療皰疹病毒感染。最廣泛使用的單純皰疹病毒(herpes simplex virus, HSV)抗病毒藥物是阿昔洛韋(acyclovir , ACV)、伐昔洛韋(vaxilovir)、泛昔洛韋(famciclovir)、西多福韋(cidofovir)和膦甲酸(sodium phosphate)等[29]。ACV和相關核苷類似物可以成功抑制病毒復制,從而治療HSV感染。但臨床中已出現大量對ACV耐藥性的毒株,ACV耐藥性的出現,為皰疹病毒的治療增加了新的難度[30]。因此,迫切需要探索新的有效和耐受性良好的藥物來治療皰疹病毒感染。天然產物是抗菌和抗病毒活性物質的豐富來源,而其中的抗菌和抗病毒機制有待進一步挖掘[31]。
作者通過篩選發現去甲澤拉木醛、托泊替康和氯化兩面針堿這3種化合物具有顯著的抗PRV效果。其中,去甲澤拉木醛是一種從雷公藤中提取的藥理活性三萜類單體。研究最多且最為突出的是去甲澤拉木醛的抗腫瘤活性,該藥物可通過阻斷細胞周期和誘導細胞凋亡等多種機制發揮抗腫瘤活性[32],同時具有較好的免疫抑制活性[33]、抗炎活性、抗菌活性和抗病毒活性。Zhu等[34]利用表面等離子體共振技術發現去甲澤拉木醛有抗新型冠狀病毒的作用。托泊替康是一種喜樹堿的半合成衍生物,主要通過抑制DNA拓撲異構酶I發揮其細胞毒性作用,具有較好的抗腫瘤活性,對卵巢癌、肺癌、乳腺癌和急性白血病有一定的治療效果[35]。氯化兩面針堿是花椒的主要活性成分之一,主要通過抑制細胞增殖、刺激細胞凋亡、誘導細胞周期停滯、延遲遷移、侵襲和轉移等方式發揮抗腫瘤活性[36]。上述3種藥物在抗病毒研究領域的報道較少,其發揮抗PRV作用的具體機制還有待于進一步探究。
本研究中,作者構建了PRV熒光標簽毒株,并成功建立了抗PRV藥物的高通量篩選方法。該方法簡單直接、準確度高,適用于抗病毒藥物的初步大量篩選。基于該方法從天然產物庫1 621種藥物中篩選出3種SI較好的藥物,下一步將基于小鼠攻毒模型,在體內評估3種藥物的有效性和藥物毒性,并對藥物的抗病毒機制進行進一步解析。本研究為抗PRV藥物的篩選提供新的策略和思路,為未來人偽狂犬病腦炎的臨床治療提供新的科學依據。
4 結 論
本研究成功構建偽狂犬病病毒熒光標簽毒株,對構建重組毒株的增殖特性和遺傳穩定性進行評估,熒光標簽毒株PRV-mCherry與親本毒株在PK-15細胞上的增殖曲線趨勢一致,且熒光強度可反映病毒增殖情況,說明該毒株可應用于后期篩選試驗。基于構建的熒光標簽病毒,以熒光強度為指標,對天然產物庫中1 621種化合物進行抗病毒藥物篩選,成功篩選出3種可在體外有效抑制PRV增殖的藥物,根據測定的50%細胞毒性濃度和50%抑制濃度,計算出3種藥物的選擇指數范圍為203.63~564.58 μmol·L-1,表明其具有良好的成藥性。本研究為臨床防治PRV感染的抗病毒藥物發掘提供了新的策略和思路。
參考文獻(References):
[1] 姜 平, 董永毅, 許家榮, 等. 華東部分省市PRRS和豬偽狂犬病血清流行病學調查[J]. 畜牧與獸醫, 1999, 31(6):22-23.
JIANG P, DONG Y Y, XU J R, et al. Seroepidemiologic survey of PRRS and porcine pseudorabies in selected provinces and cities of East China[J]. Animal Husbandry and Veterinary Medicine, 1999, 31(6):22-23. (in Chinese)
[2] ITOH S, KOBAYASHI K, YONEDA N, et al. Clinical study of late potentials:comparison of late potentials in myocardial infarction, cardiomyopathy and idiopathic ventricular tachycardia[J]. Jpn Circ J, 1988, 52(1):21-29.
[3] WOZ'NIAKOWSKI G, SAMOREK-SALAMONOWICZ E. Animal herpesviruses and their zoonotic potential for cross-species infection[J]. Ann Agric Environ Med, 2015, 22(2):191-194.
[4] THOMFORD N E, SENTHEBANE D A, ROWE A, et al. Natural products for drug discovery in the 21st century:innovations for novel drug discovery[J]. Int J Mol Sci, 2018, 19(6):1578.
[5] VAN DE SAND L, BORMANN M, SCHMITZ Y, et al. Antiviral active compounds derived from natural sources against herpes simplex viruses[J]. Viruses, 2021, 13(7):1386.
[6] HOGUE I B, JEAN J, ESTEVES A D, et al. Functional carboxy-terminal fluorescent protein fusion to pseudorabies virus small capsid protein VP26[J]. J Virol, 2017, 92(1):e01193-17.
[7] PEDERSEN K, TURNAGE C T, GASTON W D, et al. Pseudorabies detected in hunting dogs in Alabama and Arkansas after close contact with feral swine (Sus scrofa)[J]. BMC Vet Res, 2018, 14(1):388.
[8] CHIARI M, FERRARI N, BERTOLETTI M, et al. Long-term surveillance of Aujeszky′s disease in the alpine wild boar (Sus scrofa)[J]. EcoHealth, 2015, 12(4):563-570.
[9] 曹明珠, 呂 林, 李玉峰, 等. 2018年山東省豬偽狂犬病野毒抗體流行病學調查[J]. 畜牧與獸醫, 2019, 51(5):128-130.
CAO M Z, L L, LI Y F, et al. Epidemiological investigation of swine serum antibody against gE of pseudorabies in Shandong Province in 2018[J]. Animal Husbandry amp; Veterinary Medicine, 2019, 51(5):128-130. (in Chinese)
[10] SEHL J, TEIFKE J P. Comparative pathology of pseudorabies in different naturally and experimentally infected species-a review[J]. Pathogens, 2020, 9(8):633.
[11] METTENLEITER T C. Pathogenesis of neurotropic herpesviruses:role of viral glycoproteins in neuroinvasion and transneuronal spread[J]. Virus Res, 2003, 92(2):197-206.
[12] SKINNER G R B, AHMAD A, DAVIES J A. The infrequency of transmission of herpesviruses between humans and animals;postulation of an unrecognised protective host mechanism[J]. Comp Immunol Microbiol Infect Dis, 2001, 24(4):255-269.
[13] MRAVAK S, BIENZLE U, FELDMEIER H, et al. Pseudorabies in man[J]. Lancet, 1987, 1(8531):501-502.
[14] LIU J B, CHEN C H, LI X D. Novel Chinese pseudorabies virus variants undergo extensive recombination and rapid interspecies transmission[J]. Transbound Emerg Dis, 2020, 67(6):2274-2276.
[15] LIU Q Y, WANG X J, XIE C H, et al. A novel human acute encephalitis caused by pseudorabies virus variant strain[J]. Clin Infect Dis, 2021, 73(11):e3690-e3700.
[16] FAN S Y, YUAN H X, LIU L, et al. Pseudorabies virus encephalitis in humans:a case series study[J]. J Neurovirol, 2020, 26(4):556-564.
[17] 趙偉麗, 烏依罕, 李紅芳, 等. 偽狂犬病毒腦炎臨床觀察與腦脊液二代測序鑒定[J]. 中華醫學雜志, 2018, 98(15):1152-1157.
ZHAO W L, WU Y H, LI H F, et al. Clinical experience and next-generation sequencing analysis of encephalitis caused by pseudorabies virus[J]. National Medical Journal of China, 2018, 98(15):1152-1157. (in Chinese)
[18] WANG D, TAO X G, FEI M M, et al. Human encephalitis caused by pseudorabies virus infection:a case report[J]. J Neurovirol, 2020, 26(3):442-448.
[19] WANG Y W, NIAN H, LI Z W, et al. Human encephalitis complicated with bilateral acute retinal necrosis associated with pseudorabies virus infection:A case report[J]. Int J Infect Dis, 2019, 89:51-54.
[20] YANG X, GUAN H Z, LI C, et al. Characteristics of human encephalitis caused by pseudorabies virus:A case series study[J]. Int J Infect Dis, 2019, 87:92-99.
[21] ZHENG L H, LIU X J, YUAN D Q, et al. Dynamic cerebrospinal fluid analyses of severe pseudorabies encephalitis[J]. Transbound Emerg Dis, 2019, 66(6):2562-2565.
[22] YANG H N, HAN H, WANG H, et al. A case of human viral encephalitis caused by pseudorabies virus infection in China[J]. Front Neurol, 2019, 10:534.
[23] HU F, WANG J W, PENG X Y. Bilateral necrotizing retinitis following encephalitis caused by the pseudorabies virus confirmed by next-generation sequencing[J]. Ocul Immunol Inflamm, 2021, 29(5):922-925.
[24] AI J W, WENG S S, CHENG Q, et al. Human endophthalmitis caused by pseudorabies virus infection, China, 2017[J]. Emerg Infect Dis, 2018, 24(6):1087-1090.
[25] VERPOEST S, CAY B, FAVOREEL H, et al. Age-dependent differences in pseudorabies virus neuropathogenesis and associated cytokine expression[J]. J Virol, 2017, 91(2):e02058-16.
[26] STANGHERLIN L M, DE PAULA F N, ICIMOTO M Y, et al. Positively selected sites at HCMV gB furin processing region and their effects in cleavage efficiency[J]. Front Microbiol, 2017, 8:934.
[27] WONG G, LU J H, ZHANG W H, et al. Pseudorabies virus:a neglected zoonotic pathogen in humans?[J]. Emerg Microbes Infect, 2019, 8(1):150-154.
[28] LAVAL K, ENQUIST L W. The neuropathic itch caused by pseudorabies virus[J]. Pathogens, 2020, 9(4):254.
[29] WHITLEY R J, ROIZMAN B. Herpes simplex virus infections[J]. Lancet, 2001, 357(9267):1513-1518.
[30] JIANG Y C, FENG H, LIN Y C, et al. New strategies against drug resistance to herpes simplex virus[J]. Int J Oral Sci, 2016, 8(1):1-6.
[31] THOMAS E, STEWART L E, DARLEY B A, et al. Plant-based natural products and extracts:Potential source to develop new antiviral drug candidates[J]. Molecules, 2021, 26(20):6197.
[32] YANG Y, HAN J, MA Y L, et al. Demethylzeylasteral inhibits cell proliferation and enhances cell chemosensitivity to 5-fluorouracil in Colorectal Cancer cells[J]. J Cancer, 2020, 11(20):6059-6069.
[33] LV H W, JIANG L P, ZHU M D, et al. The genus Tripterygium:A phytochemistry and pharmacological review[J]. Fitoterapia, 2019, 137:104190.
[34] ZHU Z L, QIU X D, WU S, et al. Blocking effect of demethylzeylasteral on the interaction between human ACE2 protein and SARS-CoV-2 RBD protein discovered using SPR technology[J]. Molecules, 2021, 26(1):57.
[35] HARTWELL D, JONES J, LOVEMAN E, et al. Topotecan for relapsed small cell lung cancer:A systematic review and economic evaluation[J]. Cancer Treat Rev, 2011, 37(3):242-249.
[36] ZHAI H Y, HU S Y, LIU T X, et al. Nitidine chloride inhibits proliferation and induces apoptosis in colorectal cancer cells by suppressing the ERK signaling pathway[J]. Mol Med Rep, 2016, 13(3):2536-2542.
(編輯 白永平)

