O型口蹄疫Cathay拓撲型病毒單抗制備及雙抗體夾心ELISA方法的初步建立

摘 要: 本研究旨在純化O型口蹄疫Cathay拓撲型病毒抗原,并制備單克隆抗體,為口蹄疫新型Cathay毒株的研究提供生物材料。PEG沉淀法純化O型口蹄疫Cathay毒株抗原,免疫BALB/c小鼠,取脾細胞與SP2/0細胞融合制備雜交瘤細胞,用間接ELISA方法篩選陽性細胞,有限稀釋法進行亞克隆,獲得2株能夠穩定分泌特異性針對O型口蹄疫Cathay株病毒單克隆抗體的雜交瘤細胞,分別命名為10E6與11C7。疊加試驗表明,兩株單抗的疊加率為49.45%,識別不同的抗原表位。間接ELISA和IFA試驗顯示,兩株單抗與O型口蹄疫Cathay株病毒具有良好的反應性。單抗特異性檢測結果表明,2株單抗均能特異性識別Cathay株口蹄疫病毒,不與其他口蹄疫病毒毒株交叉反應。抗體亞型鑒定結果顯示,10E6單抗的輕鏈為Kappa鏈,11C7單抗的輕鏈為Lamda鏈,兩株單抗重鏈類型均為IgG2a。結果表明,本研究成功制備了兩株特異性結合O型口蹄疫Cathay拓撲型病毒的單克隆抗體,兩株單抗均具有良好的反應性與特異性。應用兩株單抗建立O型口蹄疫Cathay病毒的雙抗體夾心ELISA檢測方法,該ELISA檢測方法特異性、重復性和敏感性良好,為O型口蹄疫Cathay毒株的快速診斷防控與研究建立了基礎。
關鍵詞: O型口蹄疫病毒;Cathay拓撲型;雜交瘤細胞;單克隆抗體;ELISA
中圖分類號: S852.659.6;S854.43
文獻標志碼:A 文章編號: 0366-6964(2024)09-4012-09
Preparation of Monoclonal Antibody against Cathay Topotype of FMDV Type O and Development
of Double Antibody Sandwich ELISA for Cathay Topotype of FMDV Type O
LIAO" Huancheng, SHI" Zhengwang, LUO" Juncong, WANG" Wanying, FENG" Lu, ZHOU" Jing, ZHANG" Fan, SHI" Xintai, TIAN" Hong*
(State Key Laboratory for Animal Disease Control and Prevention, College of Veterinary Medicine,
Lanzhou University, Lanzhou Veterinary Research Institute,
Chinese Academy of Agricultural Sciences, Lanzhou 730000," China)
Abstract:" This study aimed to purify the cathay topotype of foot-and-mouth disease virus (FMDV) type O and prepare monoclonal antibody to provide biological materials for the study of novel cathay strain of foot-and-mouth disease. The antigen of cathay strain of FMDV type O was purified by PEG precipitation method and immunized BALB/c mice. Hybridoma cells were prepared by fusion of spleen cells and SP2/0 cells. Positive cells were screened by indirect ELISA and subcloned by limited dilution method. Two hybridoma cells, named 10E6 and 11C7, which were able to secrete monoclonal antibodies specifically against O-type FMDV Cathay strain were obtained. Additivity assay showed that the additivity rate of the two mAbs was 49.45%, and different epitopes were identified.Indirect ELISA and IFA showed that the two strains had good reactivity with O-type FMDV Cathay strain. The results of monoclonal antibody detection showed that the two monoclonal antibodies could specifically recognize Cathay FMDV strains and did not cross-react with other FMDV strains. The results of antibody subtype identification showed that the light chain of 10E6 monoclonal antibody was Kappa chain, the light chain of 11C7 monoclonal antibody was Lamda chain, and the heavy chain type of both strains was IgG2a. The results showed that two monoclonal antibodies specifically binding to O-type FMDV Cathay topological strain were successfully prepared in this study. Both monoclonal antibodies had good reactivity and specificity. Two monoclonal antibodies were used to establish a double antibody sandwich ELISA method for detecting O-type FMDV Cathay strain. The ELISA method had good specificity, repeatability and sensitivity, which laid a foundation for the rapid diagnosis, control and research of O-type foot and mouth disease virus Cathay strain.
Key words: foot-and-mouth disease virus type O; Cathay topotype; hybridoma cells; monoclonal antibody; ELISA
*Corresponding author:" TIAN Hong, E-mail: xibeitian0931@163.com
口蹄疫(foot-and-mouth disease virus, FMD)是由口蹄疫病毒(foot-and-mouth disease virus, FMDV)引起的一種急性、熱性、高度接觸性傳染的動物疫病,可快速遠距離傳播[1-4]。FMDV是小RNA病毒科(Picornaviridae)、口蹄疫病毒屬(Aphthovirus)的成員之一,包括7個血清型,即O、A、C、亞洲1型(Asia I)、南非(Southern African Territories, SAT)1、2、3型[5]。FMDV具有極高的突變率,在復制和傳播到新地區時迅速分化,血清型間沒有免疫交叉現象,即便在同一血清型內,不同毒株的抗原性仍相差較大[6-8]。FMDV的分型主要以VP1基因的相似性為標準,同一血清型在不同的地理區域獨立進化,產生不同的遺傳譜系而被分為不同的拓撲型[5,9-10]。其中,O型FMDV已經被定義了11種拓撲型[11],抗原的多樣性給口蹄疫防控工作帶來了巨大困難。
FMDV在國際上主要在非洲、亞洲及南美洲部分地區流行[12-14]。近年來,因境外毒株傳入,造成中國口蹄疫疫情多發、流行毒株復雜的態勢。2017—2022年,中國共報道口蹄疫疫情54次,其中,O型51次,A型3次,以O型口蹄疫為主[15]。在我國流行的O型FMDV主要是古典中國(Cathay)、泛亞(Pan Asia)及東南亞(SEA)3種拓撲型。其中,口蹄疫Cathay拓撲型病毒在1970年和2005年左右,曾在我國先后流行并逐漸平穩,2010年,O/Mya-98流行后,O/Cathay毒株已經很少出現。但2016年以來,該毒逐漸增多,并且上升為主要危害毒株。2018年,O型Cathay毒株引起8次疫情,2020與2021年,亦引起了疫情發生。經系統進化樹分析,2016年以來,流行的口蹄疫Cathay拓撲型病毒相較于以前流行的病毒差異很大,是Cathay拓撲型病毒一個新的可以穩定遺傳的進化分支[16]。國際上口蹄疫Cathay拓撲型病毒主要在東亞-東南亞循環存在并流行[17-19],且國內外毒株的相似性均低于95%,據此不足以認定國內新毒株是由國外傳入或由國內演化而來。同時,越南2017—2019年不同省份分離的Cathay毒株和越南舊毒株的相似性也同樣較低[20],變異后的O型口蹄疫Cathay拓撲型病毒從國外傳入的風險仍然需要重視[21]。據相關研究表明,國內現有疫苗毒株與新Cathay毒株的r值已低于0.3,國內O型疫苗對新毒株的保護力和匹配性呈現下降趨勢,現有疫苗已經不能為新Cathay毒株提供保護。Cathay新毒株與國內其他流行毒株差異大,存在抗原變異,國外流行情況復雜,對O型口蹄疫Cathay拓撲型病毒的研究已成為FMDV防治的重中之重。目前,對Cathay新毒株的認識仍處于初步階段,應臨床檢測的實際需求,需開發特異性針對Cathay新毒株的單抗,為口蹄疫Cathay新毒株的防控提供技術支撐。
本研究制備并鑒定了2株特異性識別O型口蹄疫Cathay病毒的單克隆抗體,并建立了O型口蹄疫Cathay病毒的雙抗體夾心ELISA檢測方法,為防治新Cathay株口蹄疫病毒建立監控體系提供參考,并為進一步研究Cathay新毒株的抗原變異提供生物材料。
1 材料與方法
1.1 細胞、病毒和實驗動物
本研究使用的骨髓瘤細胞系SP2/0細胞、BHK-21細胞、口蹄疫O/Cathay、O/MYA98、O/BY/2010、OZK/93、O/HNXX/2013、O/JX/2010、AF/72、A/GDMM/2013與A/WH/09毒株均由蘭州獸醫研究所家畜病原學國家重點實驗室保存;所有細胞均于37℃、一定濕度、5% CO2的細胞培養箱中培養;SPF級雌性6~8周齡 BALB/c小鼠由蘭州獸醫研究所實驗動物中心提供;動物試驗嚴格按照《中華人民共和國動物倫理學程序和準則》的規范進行處理,并經中國農業科學院蘭州獸醫研究所動物管理與倫理委員會批準。
1.2 試驗耗材和試劑
PBS、弗氏完全佐劑、弗氏不完全佐劑、聚乙二醇(PEG) 1500溶液、HAT、HT均購自Sigma公司;IPTG、氨芐青霉素、卡那霉素均購自Solarbio公司;青霉素/鏈霉素/兩性霉素B溶液(三抗)、DMEM、RPMI 1640、FBS均購自Gibco公司。ELISA酶標反應板購自Costar公司;抗體稀釋液購自百迪泰公司;TMB購自SurModics公司;Hybridoma Feeder添加因子(CM-2001)購自蘇州博奧龍公司;Goat Anti-Mouse IgG Hamp;L (HRP) (ab205719)與Goat Anti-Mouse IgG Hamp;L (FITC) (ab6785)購自Abcam公司。小鼠單克隆抗體亞型鑒定試劑盒(PK20002)購自Proteintech Group公司;HRP標記試劑盒購自Roche公司;兔抗O型口蹄疫病毒多抗血清由本實驗室制備并保存;其他試劑均為進口分裝或國產分析純。
1.3 單克隆抗體的制備
1.3.1 口蹄疫病毒粒子的富集純化
將收集好的滅活病毒懸液4℃,8 000 r·min-1離心90 min,除去病毒懸液中的細胞碎片;取上清加入8%的PEG6000,4 ℃攪拌過夜,沉淀病毒粒子;攪拌好的液體8 000 r·min-1離心60 min,棄去上清液,適量PBS (pH=7.6)緩沖液重懸沉淀,-80℃儲存備用。
1.3.2 雜交瘤細胞制備及間接ELISA檢測
取純化后的口蹄疫Cathay病毒與弗氏完全佐劑1∶1混合乳化后,采用背部皮下分點注射的方法以100 μg·只-1的劑量免疫6~8周齡的BALB/c小鼠。用弗氏不完全佐劑以相同的方式乳化病毒并免疫小鼠進行二免和三免,每次免疫間隔14 d。用間接ELISA對首免前以及三免后兩周的小鼠血清進行效價檢測,以首免前血清為陰性對照,將免疫血清S/Ngt;2.1時所對應的稀釋度定為抗體效價。融合前3 d,對免疫效價最高的1只小鼠通過腹腔注射200 μg純化口蹄疫Cathay病毒粒子(未乳化)進行加強免疫。
培養SP2/0細胞,在融合前一周復蘇凍存的SP2/0細胞,當細胞匯合度達到70%~90%時進行傳代培養,在融合前使細胞處于對數生長期。融合前對小鼠進行眼球采血并分離陽性血清;使用PEG1500融合小鼠脾細胞與SP2/0細胞,融合后的細胞分散至96孔細胞培養板中,于含20% FBS、1%三抗、2% HAT、10%生長添加因子的RPMI 1640培養基中培養;融合后7~10 d觀察細胞狀態,當雜交瘤細胞克隆群生長至一定數量后每孔吸取50 μL細胞上清進行間接ELISA檢測,選擇檢測結果為強陽性的細胞孔進行有限稀釋法亞克隆。亞克隆后的細胞在含20% FBS、1%三抗、2% HT、10%生長因子的RPMI 1640培養基中培養;為保證克隆后的細胞群來源于單個細胞且遺傳穩定,共亞克隆三次仍為陽性細胞后定株。
使用兔抗捕獲O型口蹄疫Cathay病毒粒子進行間接ELISA檢測:1)將兔抗O型口蹄疫病毒多抗1∶2 000稀釋至碳酸包被緩沖液(pH 9.6)中,50 μL·孔-1,4 ℃包被聚苯乙烯板12 h。棄液,PBST洗板4次并拍干;2)將純化后的口蹄疫Cathay病毒粒子1∶1 000稀釋至PBS (pH=7.6)緩沖液中,50 μL·孔-1加入ELISA板中4℃捕獲12 h。棄液,洗滌方法同上;3)每孔加入120 μL 1% BSA封閉液4℃封閉10 h,棄液,洗滌方法同上;4)加入50 μL雜交瘤細胞上清,37℃孵育30 min,棄液,同上方法洗滌;5)加入50 μL HRP標記的鼠二抗(1∶15 000),37℃孵育30 min,棄液,同上方法洗滌;6)每孔加入50 μL TMB,37℃避光孵育12 min;7)每孔加入50 μL終止液終止反應,OD450 nm讀值。
1.3.3 疊加試驗
為確定單抗識別的抗原表位是否一致,使用雜交瘤細胞上清進行間接ELSIA疊加試驗。按照以下公式計算疊加系數(additvity index, AI):
AI=2A(1+2)/(A1+A2)- 1
A1、A2和A(1+2)分別為單抗1、單抗2和單抗1疊加單抗2分別進行間接ELISA的OD450nm值。當疊加率AI%的值大于40%時,判定為兩株單抗識別不同的抗原結合位點。
1.3.4 腹水制備及單抗純化
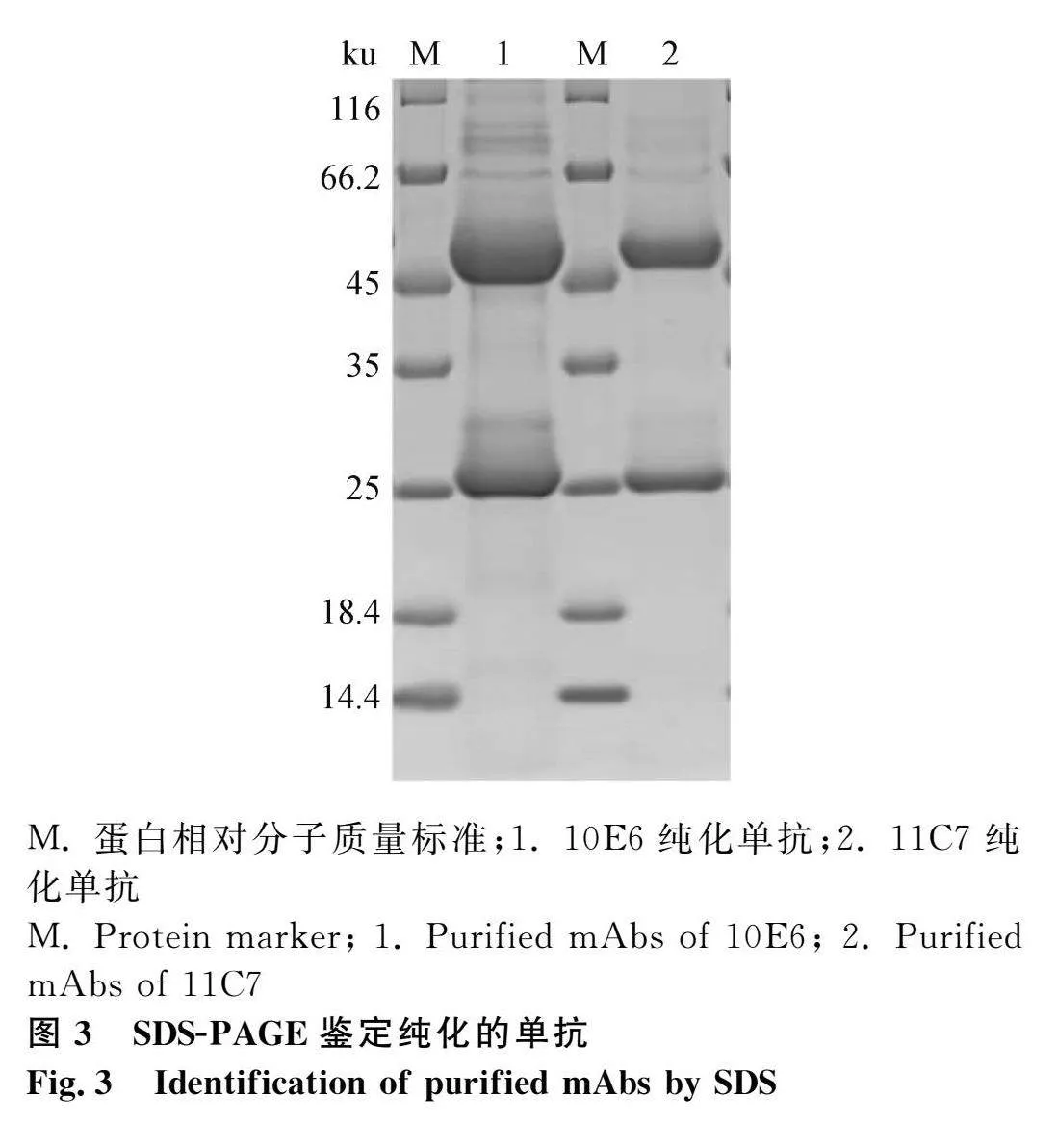
將定株細胞擴大培養后腹腔注射弗氏不完全佐劑預處理10 d的小鼠體內,注射7 d后采集腹水,并用正辛酸-飽和硫酸銨法沉淀純化抗體,純化后的抗體透析至PBS (pH=7.6)緩沖液中,-40 ℃保存。純化后的單抗使用SDS-PAGE電泳檢測單抗純度。
1.3.5 單抗效價檢測
將腹水純化的單克隆抗體作為一抗,從1∶1 000開始連續2倍稀釋至1∶2 048 000,將一個無關單抗設為陰性對照進行間接ELISA檢測。當陰性對照OD450 nmlt;0.2,S/Ngt;2.1時將對應的最大稀釋倍數作為單抗效價。
1.3.6 單抗特異性鑒定
將腹水純化后的單抗分別與O型口蹄疫Cathay病毒、O型口蹄疫病毒、A型口蹄疫病毒進行間接ELISA檢測,鑒定獲得單抗的特異性。
1.3.7 間接免疫熒光(IFA)
為驗證單抗與O型口蹄疫Cathay株病毒的反應性,對感染Cathay株病毒的BHK-21細胞進行IFA試驗,使用未感染病毒的細胞作為對照組。在試驗組感染48 h后,用4%多聚甲醛冷凍固定細胞20 min,然后,用0.1% Triton通透細胞膜并用5% BSA封閉。每個步驟之間用PBS洗滌3次。用PBS 1∶1 000稀釋純化單抗,37 ℃避光孵育2 h。洗滌后,用PBS 1∶200稀釋FITC標記的鼠二抗,37℃孵育1 h。細胞核用DAPI (1∶2 000, Beyotime Biotechnology, China)染色,使用EVOS FL熒光顯微鏡(賽默飛世爾科學公司)進行成像。
1.3.8 單抗亞類鑒定
按照抗體亞類鑒定試劑盒說明書進行亞類鑒定。
1.4 雙抗體夾心ELISA檢測方法的建立
1.4.1 酶標單抗的制備
將純化的11C7單克隆抗體按照HRP標記試劑盒說明書進行標記。
1.4.2 包被單抗與檢測單抗稀釋度的確定
將純化的10E6單抗作為包被單抗,分別以25、50、100、150 ng·孔-14個包被濃度4℃包被酶標板過夜。將HRP標記的11C7單抗作為檢測單抗分別以1∶8 000、1∶12 000、1∶16 000、1∶20 000 4個稀釋度進行稀釋,以O/Cathay滅活病毒懸液作為檢測抗原,以未接毒細胞懸液作為陰性對照進行檢測,根據檢測結果的OD450 nm值計算P/N值,確定最佳單抗包被濃度與最佳單抗檢測稀釋度。
1.4.3 最佳反應條件的確定
用最佳包被單抗與檢測單抗稀釋度,在不同反應條件下,對包被條件(37℃包被2 h、4℃包被過夜)、封閉條件(37℃封閉60、90、120 min和4 ℃封閉10 h)、檢測樣品孵育時間(15、30、45 min)、底物(TMB)孵育時間(8、10、12、15 min)進行篩選,檢測單抗反應時間設置為30 min,檢測方法同上,根據檢測結果的OD450 nm值計算P/N值,確定最佳反應條件。
1.4.4 敏感性試驗
按照已經確立的雙抗體夾心ELISA方法的操作程序,對2×、4×、8×、16×、32×、64×、128×、256×、562×稀釋后的O/Cathay病毒懸液(TCID50=10-6.0·0.1 mL-1)進行檢測,PBS作為空白對照組,根據檢測結果評價該方法的敏感性。
1.4.5 特異性試驗
按照已經確立的雙抗體夾心ELISA方法的操作程序,分別對FMDV O/Cathay、O/MYA98、AF/72、A/WH/09病毒懸液(10×稀釋)進行檢測,根據結果評價該方法的特異性。
1.4.6 重復性試驗
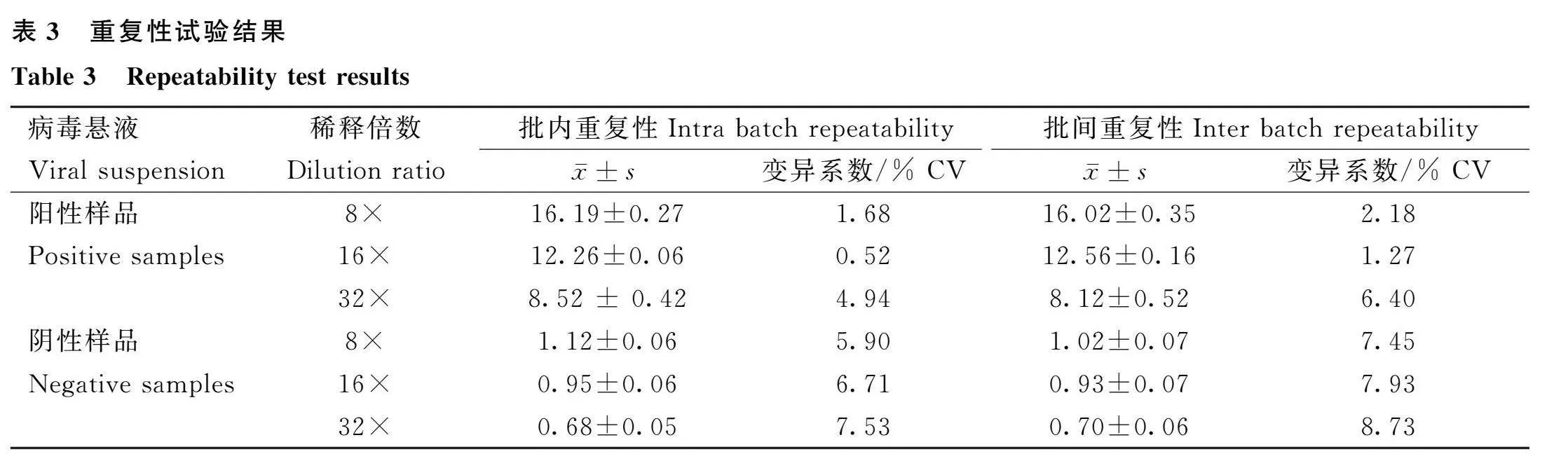
取不同批次的酶標板各4個,分別檢測8×、16×、32×稀釋的FMDV O/Cathay病毒抗原和8×、16×、32×稀釋的FMDV O/MYA98病毒抗原,每個稀釋度設置4個重復,在同一塊酶標板上進行批內重復,不同酶標板間進行批間重復,測定OD450 nm,計算變異系數。
2 結 果
2.1 免疫效價的檢測
滅活后的O型口蹄疫Cathay病毒抗原經過PEG沉淀法純化。純化后的抗原乳化并免疫小鼠,三免后用間接ELISA對3只小鼠的血清進行檢測。結果顯示,1號小鼠免疫后的抗體效價最高,可達1∶128 000,故選用1號小鼠脾用作細胞融合。
2.2 雜交瘤陽性細胞株的篩選
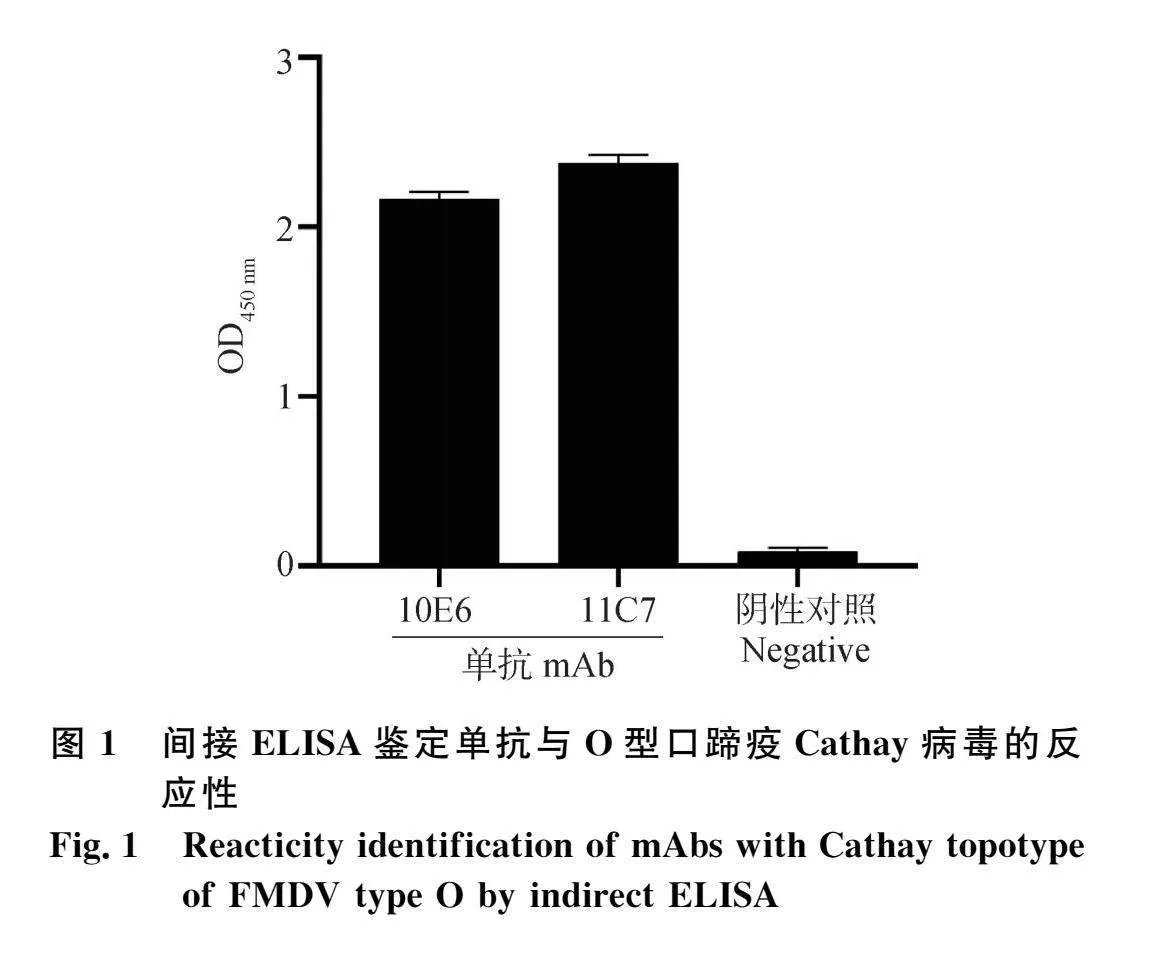
用間接ELISA檢測雜交瘤細胞株上清,3次亞克后獲得10E6、11C7兩株穩定分泌抗O型口蹄疫Cathay病毒的雜交瘤細胞株。間接ELISA結果顯示,2株單抗均與O型口蹄疫Cathay病毒有良好的反應性(圖1)。
2.3 抗原結合位點分析
疊加試驗顯示(表1),10E6單抗與11C7單抗的AI%在40%以上,說明兩株單抗識別不同的抗原結合位點。
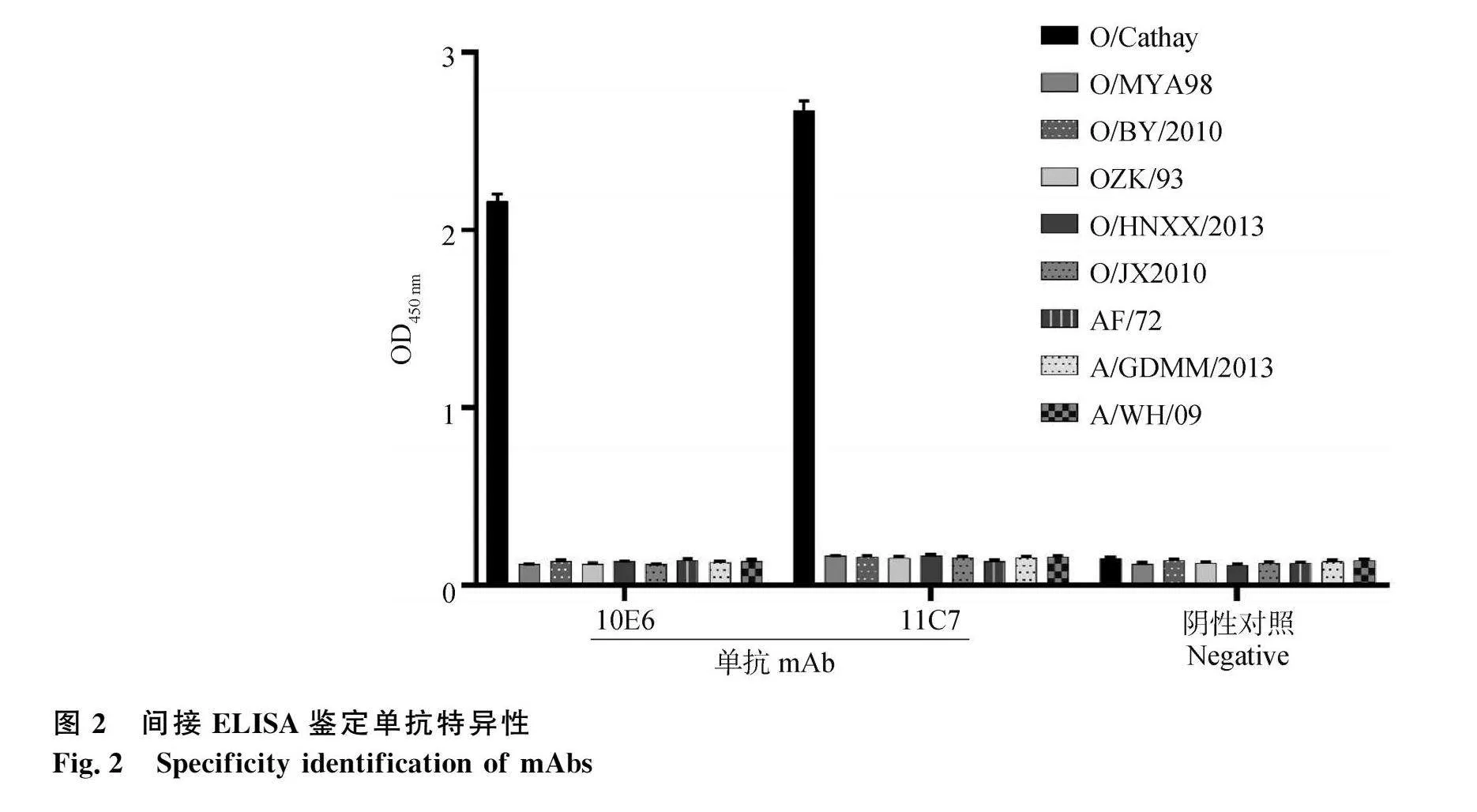
2.4 單抗特異性鑒定
應用間接ELISA對單抗細胞上清與不同的口蹄疫毒株進行特異性鑒定。結果顯示(圖2),兩株單抗均與O型口蹄疫Cathay毒株有良好的反應性,而不與口蹄疫O/MYA98、O/BY/2010、OZK/93、O/HNXX/2013、O/JX/2010、AF/72、A/GDMM/2013、A/WH/09毒株發生反應,表明兩株單抗均具有良好的特異性。
2.5 腹水單抗純化及效價測定
用SDS-PAGE鑒定純化的腹水單抗,結果顯示,在50和25 ku左右分別出現單抗的重鏈和輕鏈(圖3),且純度均較高。腹水純化獲得的單抗經間接ELISA測定效價,10E6單抗效價達到1∶2 048 000,11C7單抗效價達到1∶512 000。
2.6 單抗的IFA檢測
使用純化后單抗對O型口蹄疫Cathay病毒感染后的細胞進行IFA檢測,結果顯示(圖4),兩株單抗均與病毒感染后的細胞有良好反應,制備的單克隆抗體可用于O型口蹄疫Cathay病毒的IFA檢測。
2.7 單抗亞類鑒定
根據抗體亞類鑒定試劑盒說明書對純化單克隆抗體進行檢測,結果顯示,10E6單抗的輕鏈為Kappa鏈,11C7單抗的輕鏈為Lamda鏈,兩株單抗重鏈類型均為IgG2a。
2.8 雙抗體夾心ELISA檢測方法的建立
最佳單抗包被濃度為50 ng·孔-1(10E6),最佳單抗檢測濃度為1∶12 000(11C7-HRP);最佳包被條件為4 ℃過夜;最佳封閉條件為4℃封閉10 h;最佳樣品孵育時間為30 min;檢測單抗反應時間設為30 min;最佳底物反應時間為12 min。
2.9 雙抗體夾心ELISA檢測方法的特異性試驗
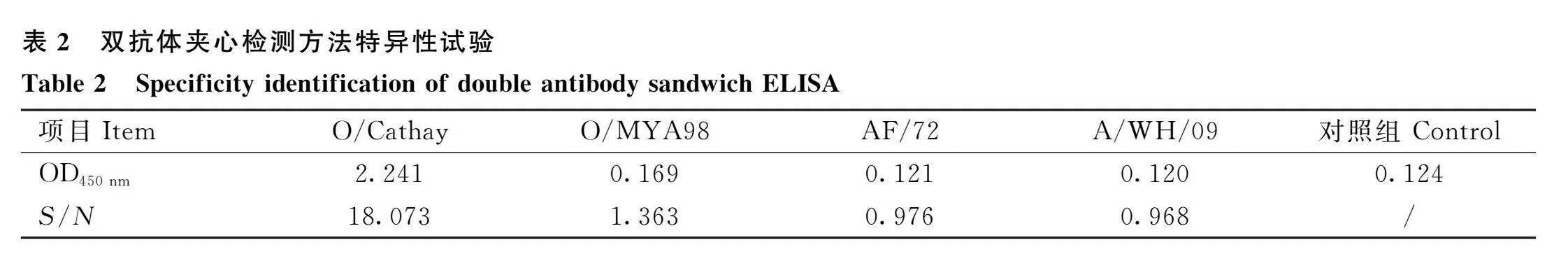
按照已經確立的雙抗體夾心ELISA操作程序,對FMDV O/Cathay、O/MYA98、AF/72、A/WH/09毒株進行檢測,結果表明(表2),建立的ELISA檢測方法與其他FMDV病原均無交叉反應,而與O/Cathay病毒抗原反應,特異性良好。
2.10 雙抗體夾心ELISA檢測方法的敏感性和重復性試驗
用建立的雙抗體夾心ELISA操作程序,對O/Cathay病毒抗原(TCID50=10-6.0·0.1 mL-1)進行2倍倍比稀釋后檢測,結果顯示該方法的最低檢出稀釋比例為1∶256。本試驗建立的雙抗體夾心ELSIA檢測方法的批間與批內重復性均小于10%,證明試驗建立的雙抗體夾心ELISA檢測方法的重復性良好(表3)。
3 討 論
口蹄疫是偶蹄動物易感的急性、高度傳染性疾病,被列為我國重大動物傳染病。我國對口蹄疫采用疫苗免疫、持續監測的防控手段。O型口蹄疫Cathay毒株是近年來危害我國養豬業的主要口蹄疫病毒流行毒株,且病毒存在較大變異,其主要表現:1)以VP1基因為主的核苷酸序列與其他流行毒株的差異較大,已形成新的進化分支;2)疫苗免疫豬血清對O/Cathay毒株的田間分離毒株中和效價低,甚至出現不匹配現象;3)動物攻毒保護試驗結果表明O型口蹄疫疫苗對O/Cathay毒株保護力出現下降趨勢。而毒株特異單抗的研究可以為FMDV型內不同毒株的臨床診斷以及病毒抗原變異研究提供生物材料,對新毒株的防控有重要意義。
雜交瘤細胞的選擇培養與亞克隆是單抗細胞株制備的關鍵[22],由于選擇培養后的細胞的抗逆性差且分裂活性低,往往需要提前采取動物腹腔巨噬細胞制備飼養層細胞為雜交瘤細胞提供增殖環境。但飼養層細胞需多次從活體動物體內采取,其制備繁瑣、質量具有隨機性且容易增加細胞污染的概率。有研究表明飼養層細胞的促細胞生長作用可能來源于飼養層細胞分泌的以細胞生長因子為主的細胞因子[23],胎牛血清提供的營養成分的多少對培養雜交瘤細胞同樣重要[24],本研究在細胞選擇培養和亞克隆階段采用人為添加生長因子和增加血清濃度的方式代替傳統飼養層細胞,雜交瘤細胞存活率明顯提升且由單個細胞分裂為足量細胞群落的時間從兩周縮短為一周,有效提升了單克隆細胞株制備的效率。
目前,O型口蹄疫Cathay病毒單克隆抗體的制備與ELISA檢測方法未見報道。本研究純化了O型口蹄疫Cathay毒株抗原,并制備篩選了2株針對O/Cathay毒株的單克隆抗體(10E6、11C7)。間接ELISA與IFA試驗顯示,2株單克隆抗體均與口蹄疫Cathay毒株具有良好的反應活性;單抗特異性鑒定顯示,兩株單抗與其他不同型的口蹄疫病毒毒株均不存在交叉反應,具有良好的特異性。疊加試驗表明,兩株單抗識別不同的抗原識別位點,其中,10E6單抗的輕鏈為Kappa鏈,11C7單抗的輕鏈為Lamda鏈,兩株單抗的重鏈類型均為IgG2a。本研究通過兩株單克隆抗體分別作為包被單抗與檢測單抗建立了O型口蹄疫Cathay病毒的雙抗體夾心ELISA檢測方法。使用本試驗建立的雙抗體夾心ELISA檢測方法檢測O型口蹄疫Cathay病毒的敏感性和重復性好,通過本試驗建立的方法檢測其他血清型的口蹄疫病毒未發生交叉反應,證明該方法具有良好的特異性。使用HRP標記檢測單抗,和預包被捕獲單抗并封閉的酶標板進行檢測,只需72 min即可得出結果,有利于快速檢測O型口蹄疫Cathay病毒。
4 結 論
本研究成功制備了2株特異性針對O型口蹄疫Cathay拓撲型病毒的單克隆抗體,并建立了O型口蹄疫Cathay病毒的雙抗體夾心ELISA檢測方法,該方法具有良好的特異性、敏感性和重復性,為O型口蹄疫Cathay拓撲型病毒的防治奠定了基礎,為研究O/Cathay株口蹄疫病毒的抗原變異提供了潛在工具。
參考文獻(References):
[1] 周衛松, 周國梅. 豬口蹄疫的臨床癥狀及防治[J]. 獸醫導刊, 2021(15):12-13.
ZHOU W S, ZHOU G M. Clinical symptoms and prevention of swine foot-and-mouth disease[J]. Veterinary Orientation, 2021(15):12-13. (in Chinese)
[2] 趙家昌, 俞 挺, 孫建國, 等. 口蹄疫流行現狀及防控措施[J]. 山東畜牧獸醫, 2023, 44(8):42-45, 49.
ZHAO J C, YU T, SUN J G, et al. Epidemic status and prevention and control measures of foot-and-mouth disease[J]. Shandong Journal of Animal Science and Veterinary Medicine, 2023, 44(8):42-45, 49. (in Chinese)
[3] GRUBMAN M J, BAXT B. Foot-and-mouth disease[J]. Clin Microbiol Rev, 2004, 17(2):465-493.
[4] RANJAN R, BISWAL J K, SHARMA G K, et al. A review on foot-and-mouth disease:pathology, diagnosis and its management[J]. Indian J Vet Pathol, 2016, 40(2):105-115.
[5] KNOWLES N J, SAMUEL A R. Molecular epidemiology of foot-and-mouth disease virus[J]. Virus Res, 2003, 91(1):65-80.
[6] PATON D J, VALARCHER J F, BERGMANN I, et al. Selection of foot and mouth disease vaccine strains--a review[J]. Rev Sci Tech, 2005, 24(3):981-993.
[7] PARIDA S. Vaccination against foot-and-mouth disease virus: strategies and effectiveness[J]. Expert Rev Vaccines, 2009, 8(3):347-365.
[8] MATTION N, K NIG G, SEKI C, et al. Reintroduction of foot-and-mouth disease in Argentina:characterisation of the isolates and development of tools for the control and eradication of the disease[J]. Vaccine, 2004, 22(31-32):4149-4162.
[9] 姚懷兵, 趙 毅, 王金泉, 等. O型口蹄疫病毒不同宿主適應毒株P1和3A基因的差異分析[J]. 畜牧獸醫學報, 2017, 48(5):881-888.
YAO H B, ZHAO Y, WANG J Q, et al. Studies on variations of P1 and 3A genes of different hosts-adapted strains type O foot-and-mouth diease virus[J]. Acta Veterinaria et Zootechnica Sinica, 2017, 48(5):881-888. (in Chinese)
[10] 李平花, 白興文, 孫 普, 等. 豬O型口蹄疫基因工程疫苗候選株的構建及其免疫原性分析[J]. 畜牧獸醫學報, 2011, 42(11):1562-1569.
LI P H, BAI X W, SUN P, et al. Construction of genetically engineered vaccine candidate of type O foot-and-mouth-disease virus of pig and analysis of its immunogenicity[J]. Acta Veterinaria et Zootechnica Sinica, 2011, 42(11):1562-1569. (in Chinese)
[11] SAMUEL A R, KNOWLES N J. Foot-and-mouth disease type O viruses exhibit genetically and geographically distinct evolutionary lineages (topotypes)[J]. J Gen Virol, 2001, 82(3):609-621.
[12] KOUATO B S, DE CLERCQ K, ABATIH E, et al. Review of epidemiological risk models for foot-and-mouth disease: Implications for prevention strategies with a focus on Africa[J]. PLoS One, 2018, 13(12): e0208296.
[13] MITIKU T, GAREDEW L, ZEMENE M, et al. A review on foot and mouth disease and its current status in Ethiopia[J]. World Rural Observ, 2016;8(4):89-99.
[14] BOUGUEDOUR R, RIPANI A. Review of the foot and mouth disease situation in North Africa and the risk of introducing the disease into Europe[J]. Rev Sci Tech, 2016, 35(3):757-768.
[15] RWEYEMAMU M, ROEDER P, MACKAY D, et al. Epidemiological patterns of foot-and-mouth disease worldwide[J]. Transbound Emerg Dis, 2008, 55(1):57-72.
[16] 何繼軍, 馬維民, 呂 律, 等. 2017—2022年中國口蹄疫流行狀況分析[J]. 微生物學報, 2023, 63(10):3955-3966.
HE J J, MA W M, L L, et al. Epidemiological characteristics of foot-and-mouth disease in China between 2017 and 2022[J]. Acta Microbiologica Sinica, 2023, 63(10):3955-3966. (in Chinese)
[17] BRITO B, PAUSZEK S J, HARTWIG E J, et al. A traditional evolutionary history of foot-and-mouth disease viruses in Southeast Asia challenged by analyses of non-structural protein coding sequences[J]. Sci Rep, 2018, 8(1):6472.
[18] BRITO B P, RODRIGUEZ L L, HAMMOND J M, et al. Review of the global distribution of foot-and-mouth disease virus from 2007 to 2014[J]. Transbound Emerg Dis, 2017, 64(2):316-332.
[19] KNIGHT-JONES T J D, ROBINSON L, CHARLESTON B, et al. Global foot-and-mouth disease research update and gap analysis: 1-overview of global status and research needs[J]. Transbound Emerg Dis, 2016, 63(1):3-13.
[20] VIERRA D, BERTRAM M R, PALINSKI R M, et al. Foot-and-mouth disease virus serotype O/CATHAY genome sequences from five outbreaks in vietnam, 2017 to 2019[J]. Microbiol Resour Announc, 2020, 9(5):e01315-19.
[21] SUTMOLLER P, OLASCOAGA R C. The risks posed by the importation of animals vaccinated against foot and mouth disease and products derived from vaccinated animals:a review[J]. Rev Sci Tech, 2003, 22(3):823-835.
[22] GREENFIELD E A. Single-cell cloning of hybridoma cells by limiting dilution[J]. Cold Spring Harb Protoc, 2019, 2019(11): 31676581.
[23] GREENFIELD E A. Preparing feeder cell cultures to support hybridoma growth[J]. Cold Spring Harb Protoc, 2019, 2019(11): 31676580.
[24] GREENFIELD E A. Screening for good batches of fetal bovine serum for myeloma and hybridoma growth[J]. Cold Spring Harb Protoc, 2018, 2018(3): 29496821.
(編輯 白永平)

