干擾素調節因子敲減細胞系的構建及其對豬偽狂犬病病毒增殖的影響


摘 要: 旨在揭示干擾素調節因子(interferon regulatory factor,IRFs)對豬偽狂犬病病毒(pseudorabies virus,PRV)增殖的影響,本研究通過shRNA技術構建敲減IRF1-9的PK15細胞系,并檢測其敲減效率。采用流式細胞術以及滴度測定檢測敲減IRF1-9后PRV的增殖情況;利用RT-qPCR技術檢測PRV感染細胞后PRV-gB、IFN-β、ISG-15和IL-6的mRNA表達水平;Western blot技術檢測PRV感染細胞后gB蛋白的表達水平。敲減效率測定結果顯示,PK15細胞中的IRF1-9 mRNA表達水平均有顯著降低;流式細胞術及滴度測定結果表明,敲減IRF1-9基因后有助于PRV的增殖;RT-qPCR及Western blot結果證明,敲減IRF1-9基因后,PRV-gB mRNA及蛋白表達水平均有顯著提高;細胞炎性因子的mRNA表達水平檢測結果發現,敲減IRF1-9抑制PRV誘導的IFN-β、ISG-15以及IL-6 mRNA表達。綜上所述,IRF1-9是PRV在PK-15細胞內復制的宿主限制因子。
關鍵詞: shRNA;干擾素調節因子;豬偽狂犬病病毒;細胞炎性因子
中圖分類號: S852.4; S852.659.1
文獻標志碼:A 文章編號: 0366-6964(2024)09-4100-10
Construction of Interferon Regulatory Factor Knockdown Cell Line and Its Effect on Pseudorabies
Virus Proliferation
FU" Yiqian "LIANG" Dongge "WANG" Mingyang "PAN" Jiajia "YANG" Yanbin "ZENG" Lei "KANG" Xiangtao4*
(1.College of Animal Medicine, Henan Agricultural University, Zhengzhou 450046," China;
2.Key Laboratory of Animal Biochemistry and Nutrition, Ministry of Agriculture and
Rural Areas, Henan Agricultural University, Zhengzhou 450046," China;
3.Henan Key Laboratory of Animal Growth and Development Regulation, Henan Agricultural
University, Zhengzhou 450046," China;
4.College of Animal Science and
Technology, Henan Agricultural University, Zhengzhou 450046," China)
Abstract:" To elucidate the impact of interferon regulatory factors (IRFs) on the proliferation of porcine pseudorabies virus (PRV), this study utilized shRNA technology to establish a PK15 cell line with the targeted knockdown of IRF1-9 genes. The knockdown efficiency was verified, and the proliferation of PRV subsequent to the knockdown was assessed using flow cytometry and titration assays. Additionally, the mRNA expression levels of PRV-gB, IFN-β, ISG-15, and IL-6 in PRV-infected cells were quantified by reverse transcription quantitative polymerase chain reaction (RT-qPCR). The expression of the gB protein in PRV-infected cells was analyzed by Western blotting. The knockdown efficiency assay demonstrated a significant reduction in the expression of IRF1-9 mRNA in PK15 cells. The results from flow cytometry and titration assays indicated that the knockdown of IRF1-9 genes facilitated the proliferation of PRV. Furthermore, RT-qPCR and Western blot results revealed a significant increase in the mRNA and protein expression levels of PRV-gB following the knockdown of IRF1-9 genes. The analysis of mRNA expression levels of cellular inflammatory factors showed that the knockdown of IRF1-9 inhibited the PRV-induced expression of IFN-β, ISG-15, and IL-6 at the mRNA level. In conclusion, these findings suggest that IRF1-9 serves as a host restriction factor, limiting the replication of PRV within PK-15 cells.
Key words: shRNA; interferon regulatory factor; pseudorabies virus; inflammatory cytokines
*Corresponding authors:" ZENG Lei, E-mail: zenglei2021918@163.com; KANG Xiangtao, E-mail: xtkang2001@263.net
偽狂犬病病毒(pseudorabies virus),屬于皰疹病毒科α皰疹病毒亞科水痘病毒屬。雙鏈線性DNA病毒,基因組長度143 kb,可編碼70多種蛋白質[1]。1902年,首次被證實PRV是奧耶斯基病的致病病原體[2],直到1947年,首次在中國發現偽狂犬病病毒[3],并在國內傳播。由于當時沒有穩定有效的疫苗,該病一直在中國大范圍傳播,給中國生豬養殖業帶來巨大經濟損失。可感染不同飼養階段的豬群:仔豬常表現為致死性中樞神經系統疾病癥狀,死亡率高,育肥豬、后備母豬出現呼吸道癥狀,但死亡率低,公豬會出現睪丸炎,懷孕母豬會發生流產,或者產死胎、木乃伊胎[4]。
目前,多項研究表明,雖然豬是PRV的唯一宿主,但是也可以導致多種動物感染,包括羊、狗、狐貍、虎、熊等[5-6]。近年,有研究報道表明,世界范圍內出現了多例人感染偽狂犬病毒引起嚴重腦炎[7]。因此,由于PRV在各種動物和人之間的傳播嚴重危害公共衛生安全,使其越來越受到人們的高度重視[8]。
偽狂犬病毒進入宿主后,首先感染宿主鼻腔和口咽黏膜的上皮細胞,然后擴散到周圍神經系統的神經元。病毒顆粒通過逆行運輸到達感覺和自主外周神經節,在此建立潛伏的終身感染[9-11]。病毒感染宿主后,宿主可以通過模式識別受體(PRRs)識別入侵的病毒,激活信號通路產生Ⅰ型干擾素(IFN-Ⅰ),從而激活先天免疫系統對抗病毒的入侵[12]。釋放的IFN-I結合IFN受體(IFNAR1和/或IFNAR2),激活下游JAK-STAT信號通路的轉導,最終導致多種干擾素刺激基因(ISGs)的表達[13]。
干擾素調節因子(interferon regulatory factor,IRFs)是一個轉錄因子家族,是調節先天和適應性免疫反應的重要成員,可以促進抗病毒反應和促炎反應,并且調節免疫細胞分化[14]。作為干擾素調節因子,其對干擾素的表達水平調節起重要的作用,調控免疫反應,發揮抗病毒的效果。本研究利用shRNA技術成功構建了敲減IRF1-9的PK15細胞系,并檢測敲減IRF1-9的PK15細胞系與對照PK15細胞系相比感染PRV后對病毒增殖的影響以及對細胞炎性因子的影響,證明IRF1-9是PRV在PK-15細胞內復制的宿主限制因子,在抑制病毒復制中發揮著重要作用,為PRV的防控及藥物研發提供策略。
1 材料與方法
1.1 材料
1.1.1 細胞系和病毒
細胞系:PK15(豬腎上皮細胞)與HEK293T/17(人胚腎上皮細胞衍生細胞系)購自美國ATCC。病毒:豬偽狂犬病病毒(PRV-QXX)由河南農業大學李永濤老師饋贈。豬偽狂犬病重組熒光病毒(PRV-GFP)由中國科學院武漢病毒所王漢中老師饋贈。
1.1.2 細胞培養耗材
PK15、HEK293T/17傳代培養基為含有10%的胎牛血清(fetal bovine serum, FBS)的DMEM。PK15細胞維持培養基為含有1% FBS的DMEM。嘌呤霉素和細胞培養耗材均購自美國Thermo公司。
1.1.3 主要感受態和質粒
E. coli TOP10感受態細胞購自北京鼎國昌盛公司。pLKO.1、pMD2.G和pSPAX2購自美國Addgene公司。
1.1.4 主要儀器設備
超低溫冷存冰箱(Thermo,美國);-20 ℃冷凍冰箱(Thermo,美國);4 ℃冷藏冰箱(美菱,安徽);全自動節能滅菌鍋(SANYO,日本);全自動直立式制冰機(Panasonic, 日本);恒溫水浴鍋(鼎國,北京);梯度PCR儀(Eppendorf, 德國);全波長酶標儀、DNA濃度測定儀、QuantStudioTM6 Flex PCR儀(Thermo, 美國);Mini-PROTEAN Tetra垂直電泳槽、水平電泳槽、電泳儀、制膠板、制膠器和凝膠成像器(Bio-Rad,美國);流式細胞儀(BD,美國);熒光倒置顯微鏡(OLYMPUS, 日本);生物安全柜(Thermo, 美國);二氧化碳細胞培養箱(Thermo, 美國);電熱恒溫培養箱(精宏,上海);超低溫液氮罐(Thermo,美國);超凈工作臺(Thermo,美國)。
1.1.5 主要試劑
反轉錄試劑盒、熒光定量PCR試劑、DNA Marker均購自大連寶生物公司;Tryptone、Yeast Extract和Agar power購自英國OXIOD公司;主要生化試劑購自北京索萊寶科技有限公司;異丙醇等有機試劑購自河南天馳生物科技有限公司;Q5高保真DNA聚合酶、限制性內切酶和DNA連接酶購自美國NEB公司;細胞基因組DNA提取試劑盒購自上海萊楓生物科技有限公司;二甲亞砜(DMSO)購自美國Sigma公司。
1.2 引物設計與合成
通過NCBI數據庫查詢豬IRF-1、2、3、4、5、8基因組序列(shIRF-6、7、9重組質粒由實驗室原先保存),根據此基因序列按照shRNA設計原則,在豬IRFs基因的外顯子中設計兩條shRNA(表1)。
通過NCBI數據庫查詢所要檢測的基因mRNA序列,利用Primer7.0 軟件設計RT-qPCR引物(表2)。
1.3 PK15 shIRFs敲減細胞系的構建
1.3.1 shIRFs重組載體的構建
將設計好的shRNA引物94℃ 4min進行退火雜交,然后將退火產物與限制性內切酶EcoRⅠ-HF和AgeⅠ-HF酶切線性化后的pLKO.1載體進行連接,并轉化進入E.coli TOP10感受態細胞,隨后挑取單菌落擴大培養,進行菌液PCR鑒定,條帶正確的菌液送北京擎科生物科技有限公司測序。測序正確的菌液進行進一步擴大培養,提取質粒,并將質粒-40℃保存。
1.3.2 敲減細胞系的構建
將pLKO.1-shIRFs、pMD2.G、pSPAX2以4∶1∶3的比例共轉染至HEK293T/17細胞并培養。48 h后收取含有慢病毒的細胞上清,并取1 mL感染PK15細胞。48 h后用8 μg·mL-1的嘌呤霉素進行篩選,待對照組細胞全部死亡后,更換含有3 μg·mL-1嘌呤霉素濃度的培養基將敲減細胞進行擴大培養。
1.4 IRFs基因敲減效率的驗證
1.4.1 RT-qPCR檢測
將PK15 control細胞與PK15 shIRFs細胞分別鋪種于6孔板中,并各設3組重復。待細胞匯合度達到80%左右時,使用TRizol法提取總RNA,并反轉錄成cDNA,以cDNA為模板進行RT-qPCR檢測,每個樣品設置3個重復。反應體系為10 μL,其中,去離子水2.7 μL,SYBR Green mix 5 μL,20 μmol·L-1的上下游引物 各0.4 μL,cDNA模板1.5 μL。反應條件為95℃預變性10 min;95℃變性10 s,60℃退火和延伸30 s,共40個循環。以β-actin mRNA轉錄水平為內參值,計算IRFs基因的相對mRNA水平。
1.4.2 Western blot檢測
在6孔板中分別鋪種PK15 control細胞與PK15 shIRF-3細胞,并各設3組重復。待細胞匯合度達到80%左右時收取蛋白,BCA法測定蛋白濃度,然后根據計算結果在SDS-PAGE膠中加入蛋白樣品,并用Loading Buffer補齊。電泳過后進行轉膜,將PVDF膜用5%的脫脂奶室溫封閉1 h后,加入IRF-3鼠多克隆抗體(1∶5 000),4℃搖床孵育過夜,之后用1×TBST在搖床室溫清洗4次后,再與HRP標記的山羊抗鼠IgG二抗(1∶5 000)室溫搖床孵育2 h。洗4遍后進行顯影,并以β-actin作為內參。
1.4.3 免疫熒光檢測
在24孔板中分別鋪種PK15 control細胞與PK15 shIRF-3細胞,并各設3組重復。待細胞匯合度達到40%左右時加入4%多聚甲醛固定30 min,隨后加入0.1%Triton X-100通透10 min,清洗后加入10%FBS PBS封閉1 h,后加入IRF-3兔多克隆抗體(1∶100)室溫孵育1 h,清洗后加入山羊抗兔IgG熒光二抗(1∶1 000)室溫孵育1 h,PBS清洗后使用超純水清洗,隨后封片,晾干后即可在共聚焦顯微鏡下拍照。
1.5 驗證shIRFs基因敲減對PRV在PK15細胞上增殖的影響
1.5.1 熒光流式檢測病毒復制
24孔板鋪種PK15 control和PK15 shIRFs細胞,待細胞匯合度為70%左右時,以MOI=0.001 感染PRV-GFP,37℃,5% CO2 培養箱孵育1 h后,更換維持培養基,并在36 h后觀察熒光結果。當多數熒光結果達到50%以上后,使用胰酶將細胞消化下來,以沒有感染PRV-GFP的PK15 control和PK15 shIRFs細胞的為空白對照,進行細胞流式檢測。
1.5.2 PRV子代病毒滴度的測定
PK15 control和PK15 shIRFs細胞分別鋪種于12孔板中,待細胞匯合度達到70%左右時棄去培養基,PBS清洗兩遍,然后將稀釋好的PRV-QXX病毒液加入孔中,37℃,5% CO2培養箱孵育1 h后更換維持培養基。觀察病變至80%左右時,于-40℃反復凍融3次。融化的病毒1 000×g離心6 min,吸取上清液,并于-80℃凍存。
將PK15細胞鋪種于24孔板中,細胞匯合度達80%以上時,棄去培養基,PBS清洗兩遍,每個病毒樣品從10-1倍梯度稀釋至10-6倍,加入孔中,每個樣品設3個重復。37℃,5% CO2 培養箱孵育1 h后,更換維持培養基。等待至無新蝕斑出現后,棄去培養基,PBS清洗兩遍,4%多聚甲醛固定1 h后,使用1%結晶紫染色液染色30 min,選擇蝕斑清晰且數目適中的孔,在顯微鏡下計數蝕斑數。
1.5.3 Western blot檢測PRV-gB蛋白表達
在6孔板中分別鋪種PK15 control細胞與PK15 shIRFs細胞,并各設3組重復。待細胞匯合度為70%左右時,以MOI=0.001 感染PRV-QXX,37℃,5% CO2 培養箱孵育1 h后,更換維持培養基,36 h后收取蛋白,BCA法測定蛋白濃度,然后根據計算結果在SDS-PAGE膠中加入蛋白樣品,并用Loading Buffer補齊。電泳后進行轉膜,將PVDF膜用5%的脫脂奶室溫封閉1 h后,加入PRV-gB(1∶5 000)鼠多克隆抗體,4℃搖床孵育過夜,之后用1×TBST在搖床室溫清洗4次后,再與HRP標記的山羊抗鼠IgG二抗(1∶5 000)室溫搖床孵育2 h。洗4遍后進行顯影,并以β-actin作為內參。
1.5.4 RT-qPCR檢測PRV-gB基因轉錄水平將PK15 control細胞與PK15 shIRFs細胞分別鋪種于6孔板中,并各設3組重復。待細胞匯合度為70%左右時,以MOI=0.001 感染PRV-QXX,37℃,5% CO2 培養箱孵育1 h后更換維持培養基,待36 h后使用TRizol法提取總RNA,并反轉錄成cDNA,以cDNA為模板進行RT-qPCR檢測,每個樣品設置3個重復。以β-actin mRNA轉錄水平為內參值,計算PRV-gB基因的相對mRNA水平。
1.6 驗證shIRFs基因敲減對細胞內炎性因子轉錄水平的影響
將PK15 control細胞與PK15 shIRFs細胞分別鋪種于6孔板中,并各設3組重復。待細胞匯合度為70%左右時,以MOI=0.001 感染PRV-QXX,37 ℃,5% CO2 培養箱孵育1 h后更換維持培養基,待36 h后使用TRizol法提取總RNA,并反轉錄成cDNA,以cDNA為模板進行RT-qPCR檢測,每個樣品設置3個重復。以β-actin mRNA轉錄水平為內參值,計算IFN-β、ISG-15以及IL-6基因的相對mRNA水平。
1.7 統計學分析
各試驗均平行重復3次,結果通過GraphPad Prism 8.0進行t-test檢驗及統計學分析。
2 結 果
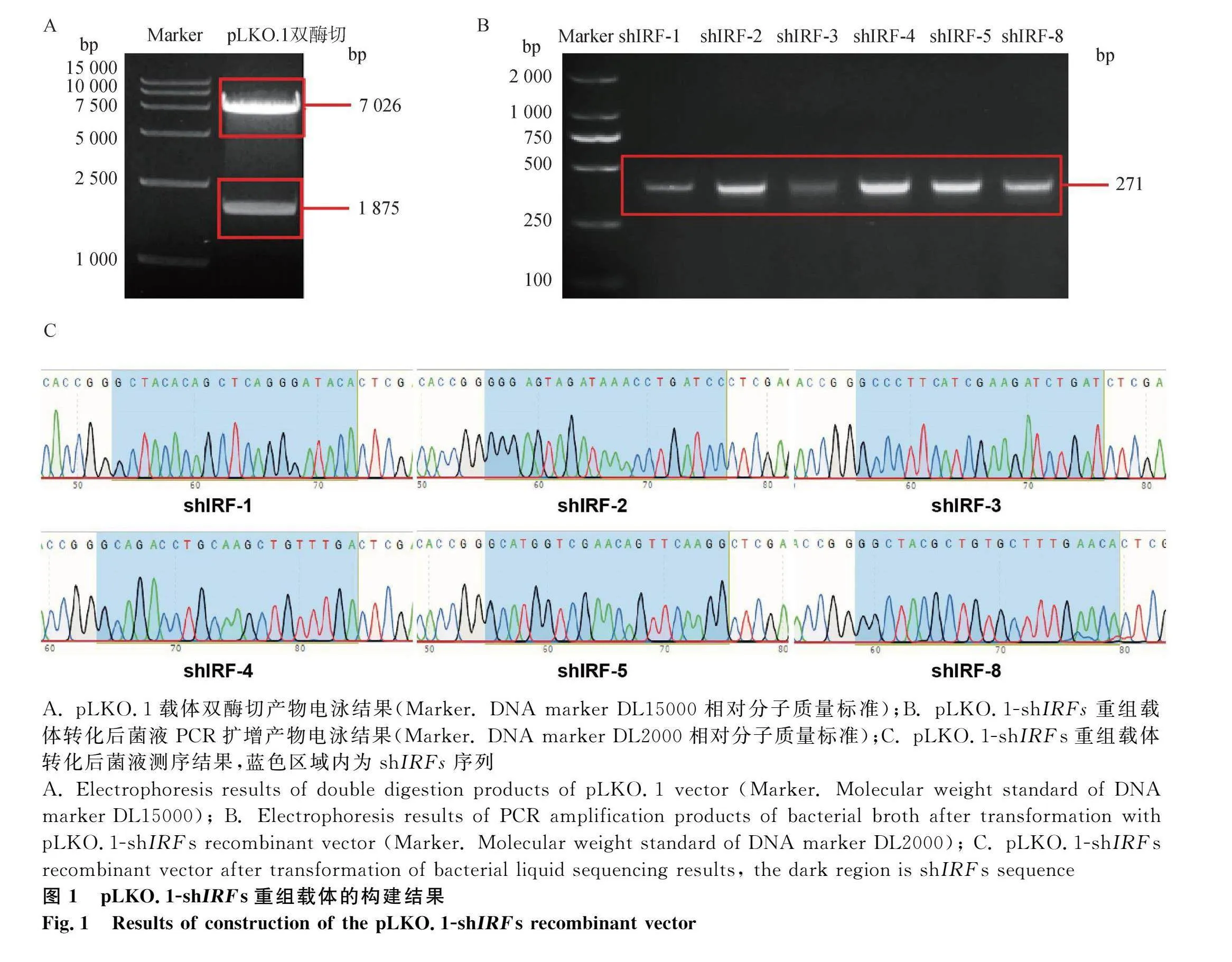
2.1 豬pLKO.1-shIRFs重組載體的構建
為了構建豬IRFs基因敲減細胞系,針對豬IRFs基因的外顯子上設計兩條shRNA,將其雜交退火,后將pLKO.1載體雙酶切(圖1A),產物凝膠電泳結果顯示在7 026與1 875 bp處有明顯條帶,將大條帶切割進行膠回收,與shRNA退火產物進行連接,轉化后挑取單菌落培養,并進行菌液PCR驗證,結果顯示,在271 bp處有明顯大小,為理想條帶(圖1B),隨后進行菌液測序,結果表明豬pLKO.1-shIRFs重組載體構建正確(圖1C)。隨后提取質粒進行后續試驗(pLKO.1-IRF-6、7、9質粒由實驗室原先保存)。
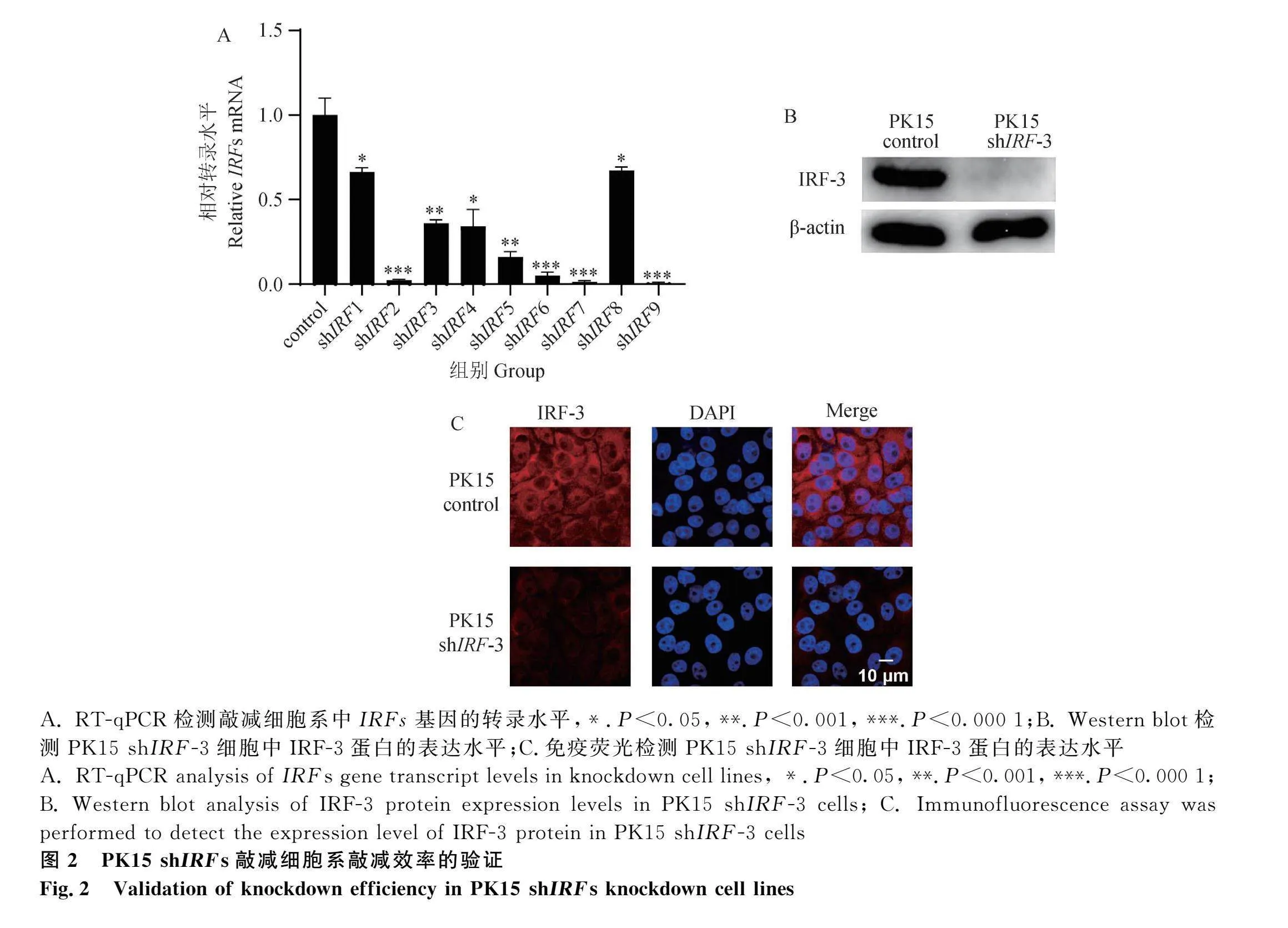
2.2 PK15 shIRFs敲減細胞系的構建
將構建成功的重組質粒通過慢病毒包裝轉染至PK15細胞中,通過嘌呤霉素篩選出敲減成功的細胞,并將其擴大培養。隨后對每組敲減細胞系進行總RNA提取,以總RNA為模板反轉錄為cDNA,再以cDNA為模板進行RT-qPCR檢測,以β-actin mRNA轉錄水平為內參值,檢驗IRFs基因的轉錄水平。結果表明,相較于對照組,敲減組的IRFs基因轉錄水平均有明顯降低,證明PK15 shIRFs敲減細胞系構建成功(圖2A)。
隨后抽選PK15 shIRF-3細胞系進行Western blot檢測,以β-actin作為內參蛋白,檢測IRF-3基因表達水平。可以看到相較于PK15 control,PK15 shIRF-3樣品并未出現明顯條帶(圖2B)。在免疫熒光試驗中,PK15 shIRF-3細胞中IRF-3蛋白的表達量明顯低于PK15 control細胞。證明PK15 shIRF-3敲減細胞系構建成功。
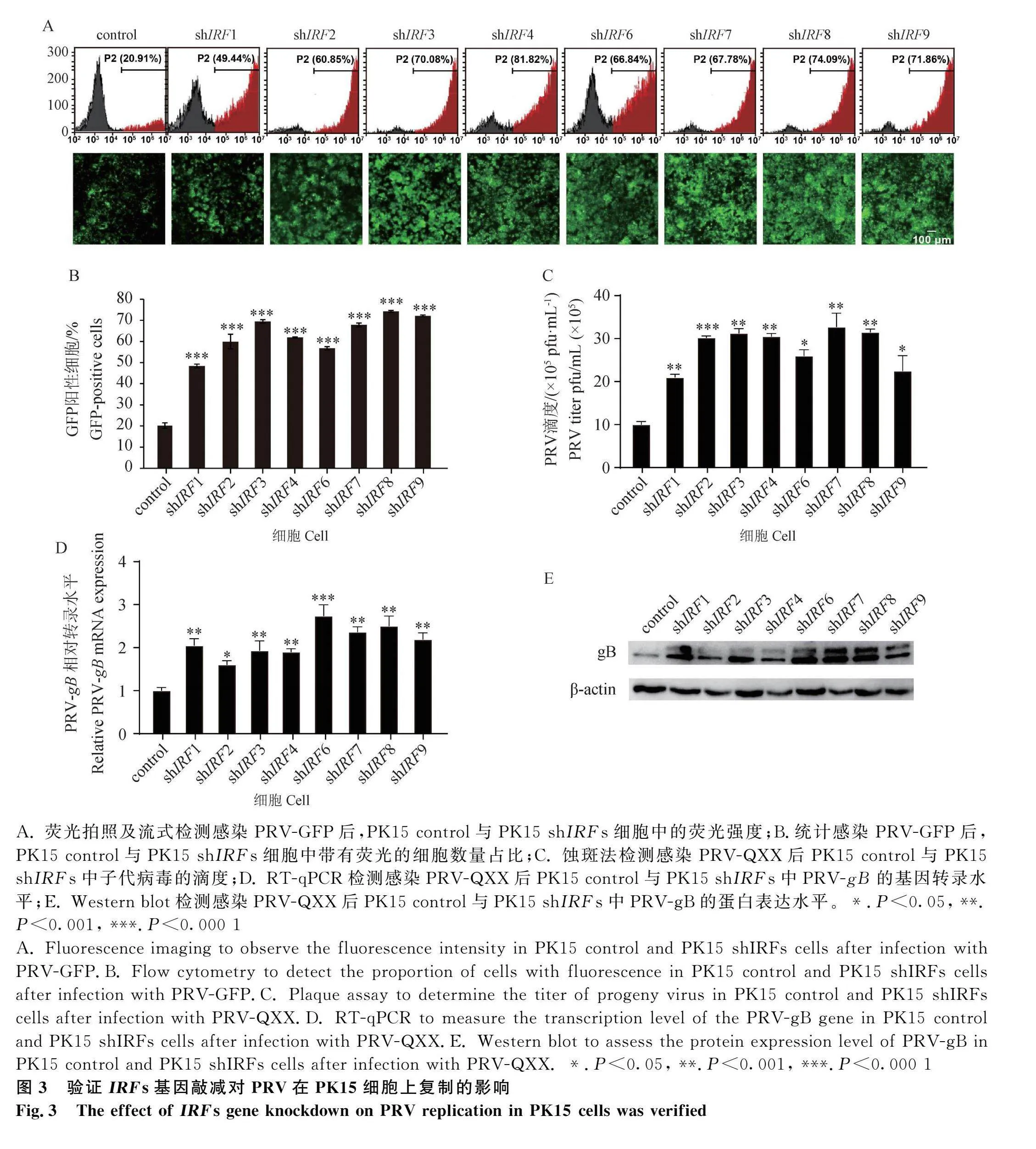
2.3 驗證IRFs基因敲減對PRV在PK15細胞上復制的影響
為探究IRFs基因敲減對PRV病毒復制的影響,將PK15 control細胞與PK15 shIRFs細胞以MOI=0.001 感染PRV-GFP,隨后觀察熒光并進行細胞流式檢測,結果表明,相較于PK15 control細胞,PK15 shIRFs細胞帶有熒光的細胞數明顯上調(圖3A)。隨后又將PK15 control細胞與PK15 shIRFs細胞以MOI=0.001感染PRV-QXX,收取病毒液后以蝕斑法測定子代病毒滴度,結果表明,相較于PK15 control,PK15 shIRFs細胞上的病毒滴度同樣有明顯升高(圖3B)。初步證實IRFs基因敲減有助于PRV-GFP在細胞中的增殖。
為進一步探究IRFs基因敲減對PRV的影響,本研究驗證了PRV-gB的基因轉錄水平以及蛋白表達水平。將PK15 control細胞與PK15 shIRFs細胞鋪種于6孔板中,以MOI=0.001感染PRV-QXX,分別收取總RNA,反轉錄并進行RT-qPCR,以及收取蛋白質,進行SDS-PAGE凝膠電泳。結果顯示,相較于PK15 control,在PK15 shIRFs細胞中PRV-gB的基因轉錄水平(圖3C)以及蛋白表達水平(圖3D)均有明顯增多。證明IRFs基因的敲減對PRV-gB的轉錄和表達均有上調作用。
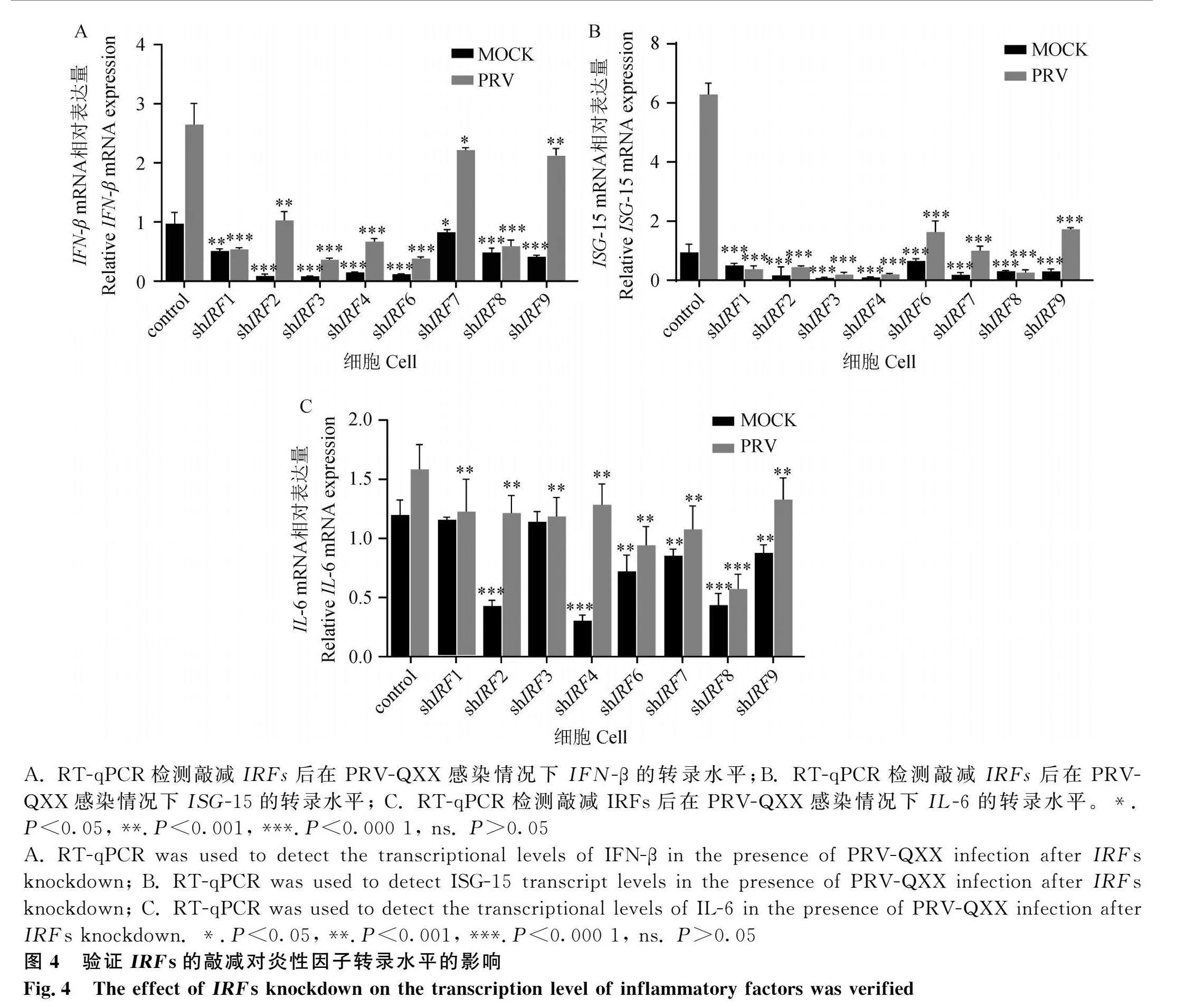
2.4 驗證IRFs的敲減對炎性因子轉錄水平的影響
為進一步探究IRFs基因敲減有助于病毒在細胞中的復制,本試驗通過RT-qPCR分別檢測了在未感染病毒以及以MOI=0.001感染PRV-QXX時,細胞中IFN-β、ISG-15以及IL-6基因的轉錄水平。結果顯示,不論有無PRV-QXX感染,相比對照組,IRFs敲減組的IFN-β、ISG-15以及IL-6的基因轉錄水平均有明顯下調(圖4),表明IRFS對于病毒的抑制作用是通過促進細胞內炎性因子的表達實現的。
3 討 論
病毒感染宿主后首先激活機體抵御病原體入侵的第一道防線—先天性免疫系統,活化的NF-κB、IRF3等轉錄因子可誘導細胞促炎性因子和干擾素的產生。野生PRV會調節宿主的早期免疫應答建立病毒潛伏感染條件,以便逃逸免疫。干擾素調節因子是調節先天和適應性免疫反應的重要成員,可以促進抗病毒反應和促炎反應,并且調節免疫細胞分化[14]。自1988年第一個干擾素調節因子被發現以來[15-16],迄今為止,在哺乳動物中已經發現有9個IRF因子。另外,IRF-10在魚類和鳥類中被證實存在,IRF-11僅在硬骨魚中被發現[17]。所有IRF家族成員都具有多個結構域,包括:N-末端DNA結合域(DBD)、多肽連接物(LK)和C末端激活結構域(AD)內的IRF-關聯域(IAD)1或IAD2。通過這種方式,IRFs密切控制著IFN-Ⅰs和ISGs的轉錄激活。所以,它們是Toll樣受體(TLR)和干擾素信號的關鍵調節器[18]。
近年來,眾多研究表明IRF家族具有抗病毒作用。有報道IRF-4與IRF-5共同參與EB病毒入侵宿主后所引起的免疫反應,其中,IRF-5誘導細胞凋亡,從而達到抗病毒的效果[19]。此外,蜱傳腦炎病毒誘導的中樞神經系統炎癥反應,激活RIG-I/MDA5和TBK 隨后激活IRF-3[20]。在仙臺病毒的感染中,IRF-3發揮了促進細胞凋亡的功能,通過迅速消滅受感染的細胞來達到有效的病毒控制[21]。還有研究發現草魚呼腸孤病毒可誘導脾、腎和頭部中的IRF-5的表達,并且IRF-5可參與固有免疫應答和DNA損傷誘導的細胞凋亡的調節[22],表明IRFs的抗病毒作用在動物界中是廣泛存在的。因此,本研究利用shRNA技術,成功構建了以PK15細胞為模型的針對豬源IRFs基因文庫。篩選出9種敲減效率高的PK15細胞株,以此來確定敲減IRFs基因是否影響PRV病毒的增殖。因此本研究通過流式細胞術以及滴度測定檢測敲減IRF1~9后PRV的增殖情況,發現敲減IRF1~9基因后感染PRV-GFP的熒光細胞數明顯增多,病毒滴度明顯增高,說明敲減IRF1~9基因后有助于PRV的增殖。再利用RT-qPCR技術檢測PRV-gB基因轉錄水平,Western blot技術檢測PRV-gB蛋白表達水平,RT-qPCR以及Western blot結果顯示,敲減IRF1~9后PRV-gB基因的轉錄水平以及蛋白表達水平均有顯著升高。綜上所述,在PK15細胞中敲減IRFs基因有助于PRV的增殖,但具體的分子機制研究尚不明確。因此本研究進一步探究了IRFs基因有助于PRV增殖的分子機制,通過實時熒光定量PCR檢測發現敲減IRF1-9抑制PRV誘導的IFN-β、ISG-15以及IL-6 mRNA表達,推測其可能是通過誘導干擾素的生成來抑制PRV 的增殖。最近研究發現敲除ISG15的PK15細胞中可阻斷IRF3激活干擾IFN-β的產生從而利于PRV的復制,而PRV的UL13則可通過IRF3的磷酸化抑制cGAS-Sting介導的IFN-β的產生[23]。此外有報道指出,對于偽狂犬病毒基因缺失疫苗毒株Bartha K61株的感染同樣適用于本機制,該研究指出Bartha K61毒株感染細胞后,誘導激活Ⅰ型干擾素的表達[24]。另有研究指出Bartha K61感染pDC細胞后,可通過LPS與TLR-4相互作用激活NF-κB信號通路,從而促進IRFs基因的表達[25]。IRFs抗PRV的具體分子機制還需要更多的研究來探明。本研究結果將為該機制研究提供重要的理論依據,對于IRFs的研究也有著十分重要的意義,不僅有助于研發抗病毒藥物,也為眾多疾病機制的探索提供了一個相對可靠的靶標。
4 結 論
本研究利用shRNA技術成功構建了敲減IRF1-9的PK15細胞系,并檢測敲減IRF1-9的PK15細胞系與對照PK15細胞系相比感染PRV后對病毒增殖的影響以及對細胞炎性因子的影響,結果顯示敲減IRF1-9有助于病毒在細胞中的復制,抑制PRV誘導的IFN-β、ISG-15以及IL-6mRNA表達水平,證明IRF1-9是PRV在PK-15細胞內復制的宿主限制因子,在抑制病毒復制中發揮著重要作用。本研究為未來探究IRFs抗病毒機制提供了有力的細胞工具,進而為今后的疫病防控及治療提供新的見解和應對策略。
參考文獻(References):
[1] POMERANZ L E, REYNOLDS A E, HENGARTNER C J. Molecular biology of pseudorabies virus:impact on neurovirology and veterinary medicine[J]. Microbiol Mol Biol Rev, 2005, 69(3):462-500.
[2] WITTMANN G, RZIHA H J. Aujeszky’s disease (Pseudorabies) in pigs[M]//WITTMANN G. Herpesvirus Diseases of Cattle, Horses, and Pigs. New York:Springer, 1989:230-325.
[3] 袁慶志, 吳裕祥, 李亞香, 等.偽狂犬病免疫的研究:Ⅰ偽狂犬病弱毒疫苗的研究[J]. 家畜傳染病, 1983(1):1-6.
YUAN Q Z, WU Y X, LI Y X, et al. The pseudorabies vaccination research. I: Pseudorabies attenuated vaccine research[J]. Chinese Journal of Preventive Veterinary Medicine, 1983(1):1-6. (in Chinese)
[4] METTENLEITER T C. Aujeszky’s disease (pseudorabies) virus: the virus and molecular pathogenesis—State of the art, June 1999[J]. Vet Res, 2000, 31(1):99-115.
[5] LAVAL K, ENQUIST L W. The neuropathic itch caused by pseudorabies virus[J]. Pathogens, 2020, 9(4):254.
[6] MLLER T, HAHN E C, TOTTEWITZ F, et al. Pseudorabies virus in wild swine: a global perspective[J]. Arch Virol, 201 "156(10):1691-1705.
[7] WONG G, LU J H, ZHANG W H, et al. Pseudorabies virus: a neglected zoonotic pathogen in humans?[J]. Emerg Microbes Infect, 2019, 8(1):150-154.
[8] BO Z Y, LI X D. A review of pseudorabies virus variants: genomics, vaccination, transmission, and zoonotic potential[J]. Viruses, 2022, 14(5):1003.
[9] MASIC' M, ERCEGAN M, PETROVIC' M. The significance of the tonsils in the pathogenesis and diagnosis of Aujeszyk’s disease in pigs[J]. Zentralbl Veterinarmed B, 1965, 12(5):398-405.
[10] TIRABASSI R S, TOWNLEY R A, ELDRIDGE M G, et al. Molecular mechanisms of neurotropic herpesvirus invasion and spread in the CNS[J]. Neurosci Biobehav Rev, 1998, 22(6):709-720.
[11] GUTEKUNST D E, PIRTLE E C, MILLER L D, et al. Isolation of pseudorabies virus from trigeminal ganglia of a latently infected sow[J]. Am J Vet Res, 1980, 41(8):1315-1316.
[12] AKIRA S, UEMATSU S, TAKEUCHI O. Pathogen recognition and innate immunity[J]. Cell, 2006, 124(4):783-801.
[13] YE G Q, LIU H Y, ZHOU Q Q, et al. A tug of war: pseudorabies virus and host antiviral innate immunity[J]. Viruses, 2022, 14(3):547.
[14] TAMURA T, YANAI H, SAVITSKY D, et al. The IRF family transcription factors in immunity and oncogenesis[J]. Annu Rev Immunol, 2008, 26:535-584, doi:10. 1146/annurev. immunol. 26. 021607. 090400.
[15] FUJITA T, SAKAKIBARA J, SUDO Y, et al. Evidence for a nuclear factor(s), IRF- "mediating induction and silencing properties to human IFN-beta gene regulatory elements[J]. EMBO J, 1988, 7(11):3397-3405.
[16] MIYAMOTO M, FUJITA T, KIMURA Y, et al. Regulated expression of a gene encoding a nuclear factor, IRF- "that specifically binds to IFN-β gene regulatory elements[J]. Cell, 1988, 54(6):903-913.
[17] SUZUKI Y, YASUIKE M, KONDO H, et al. Molecular cloning and expression analysis of interferon regulatory factor 10 (IRF10) in Japanese flounder, Paralichthys olivaceus[J]. Fish Shellfish Immunol, 201 "30(1):67-76.
[18] ANTONCZYK A, KRIST B, SAJEK M, et al. Direct inhibition of IRF-dependent transcriptional regulatory mechanisms associated with disease[J]. Front Immunol, 2019, 10:1176, doi:10. 3389/fimmu. 2019. 01176.
[19] XU D S, MEYER F, EHLERS E, et al. Interferon regulatory factor 4 (IRF-4) targets IRF-5 to regulate Epstein-Barr virus transformation[J]. J Biol Chem, 201 "286(20):18261-18267.
[20] ZHANG X W, ZHENG Z H, LIU X J, et al. Tick-borne encephalitis virus induces chemokine RANTES expression via activation of IRF-3 pathway[J]. J Neuroinflammation, 2016, 13(1):209.
[21] HEYLBROECK C, BALACHANDRAN S, SERVANT M J, et al. The IRF-3 transcription factor mediates Sendai virus-induced apoptosis[J]. J Virol, 2000, 74(8):3781-3792.
[22] XU Q Q, CHANG M X, XIAO F S, et al. The gene and virus-induced expression of IRF-5 in grass carp Ctenopharyngodon idella[J]. Vet Immunol Immunopathol, 2010, 134(3-4):269-278.
[23] LIU H M, LI C, HE W F, et al. Free ISG15 inhibits pseudorabies virus infection by positively regulating type I IFN signaling[J]. PLoS Pathog, 2022, 18(10):e1010921.
[24] DELVA J L, VAN WAESBERGHE C, VAN DEN BROECK W, et al. The attenuated pseudorabies virus vaccine strain Bartha Hyperactivates Plasmacytoid dendritic cells by generating large amounts of cell-free virus in infected epithelial cells[J]. J Virol, 2022, 96(12):e02199-21.
[25] DAI J H, MEGJUGORAC N J, AMRUTE S B, et al. Regulation of IFN regulatory factor-7 and IFN-α production by enveloped virus and lipopolysaccharide in human plasmacytoid dendritic cells[J]. J Immunol, 2004, 173(3):1535-1548.
(編輯 白永平)

