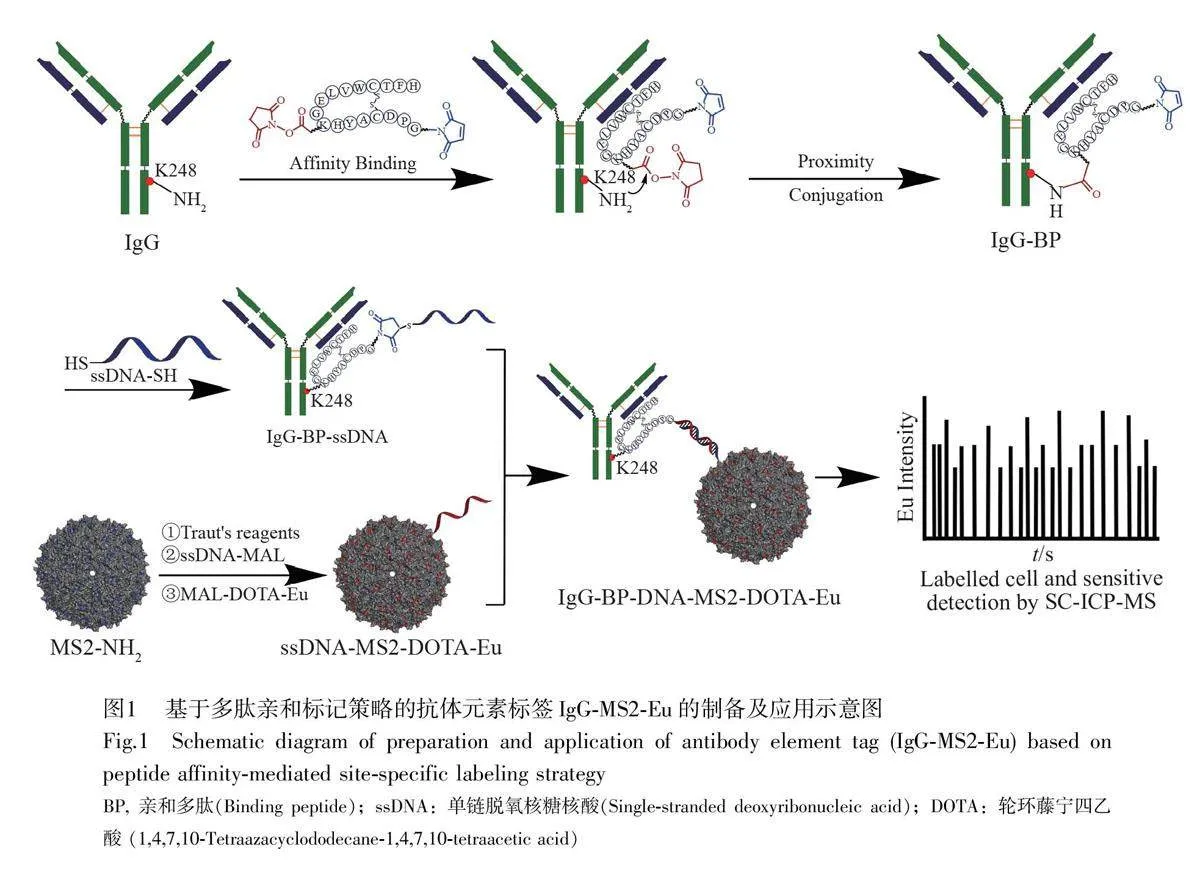
基于多肽親和介導定點偶聯策略的抗體元素標簽的合成及單細胞分析應用
關鍵詞 多肽親和標記;定點偶聯;抗體;元素標簽;單細胞-電感耦合等離子體質譜
近年來,基于電感耦合等離子體質譜(Inductively coupled plasma mass spectrometry, ICP-MS)的生物分析方法在生物醫學研究領域得到了廣泛應用[1-11]。ICP-MS 可在痕量和超痕量濃度水平實現高靈敏的元素分析,具有多元素/同位素分析以及元素信號強度與化學形態無關等優勢[12-13]。元素標簽的信號響應強度與每個元素標簽所攜帶的金屬原子數量成正比,而納米顆粒可一次性負載成千上萬的金屬原子,因此,納米顆粒是提高ICP-MS 生物測定靈敏度的有效載體之一,可實現對低豐度細胞標記物的高靈敏度定量分析檢測[14-18]。
抗體(Antibody),又稱免疫球蛋白G(Immunoglobulin, IgG),是一種由B 細胞產生的Y 形蛋白,能夠特異性識別并結合目標分子,是最常用的靶向遞送載體之一。IgG 由兩條重鏈(Heavy chain)和兩條輕鏈(Light chain)構成,表面含有多種溶劑可及性的反應性氨基酸,例如賴氨酸和半胱氨酸等可用于化學修飾,是一種常用的制備元素標簽的靶向分子[19-21]。
目前,已經發展了多種基于金屬螯合物、金屬聚合物和金屬納米粒子的抗體元素標簽,并被應用于生物分子特異性識別和高靈敏定量分析[22-23]。2001 年,張新榮研究組[24]首次報道了金屬穩定同位素(Eu同位素)抗體元素標簽,并實現了對促甲狀腺激素(TSH)的ICP-MS 定量分析。2011 年, Bendall 等[25]使用抗體聚合物元素標簽,結合單細胞-質譜流式細胞技術,成功實現了對免疫細胞高達34 個參數的高通量分析。金屬穩定同位素標記和絕對定量分析策略在高靈敏度檢測和多通道多參數生物分析等方面展現了巨大的應用潛力,為生物分子研究和臨床診斷帶來了技術革新[26]。
目前,抗體元素標簽多采用隨機偶聯的方式制備,即通過抗體表面廣泛的游離氨基或者巰基,與目標載體的反應官能團隨機碰撞,實現抗體與納米載體的共價偶聯[27-28]。這種隨機偶聯會導致抗體偶聯位點和偶聯比例的不可控。偶聯位點的不確定性可能會阻塞抗體的抗原結合位點,降低其特異性結合目標的能力,影響元素標簽的專一性和親和力;偶聯比例無法控制會導致制備的元素標簽無法進行準確的定量分析,增加元素標簽異質性,影響標簽的穩定性。隨著Thiomab 工程、非天然氨基酸插入等技術的發展,研究者可采用這些技術實現抗體位點特異性偶聯[29-32]。但是,這些技術路線需要通過復雜的基因工程技術,將具有反應性的氨基酸引入到抗體的目標位點,技術要求高,生產過程周期長,并且價格昂貴。
多肽介導的親和標記技術是一種利用多肽作為橋梁,特異性地將標記物結合到目標生物分子(如蛋白質、核酸和細胞表面受體等)上的方法。Delano 等[33]通過建立環肽文庫,篩選出可與IgG 抗體的Fc 片段特異性結合的親和多肽Fc-Ⅲ(DCAWHLGELVWCT-NH2),并以2.7 ?的分辨率確定了Fc-Ⅲ肽與Fc 片段復合物的X 射線晶體結構,證明了Fc-Ⅲ肽與Fc 片段的CH2 和CH3 區域的交界面結合。在此基礎上, Kishimoto 等[34]結合之前的工作,通過空間結構分析,確定了序列為GPDCAYHKGELVWCTFH 的環肽的第8 位賴氨酸與抗體Fc 片段的K248 位賴氨酸距離僅為6.1 ?,并在該多肽的第8位賴氨酸的氨基上修飾了一條碳鏈長度為7.1 ?、末端帶有甲基丙烯酸N-琥珀酰亞胺酯(N-Hydroxysuccinimide ester,NHS)的Linker。在親和標記過程中,游離的親和多肽分子首先與抗體的CH2 和CH3 區域發生非共價特異性結合(圖1)。這種非共價的結合拉近了抗體上K248 的氨基和多肽上的NHS 酯之間的距離,從而使得氨基親和進攻羰基,形成酰胺鍵,實現抗體的位點特異性偶聯;然后,通過多肽上的馬來酰亞胺基團與巰基化DNA 偶聯,得到化學計量比為1∶1 的抗體-DNA 偶聯物;最后,通過IgG 與修飾了Eu 的MS2 蛋白納米顆粒[35-36]之間的DNA 雜交,實現元素標簽的精準組裝。這種元素標簽制備技術可實現抗體的位點特異性偶聯和化學計量比1∶1 的精確偶聯,無需對抗體進行工程改造,具備更強的通用性。本研究采用多肽介導的親和標記技術,實現了抗體與修飾稀土元素Eu 的MS2 衣殼蛋白納米顆粒定點偶聯,構建了一種高靈敏和高親和力的元素標簽,并利用單細胞-電感耦合等離子體質譜(Single cell inductively coupledplasma mass spectrometry, SC-ICP-MS)技術對此元素標簽的專一性和靈敏度進行了評價。
1 實驗部分
1.1 儀器與試劑
LC-20AD高效液相色譜儀和LC-16P制備液相色譜系統(日本Shimadzu公司);XBridge Protein BEH尺寸排阻色譜柱(SEC, 7.8 mm×300 mm, 3.5 μm,美國Waters公司);制備色譜柱C18(10 mm×150 mm, 5 μm,日本Shimadzu 公司);分析色譜柱C18(4.6 mm×150 mm, 5 μm,日本Shimadzu 公司);NexION?2000 ICPMass Spectrometer(美國PerkinElmer公司);autoflex?maX基質輔助激光解吸電離飛行時間質譜儀(MALDITOFMS,美國Bruker 公司);JEM1400 透射電鏡(日本JEOL 公司);PowerPac?基礎電泳儀電源、Mini-PROTEAN?Tetra 電泳槽(美國Bio-Rad 公司);UVP GelStudio PLUS 多功能凝膠成像系統(德國AnalytikJena公司);DYCP-31BN型瓊脂糖水平電泳儀(北京六一生物公司)。
NexION Setup Solution 調諧液(TruQ?ms, 500 mL,美國PerkinElmer 公司);四元素微球校準液(TruQ?ms, 100 mL,美國Fluidigm 公司);西妥昔單抗(Cetuximab,廈門大學國家傳染病診斷試劑與疫苗工程技術研究中心);氯化銪(Ⅲ)六水合物(25 g,上海阿拉丁生化科技股份有限公司);DOTA-馬來酰亞胺(100 mg,陜西新研博美生物科技有限公司);三氟乙酸(TFA, 500 mL,上海麥克林生化科技股份有限公司);N,N-二甲基甲酰胺(DMF, 500 mL,國藥集團化學試劑有限公司);超濾管(30和100 kDa, 0.5 mL,美國Millipore 公司);雙琥珀酰亞胺戊二酸酯(Diosuccinimidyl glutamate, DSG, 50 mg,上海麥克林生化科技股份有限公司);親和多肽(BP)、ssDNA、BCA 試劑盒、SDS 預制膠和Protein Ladder(生工生物工程(上海)股份有限公司);尼龍篩網(300 目,孔徑約為48 μm,北京索萊寶科技股份有限公司);非小細胞肺癌細胞系A549 和人乳腺癌細胞MDA-MB-231 來自American Type Culture Collection。
1.2 實驗方法
1.2.1 基于多肽親和標記策略的元素標簽IgG-MS2-Eu的制備
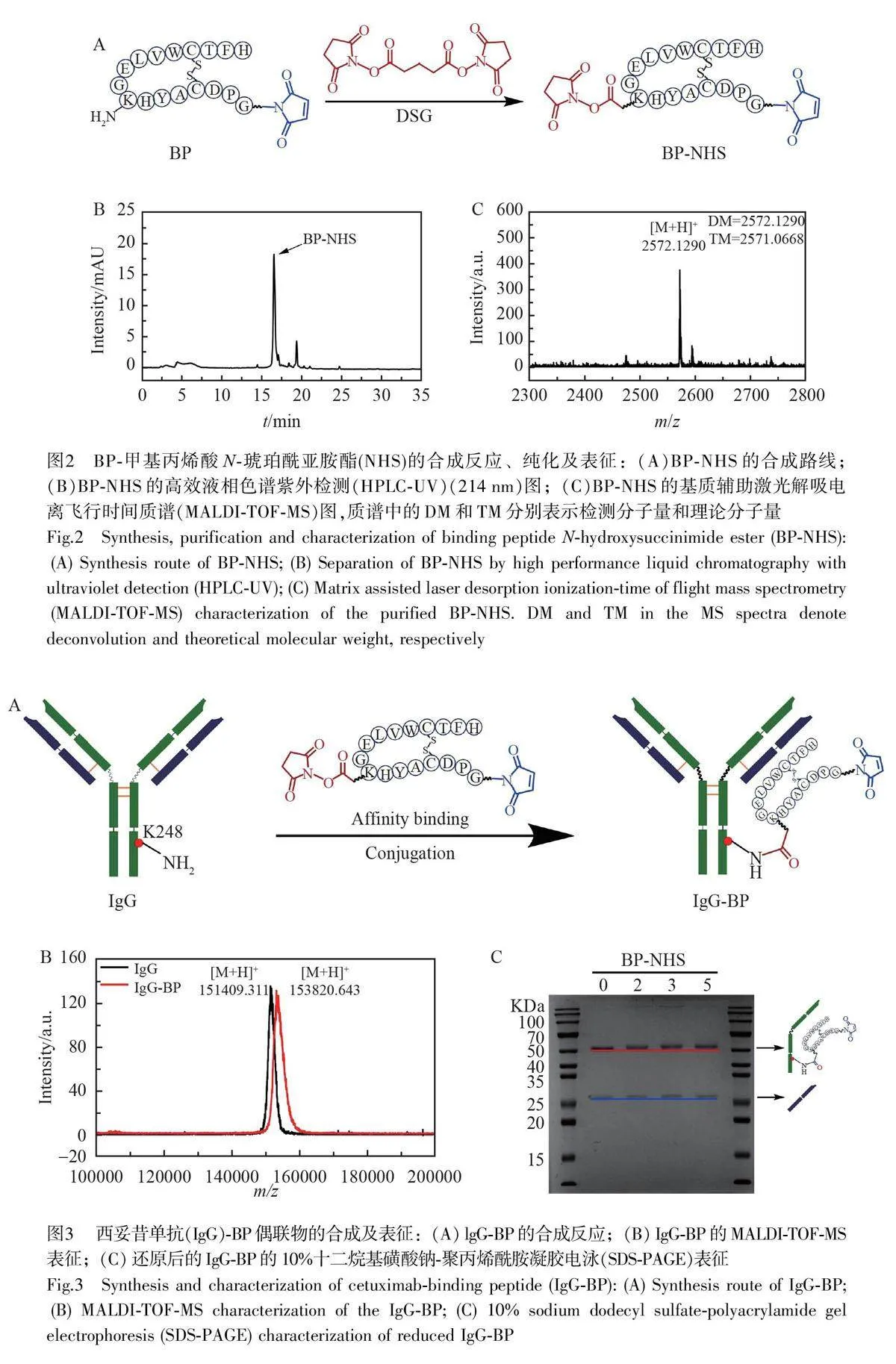
BP-NHS的制備BP的NHS修飾反應在DMF中進行。在終濃度為0.5 mmol/L的多肽中加入100倍當量的雙琥珀酰亞胺戊二酸酯(DSG),于37 ℃中振蕩反應5 h。采用制備色譜儀進行純化,流動相由A 相(TFA/H2O, 0.1%, V/V)和B 相(TFA/ACN, 0.1%, V/V)組成。以0.5 mL/min 的流速洗脫,洗脫程序為:0~5 min, 5% B,用于樣品的加載及系統平衡;5~15 min, 5%~90% B,實現目標多肽的逐步分離;15~20 min,90% B,用于快速洗脫未完全分離的雜質或高極性組分。
IgG-BP 的制備IgG 與BP 的親和偶聯反應在磷酸鹽緩沖溶液(PBS, pH=7.5)中進行。在終濃度為7 μmol/L 的西妥昔單抗中加入5 倍當量的親和多肽NHS-BP-MAL,室溫反應1 h。采用超濾管(MWCO=30 kDa)在4 ℃下超濾純化5 min,共超濾4次,得到抗體多肽偶聯物IgG-BP。
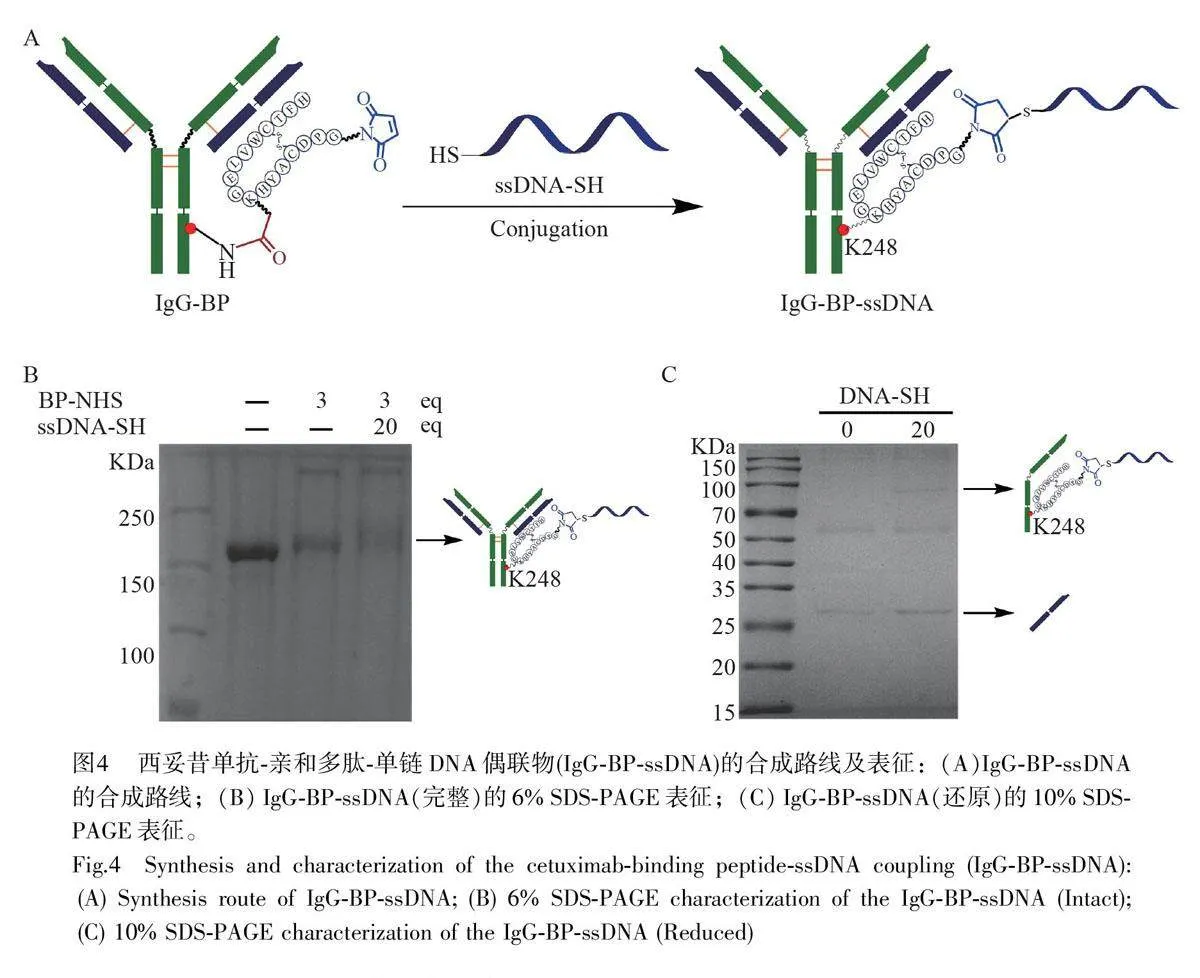
IgG-BP-ssDNA 的制備向反應終濃度為10 μmol/L 的IgG-BP 偶聯物中加入20 倍當量的ssDNA-SH,于4 ℃下過夜反應。采用超濾管(MWCO=30 kDa)濾除小分子,并將溶劑置換為4-羥乙基哌嗪乙磺酸(Hepes)緩沖溶液,最終得到IgG-BP-ssDNA 偶聯物。
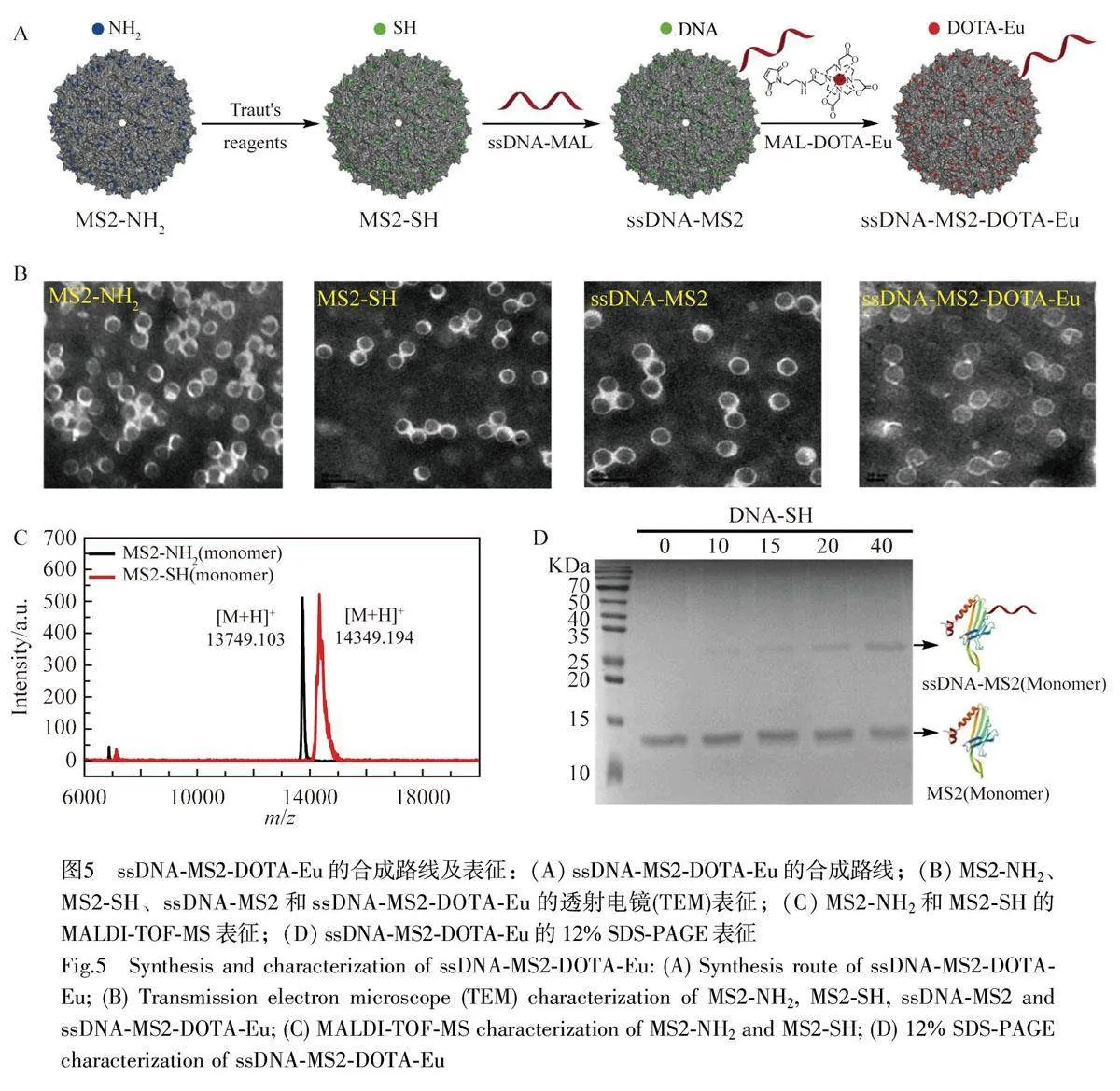
ssDNA-MS2-DOTA-Eu 的制備在噬菌體MS2 衣殼蛋白表面修飾DOTA-Eu 和ssDNA。首先將噬菌體MS2衣殼蛋白內外表面的氨基轉化為巰基,然后在噬菌體MS2 衣殼蛋白中加入20倍當量的2-亞氨基硫烷Traut′s 試劑,在5 mmol/L 的乙二胺四乙酸(EDTA)和pH=8.0 的NaHCO3 溶液中室溫振蕩反應3h。采用超濾管(MWCO=100 kDa)純化,得到巰基化MS2 衣殼蛋白(MS2-SH)。
對MS2-SH 進行DNA 和Eu 元素的組裝在MS2-SH 中加入9 倍當量的ssDNA-MAL,于4 ℃過夜反應。然后繼續加入巰基50 倍當量的MAL-DOTA-Eu,振蕩反應2 h。采用超濾管(MWCO=100 kDa)超濾3 次,得到ssDNA-MS2-DOTA-Eu。
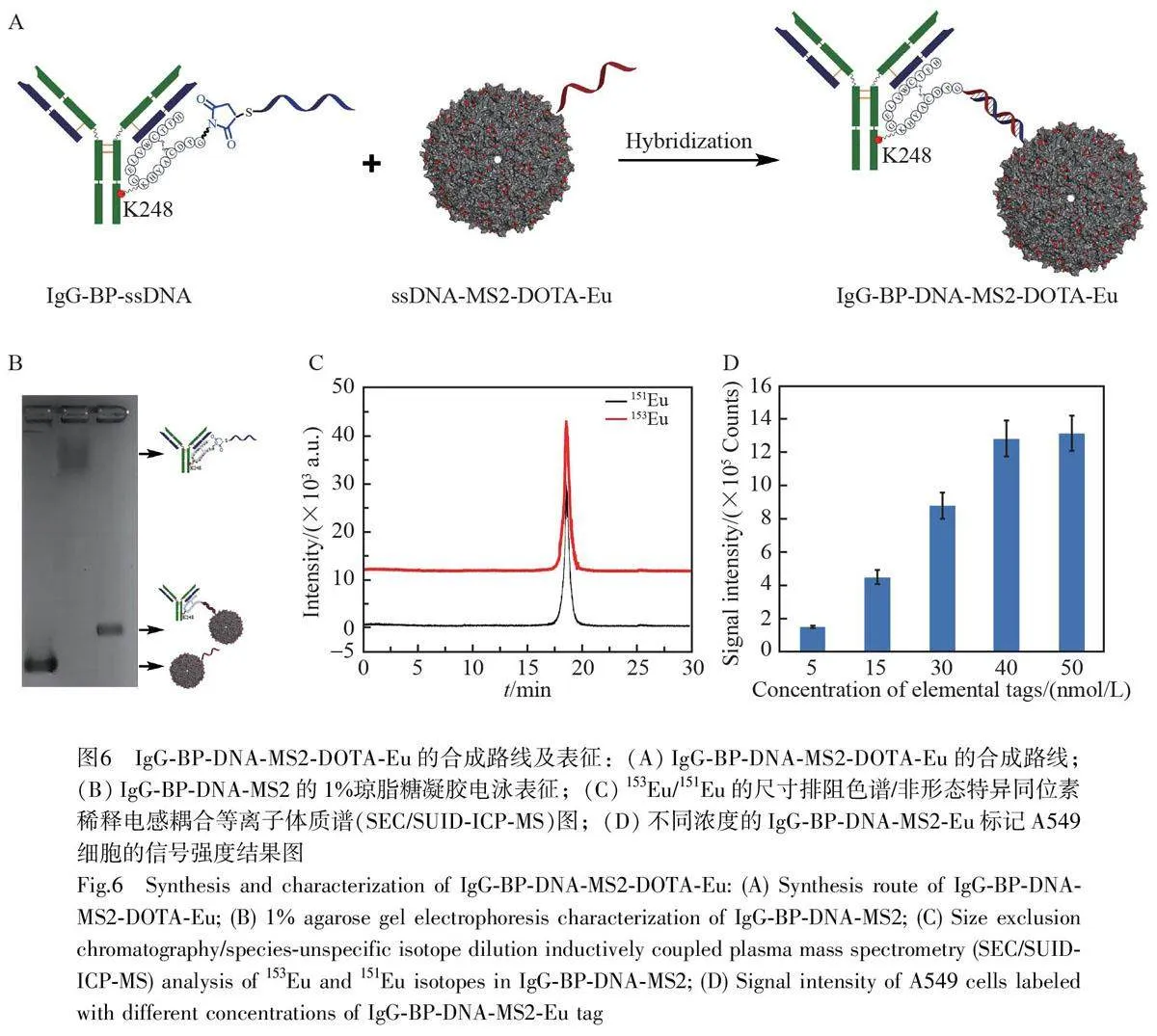
IgG-BP-DNA-MS2-DOTA-Eu 元素標簽的組裝 反應在50 mmol/L Hepes(pH=7.0)緩沖溶液中進行,將IgG-BP-ssDNA 與ssDNA-MS2-DOTA-Eu 偶聯物以2∶1 的比例混合,即可組裝得到IgG-BP-DNA-MS2-DOTA-Eu 元素標簽。
1.2.2 基于氨基隨機偶聯策略的元素標簽IgG-PEG-MS2-Eu的制備
通過抗體上的賴氨酸側鏈上的氨基或N 端的氨基實現偶聯。為了將西妥昔單抗與MS2-SH 偶聯,需要在西妥昔單抗上偶聯一端帶有馬來酰亞胺基團的連接子。西妥昔單抗和MAL-PEG-NHS 連接子通過NHS 酯與氨基發生酰胺化反應,生成IgG-PEG-MAL 偶聯物。此反應在含有10%(V/V)二甲基亞砜(Dimethyl sulfoxide, DMSO)的PBS 緩沖溶液中進行,在終濃度為3 μmol/L 的西妥昔單抗中加入4 倍當量的NHS-PEG-MAL,室溫下反應2 h。采用超濾管(MWCO=30 kDa)于4 ℃以4500 g 的離心力超濾純化5 min,共超濾4 次,得到抗體偶聯物。通過BCA 微量蛋白定量試劑盒定量分析抗體偶聯物的蛋白濃度。
通過巰基和馬來酰亞胺的邁克爾加成反應,將抗體偶聯物與MS2-SH 偶聯,并在標簽上修飾Eu,制備lgG-PEG-MS2-DOTA-Eu 元素標簽,此反應在10 mmol/L Hepes 緩沖溶液(pH=7.0)中進行。在終濃度為2 μmol/L 的抗體偶聯物中加入2 倍當量的巰基化MS2,室溫反應2 h,加入5 倍巰基當量的MALDOTA-Eu,室溫反應2 h。采用超濾管(MWCO=100 kDa)于4 ℃以3500 g離心超濾純化3 min,共超濾4 次,得到元素標簽IgG-PEG-MS2-Eu。
1.2.3 元素標簽中Eu 含量的定量分析
采用柱后同位素稀釋法測定元素標簽中Eu 的總量[37-38]。在每次測定前,采用含有1 μg/L 的Be、Ce、Fe、In、Li、Mg、Pb 和U 的調諧液對ICP-MS 進行調諧,以達到最大靈敏度。在測試樣品前,使用2% HNO3 溶液沖洗ICP-MS 的霧化室5 min。搭建尺寸排阻色譜/非形態特異同位素稀釋電感耦合等離子體質譜法(Size exclusion chromatography/species-unspecific isotope dilution inductively coupled plasma massspectrometry, SEC/SUID-ICP-MS)平臺,以三通接口連接高效液相色譜(High-performance liquid chromatography,HPLC)的流動相出口和注射泵上的注射器口,使得兩股液流混合,共同進入ICP-MS 進行檢測。通過SEC 柱分離蛋白樣品,色譜流速為0.3 mL/min,注射泵以0.06 mL/min 的流速注入1 μg/L 153Eu 標準品溶液。通過色譜和質譜的信息對元素標簽中Eu 的含量進行絕對定量分析。
1.2.4 元素標簽的單細胞ICP-MS 分析[30]
貼壁細胞用胰蛋白酶處理后收集,懸浮細胞通過離心收集,然后采用預冷的Hepes 溶液置換細胞培養液。在每組100 μL 的2×106 個細胞中,加入不同濃度元素標簽,在4 ℃下孵育30 min,期間將樣品緩慢旋轉混勻。采用預冷的Hepes 緩沖溶液洗滌3 次,在室溫下加入4%通用多聚甲醛固定液并放置15 min以固定細胞。固定操作結束后,繼續使用預冷的Hepes 緩沖溶液洗滌3 次,除去多余的元素標簽。細胞樣品測試前通過300目(孔徑48 μm)的尼龍篩網過濾,防止粘連的細胞進入裝置堵塞管路。采用SC-ICPMS對細胞樣品進行測試。
2 結果與討論
2.1 IgG-MS2-Eu 元素標簽的制備及表征
2.1.1 BP-NHS 的制備及表征
BP 的NHS修飾反應如圖2A 所示, BP的第8位賴氨酸與DSG發生酰胺縮合,引入NHS 官能團,用于后續與抗體的親和交聯反應。采用HPLC以及基質輔助激光解吸電離飛行時間質譜(Matrix-assisted laserdesorption/ionization time-of-flight mass spectrometry, MALDI-TOF-MS)對BP-NHS 產物進行了純化和表征(圖2B和2C),測得分子量([M+H]+)為2572.1290 Da,與理論分子量結果吻合,說明成功實現了多肽的NHS修飾(1∶1),得到目標物BP-NHS。
2.1.2 IgG-BP 的制備及表征
利用多肽配體對單克隆抗體的親和性,實現抗體與目標多肽之間的共價結合,最終完成對抗體Fc 片段的定向修飾,具體的反應過程如圖3A 所示。使用MALDI-TOF-MS 對產物進行表征分析,結果如圖3B所示。抗體多肽偶聯物(IgG-BP)的分子量為153820.6 Da,而IgG 的分子量為151409.3 Da,表明西妥昔單抗均與BP-NHS 成功偶聯,并且平均每個單克隆抗體上偶聯了一條目標多肽。利用十二烷基磺酸鈉-聚丙烯酰胺凝膠電泳(SDS-PAGE)對產物進行分析,如圖3C 所示,隨著BP-NHS 加入劑量增加,抗體的重鏈逐漸上移,輕鏈無反應,表明此親和標記反應僅發生在抗體的重鏈位置,與預期相符。
2.1.3 IgG-BP-ssDNA的制備及表征
IgG-BP 與巰基化單鏈DNA(ssDNA-SH)的反應過程如圖4A 所示, IgG-BP 上的親和肽C 端的馬來酰亞胺官能團與ssDNA-SH 反應形成穩定的硫醚鍵,實現IgG-BP 和ssDNA-SH 的共價偶聯。如圖4B 所示,完整的IgG-BP-ssDNA 條帶存在明顯上移,證實抗體與DNA 成功結合。對產物IgG-BP-ssDNA 進行還原處理,結果如圖4C 所示,抗體重鏈的條帶出現上移,而輕鏈無變化,證實ssDNA-SH 與抗體的共價反應僅發生在抗體的重鏈部位,而且每個抗體上僅偶聯一條ssDNA,證明發展的親和介導的位點特異性偶聯技術可實現對抗體的化學計量比修飾。
2.1.4 ssDNA-MS2-DOTA-Eu的制備及表征
利用Traut′s 試劑對噬菌體MS2 衣殼蛋白納米顆粒表面的賴氨酸殘基進行化學改造[36],將噬菌體MS2 衣殼蛋白中的天然氨基轉化為巰基,再通過巰基與馬來酰亞胺的反應分別在MS2 的表面修飾ssDNA 及DOTA-Eu,反應路線圖如圖5A 所示。為了監測反應過程中MS2 納米顆粒的完整性,使用透射電鏡對產物進行表征,結果如圖5B 所示,經由多步偶聯反應制得的元素標簽仍保持完整形態,具有良好的穩定性,元素標簽顆粒尺寸均一,并且分散性良好。采用MALDI-TOF-MS 對MS2-SH 表征,結果如圖5C 所示, MS2-SH 亞基分子量約為14349 Da,而噬菌體MS2 衣殼蛋白亞基分子量為13760 Da,此結果表明MS2 表面的氨基被成功轉換成游離巰基,并且平均每個MS2 亞基上修飾6 個巰基。通過麥克加成反應實現MS2-SH 表面的DNA 偶聯,利用SDS-PAGE 對樣品進行分析。如圖5D 所示,隨著ssDNA-MAL劑量增加, ssDNA-MS2 的條帶逐漸加深,表明MS2-SH 與ssDNA-MAL 成功偶聯。
2.1.5 IgG-BP-DNA-MS2-DOTA-Eu(IgG-MS2-Eu)標簽的制備及表征
將上述純化后的IgG-BP-ssDNA 和ssDNA-MS2-DOTA-Eu 在50 mmol/L Hepes 緩沖溶液中混勻,抗體與MS2 在DNA 的雜交作用下實現精準組裝,反應過程如圖6A 所示。采用瓊脂糖凝膠電泳對反應過程進行檢測,結果如圖6B 所示,反應物條帶消失,并且出現了全新的條帶,表明IgG-BP-ssDNA 和MS2-ssDNA 經由單鏈DNA 的堿基互補配對雜交成功。采用柱后同位素稀釋法對元素標簽IgG-MS2-Eu 的Eu含量進行定量分析。將元素標簽稀釋104 倍,采用SEC/SUID-ICP-MS 對樣品中Eu 進行定量檢測,結果見圖6C。計算結果表明,平均每個MS2 顆粒上攜帶了800 個Eu 原子。
為獲得最佳標記細胞的元素標簽濃度,考察了不同濃度的IgG-MS2-Eu 標簽對A549 肺癌細胞的標記效果,建立了標簽濃度與細胞信號強度的關系。如圖6D 所示,隨著元素標簽孵育濃度增加,細胞的Eu信號強度逐漸增強。當元素標簽的濃度為40 nmol/L 時, Eu 的檢測值達到最大。因此,最佳的元素標簽孵育濃度為40 nmol/L。
2.2 IgG-BP-DNA-MS2-Eu 的SC-ICP-MS 分析
為了檢測元素標簽IgG-BP-DNA-MS2-Eu 在細胞標記實驗中的靶向性能以及評價其非特異性吸附情況,選擇A549 細胞(表皮生長因子受體(EGFR)陽性)和MDA-MB-231 細胞(EGFR 陰性)作為對照樣品,利用SC-ICP-MS 進行單細胞分析,并通過產生的元素單細胞信號響應強度進行對比分析。
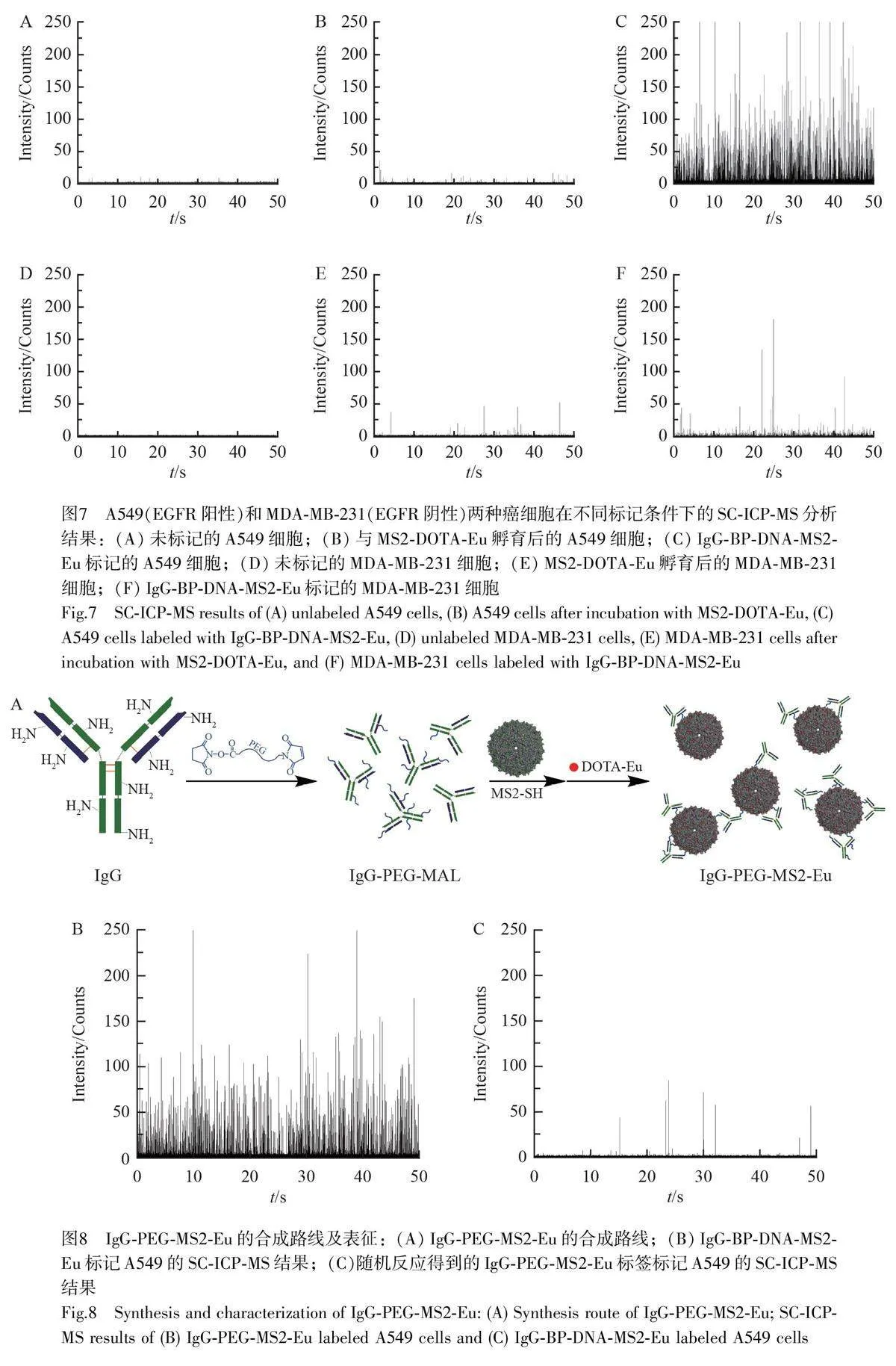
如圖7A 所示,未標記A549 細胞沒有Eu 元素的信號,說明A549 細胞中Eu 元素背景很低。如圖7B所示, A549 細胞與MS2-DOTA-Eu 孵育后,僅存在微弱的脈沖信號,說明元素標簽對A549 細胞沒有非特異性吸附。如圖7C 所示,在IgG-BP-DNA-MS2-Eu 標記A549 細胞30 min 后,得到很強的Eu 元素信號響應,說明元素標簽具有高靈敏性,并且標記作用來自標簽與A549細胞表面EGFR 抗原之間的特異性相互作用,表明IgG-BP-DNA-MS2-Eu 能夠與A549 細胞特異性結合,并且這種結合能力來源于西妥昔單抗的靶向特異性。
以低表達EGFR 的MDA-MB-231 細胞作為陰性對照,測試結果見圖7D~7F。如圖7D 所示,未標記的MDA-MB-231 細胞沒有Eu 元素的脈沖信號,說明MDA-MB-231 細胞中Eu 元素背景很低。如圖7E 所示,MS2-DOTA-Eu 孵育后的MDA-MB-231 細胞僅存在少量脈沖信號,說明元素標簽對MDA-MB-231 細胞的非特異性吸附也很少。利用相同濃度的元素標簽IgG-BP-DNA-MS2-Eu 進行標記實驗后, MDA-MB-231的信號強度遠低于A549 細胞。此結果再次說明標記作用是來自標簽與A549 細胞表面EGFR 抗原之間的特異性相互作用。以上結果表明,親和標記技術制備得到的IgG-BP-DNA-MS2-Eu 元素標簽能夠與目標細胞表面的EGFR 特異性結合,并具有低的非特異性吸附和高靈敏度的優勢。
2.3 基于隨機偶聯技術制備的元素標簽的SC-ICP-MS分析
為比較親和標記技術和通過隨機偶聯技術制備的元素標簽的差異,利用NHS-PEG-MAL 將IgG 抗體的氨基與MS2-SH 的巰基通過隨機偶聯,合成了IgG-PEG-MS2-Eu 標簽(圖8A)。采用相同濃度的元素標簽對A549 細胞進行標記和SC-ICP-MS 分析,結果如圖8B 和圖8C 所示,在A549 單細胞檢測分析中,使用基于隨機偶聯方法得到的IgG-PEG-MS2-Eu 元素標簽,其細胞上幾乎沒有Eu 的信號;而基于親和標記制備的元素標簽Eu 信號良好,說明采用隨機偶聯得到的元素標簽幾乎未靶向定位到細胞表面EGFR 受體。這可能是因為NHS-PEG-MAL 與抗體的隨機偶聯發生在抗體輕鏈的抗原識別區,導致標簽無法特異性識別細胞表面抗原,進而無法實現對細胞的標記和定量分析;也可能是在反應的過程中,多個抗體和多個巰基化MS2 之間發生交聯,阻礙了抗體與抗原的特異性識別與結合,最終導致標簽無法正常標記細胞。
3 結論
建立了一種通過多肽介導的親和標記策略,實現了抗體的定點偶聯與噬菌體MS2 衣殼蛋白納米顆粒元素標簽的組裝。此親和標記策略避免了隨機偶聯造成的元素標簽的異質性和無法正常標記的問題,制備得到的抗體納米元素標簽具有偶聯位點精確、化學計量比可控、專一性好以及靈敏度高等優勢,已成功用于癌細胞表面生物標志物的高靈敏度、高特異性單細胞分析。此外,該策略無需對抗體進行基因工程改造,可用于天然抗體的偶聯,具有很好的普適性;可用于快速精準地合成不同類型天然抗體元素標簽,通過對不同細胞生物標志物的靶向標記檢測,實現對低豐度蛋白的定性和定量分析,以及對疾病的診斷和不同類型癌癥的診斷、分型和預后分析。然而,該策略僅在IgG1 抗體上驗證了其可行性,存在偶聯步驟較復雜的問題。在此基礎上,未來可研究蛋白納米顆粒與不同類型的抗體偶聯,簡化偶聯步驟,實現模塊化組裝,形成標準的純化工藝,發展成為質譜流式細胞儀的配套試劑盒。此外,基于此偶聯策略,可在MS2 蛋白納米顆粒上偶聯/組裝藥物,構建抗體-藥物偶聯物(Antibody-drug conjugate, ADC),用于藥物的靶向遞送。

