不同凝固浴對再生纖維素超濾膜結構和性能的影響



摘要: 本文利用新型的常溫纖維素溶解體系ZnCl2/AlCl3直接從棉漿中制備再生纖維素超濾膜,探討了不同凝固浴對再生纖維素超濾膜結構和性能的影響。研究發現,當采用有機溶劑作為凝固浴時,可以提升相分離過程中溶劑—非溶劑的交換速度。隨著凝固浴中有機溶劑比例的增加,可以使得膜表面致密皮層厚度增加、膜表面孔徑大小減小,并使得膜內部出現非對稱指狀孔結構。在乙醇中得到的再生纖維素超濾膜的截留分子量(MWCO)可以達到314.5 kDa,水通量可以達到628.57 LMH/bar,并且能夠分離病毒標志物2 000 kDa的藍色葡聚糖和人體免疫球蛋白(IgG)。結果表明,可以通過控制凝固浴中有機溶劑的比例來獲取不同結構的再生纖維素超濾膜,并進一步展示了該種再生纖維素超濾膜在生物制藥應用中的潛力。
關鍵詞: 再生纖維素超濾膜;ZnCl2/AlCl3;相分離;有機溶劑;凝固浴;膜孔結構;分離性能
中圖分類號: TS102.51
文獻標志碼: A
文章編號: 10017003(2024)12期數0079起始頁碼09篇頁數
DOI: 10.3969/j.issn.1001-7003.2024.12期數.008(篇序)
超濾膜在生物制藥生產流程中的運用為人們帶來了令人振奮的機遇[1]。這些膜以低能耗、無須額外化學添加物的方式,有效地將目標物質與溶液分離。相較于常見的石油基材料,如聚醚砜(polyethersulfone,PES)和聚偏二氟乙烯(polyvinylidene difluoride,PVDF),再生纖維素(regenerated cellulose,RC)超濾膜在實際過濾中表現出獨特的優勢。其優異的親水性大幅減少了蛋白質吸附,從而延長了膜的使用壽命[2]。與此同時,由于纖維素是地球上最豐富的天然聚合物之一,具備可再生性和環境友好性,因此使用纖維素為原料代替石油基材料制備超濾膜能夠有效降低對環境的影響,符合可持續發展的目標[3]。
由于纖維素具有豐富的氫鍵和高結晶度,幾乎不溶于常見的各類溶劑,這為其直接加工帶來了挑戰[4]。目前市售的大部分RC超濾膜主要是醋酸纖維素膜,或者是通過水解醋酸纖維素超濾膜獲得的[5-6]。雖然化學修飾可以增強纖維素的加工性,但工業生產纖維素衍生物仍然采用異質反應方法[7],這種反應過程通常局限于纖維素的表面,難以控制,帶來了一系列問題,如產生不良的副反應及大量廢物[8]。直接從纖維素原料出發,溶解并制備RC產品需要開發高效的纖維素溶解體系[9]。為了符合可持續化發展需求,一系列低成本、可回收的室溫纖維素溶劑被開發出來[10]。通過添加酸[11-12]或者小分子氯鹽與ZnCl2組成的溶劑體系能夠在常溫下溶解纖維素[13-15],具有低成本、低耗能、環境友好的特點,也為RC超濾膜的制備提供了新的路徑。
由于簡單、易操作,非溶劑誘導相轉化(nonsolvent Induce phase separation,NIPS)法是目前主流的制膜方法[16-17]。對于NIPS法,影響最終膜形態的因素有很多,其中凝固浴的理化性質對成膜的結構形態極為關鍵,而膜結構的差異對于膜的過濾性能具有重要影響。
本文采用ZnCl2/AlCl3溶解體系,研究其在常溫下直接從棉漿中制備RC超濾膜的可行性。使用水、乙醇、乙二醇和丙酮作為凝固浴,研究在不同凝固浴中再生得到的膜的結構變化。基于水/乙醇混合溶劑,研究混合凝固浴中乙醇比例對RC超濾膜結構的影響。最后利用藍色葡聚糖(blue dextran,BD)和人體免疫球蛋白(immunoglobulin G,IgG)評價這一系列結構變化對超濾膜的分離性能的影響。
1 實 驗
1.1 材料與儀器
材料:α-cellulose≥98%精制棉(湖北金漢江精細棉纖維有限公司)。
試劑:無水氯化鋅(ZnCl2)、六水氯化鋁(AlCl3·6H2O)、乙醇、乙二醇(上海阿拉丁生化科技股份有限公司)、丙酮(國藥集團化學試劑有限公司),IgG、2000 kDa BD(美國Sigma-Aldrich公司)、Dextran-1(1 kDa)、Dextran-5(5 kDa)、Dextran-40(40 kDa)、Dextran-70(70 kDa)、Dextran-500(500 kDa)、Dextran-2000(2000 kDa)(生工生物工程(上海)股份有限公司)。所有材料均未經進一步的純化,試劑均為分析純。
儀器:IRSpirit傅里葉紅外光譜儀(日本島津公司),DX-2700BH X射線衍射儀(丹東浩元儀器有限公司),GeminiSEM 500掃描電子顯微鏡(德國蔡司公司),Agilent 1260 Infinity Ⅱ液相色譜儀(安捷倫科技有限公司),TSK gel G5000PWXL色譜柱(日本東曹公司)。
1.2 實驗方法
1.2.1 纖維素的溶解
纖維素的溶解參照文獻[13]描述的方法。具體來說,在一個燒杯中配制了AlCl3/ZnCl2水溶液(摩爾比為AlCl3︰ZnCl2︰H2O=0.1︰0.9︰4)。稱取質量分數為3%纖維素加入上述溶液中,在室溫下連續攪拌3 h,確保所有纖維素溶解,生成無可見殘留物的清澈纖維素溶液。隨后,纖維素溶液經離心處理,直至不再存在顯著氣泡。
由于在纖維素溶解過程中攪拌速度、投料速度等因素會導致溶解后纖維素降解程度的不可控,所以在纖維素溶液使用前,會在50 ℃烘箱中加熱使纖維素聚合度(DP)降解至(250±10),再使用纖維素溶液進行后續實驗,以排除纖維素聚合度對膜結構的影響。采用GB/T 1548—2016《紙漿銅乙二胺(CED)溶液中特性粘度值的測定》的方法來測量纖維素聚合度并確認纖維素聚合度到達上述范圍。在降解之后再次離心以去除溶液中的氣泡。
1.2.2 再生纖維素超濾膜的制備
將纖維素溶液倒在玻璃板上,用特制的間隙為200 μm的不銹鋼刮刀刮平。靜置片刻后,將其浸入1 L的凝固浴中10 min,以確保纖維素完全再生。隨后,將RC膜浸入5 L去離子水中洗滌,靜置24 h以去除無機殘留物,此過程重復兩次。RC膜按凝固浴命名:在水、乙醇、乙二醇、丙酮中再生的膜分別命名為RC-HO、RC-ET、RC-EG、RC-AC,在水和乙醇混合比例中再生的膜按乙醇的質量分數+ET命名,如在40%乙醇中再生的膜命名為RC-40ET。
1.3 表征和測試方法
1.3.1 化學結構表征
使用IRSpirit傅里葉變換紅外光譜儀以ATR模式在4 000~400 cm-1光譜寬度內對膜進行掃描以表征膜的化學結構。濕潤的RC膜樣品在冷凍干燥機中干燥24 h后,每張膜在室溫下掃描了64次,每個試樣測試至少3次。
1.3.2 晶體結構表征
使用DX-2700BH X射線衍射儀掃描并評估膜的結晶情況。掃描步長設定為0.02°,結晶度指數(CrI)通過下式計算[18]:
CrI=100×AcrystAcryst+Aamorph(1)
式中:Acryst是結晶纖維素計算圖案下的面積,而Aamorph是計算得到的無定形含量的圖案下的面積。
1.3.3 表面形貌和微觀結構表征
使用GeminiSEM 500掃描電子顯微鏡在2 kV的加速電壓下獲取膜的表面形貌和微觀結構圖像。樣品在液氮淬斷并立即放入冷凍干燥機進行干燥,并在觀察前使用了濺射鍍膜儀,在0.1 mbar和20 mA的條件下,用Pt進行涂覆,持續120 s。通過NIH Image J分析軟件對膜的表面孔徑進行統計分析。
1.3.4 分子量截留率(MWCO)表征
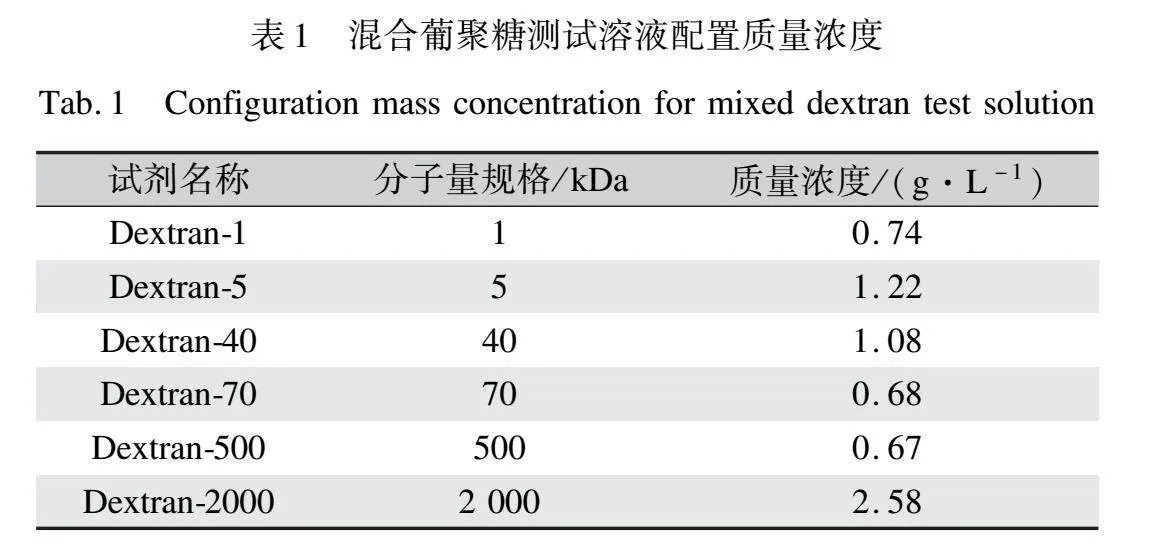
MWCO是評估膜孔徑分布和保留性能的常用方法[19-20]。葡聚糖測試溶液包含各種分子量的葡聚糖混合物,質量濃度和試劑如表1所示。
將膜放入一個Amicon攪拌池式過濾器(默克,操作面積為13.4 cm2)中,注入50 mL的葡聚糖測試溶液。采用蠕動泵(BQ50-1J)循環葡聚糖溶液。泵從M+lkifCCKPqBo6f1AuKvMg==Amicon攪拌池式過濾器的出口處抽取葡聚糖溶液,循環,然后將其返回到過濾器的進液口中。在泵的流速為0.1 mL/min的情況下,過濾器中的溶液循環了1 h。隨后,通過Agilent 1260 Infinity Ⅱ液相色譜儀對在過濾器中的保留樣品和在泵循環中的透過樣品進行分析,以計算峰面積。在40 ℃下使用液相色譜儀進行分析,流動相為50 mmol/L磷酸鹽緩沖液,用氫氧化鈉溶液調pH值至7.0。對不同分子量的截留率RA通過下式計算:
RA=1-APAR×100(2)
式中:AP是透過樣品的峰面積,AR是原測試樣品的峰面積。
1.3.5 膜超濾性能測試
使用Amicon攪拌池式過濾器,評估膜的純水通量和溶質截留能力。膜的水通量測試和過濾性能測試的操作壓力均設置為1 bar。膜的純水通量通過下式計算:
Jw=VAΔt(3)
式中:Jw表示純水通量,L/(m2·h);V表示透過水的體積,L;A表示操作膜面積,m2;Δt表示滲透時間,h。
膜的溶質阻隔能力通過使用1 g/L BD水溶液(溶于去離子水)、1 g/L IgG(溶解于0.9%氯化鈉溶液中)溶液進行評估。由于BD與噬菌體尺寸近似,用來模擬膜對噬菌體的阻隔能力。為了減輕由于濃縮極化導致的污染,使用了磁力攪拌器,以200 r/min的速度攪動溶液[21]。隨后,阻隔率R通過下式確定:
R/%=1-CpCf×100(4)
式中:Cp和Cf表示透過液和原始溶液中的質量濃度,通過UV-可見分光光度法測定透過液(Cp)和進料溶液(Cf)中BD、IgG和BSA的質量濃度。
2 結果與分析
2.1 再生纖維素膜的紅外光譜分析
針對在不同凝固浴中得到的再生纖維素膜,首先研究了其化學結構的變化。不同再生纖維素超濾膜的FTIR-ATR光譜如圖1所示。
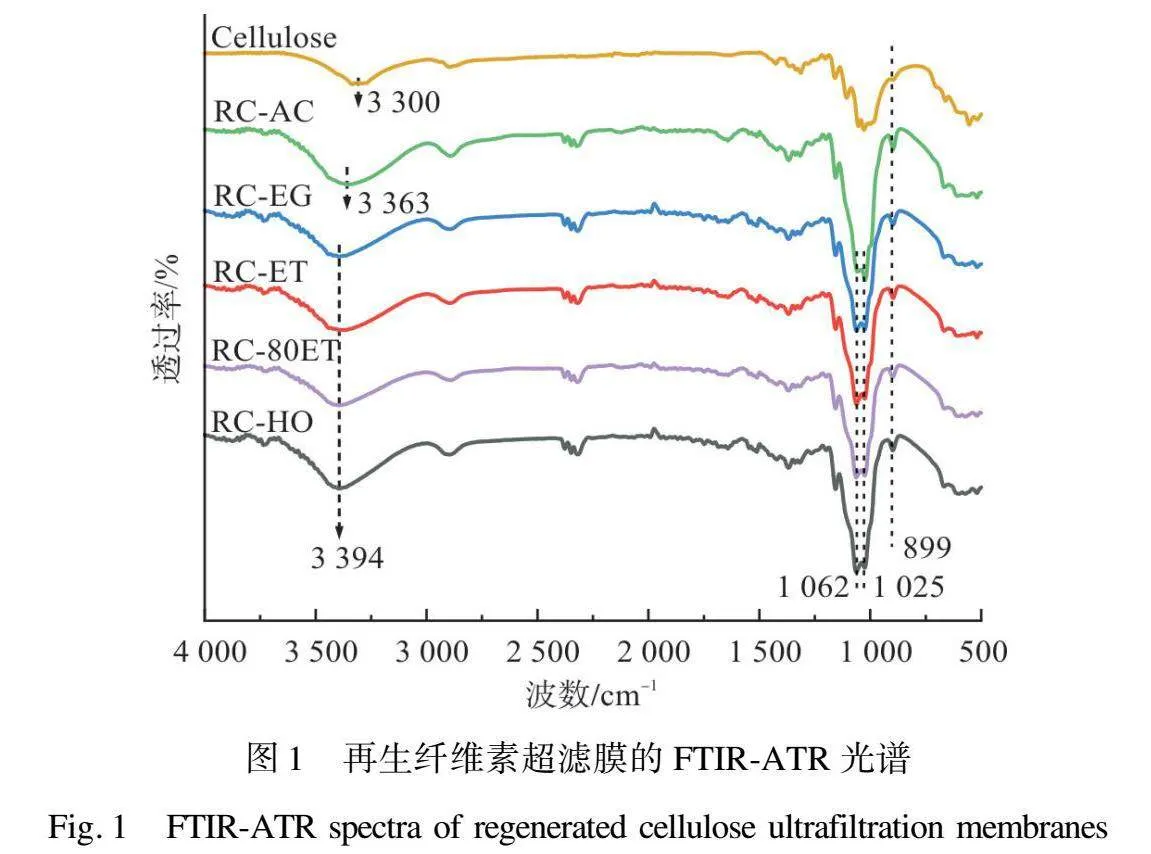
由圖1可見,纖維素原料的O—H峰出現在3 300 cm-1附近。而在溶解和再生過程之后,O—H峰移動到更大的波長。具體來說,對于在丙酮中再生的纖維素膜,O—H峰移動
到3 363 cm-1,而對于在水、乙二醇、乙醇和乙醇/水混合物中再生的纖維素膜,O—H峰移動到3 394 cm-1。同時,C—H峰從2 896 cm-1移動到略低的2 893 cm-1[12]。此外,與原材料相比,RC超濾膜在899 cm-1處的吸收峰明顯增強,表明再生纖維素無定形區域的增加,結晶度變低[22-23]。很明顯,在不同凝固浴中再生的纖維素超濾膜的光譜與纖維素原料的光譜非常相似,與文獻[23]中RC材料的紅外光譜結果相似,并沒有纖維素衍生物峰的出現,這證實了這種RC超濾膜制造方法的非衍生性[12]。
2.2 凝固浴對于再生纖維素超濾膜結構的影響
纖維素原料及在不同凝固浴中獲得的再生纖維素膜的XRD圖譜如圖2所示。
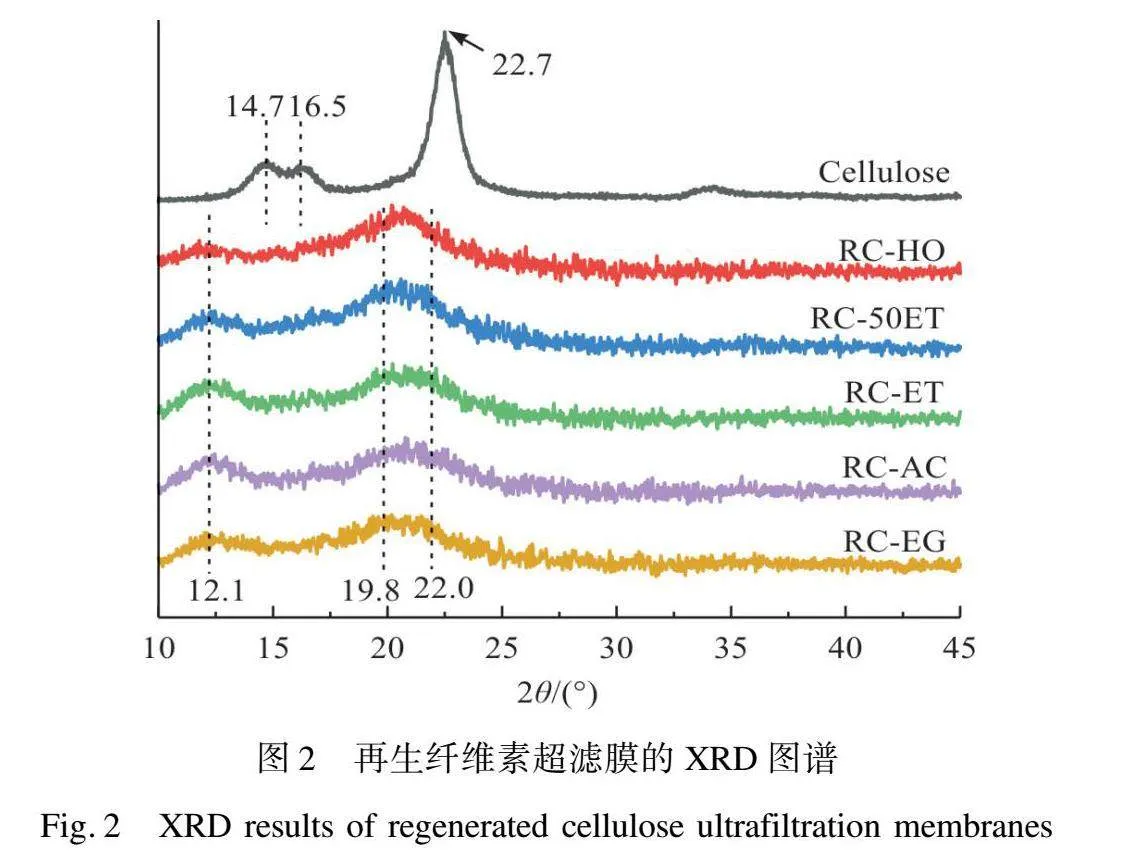
由圖2可見,在不同凝固浴中再生的RC超濾膜呈現相似的晶型結構,但由于凝固浴類型的不同,衍射峰的強度略有差異。纖維素原料樣品在2θ=14.8°、16.3°和22.6°處的衍射峰對應典型的纖維素Ⅰ晶體的晶面衍射峰,即(11-0)(110)(200)[24-25]。而RC超濾膜樣品在2θ=12.1°、19.8°和22.0°處的衍射峰則對應典型的纖維素Ⅱ的晶面衍射峰,即(11-0)(110)(020)晶面[24,26]。值得注意的是,在有機溶劑中再生的纖維素超濾膜的(11-0)和(020)晶面的衍射峰強度明顯強于在水中再生的纖維素膜,而(110)晶面的衍射峰強度略微減弱。類似的趨勢也在乙醇和水的混合溶液再生纖維素膜上觀察到:隨著乙醇比例的增加,纖維素膜的(11-0)和(020)峰的強度逐漸增強。在一些其他系統的纖維素再生材料中也存在類似的現象。由于纖維素中的羥基位于吡喃葡萄糖環的赤道位置[27],與(1-10)晶面的表面對齊,因此(1-10)晶面具有顯著的親水性。因此,(1-10)平面的排列提高和結晶度增加有助于增加RC超濾膜表面上羥基的濃度,從而增強其潤濕性[27],這也是RC超濾膜具有高親水性和抗蛋白質污染性的原因[28-29]。總的來說,RC超濾膜的制造過程僅涉及纖維素晶型的變化,而沒有額外的衍生化反應。
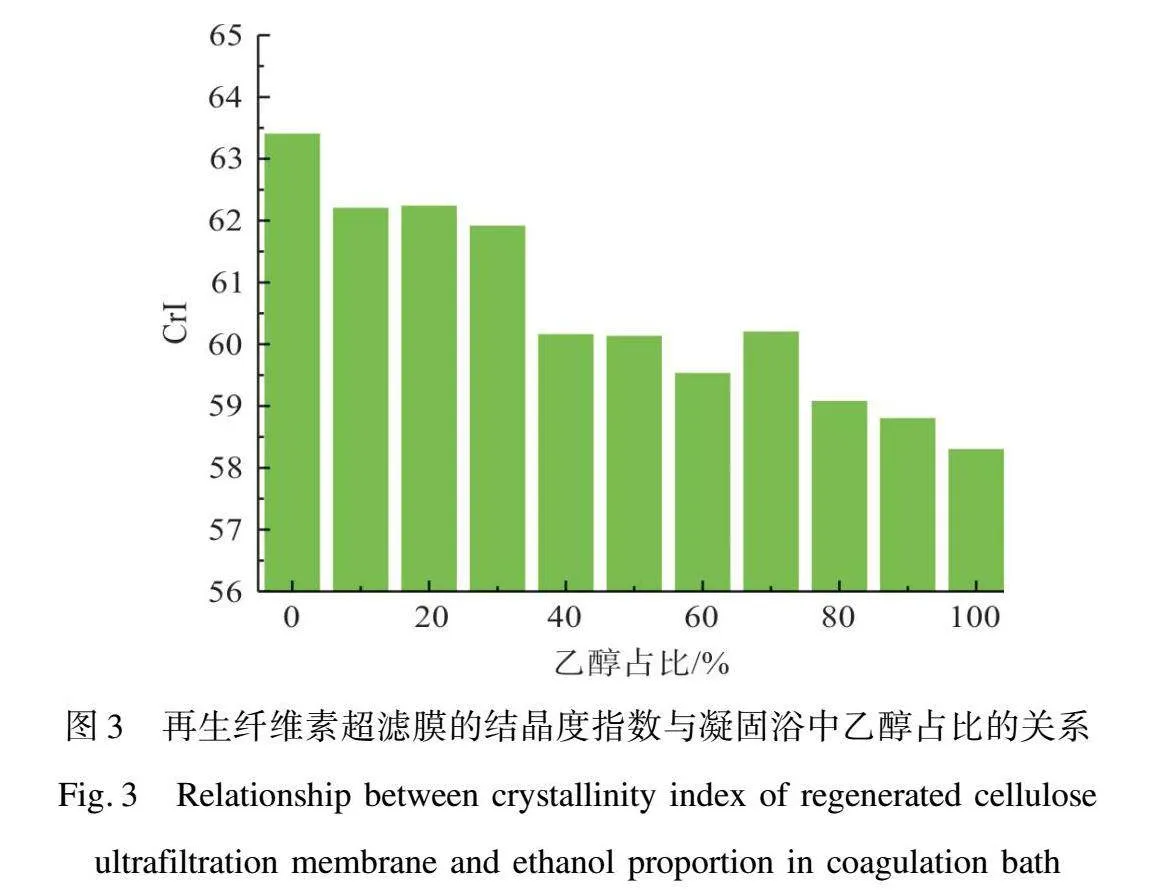
RC超濾膜的結晶度指數如圖3所示。隨著凝固浴中乙醇占比的增加,RC超濾膜的結晶度略微下降,從RC-HO的63.4降低至RC-ET的58.3。結晶度的降低說明RC超濾膜的無定形區域增加,并且結構趨于松散,這或許會導致膜孔徑結構的略微變大。
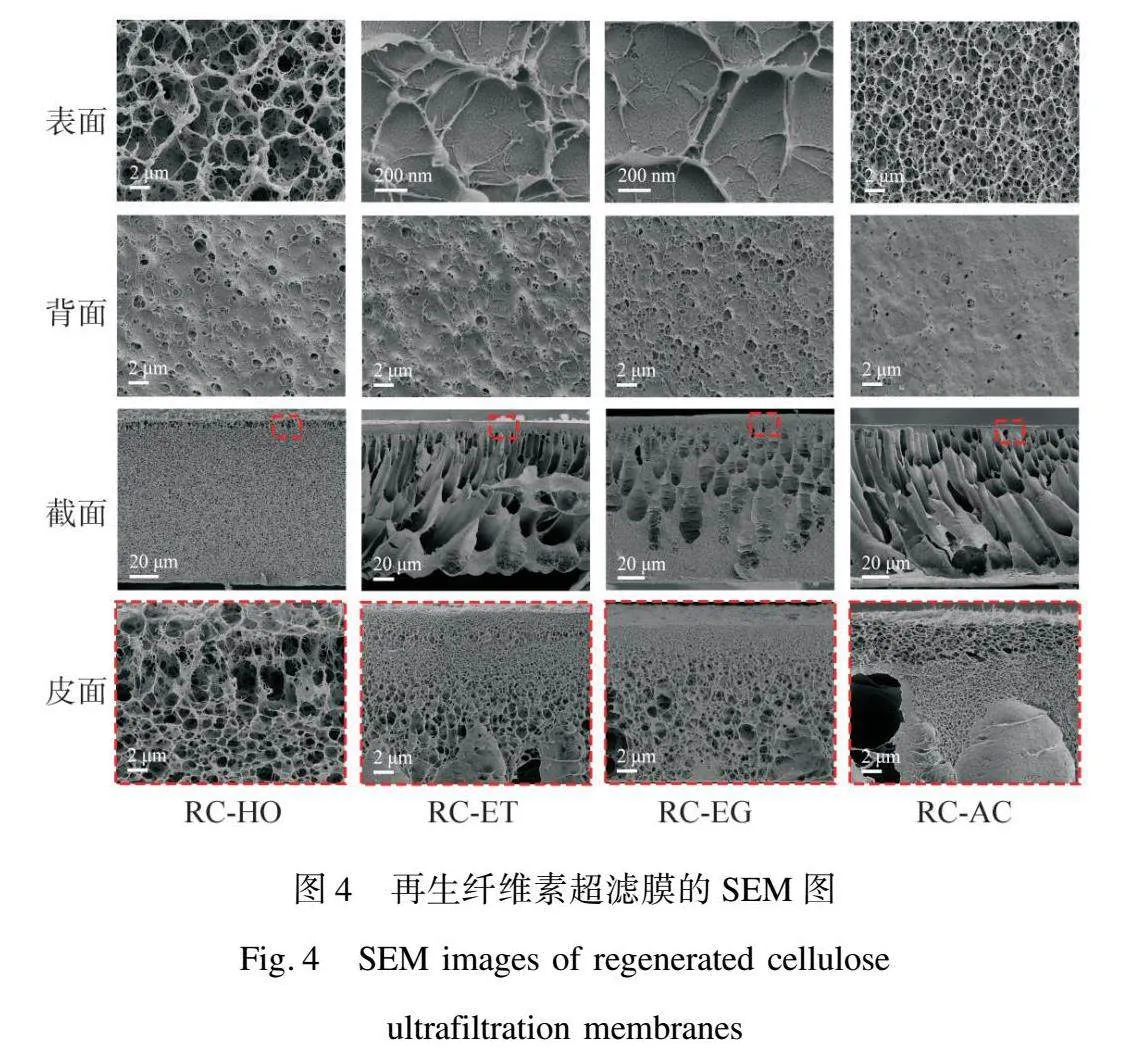
圖4展示了在不同凝固浴中得到的RC超濾膜的結構。由膜的正反面可以看到,在乙醇(RC-ET)和乙二醇(RC-EG)中得到的RC超濾膜均具有較為密實的表面,以及大孔的背面;在丙酮(RC-AC)和水(RC-HO)中得到的RC超濾膜的背面也具有類似的結構,但是他們的表面均為大孔的疏松層。在乙醇和乙二醇中得到的膜的致密表面歸因于浸入凝固浴的瞬間產生的瞬時相分離[30],在橫截面中也可以看到RC-ET和RC-EG明顯的致密層。不同的是,RC-AC和RC-HO的疏松表層可能歸因于分相的延遲。在ZnCl2/AlCl3/RH2O體系中,纖維素一旦溶解,即使添加水,ZnCl2/AlCl3/RH2O體系也會在3<R<9內保持纖維素的溶解狀態[31],而丙酮也具有相似的機理,能夠在少量添加的情況下保持纖維素的溶解狀態[32]。所以當初生膜浸入凝固浴時,凝固浴中的非溶劑會先侵入初生膜內部,導致纖維素質量濃度的降低,使得其在再生時以一種更低密度的形式進行沉淀。RC-AC相比RC-HO具有更小的孔徑,這歸因于溶劑與非溶劑更快的交換速度,在截面結構中也可以看到這樣的交換速度差帶來的結構變化。從截面中還可以看到,在有機溶劑中得到的RC膜均具有典型的不對稱超濾結構,包括一個致密的表層和一個具有大孔的支撐層,而在水中再生得到的膜(RC-HO)表現出典型的海綿狀結構。這是由于在水中再生時,溶劑與非溶劑的交換速率較慢,導致膜具有海綿狀形態[30],而在有機溶劑中再生時,由于較高的溶劑—非溶劑交換速度,導致膜的亞結構中形成了大型“指狀”孔[33]。RC-EG和RC-ET內部的孔徑隨著和膜表面距離的增加而不斷變大,與PES和PVDF等材料通過NIPS法制備的膜結構相似[34],呈現梯度狀的孔徑分布。雖然RC-AC膜表面出現了一些相對較大的孔洞,但整體上看,膜內部的孔徑仍隨著距離增加而增大。
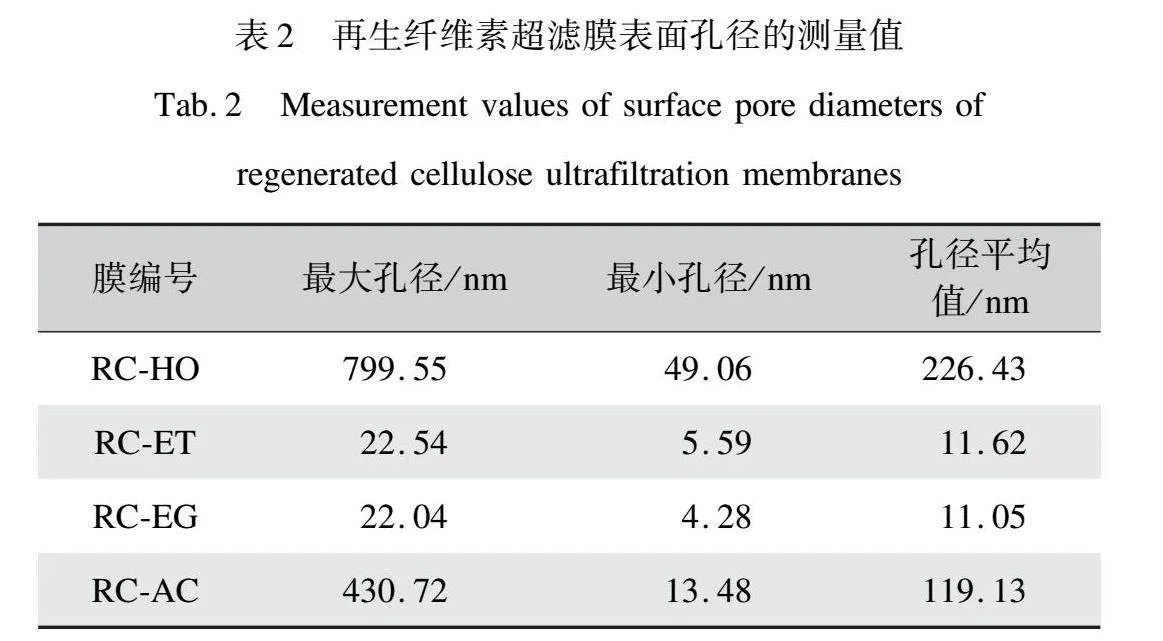
對膜表面孔徑的統計數據如表2所示,可見RC-HO表現出最大的表面孔徑,平均孔徑達到了226.43 nm,RC-AC的表面平均孔徑也達到了119.13 nm。相對而言,RC-ET和RC-EG的表面平均孔徑分別為11.62 nm和11.05 nm。這一系列結果表明,雖然有機溶劑能夠帶來更高的溶劑—非溶劑交換速度,更利于超濾結構的產生,但是有機溶劑的選擇是至關重要的。在乙醇和乙二醇這兩種醇中可以得到具有典型超濾結構的RC超濾膜,膜整體結構優于在丙酮和水中得到的RC超濾膜。
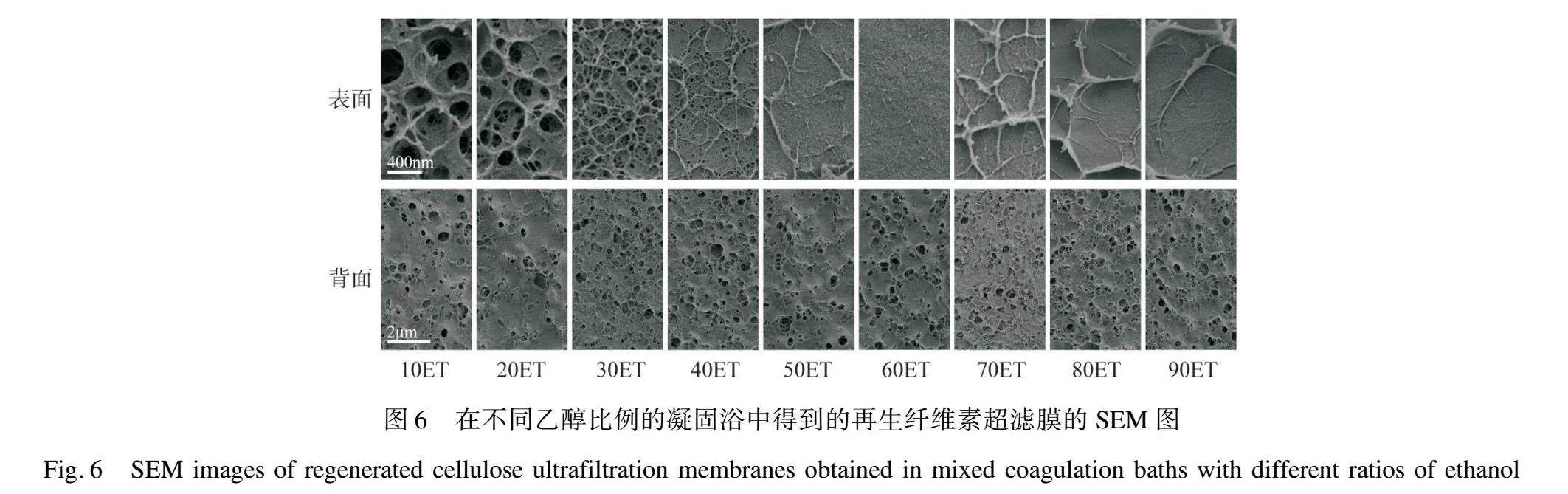
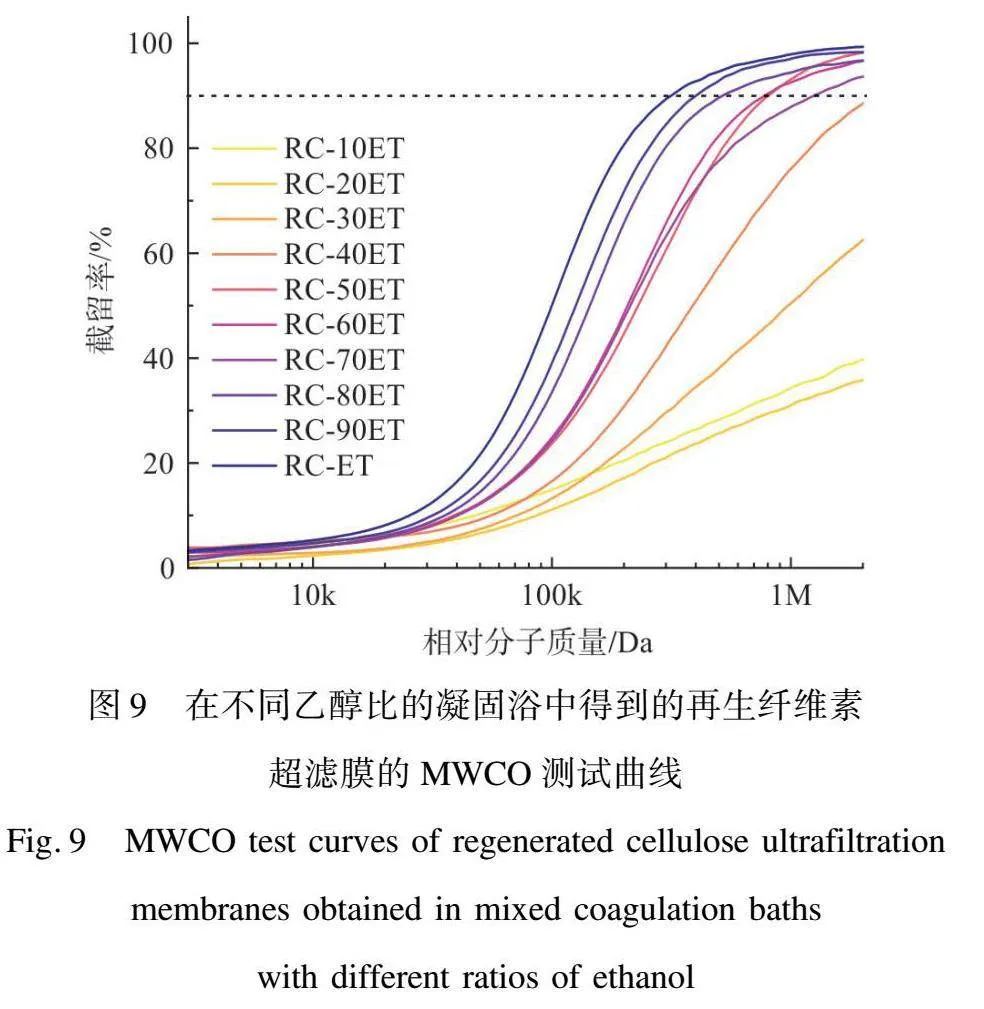
本文選用水和乙醇混合物作為凝固浴,并通過調整其中的乙醇質量分數來研究有機溶劑對RC超濾膜結構的影響。圖5展示了在不同乙醇比的混合凝固浴中得到的RC超濾膜的截面SEM圖。當乙醇質量分數達到30%時,膜的表面出現了微小的皮層狀結構(RC-30ET),同時膜內部的孔徑大小開始呈階梯狀分布,即靠近膜表面時孔徑變小,而遠離膜表面時孔徑變大。這種趨勢僅存在于膜表面約2 μm的部分。隨著乙醇質量分數的增加,該致密皮層的厚度也逐漸增加,從一開始的RC-30ET中約2 μm逐漸上升到RC-ET中約6 μm。這表明隨著凝固浴中乙醇比例的增加,溶劑—非溶劑交換速度加快,初生膜浸入凝固浴時瞬時分相對膜的影響區域逐漸增大,使得膜的致密皮層逐漸變厚。對于膜內部而言,當乙醇質量分數低于70%時,主要形成海綿狀的孔通道結構,但是當乙醇占比達到70%左右時,再生膜內的沉淀速率超過臨界閾值,直接導致膜內形成大的“指狀”空隙。這意味著可以通過控制乙醇比例實現對膜表面和內部結構的控制,以根據實際應用需要選擇指狀孔或是海綿狀孔洞。圖6展示了在不同乙醇和水比例的混合凝固浴中得到的再生纖維素超濾膜的表面和背面SEM圖。
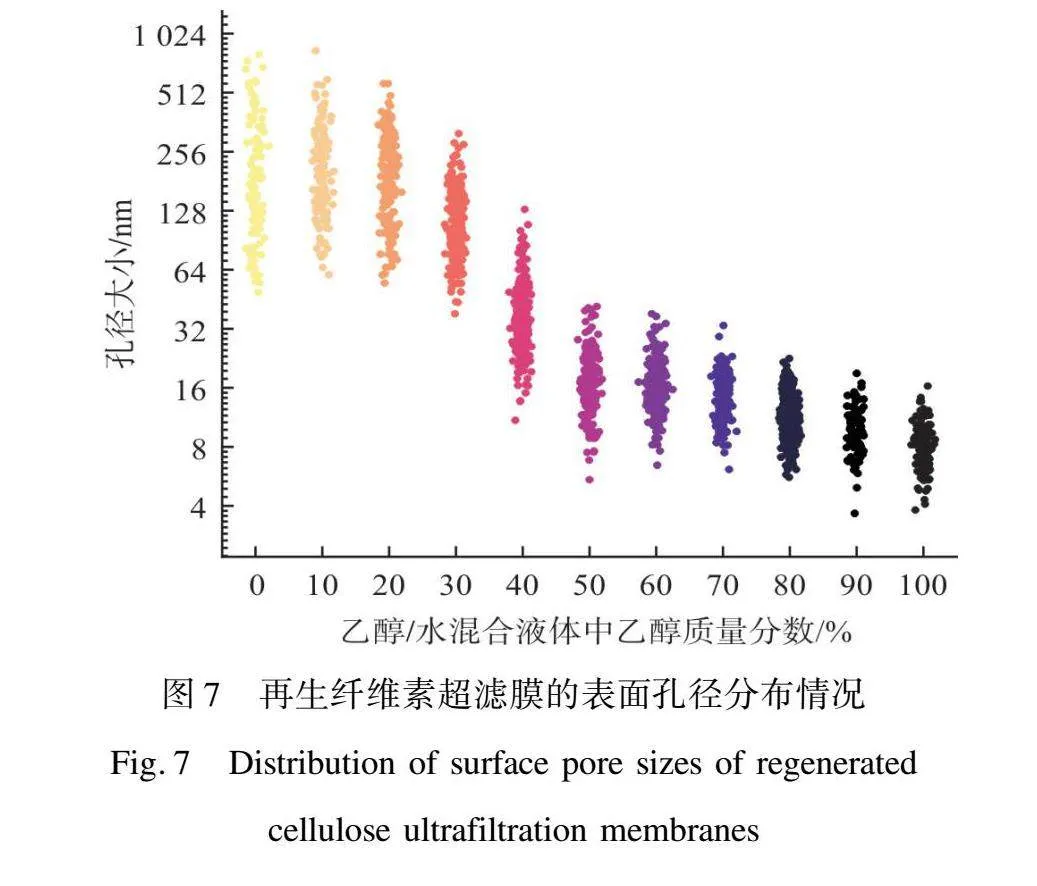
由圖6可以觀察到,隨著乙醇質量分數的增加,再生纖維素超濾膜的表面孔徑逐漸變小,而膜的背面的孔徑大小和形態保持相對穩定。這些正面圖像中孔徑大小的變化也說明了致密層的增厚和膜表面孔徑的減小是一致的趨勢。從圖7中的孔徑統計數據可以進一步看出,隨著乙醇質量分數的增加,膜表面孔徑的平均值逐漸減小。在乙醇質量分數從0到100%的過程中,膜表面孔徑的平均值從226.43 nm(RC-HO)降至11.62 nm(RC-ET)。同時,孔徑的分布也逐漸變窄。上述結果表明乙醇質量分數的增加能夠有效減小膜表面孔徑。
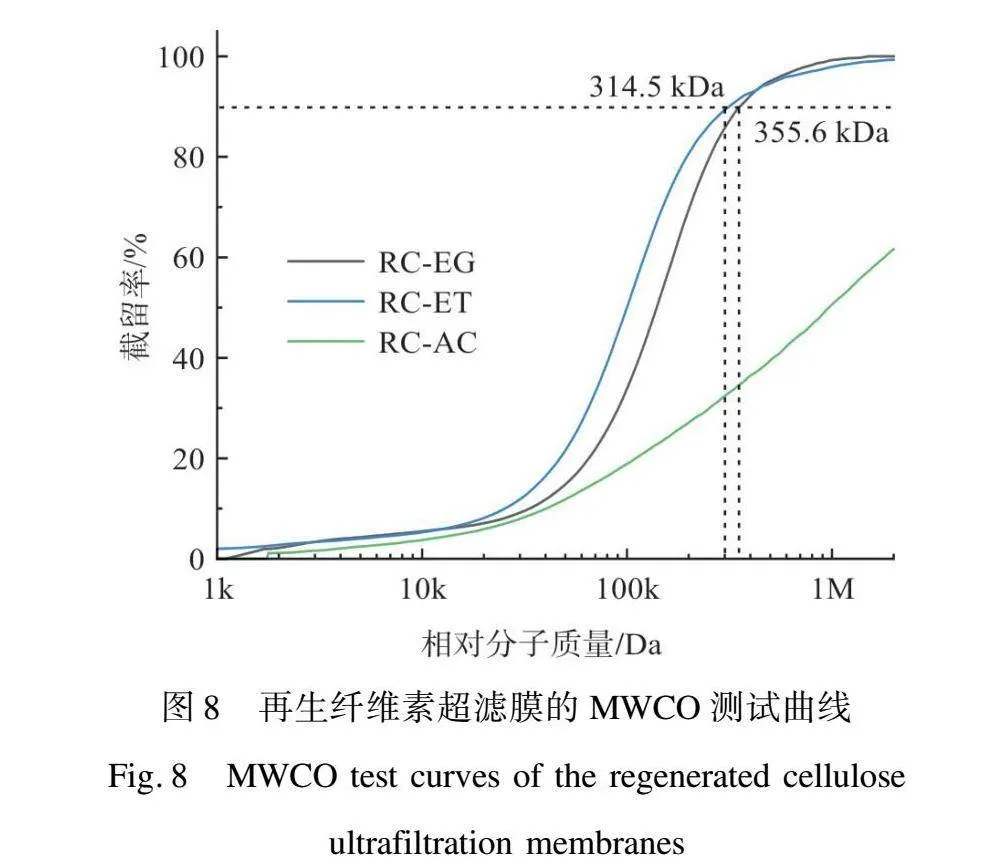
在生物純化領域使用的超濾膜通常采用MWCO來評價膜對于不同相對分子質量物質的截留能力,因此在SEM圖像統計的基礎上,本文進一步使用了MWCO測試以更精確地評價膜的孔徑大小。圖8顯示了在純有機溶劑或純水中膜對于不同相對分子質量葡聚糖的截留能力。可以看到,RC-EG和RC-ET展現出相似的孔徑大小,MWCO值分別為355.6 kDa和314.5 kDa。對于RC-AC來說,其并不具備典型的MWCO值,主要由于其表面大量的缺陷孔,使得其不能對2 000 kDa及以下的物質進行90%以上的截留。而RC-HO相較于RC-AC具有更大的表面孔徑,允許大多數葡聚糖分子通過,使得其在圖8中展現出低于5%的曲線。由圖9可以看到,再生纖維素超濾膜的MWCO曲線從RC-30ET開始,膜開始出現小于2 000 kDa的MWCO值,這也是膜致密皮層出現的節點。隨著乙醇占比的提升,再生纖維素膜的MWCO值開始變小。其中,RC-80ET、RC-90ET、RC-ET的MWCO值分別為516.47、402.43 kDa和314.5 kDa。這些結果與膜表面孔徑統計結果的變化趨勢相似。
2.3 凝固浴的對再生纖維素膜超濾性能的影響
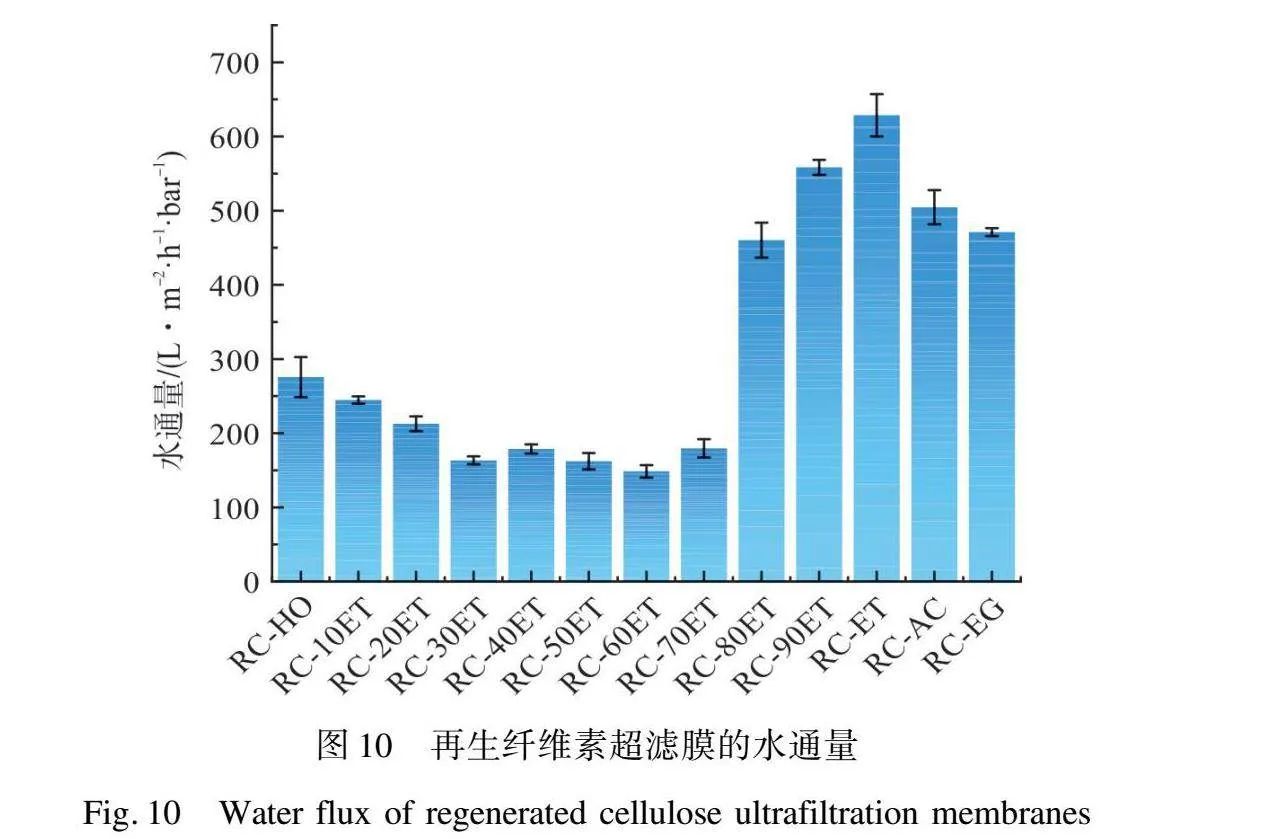
由圖10可以看到,RC-ET、RC-AC和RC-EG均表現出高于RC-HO的水通量性能,分別為628.57、504.64、471.05 LMH/bar和275.71 LMH/bar,水通量的顯著提升可以歸因于膜內部指狀孔的出現。在RC-HO到RC-60ET這個過程中,膜的水通量從275.71 LMH/bar逐漸下降至148.58 LMH/bar,對應凝固浴中乙醇質量分數從0提升至60%。水通量的降低歸因于膜的表面孔徑逐漸變小。當乙醇質量分數達到70%時,膜RC-70ET的水通量相較于RC-60ET有了微小的提升,達到了179.69 LMH/bar,而從圖5中可以看出,RC-70ET膜內部指狀孔已經開始出現。隨著凝固浴中乙醇質量分數的進一步提升,膜的水通量顯著變大,RC-80ET和RC-90ET膜的水通量分別提升至460.23 LMH/bar和558.39 LMH/bar。當乙醇質量分數達到100%時,RC-ET表現出最好的通量628.57 LMH/bar。這可以說明指狀孔對于膜水通量性能的巨大貢獻作用,且在高乙醇占比的凝固浴中再生的RC超濾膜具有更多的指狀孔。
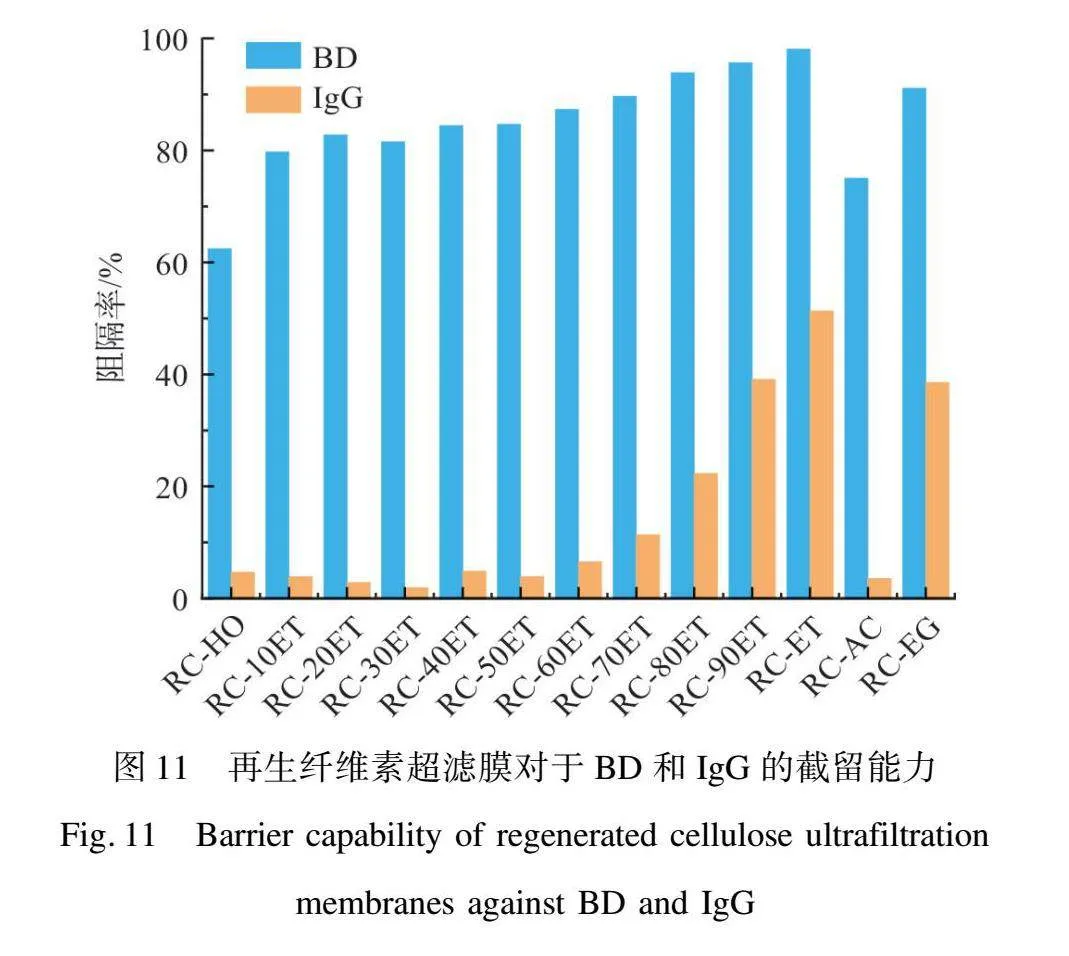
為了評估膜在實際應用中對蛋白及其他物質的截留性能,本文采用了IgG和平均相對分子質量為2 000 kDa的BD進行膜的截留性能測試。由圖11可知,在幾種有機溶劑和水中再生得到的膜中,RC-ET和RC-EG表現出了最佳的截留性能,RC-ET和RC-EG對BD的截留率分別為98.07%和9111%,對IgG的截留率分別為51.33%和38.57%,這與前文中孔徑的統計結果相符。然而,在水和丙酮中再生的纖維素超濾膜RC-HO和RC-AC由于表面孔洞的巨大,截留性能均較差。隨著水和乙醇混合凝固浴中乙醇比例的提高,膜的截留能力也有所增強。乙醇質量分數從0提升至100%這個過程中,再生纖維素超濾膜對BD和IgG的截留量逐漸增大,分別從62.44%和4.68%提升至98.07%和51.33%。這些結果與膜的表面孔徑分布測試及膜的MWCO測試結果一致,進一步證明了在高乙醇質量分數的凝固浴中能夠得到具有更小表面孔徑的再生纖維素超濾膜。
3 結 論
本文驗證了使用ZnCl2/AlCl3溶解體系直接從棉漿中制備RC超濾膜的可行性,在不同凝固浴中再生的RC超濾膜具有不同的結構。在特定的有機溶劑(如乙醇和乙二醇)凝固浴中獲得的RC膜具有典型超濾結構,包括一個致密的表層和一個具有大孔的支撐層。相比之下,在水中只能獲得具有大的海綿狀孔洞的超濾膜。隨著水/乙醇混合凝固浴中乙醇質量分數的增加,在其中獲得的RC超濾膜的皮層厚度逐漸變厚、皮層孔徑逐漸變小,并且當乙醇質量分數達到70%時膜內部開始出現指狀孔。這樣的結構變化顯著提升了RC超濾膜的水通量和截留性能,使得在純乙醇中再生得到的RC-ET水通量可達到628.57 LMH/bar,并且MWCO值可以達到314.5 kDa,能夠有效分離病毒標志物BD和IgG。這種新型RC超濾膜制備方法簡單、成本低、無須額外耗能,因此在醫藥生產中具備廣闊的應用前景。
參考文獻:
[1]RATHORE A S, SHIRKE A. Recent developments in membrang-based separations in biotechnology processes: Review[J]. Preparative Biochemistry & Biotechnology, 2011, 41(4): 398-421.
[2]VAN REIS R, ZYDNEY A. Bioprocess membrane technology[J]. Journal of Membrane Science, 2007, 297(1/2): 16-50.
[3]VARANASI S, LOW Z X, BATCHELOR W. Cellulose nanofibre composite membranes: Biodegradable and recyclable UF membranes[J]. Chemical Engineering Journal, 2015(265): 138-146.
[4]胡旦花. 再生纖維素纖維制造技術的發展[J]. 化纖與紡織技術, 2023, 52(3): 41-43.
HU D H. Development of regenerated cellulose fiber manufacturing technology[J]. Chemical Fiber & Textile Technology, 2023, 52(3): 41-43.
[5]KAMMAKAKAM I, LAI Z P. Next-generation ultrafiltration membranes: A review of material design, properties, recent progress, and challenges[J]. Chemosphere, 2023(316): 137669.
[6]李江琴, 姚凱利, 胡天丁, 等. 纖維素基膜材料的應用研究進展[J]. 功能材料, 2023, 54(6): 6080-6087.
LI J Q, YAO K L, HU T D, et al. Research progress in the application of cellulose-based membrane materials[J]. Journal of Functional Materials, 2023, 54(6): 6080-6087.
[7]OPREA M, VOICU S I. Recent advances in composites based on cellulose derivatives for biomedical applications[J]. Carbohydrate Polymers, 2020(247): 116683.
[8]JIANG F, LI T, LI Y J, et al. Wood-based nanotechnologies toward sustainability[J]. Advanced Materials, 2018, 30(1): 1703453.
[9]GE W J, SHUAI J B, WANG Y Y, et al. Progress on chemical modification of cellulose in “green” solvents[J]. Polymer Chemistry, 2022, 13(3): 359-372.
[10]韓宗保, 王運利. 纖維素溶解體系研究進展[J]. 合成纖維, 2021, 50(2): 1-6.
HAN Z B, WANG Y L. Research progress of cellulose dissolving system[J]. Synthetic Fiber in China, 2021, 50(2): 1-6.
[11]TONG Z H, MENG J, LIU S, et al. Room temperature dissolving cellulose with a metal salt hydrate-based deep eutectic solvent[J]. Carbohydrate Polymers, 2021(272): 118473.
[12]ZHAO J C, DENG M W, LI S Y, et al. Room temperature preparation of cellulose nanocrystals with high yield via a new ZnCl2 solvent system[J]. Carbohydrate Polymers, 2022(278): 118946.
[13]XI Y, ZHANG L L, TIAN Y H, et al. Rapid dissolution of cellulose in an AlCl3/ZnCl2 aqueous system at room temperature and its versatile adaptability in functional materials[J]. Green Chemistry, 2022, 24(2): 885-897.
[14]周慧梅, 張莉莉, 馬金霞, 等. 基于金屬鹽溶液的纖維素溶解及其應用研究進展[J]. 精細化工, 2023, 40(7): 1393-1404.
ZHOU H M, ZHANG L L, MA J X, et al. Research and application progress on dissolution of cellulose in metal salt solutions[J]. Fine Chemicals, 2023, 40(7): 1393-1404.
[15]呂文志, 周小凡, 龍柱. 氯化鋅溶解制備纖維素膜及其透析性能研究[J]. 纖維素科學與技術, 2015, 23(4): 16-22.
L W Z, ZHOU X F, LONG Z. Preparation of cellulose membrane with ZnCl2 dissolved fiber and study to its dialysis performance[J]. Journal of Cellulose Science and Technology, 2015, 23(4): 16-22.
[16]LI Y, PAN G Y, ZHANG Y, et al. A new method for tailoring the surface pore size and internal pore structure of ultrafiltration membranes without using additives: Atomization-assisted nonsolvent induced phase separation method[J]. Separation and Purification Technology, 2023(304): 122334.
[17]POCHIVALOV K V, BASKO A V, ILYASOVA A N, et al. Experimental phase diagram for the PVDF-DMAc-water ternary system with new topology: Method of construction, thermodynamics, and structure formation of membranes[J]. Polymer, 2023(282): 126152.
[18]LING Z, WANG T, MAKAREM M, et al. Effects of ball milling on the structure of cotton cellulose[J]. Cellulose, 2019, 26(1): 305-328.
[19]SAVA瘙塁-ALKAN A, ULFAZ-EMECEN P Z. Solvent recovery from photolithography wastes using cellulose ultrafiltration membranes[J]. Journal of Membrane Science, 2022(647): 120261.
[20]YEHL C J, ZYDNEY A L. Characterization of dextran transport and molecular weight cutoff (MWCO) of large pore size hollow fiber ultrafiltration membranes[J]. Journal of Membrane Science, 2021(622): 119025.
[21]GUO W S, NGO H H, LI J X. A mini-review on membrane fouling[J]. Bioresource Technology, 2012(122): 27-34.
[22]XIA G M, HAN W J, XU Z, et al. Complete recycling and valorization of waste textiles for value-added transparent films via an ionic liquid[J]. Journal of Environmental Chemical Engineering, 2021, 9(5): 106182.
[23]XIA G M, ZHOU Q W, XU Z, et al. Cellulose-based films with ultraviolet shielding performance prepared directly from waste corrugated pulp[J]. Polymers, 2021, 13(19): 3359.
[24]XU K J, XIAO Y X, CAO Y, et al. Dissolution of cellulose in 1-allyl-3-methylimidazolium methyl phosphonate ionic liquid and its composite system with Na2PHO3[J]. Carbohydrate Polymers, 2019(209): 382-388.
[25]YUAN H M, WU J F, WANG D, et al. Ultra-high-strength composite films prepared from NMMO solutions of bamboo-derived dissolving pulp and chitosan[J]. Industrial Crops and Products, 2021(170): 113747.
[26]CAI J, ZHANG L. Rapid dissolution of cellulose in LiOH/Urea and NaOH/Urea aqueous solutions[J]. Macromolecular Bioscience, 2005, 5(6): 539-548.
[27]YAMANE C, AOYAGI T, AGO M, et al. Two different surface properties of regenerated cellulose due to structural anisotropy[J]. Polymer Journal, 2006, 38(8): 819-826.
[28]RAZMJOU A, MANSOURI J, CHEN V. The effects of mechanical and chemical modification of TiO2 nanoparticles on the surface chemistry, structure and fouling performance of PES ultrafiltration membranes[J]. Journal of Membrane Science, 2011, 378(1/2): 73-84.
[29]VATANPOUR V, MADAENI S S, RAJABI L, et al. Boehmite nanoparticles as a new nanofiller for preparation of antifouling mixed matrix membranes[J]. Journal of Membrane Science, 2012(401/402): 132-143.
[30]STRATHMANN H, KOCK K, AMAR P, et al. The formation mechanism of asymmetric membranes[J]. Desalination, 1975, 16(2): 179-203.
[31]SEN S, LOSEY B P, GORDON E E, et al. Ionic liquid character of zinc chloride hydrates define solvent characteristics that afford the solubility of cellulose[J]. The Journal of Physical Chemistry B, 2016, 120(6): 1134-1141.
[32]SCHESTAKOW M, KARADAGLI I, RATKE L. Cellulose aerogels prepared from an aqueous zinc chloride salt hydrate melt[J]. Carbohydrate Polymers, 2016(137): 642-649.
[33]MOUSAVI S M, RAVESHIYAN S, AMINI Y, et al. A critical review with emphasis on the rheological behavior and properties of polymer solutions and their role in membrane formation, morphology, and performance[J]. Advances in Colloid and Interface Science, 2023(319): 102986.
[34]GUILLEN G R, PAN Y J, LI M H, et al. Preparation and characterization of membranes formed by nonsolvent induced phase separation: A review[J]. Industrial & Engineering Chemistry Research, 2011, 50(7): 3798-3817.
Effect of different coagulation baths on the structure and performance ofregenerated cellulose ultrafiltration membranes
ZHANG Chi, WANG Xiangrong
CHEN Ming1, YANG Shujuan1,2, ZHANG Yong1,2
(1.Key Laboratory of Advanced Textile Materials and Manufacturing Technology, Ministry of Education, Zhejiang Sci-Tech University,Hangzhou 310018, China; 2.Zhejiang Sci-Tech University Xiangshan Knitting Institute Co., Ltd., Ningbo 315700, China)
Abstract: The application of various ultrafiltration membranes in biopharmaceutical production presents promising opportunities, offering effective separation of target substances with low energy consumption and minimal chemical additives. These membranes achieve effective separation of target substances from solutions while requiring minimal supplementary chemical additives. Materials such as polyethersulfone (PES), polyvinylidene difluoride (PVDF), and cellulose are commonly used for membrane fabrication. Among them, regenerated cellulose (RC) ultrafiltration membranes demonstrate unique advantages in practical filtration. Due to their excellent hydrophilicity of cellulose, they significantly reduce protein adsorption during filtration, thus prolonging membrane lifespan. Additionally, cellulose, being abundant and renewable, aligns with sustainability goals by mitigating environmental impact. The use of cellulose products can reduce the environmental impact of synthetic products, aligning with sustainability goals. However, the abundant hydrogen bonds and high crystallinity of cellulose make it nearly insoluble in common solvents, posing challenges for direct processing. Currently, most cellulose ultrafiltration membranes on the market are either cellulose acetate membranes or are obtained through hydrolyzing cellulose acetate membranes. Although chemical modification can enhance the processability of cellulose, the industrial production of cellulose derivatives still relies on heterogeneous reaction methods, which are typically limited to the surface of cellulose and difficult to control, leading to issues such as adverse reactions and waste. Developing efficient cellulose dissolution systems is necessary for directly dissolving and preparing RC products from cotton pulp. To meet the requirements of sustainable development, a series of low-cost and recyclable room-temperature cellulose solvents have been developed, enabling the clean preparation of green RC ultrafiltration membranes.
To achieve the direct preparation of RC ultrafiltration membranes from cotton linters at room temperature, this study selected ZnCl2/AlCl3 as the cellulose dissolution system and used water, ethanol, ethylene glycol, and acetone as coagulation baths. RC ultrafiltration membranes were prepared using the NIPS method. The influence of different coagulants on the structure of RC ultrafiltration membranes was studied, and based on this, the effect of ethanol proportion in water/ethanol mixed coagulation baths on the structure of RC ultrafiltration membranes was investigated. Finally, the impact of these structural changes on the separation performance of ultrafiltration membranes was analyzed and evaluated through water flux, MWCO, and membrane retention capacity for blue dextran (BD) and human immunoglobulin G (IgG). The results show that RC ultrafiltration membranes prepared in different coagulation baths have different structures. RC membranes obtained in specific organic solvent (such as ethanol and ethylene glycol) coagulation baths exhibit typical ultrafiltration structures, including a dense surface layer and a support layer with large pores. In contrast, ultrafiltration membranes with large sponge-like pores can only be obtained in water. With the increase of ethanol concentration in water/ethanol mixed coagulation baths, the thickness of the RC ultrafiltration membrane’s skin layer gradually increases, the pore size of the skin layer decreases, and finger-like pores begin to appear inside the membrane when the ethanol concentration reaches 70%. Such structural changes significantly enhance the water flux and retention performance of RC ultrafiltration membranes. The water flux of RC-ET (regenerated from pure ethanol) can reach 628.57 LMH/bar, with a MWCO value of 314.5 kDa, effectively separating virus markers BD and IgG. This new method for preparing RC ultrafiltration membranes is simple, economical, and requires no additional energy consumption, thus holding broad prospects for application in pharmaceutical production.
Key words: regenerated cellulose ultrafiltration membranes; ZnCl2/AlCl3; phase separation; organic solvent; coagulation bath; pore structure; separation performance

