河北省唐秦地區蛋雞致病性大腸桿菌耐藥及毒力檢測

摘 要:為了解河北省唐秦地區蛋雞大腸桿菌病流行情況,對來自河北省唐山市和秦皇島市部分地區的92株蛋雞致病性大腸桿菌分離株的血清型、毒力基因、耐藥性及生物被膜形成能力進行檢測,結果顯示:分離的92株大腸桿菌共分為11種血清型,優勢血清型為O78(62/69.57%)、O45(30/32.61%)、O2(20/21.74%);分離菌株毒力基因檢測16種毒力基因的攜帶情況,未檢測到iutB、Ler、eaeA2毒力基因。分離菌株耐藥基因檢測25種耐藥基因的攜帶情況,KPC、CMY-2、
Oxa-1、SHV、Tet(C)、Tet(G)、qnrA、qnrB qnrC、qnrD、ermA、mefA基因均未檢出;對林可霉素、氨芐西林、阿莫西林、復方新諾明、四環素耐藥嚴重,對環丙沙星、大觀霉素敏感;92株大腸桿菌中,強形成膜能力的菌株有46株(50%),中形成膜能力的菌株有24株(26.09%),弱形成膜能力的菌株有12株(13.04%),不形成生物被膜的菌株有10株(10.87%)。本試驗結果為河北秦皇島地區和唐山地區蛋雞大腸桿菌病防治提供了科學根據。
關鍵詞:蛋雞;大腸桿菌;血清型;毒力基因
中圖分類號:S858.31 文獻標識碼:B 文章編號:1673-1085(2024)09-0014-12
收稿日期:2024-02-29
近幾年來,隨著我國蛋雞養殖業的迅速發展,大腸桿菌病的發生呈不斷上升趨勢,給蛋雞養殖業造成了很大損失。近幾年,有關蛋雞大腸桿菌病的報道較多,但其分子流行病學報道較少。蛋雞大腸桿菌病是由致病性大腸桿菌(Escherichia coil, E. coil)引起的一種疾病,可引起雛雞、青年雞、成年雞的多種癥狀[1],引起腹膜炎、輸卵管炎、大腸桿菌性敗血癥、腫頭綜合征、氣囊炎、心包炎、肝周炎[2]等特征性病癥。在合適的外部環境下,細菌都有能力形成生物被膜,這被認為是細菌自我保護的一種適應惡劣環境的方式[3]。此外,細菌的毒力和耐藥性與其生物被膜的形成能力也有一定的關聯 [4]。
本試驗對2023年從河北省秦皇島市和唐山市地區分離的92株蛋雞致病性大腸桿菌進行血清型、毒力基因及耐藥性檢測、生物被膜形成能力檢測,從而有助于科學防控蛋雞大腸桿菌病,保障禽畜業的健康發展。
1 材料與方法
1.1 菌株來源
2023年從河北省秦皇島市和唐山市地區不同養雞場分離鑒定的92株蛋雞致病性E.coli,由河北省預防獸醫學重點實驗室保存。E.coli質控菌株ATCC25922由河北省預防獸醫學重點實驗室保存。
1.2 主要試劑與儀器
麥康凱瓊脂、伊紅美藍瓊脂、2×MasterMix、DL-2000Marker,購自北京康為世紀生物科技有限公司;瓊脂糖,購自西班牙Biowest公司;頭孢噻肟、慶大霉素等14種藥敏紙片,購自杭州微生物試劑有限公司;ID32E腸桿菌科生化鑒定試紙條,購自生物梅里埃中國有限公司。
1.3 細菌分離純化與鑒定
將疑似大腸桿菌感染病/死蛋雞進行解剖,將患病蛋雞的肝、腎、心臟和脾臟等組織處理后無菌劃線接種于麥康凱(MAC)培養基,倒置37 ℃恒溫培養12 h后,觀察菌落形態和生長特性;挑選MAC培養基上桃紅色邊緣整齊的單菌落接種于伊紅美藍平板,倒置37 ℃恒溫培養12 h,觀察菌落形態和生長特性;挑選伊紅美藍培養基上紫黑色有金屬光澤的單菌落在普通瓊脂平板上進行純化培養,并對純化后的單菌落進行革蘭氏染色鏡檢,并接種于LB液體培養基中37 ℃培養12 h后,按照生化鑒定試紙條說明書進行生化鑒定。收集剩余的純化菌株,-20 ℃凍存備用。
1.4 細菌16S rRNA PCR鑒定
水煮法制備DNA模板:將純化好的菌落在LB液體培養基中進行培養,搖床培養12 h(溫度為37 ℃),將菌液10 000 rpm/min離心2 min,棄上清,取1 mL高壓后的PBS溶液入到菌體沉淀中,沖懸沉淀,再經10 000 rpm/min離心 2min,棄上清,留沉淀,反復洗滌 2~3次,取200 μL 高壓后的PBS溶液將菌體吹懸起來,100 ℃煮沸10 min,在冰上放置2 min,10 000 rpm/min離心 2 min后收集上清,即為所提取的 DNA,-20 ℃冰箱保存備用。
參照文獻[5]設計引物,PCR 反應條件:94 ℃ 5 min;94 ℃ 1 min,50 ℃ 1 min,72 ℃ 1.5 min,共34個循環;72 ℃延伸5 min。取5 μL擴增產物加入1%瓊脂糖凝膠樣孔中,一個樣孔中加入5 μL的PCR產物,設置電泳電壓為120 V,電泳時間30 min,將凝膠放入凝膠成像儀中觀察條帶并拍照。引物合成及PCR產物測序均在上海生工生物工程有限公司進行。
1.5 大腸桿菌血清型檢測
1.5.1 DNA模板的制備 操作方法同1.4中水煮法DNA提取。
1.5.2 PCR反應及電泳 參考文獻[6],采用PCR方法對大腸桿菌O抗原進行檢測,反應體系如下,2×Taq PCR Mastermix 10 μL,DNA 2 μL,上下游引物各1 μL,超純水6 μL。94 ℃ 10 min;94 ℃ 30 s,58 ℃ 30 s和72 ℃ 1 min,共34個循環;72 ℃延伸5 min。取PCR產物5 μL加入到1.5%瓊脂糖加樣孔中,120 V電泳30 min,結果在凝膠成像儀下拍照并記錄結果。
1.6 分離菌株的毒力基因檢測
參考文獻[7],由北京生物工程有限公司合成毒力基因16對引物。以提取的DNA為模板,采用PCR方法進行毒力基因的檢測。PCR反應程序:94 ℃ 5 min;94 ℃ 30 s,52~66 ℃ 30 s,72 ℃ 90 s,30個循環;72 ℃ 10 min。
1.7 藥物敏感性試驗方法
對分離的92株蛋雞致病性E.coli采用了美國臨床檢驗標準委員會CLSI(Clinicaland Laboratory Standards Institute)推薦的K-B藥敏紙片法進行試驗,對分離菌株的試驗結果進行整理,分析其耐藥性。
1.8 細菌耐藥基因的PCR檢測
參考文獻[8],由上海生工生物工程有限公司合成25種耐藥基因引物。以提取的基因組DNA為模板,采用PCR方法進行檢測。
1.9 細菌的生物被膜形成能力檢測
參考文獻[9],采用結晶紫微孔板法對唐秦地區臨床分離到的92株蛋雞源大腸桿菌分離株進行被膜形成能力測定。判定標準以陰性對照OD590 平均值加3倍標準差定義為ODc,將菌株生物被膜形成能力分為4類:生物被膜無形成能力,OD590 lt;ODc;生物被膜形成能力弱,ODclt;OD590 lt;2ODc;生物被膜形成能力中,2ODclt;ODOD590 lt;4ODc;生物被膜形成能力強,OD590 ≥4ODc。
2 結果
2.1 細菌的分離鑒定
從采集的211份病料中對分離菌株進行分離純化、染色鏡檢、生化鑒定。結果顯示,分離到了92株菌株,分離率為43.60%。革蘭氏染色,在顯微鏡下觀察菌株的形態呈兩端鈍圓的紅色短桿狀,在麥康凱平板上呈桃紅色、表面光滑、邊緣整齊的單菌落(圖1);在伊紅美藍培養基上生長形態為紫黑色并有金屬光澤菌落(圖2),培養基上的菌株特征與E.coli特征符合。鏡檢菌株呈紅色短桿狀,未觀察到芽孢,屬于革蘭氏陰性菌(圖3)。92株分離菌株經ID32E腸桿菌科生化鑒定試紙條鑒定分析,評定結果均符合E.coli生化鑒定標準,符合率為99.60%~99%。
2.2 細菌的生化鑒定
分離菌株經生化鑒定后,分離的92株致病性菌株能夠將麥芽糖、葡萄糖乳糖、果糖等發酵,V-P試驗、尿素酶反應均為陰性,M.R試驗為陽性。菌株鑒定結果與E.coli生化特性相符。
2.3 分離菌株16S rRNA PCR鑒定
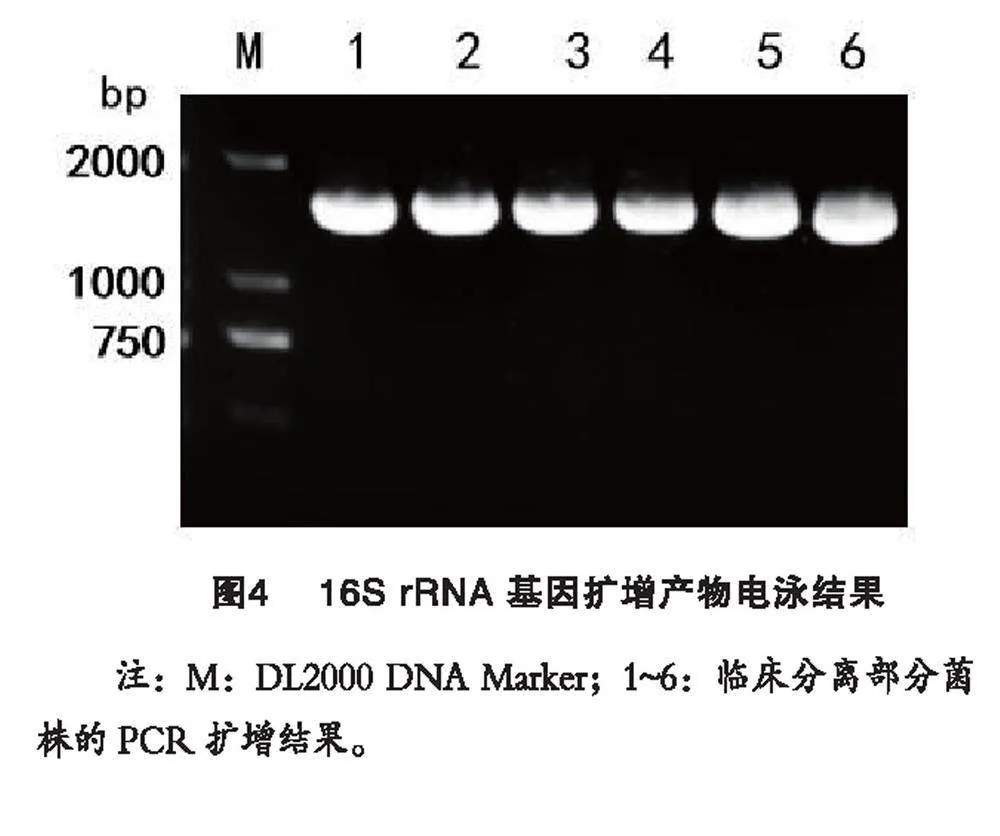
92株分離菌株經PCR擴增后,在約1 500 bp位置上出現清晰的條帶。分離菌株測序結果與GenBank數據庫中登錄的E.coli的參考株基因序列進行比對,同源性在98.8%~99.9%之間,結果表明92株分離菌株均為E.coli。部分菌株的PCR結果見圖4。
2.4 分離菌株血清型檢測
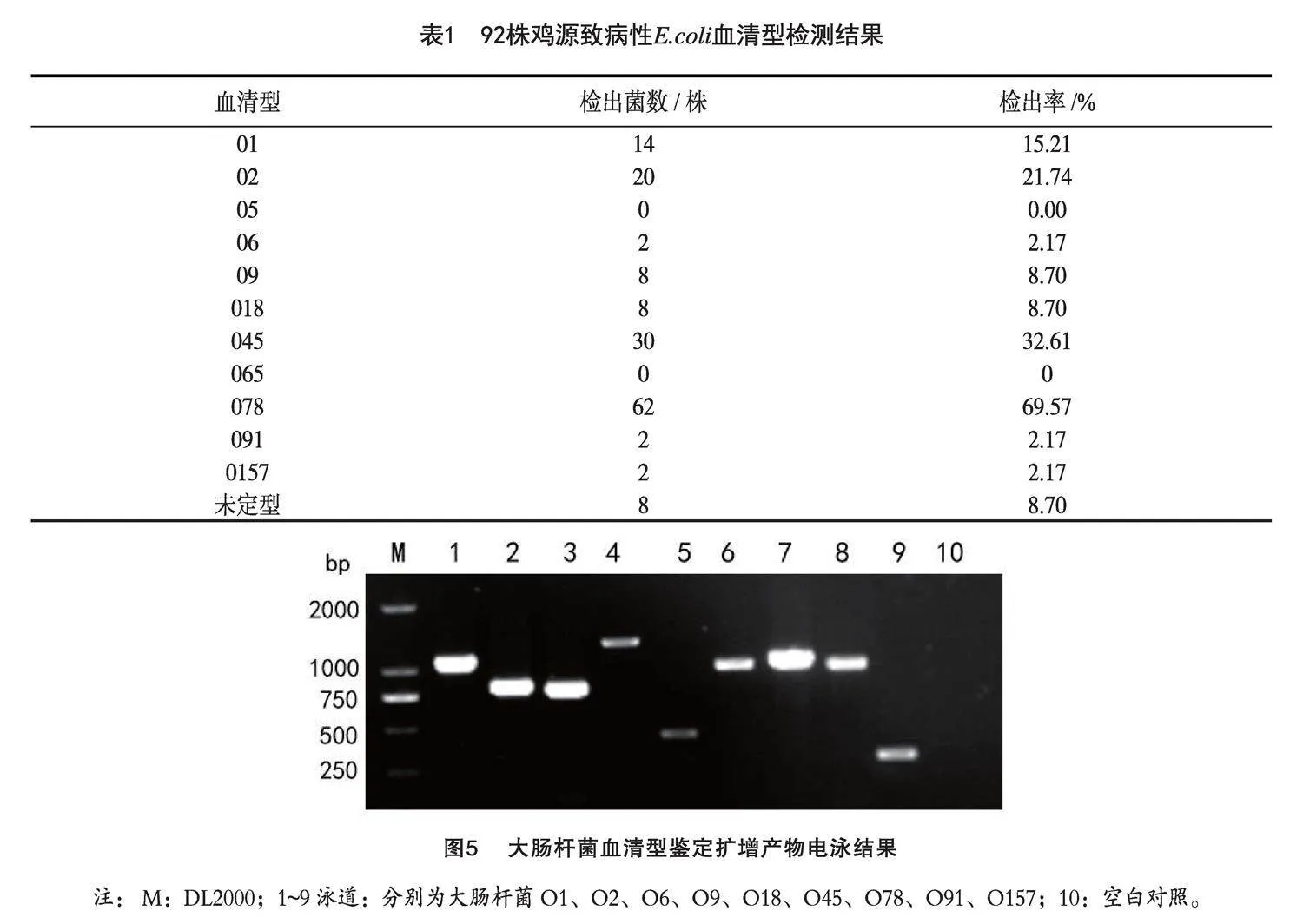
對初步分離確定的92株致病性E.coli通過PCR技術進行O血清型檢測,共分為11種血清型,分別為O1、O2、O5、O6、O9、O18、O45、O65、O78、O91和O157。由表1可知,62株大腸桿菌血清型為O78,比例為69.57%;O45、O2和O1血清型分離菌株分別是30株、20株和14株,比例分別為32.61%、21.74%和15.21%,為優勢血清型;O6、O9、O18、O45、O91和O157血清型大腸桿菌菌株數量較少,見表1。未檢出O5、O65血清型,見圖5。
2.5 分離菌株毒力基因檢測結果
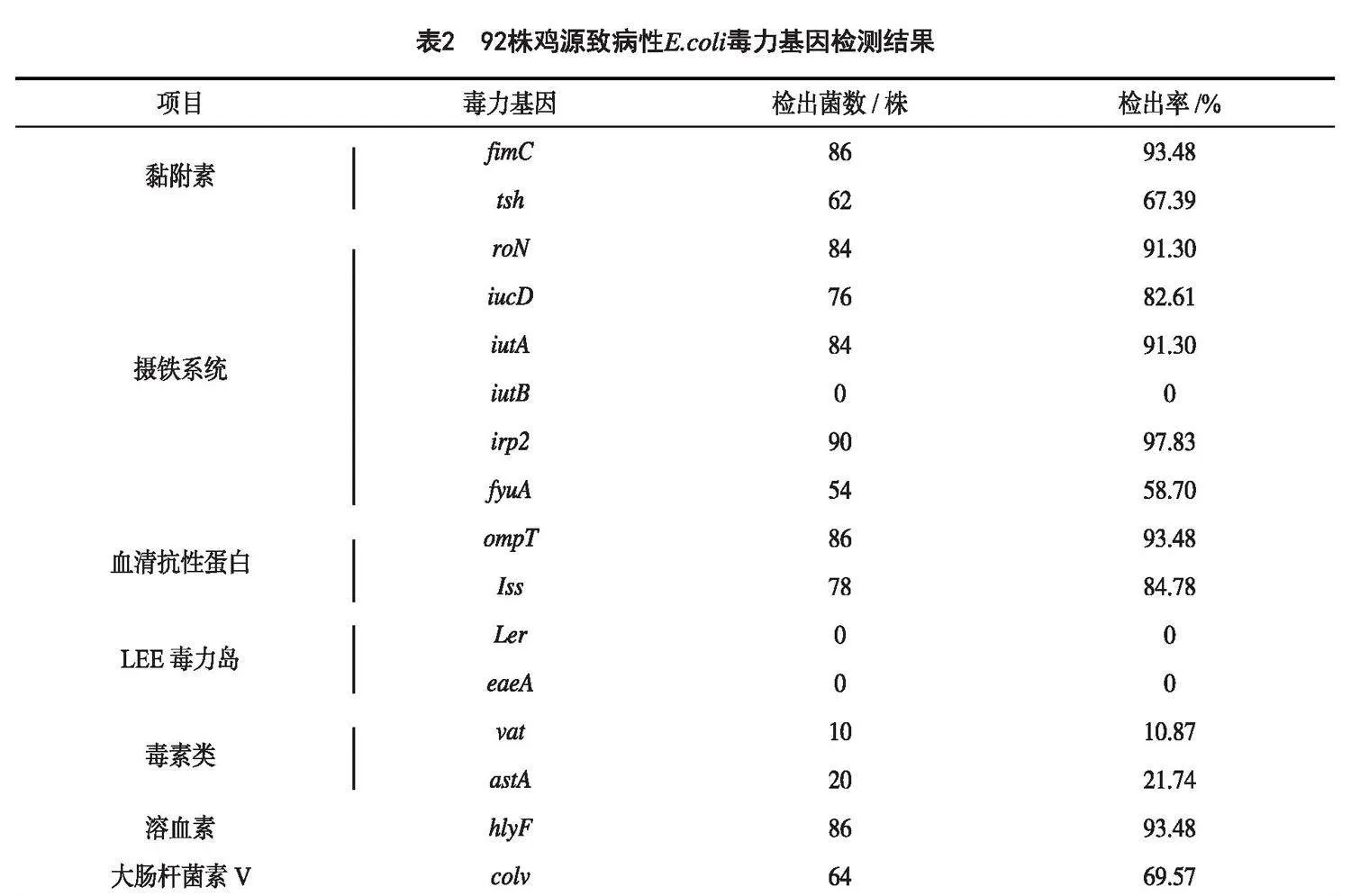
通過PCR方法檢測16種毒力基因的攜帶情況,結果顯示,92株致病性E.coli攜帶13種不同毒力基因,未檢測到iutB、Ler、eaeA 3種毒力基因(圖6)。92株致病性E.coli中irp2毒力基因檢出率最高,為97.83%(90/92);其次為ompT、fimC和hlyF毒力基因,檢出率也較高,均為93.48%;iroN、iucD、Iss和fyuA的檢出率在58.70%~91.30%之間,而Vat、astA毒力基因檢出率較低,分別為10.87%和21.74%(表2)。
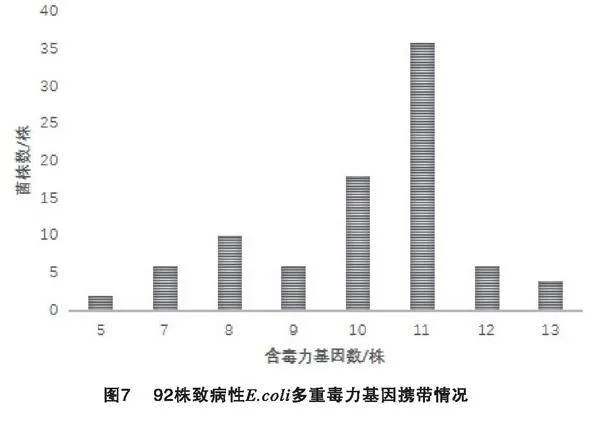
圖7為多重毒力基因檢測結果。由圖7可知,92株致病性E.coli攜帶5~13種毒力基因不等。其中,有2株攜帶5種毒力基因,占比2.32%;攜帶11種毒力基因的菌株數量高達36株,占比41.86%。92株致病性E.coli主要攜帶毒力譜見表3。由表3可知,含有(hlyF+Colv+Tsh+ompT+Iss+iroN+fimC+iucd+iutA+irp2+fyuA)毒力基因的毒力譜檢出率最高,占比32.56%;其次是含有(hlyF+Colv+fimC+Tsh+ompT+Iss+iroN+Iucd+iutA+irp2)毒力基因的毒力譜,檢出率為11.63%;第三是含有(astA+hlyF+Colv+fimC+Tsh+ompT+Iss+iroN+iucd+iutA+irp2)毒力基因的毒力譜,檢出率為6.98%;含有(hlyF+Colv+fimC+ompT+iroN+iucd+iutA+irp2)和(Tsh+ompT+Iss+iroN+iucd+iutA+Vat+astA+hlyF+Colv+fimC+irp2+fyuA)毒力基因的毒力譜,檢出率均是4.65%。
2.6 92株禽致病性E.coli耐藥性檢測結果
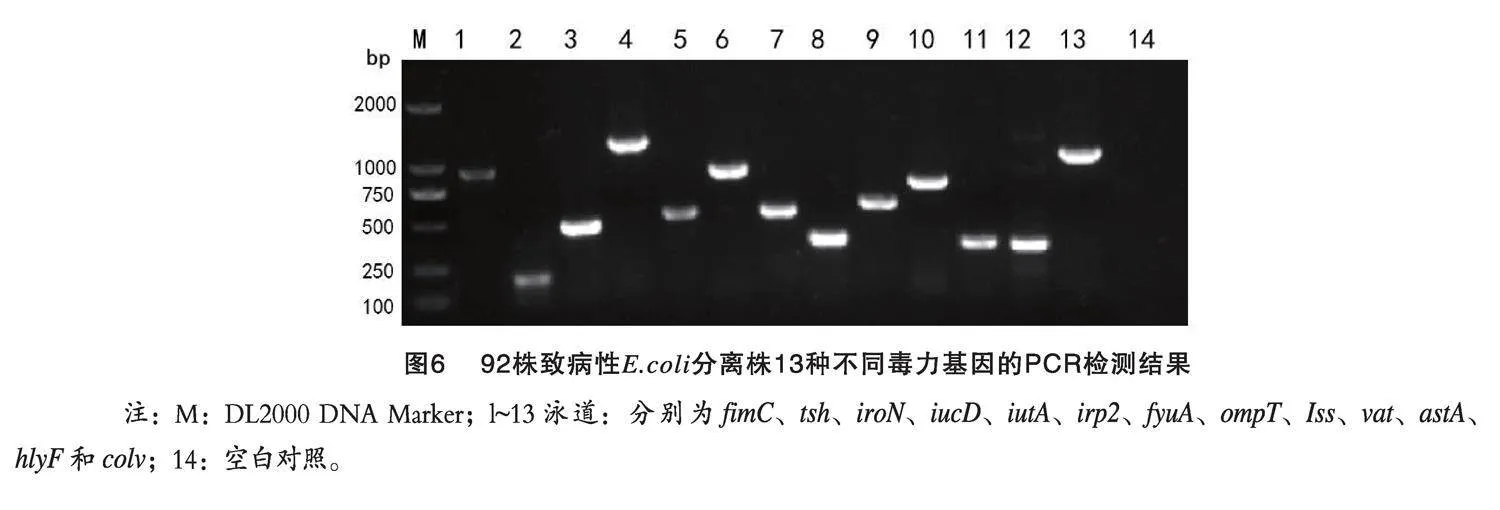
由表4可知,92株禽致病性E.coli對林可霉素、氨芐西林、阿莫西林、復方新諾明、四環素耐藥率較高,均在84.78%以上;對頭孢曲松、鏈霉素、紅霉素、頭孢噻肟、恩諾沙星的耐藥率在50.00%~60.87%之間;對氟苯尼考、慶大霉素、恩諾沙星、環丙沙星的耐藥率在30.43%~56.52%之間;而大觀霉素、耐藥率較低,在19.57%。
分離菌株多重耐藥結果見圖8。由圖8可知,2023年分離的92株菌最少耐2種藥物的有2株,占比2.17%;最多耐14種藥物的有2株,占比2.17%;對7、10種藥物耐藥的菌株最多,為14株,占比均為15.22%。
2.7 分離的92株禽致病性E.coli耐藥基因檢測
通過PCR方法對唐秦地區分離的92株E.coli的25種耐藥基因進行檢測,部分陽性菌株的PCR結果見圖9。
92株雞源致病性E.coli耐藥基因檢測結果見表5。由表5可知,檢出耐藥基因以gyrA、aadA1、dhps、Oxa-5為主,檢出率均在93.48%以上;Sul-3、Sul-1、aadA2、Tet(E)、StrA、ermB、StrB耐藥基因的檢出率分別為34.78%、52.17%、54.35%、56.52%、65.22%、86.96%、89.13%,而KPC、CMY-2、Oxa-1、SHV、Tet(C)、Tet(G)、qnrA、qnrB、qnrC、qnrD、ermA、mefA耐藥基因均未檢出。
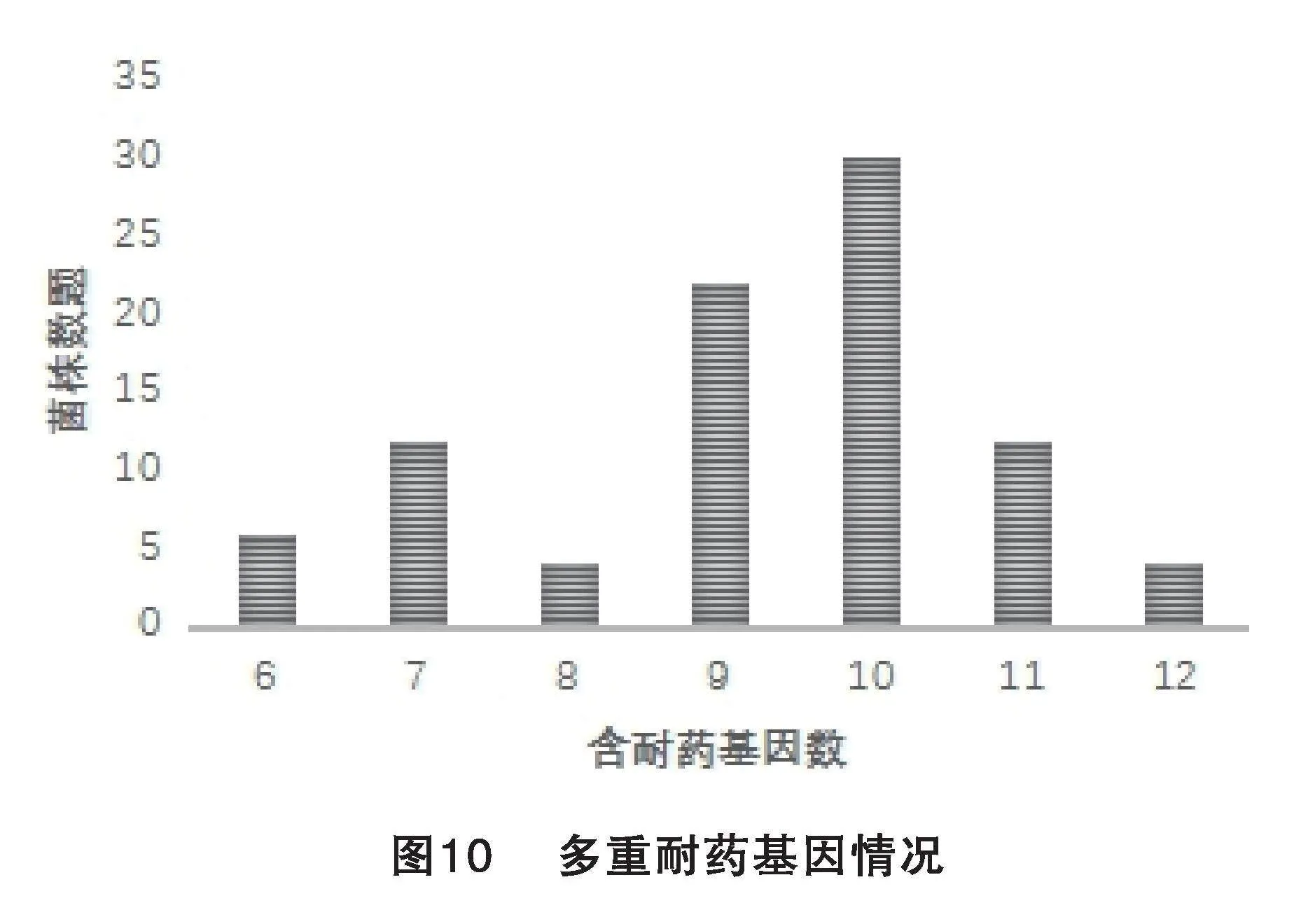
由圖10可知,分離的92株E.coli存在多重耐藥基因攜帶情況,攜帶10種耐藥基因的菌株數最多,為30株,占比32.61%;其次,攜帶9種耐藥基因的菌株數為22株,占比23.91%;攜帶7、11種耐藥基因的菌株數都是12株,占比13.04%;攜帶6種耐藥基因的菌株數有6株,占比6.52%;攜帶8、12種耐藥基因最少,都是4株,占比4.35%。
2.8 92株禽致病性E.coli生物膜形成能力檢測結果
河北省秦皇島市和唐山市分離的92株大腸桿菌中,能形成生物膜的有82株,占全部菌株的為89.13%。其中,有46株菌株形成膜能力強,有24株菌株形成膜能力中等,有12株菌株生物被膜形成能力弱,有10株菌株不形成生物被膜,分別占比50.00%、26.09%、13.04%和10.87%。
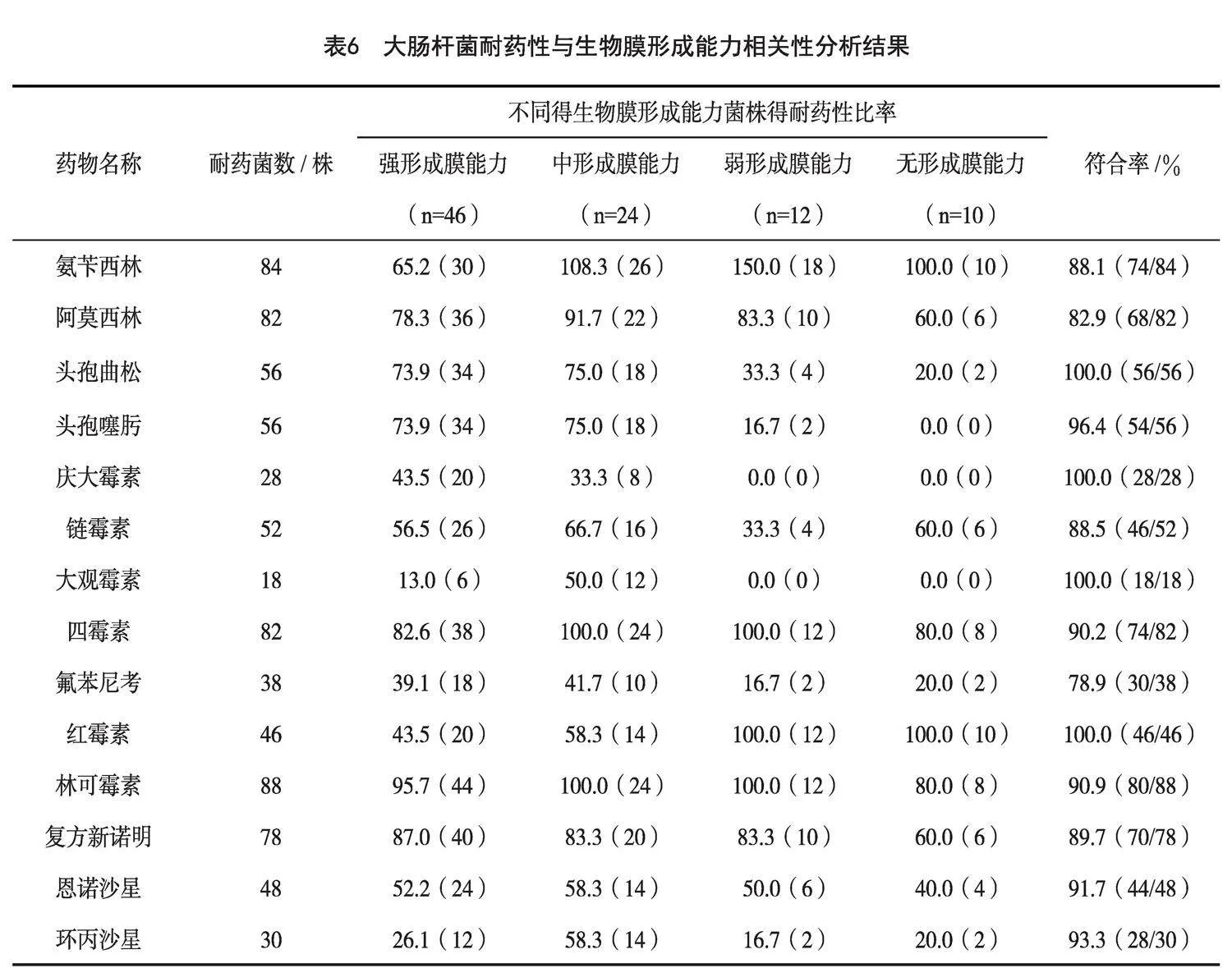
2.9 生物膜形成能力與耐藥性相關性分析
生物膜形成能力與耐藥性相關性分析結果見表6。由表6可知,分離的92株大腸桿菌生物被膜形成能力與頭孢曲松、頭孢噻肟、紅霉素、恩諾沙星、環丙沙星、大觀霉素、氟苯尼考、慶大霉素9種抗生素的耐藥性符合率為91.7%~100.0%,分離的92株大腸桿菌生物被膜形成能力與阿莫西林、鏈霉素、氟苯尼考、復方新諾明、林可霉素、氨芐西林5種抗生素的耐藥性符合率為78.9%~90.9%。
3 討論
3.1 唐秦地區蛋雞致病性E.coli的血清型分析
不同地區流行的血清型有所不同,致病能力也有所差異。楊文文等[10]對分離的150株大腸桿菌菌株進行O抗原血清型鑒定,其中131株可以鑒定出血清型,其中O78和O1陽性率最高,分別為16.8%和15.3%。王瑤等[11]對江蘇、安徽、河南、山東等地區分離的210株大腸桿菌進行O抗原血清型,主要流行血清型為O78、O2、O1,分別占比44.76%、24.29%、13.33%。趙素華等[12]對皖北地區分離的36株大腸桿菌進行血清型鑒定,顯示主要流行的血清型為O78、O18、O88,分別占比29.03%、22.58%、16.12%。楊立軍等[13]對福建省龍巖市分離的139株大腸桿菌分離株鑒定血清型,優勢血清型為O78、O2、O1,陽性率分別為10.0%、10.0%、8.0%。本試驗對河北地區秦皇島市和唐山市92株E.coli進行血清型鑒定,發現84株定型,8株未定型,其中優勢血清型為O78、O45、O2,分別占比69.57%、32.61%、21.74%。相關研究表明,蛋雞致病性E.coli的優勢血清型與地區存在一定相關關系。
3.2 唐秦地區蛋雞致病性E.coli的毒力基因分析
通過檢測禽致病性大腸桿菌攜帶的毒力因子來判斷其對機體的致病能力,毒力因子是直接導致禽大腸桿菌病發生的基礎。陳亞強等[14]對重慶地區分離的286株禽致病性E.coli的9種毒力基因進行檢測,結果表明iss、iucD、hlyF、irp2檢出率較高,分別為75.52%、69.58%、52.10%、46.50%。陳祥等[15]對江蘇等20個地區分離的243株禽致病性E.coli的13種毒力基因進行檢測,結果iss、tsh、iucD、irp2、fyuA的檢出率分別為79.4%、68.7%、67.1%、67.1%、66.7%。胡林等[16]對華東部分地區77株禽致病性E.coli進行26個毒力基因的檢測,結果fimc、ompa、iss毒力基因的檢出率超過75%,未檢出hlyF毒力基因。李麗麗等[17]對江蘇、安徽、河南、山東等地區分離的210株禽致病性E.coli進行16種毒力基因檢測,結果表明fimc、iss、iroN、iucD、fyuA檢出率較高,分別為90.00%、79.05%、69.05%、65.24%、50.48%;含有多種毒力基因的禽致病性E.coli分離株有207株,其中含有5種毒力基因最多,占比98.57%,其次是含6、7、8、9種毒力基因的菌株分別占比91.90%、82.38%、72.86%。本試驗對從河北地區秦皇島市和唐山市分離的92株禽致病E.coli的16種毒力基因檢測,結果表明irp2、ompT、fimC、hlyF毒力基因的檢出率最高,分別為97.83%、93.48%、93.48%、93.48%;含有11種毒力基因的致病性E.coli最多,占比41.86%;其次是含10、8種毒力基因的菌株,占比分別為20.93%、11.63%。由上述結果可知,不同地區蛋雞致病性E.coli的毒力基因的流行趨勢有所不同。
3.3 唐秦地區禽致病性E.coli的耐藥基因分析
禽致病E.coli產生耐藥性一般是由攜帶的耐藥基因導致的,不同地區分離的禽致病性E.coli攜帶的耐藥基因也有所不同。王永亮等[18]對66株大腸桿菌耐藥基因檢測,對喹諾酮類藥物檢測的基因型以qnrA為主,占比50.0%;對氨基糖苷類以aadD為主,占比36.4%。張濟培等[19]對廣東地區分離的149株水禽源大腸桿菌,對氨基糖苷類藥物進行檢測,結果表明檢測基因型以aadA1為主,占比84.6%。張海龍[20]分離的76株致病性E.coli的gyrA檢出率高達100%,其次為Oxa-5、StrB、Sul-2、aadA1,檢出率均在78.95%以上。本試驗結果表明,對92株禽致病性E.coli進行耐藥基因檢測,包括β-內酰胺類、四環素類、喹諾酮類、氨基糖苷類、大環內酯類、磺胺類藥物等25種耐藥基因,檢測到gyrA、aadA1、dhps、Oxa-5、StrA、StrB、ermB、Sul-1、Sul-3、Tet(E)、Sul-1、aadA2、Sul-2等13種基因。本試驗分離的92株禽致病性E.coli以gyrA、aadA1、dhps、Oxa-5耐藥基因為主,檢出率在93.48%以上,而KPC、CMY-2、Oxa-1、SHV、Tet(C)、Tet(G)、qnrA、qnrB、qnrC、qnrD、ermA、mefA基因均未檢出。與上述研究者的結果存在部分不同,不同地區耐藥基因的檢測結果有所差異,分析認為攜帶的耐藥基因不同,可能與動物的品種與地區有關。
3.4 唐秦地區禽致病性E.coli的耐藥性檢測分析
禽致病性E.coli在防控過程存在復雜的耐藥性以及耐藥多重性。潘玉善等[21]對河北、山東、河南、四川、江西、浙江等8省12個地區分離的20株禽致病E.coli分離株進行耐藥性檢測,結果發現20株禽E.coli分離株對氨芐西林、頭孢曲松、頭孢頭孢噻肟耐藥率高達100%,對慶大霉素耐藥率為35%,對氟苯尼考耐藥率為60%。魏清宇等[22]對從山西省北部地區分離的81株雞大腸桿菌菌株進行耐藥性檢測,結果發現對四環素耐藥率為92.3%,對恩諾沙星、阿莫西林的耐藥率分別為87.7%、84.0%,對鏈霉素、復方新諾明耐藥率分別為77.8%、76.5%,對氟苯尼考、慶大霉素、環丙沙星和頭孢噻肟的耐藥率分別為55.6%、43.2%、34.6%和9.8%。崔笑博等[23]對山東泰安周邊部分地區分離的78株禽致病E.coli進行耐藥性檢測,結果表明對紅霉素耐藥率96.2%,對氨芐西林耐藥率為92.4%,對環丙沙星耐藥率為82.27%,對鏈霉素耐藥率為74.68%,對復方新諾明耐藥率為91.1%,對氟苯尼考耐藥率為89.8%,對慶大霉素耐藥率為72.15%。陳濤等[24]對山東部分地區的試驗中發現,家禽大腸桿菌普遍存在多重耐藥菌株,占所有耐藥菌株的50%以上,且日益增長。2重、3重耐藥菌株呈現下降趨勢,而5重、6重、7重耐藥菌株占比較多。董向磊等[25]對江蘇省部分地區(南通、常州和泰州)和山東省膠東地區(煙臺、青島)分離的154株大腸桿菌耐藥性檢測,結果顯示均表現出多重耐藥性,最少耐5重,13重耐藥菌株最多,占全部菌株的19.48%;其次為12重,占全部菌株的16.88%;10重以上耐藥菌株達69.48%。本試驗中,92株大腸桿菌對林可霉素、氨芐西林、阿莫西林、復方新諾明、四環素耐藥率較高,均在84.78%以上;對頭孢曲松、鏈霉素、紅霉素、頭孢噻肟、恩諾沙星的耐藥率在50.00%~60.87%之間,對氟苯尼考、慶大霉素、恩諾沙星、環丙沙星的耐藥率在30.43%~56.52%之間;大觀霉素、耐藥率較低,在 19.57%。其中,最少耐2種藥物的有2株,占比2.17%;最多耐14種藥物的有2株,占比2.17%;最多耐7、10種藥物的有14株,占比15.22%。試驗結果顯示蛋雞致病性E.coli耐藥性嚴重,不合理使用抗菌藥會導致耐藥性越來越嚴重,根據地區的不同其耐藥性也有所差異性。
3.5 唐秦地區禽致病性E.coli生物膜與耐藥性之間的關系
細菌的黏附是細菌生物被膜形成的關鍵過程,部分細菌性疾病與細菌被膜有關。生物膜的形成可以對外界抗菌藥物有抵抗力,大腸桿菌生物膜形成能力與耐藥性有關。宋學紅等[26]對北京、上海、廣東、河南分離的198株雞肉源大腸桿菌進行生物膜形成能力測定,結果表明強生物膜分離株有95株,占比47.98%;弱生物膜分離株有93株,占比46.97%;不形成生物膜有10株,占比5.05%。其生物膜形成能力與耐藥性相關性分析,顯示沒有顯著性差異(P 值為 0.493,P>0.05)。張召興等[27]對河北地區分離出92株大腸桿菌進行生物膜能力進行測定,與14種抗生素的符合率在73.70%以上。本試驗從河北地區秦皇島市和唐山市分離的92株禽致病性E.coli中,共有82株能形成生物膜,占分離菌株的89.13%。其中,強形成膜能力菌株有46株,中形成膜能力菌株有24株,弱形成膜能力菌株有12株,不形成被膜菌株有10株,分別占分離菌株的50.00%、26.09%、13.04%和10.87%。其生物被膜形成能力與耐藥性相關性分析結果顯示,分離的92株蛋雞致病性E.coli的生物被膜形成能力與13種抗生素耐藥性的符合率在78.9%以上,其產生的耐藥性與大腸桿菌的生物被膜形成能力有所相關。
參考文獻:
[1] KAPET J B, NATARO J P, MOBLEY H L T. Pathogenic escherichia coli[J]. Nat Rev Microbiol, 2004, 2(2): 123-140.
[2] 陳祥.禽病原性大腸桿菌的生物學特性及其可能毒力相關基因的鑒定[D].揚州:揚州大學,2006.
[3] MELLATA M, DHO-MOULIN M, DOZOIS C M, et al. Role of virulence factors in resistance of avian pathogenic Escherichia coli to serum and in pathogenicity[J]. Infection and immunity, 2003, 71(1): 536-540.
[4] 歐陽鳳菊.禽致病大腸桿菌生物被膜檢測及形成基因研究[D].哈爾濱:東北農業大學,2010.
[5] 張召興,李佩國,陳玥,等.2018年~2019年河北地區蛋雞源大腸桿菌流行病學調查與分析[J].中國預防獸醫學報,2020,42(03):228-233.
[6] 張立偉.河北地區雞源致病性大腸桿菌分離鑒定及耐藥性研究[D].邯鄲:河北工程大學,2021.
[7] 張海龍,劉優優,何云鳳,等.秦皇島地區蛋雞致病性大腸桿菌的血清型、毒力基因及耐藥性檢測分析[J].中國獸醫學報,2022,42(07):1369-1375.
[8] 李蘊玉,葛成,焦賀靜,等.秦皇島地區育成雞大腸桿菌血清型鑒定及耐藥性分析[J].中國獸醫雜志,2019,55(08):71-73+76.
[9] SKYBERG J A, SIEK KE,DOETKOTT,C et al. Biofilm formation by avian Escherichia coli in relation to media, source and phylogeny[J].Journal of Applied Microbiology,2007,102(2):548-554.
[10]楊文文,李玉保,路建彪,等.雞源大腸桿菌攜帶毒力基因、血清型及與致病性相關性的研究[J].中國預防獸醫學報,2021,43(10):1051-1056.
[11]王瑤,張耀東,易正飛,等.禽致病性大腸桿菌血清型、進化分群及毒力基因的分子流行病學調查[J].中國獸醫科學,2020,50(09):1159-1166.
[12]趙素華,范紅結.皖北地區禽源大腸桿菌的血清型鑒定與耐藥性分析[J].畜牧與獸醫,2017,49(04):95-98.
[13]楊立軍,韓先干,尹會方,等.福建省龍巖市禽致病性大腸桿菌的血清型、毒力因子及耐藥研究[J].中國動物傳染病學報,2016,24(06):24-29.
[14]陳亞強.重慶地區禽大腸桿菌流行特征及評估模型研究[D].廣州:華南農業大學,2019.
[15]陳祥.禽病4性大腸桿菌的生物學特性及其可能毒力相關基因的鑒定[D].揚州:揚州大學,2006.
[16]胡林.華東部分地區禽大腸桿菌病的分子流行病學調查[D].南京:南京農業大學,2015.
[17]李麗麗.禽源大腸桿菌主要毒力因子的分子流行病學分析及F1與P菌毛單克隆抗體的制備[D].揚州:揚州大學,2014.
[18]王永亮.吉林省部分地區動物源大腸桿菌耐藥性及多重耐藥株全基因組序列分析[D].長春:吉林農業大學,2022.
[19]張濟培,韋慶蘭,譚華龍,等.廣東水禽源大腸桿菌耐藥性及氨基糖苷類耐藥基因的研究[C]//廣東省畜牧獸醫學會.第25屆廣東省科技進步活動月畜牧獸醫學術與科技創新發展大會論文集.2016:5.
[20]張海龍.河北省雞源大腸桿菌的分離鑒定及毒力與耐藥性檢測[D].秦皇島:河北科技師范學院,2021.
[21]潘玉善.禽源大腸桿菌、奇異變形桿菌多重耐藥的分子特征及CTX-M基因傳播擴散機制[D].鄭州:河南農業大學,2012.
[22]魏清宇.山西省北部地區雞大腸桿菌的分離鑒定及耐藥性分析[D].晉中:山西農業大學,2014.
[23]崔笑博.禽源大腸桿菌的分離鑒定,耐藥性分析及聯合藥敏試驗的研究[D].泰安:山東農業大學,2014.
[24]陳濤.山東部分地區禽大腸桿菌分離鑒定及耐藥分析[D].泰安:山東農業大學,2014.
[25]董向磊.禽致病性大腸桿菌的分離鑒定和分離株毒力基因與致病性相關性研究[D].揚州:揚州大學,2014.
[26]宋學紅.雞肉源大腸桿菌群體感應基因分布、耐藥性及生物膜等特性的研究[D].楊凌:西北農林科技大學,2016.
[27]張召興,李佩國,張海龍,等.河北地區蛋雞源大腸桿菌分子分群、耐藥性及生物被膜檢測與分析[J].中國獸醫學報,2020,40(08):1474-1478.
Detection and Analysis of Serotypes, Virulence Genes, Drug Resistance, and Biofilm of Pathogenic Escherichia coli in Laying Hens in the Tang and Qin Regions
YIN Heyu, YI Xueyan, GU Yuhua, KUANG Huali, ZHOU Runyu, LI Yunyu, LI Peiguo, JIA Qinghui
(Key Laboratory of Preventive Veterinary Medicine in Hebei Province, Hebei Normal University of Science and Technology, Qinhuangdao 066604,China)
Abstract: To understand the prevalence of Escherichia coli in laying hens in the Tangqin region, this study collected 92 strains of Escherichia coli identified from the Tangqin region in 2023, and tested the serotypes, virulence genes, drug resistance, and biofilm formation ability of 92 pathogenic Escherichia coli strains isolated from some areas of Tangshan and Qinhuangdao in Hebei Province. The results showed that the isolated strains of Escherichia coli were divided into 11 serotypes. The dominant serotypes are O78 (62/69.57%), O45 (30/32.61%)and O2 (20/21.74%). The carrying status of 16 virulence genes was detected by testing the virulence genes of isolated strains, but no virulence genes such as iutB, Ler, and eaeA2 were detected. The carrier status of 25 antibiotic resistance genes was detected in the isolated strains, but KPC, CMY-2, Oxa-1, SHV, Tet (C), Tet (G), qnrA, qnrB, qnrC, qnrD, ermA, and mefA genes were not detected. Severe resistance to lincomycin, ampicillin, amoxicillin, compound sulfamethoxazole, and tetracycline, sensitive to ciprofloxacin and spectinomycin. Among the 92 strains of Escherichia coli, 46 strains (50%) had strong membrane forming ability, 24 strains (26.09%) had medium membrane forming ability, 12 strains (13.04%) had weak membrane forming ability, and 10 strains 10.87% did not form BF. The results of this experiment provide a scientific basis for the prevention and treatment of Escherichia coli disease in laying hens in the Qinhuangdao and Tangshan regions of Hebei Province.
Keywords: Laying hens; Escherichia coli; Serotypes; Virulence gene

