提高豬體細胞克隆胚胎發育率的研究進展

摘要:體細胞克隆技術可使終末分化的體細胞獲得完整全能性,進而生產出完整個體。豬體細胞克隆技術在種質資源的保護與利用及制備基因編輯豬等方面具有廣泛的應用前景。然而,豬體細胞克隆的胚胎發育率和移植存活率限制著該技術在實際生產中的推廣應用。隨著微量細胞測序技術的發展,克隆胚胎發育異常機制不斷被揭示,諸多研究人員嘗試通過改良核移植操作程序或糾正克隆胚胎的異常重編程來提高克隆成功率,取得了一定效果。綜述了近年來圍繞卵母細胞、供體細胞和克隆胚胎3個方面來提高豬體細胞克隆胚胎發育率的相關研究,以期為提高豬體細胞克隆效率提供參考,有助于推動體細胞克隆技術在豬生產中的應用。
關鍵詞:豬;體細胞;核移植;胚胎;發育doi:10.13304/j.nykjdb.2024.0209
中圖分類號:S828 文獻標志碼:A 文章編號:10080864(2024)12020109
體細胞克隆又稱體細胞核移植(somatic cellnuclear transfer,SCNT),是一種可使移入去核卵母細胞的終末分化體細胞獲得全能性,進而生產出與供體細胞相同基因型個體的技術。自1996年克隆羊“Dolly”問世以來[1],通過SCNT技術獲得克隆后代的哺乳動物已超過20多種,特別是我國科學家率先完成體細胞克隆猴的研究,實現了歷史性突破[2]。克隆豬的歷史可追溯至1989 年,Prather等[3]將4-細胞胚胎的細胞核移入去核卵母細胞,獲得的重構胚胎移植至受體母豬體內繼續發育誕生一頭克隆仔豬。由于豬SCNT技術發展緩慢,直到2000年才獲得第一頭體細胞克隆豬[4]。SCNT發展至今,在保護珍貴或瀕危豬種、快速繁育優良種豬和加快生豬遺傳改良等方面發揮著重要的作用[5]。此外,SCNT 與基因編輯技術相結合,生產的基因輯編豬已應用于異種器官移植、再生醫學和抗病育種等領域[6]。然而,豬體細胞克隆效率仍然很低,克隆豬平均出生率僅1%左右,新生克隆豬死亡率高達30%以上[78],嚴重制約著該技術在實際生產中的應用。SCNT主要包括卵母細胞體外成熟培養、去核、供體細胞培養、融合、重構胚胎培養和胚胎移植等操作,每一環節對克隆胚胎的發育都至關重要。隨著高通量測序技術的發展,SCNT胚胎重編程機制逐步被揭示,諸多學者嘗試改良SCNT操作程序或糾正異常表觀遺傳修飾來提高SCNT胚胎發育率,進一步提升克隆效率。本文圍繞供體細胞、卵母細胞和克隆胚胎3個方面綜述了提高豬SCNT胚胎發育率的研究,為提高豬體細胞克隆效率提供參考。
1 體細胞克隆胚胎發育異常原因
SCNT通過重編程體細胞基因組來產生全能基因組,重構胚胎能夠發生類似于正常受精胚胎合子基因組激活(zygotic genome activation,ZGA)的過程。SCNT胚胎與正常受精胚胎存在遺傳和表觀遺傳方面的差異。研究報道,SCNT發生的遺傳異常是由于供體細胞和卵母細胞之間的細胞周期不同步或體外操作失誤造成染色體畸變,如SCNT胚胎早期卵裂階段經常出現的異常染色體分離[9]。表觀遺傳修飾異常被認為是SCNT胚胎發育的主要障礙,主要包括DNA高度甲基化、組蛋白的異常修飾以及X染色體失活異常。此外,卵母細胞成熟質量同樣是影響體細胞克隆胚胎發育率的重要因素。
1.1 卵母細胞體外成熟質量差
卵母細胞體外成熟(in vitro maturation,IVM)培養是SCNT的關鍵步驟,其成熟質量對克隆胚胎發育至關重要。卵母細胞IVM培養的關鍵在于用IVM培養基模擬卵泡液微環境,使未成熟的卵母細胞同時達到細胞核和細胞質的成熟。但由于SCNT所需的大量卵母細胞來自于未性成熟的青年母豬卵巢,卵母細胞體外成熟效率普遍低于體內正常發育[10],因此,揭示卵母細胞成熟的分子機制與影響因素對改善卵母細胞的成熟質量至關重要。
Ye等[11]通過單細胞多組學分析發現,人體外與體內發育成熟的卵母細胞相比,存在507個差異表達基因,體內成熟的卵母細胞中富集的差異基因與細胞周期過程有關,而體外成熟的卵母細胞中富集的差異基因與線粒體呼吸生物合成有關。卵母細胞體外成熟培養過程相關信號調控通路受到影響將導致體外培養成熟效率和質量下降。體內與體外成熟卵母細胞的主要差異是線粒體功能,體外成熟的有限條件可導致線粒體形態改變以及編碼與線粒體功能相關的基因表達改變,功能失調的線粒體抗氧化應激能力減弱,進而影響卵母細胞的成熟[12]。
1.2 供體細胞DNA 高度甲基化
DNA 甲基化是最早發現的表觀修飾遺傳標記,指DNA分子在DNA甲基轉移酶的作用下將甲基選擇性地添加到特定堿基上的過程。其中5-甲基胞嘧啶(5-methylcytosine,5mC)是最常見的DNA甲基化標記。供體細胞基因組DNA的高度甲基化是阻礙SCNT胚胎發育的主要因素之一,不同供體的細胞DNA甲基化存在明顯差異,使用DNA甲基化水平低的供體細胞獲得的SCNT胚胎具有更強的發育潛力[13]。羅嬋[14]研究發現,水牛胎兒的4個成纖維細胞系中,克隆效率高的供體細胞DNA甲基化水平較低,趙鑫[15]的研究進一步證實了此結果。此外,Zhai等[16]研究發現,用豬骨髓間充質干細胞(bone marrow mesenchymal stemcell,BMSC)作為供體細胞的SCNT(BMSC nucleartransfer,BMSC-NT)胚胎比豬胎兒成纖維細胞(porcine fetal fibroblast,PFF) 的SCNT (PFFnuclear-transfer,FF-NT)胚胎具有更低的DNA 甲基化和5mC水平,更有利于SCNT胚胎的發育。
SCNT胚胎的DNA甲基化主要來源于供體細胞的細胞核,合子基因組激活后,供體細胞核基因的不完全去甲基化致使胚胎發育相關基因表達紊亂,進而導致胚胎發育阻滯[17]。供體細胞基因組DNA 高度甲基化是引起SCNT 胚胎發育過程中DNA甲基化水平動態變化的直接原因。Liu等[18]通過胚胎活檢系統和單細胞簡化亞硫酸氫鹽測序(reduced representation bisulfite sequencing,RRBSseq)分析了SCNT胚胎的DNA甲基化水平發現,在2-細胞和4-細胞階段,SCNT樣本的甲基化水平普遍高于對應時期的體外受精胚胎(in vitrofertilization,IVF)[19],而SCNT與IVF囊胚的甲基化水平相似。此外,Canovas等[20]通過RNA測序并結合RRBS-seq對豬體內和體外胚胎分析發現,通過輔助生殖技術獲得的胚胎甲基化水平顯著高于體內發育胚胎。綜上表明,體細胞克隆胚胎供體細胞基因組DNA甲基化的擦除和重新建立對其后續SCNT胚胎發育至關重要,與受精胚胎相似的DNA甲基化模式更有利于克隆胚胎的發育。
1.3 克隆胚胎表觀修飾異常
克隆胚胎表觀修飾異常是導致SCNT胚胎發育異常的最主要原因,包括組蛋白異常修飾和X染色體失活異常等。哺乳動物基因組組蛋白的N端存在多種修飾,其中最常見的是組蛋白甲基化和乙酰化修飾。組蛋白甲基化是調控早期胚胎發育的重要遺傳標記,在胚胎發育的各個階段均發揮著重要作用。正常豬體外受精胚胎組蛋白H3第4和第27位賴氨酸的三甲基化位點(H3K4me3和H3K27me3)參與調控ZGA 的發生和退出,而SCNT胚胎H3K4me3和H3K27me3大量富集則會導致異常的ZGA[21]。SCNT 胚胎H3K27me3 和H3K9me3的不完全去甲基化使胚胎發育相關基因的表達下降,將導致胚胎發育阻滯[17]。有研究分別通過RRBS-seq及單細胞測序等手段發現小鼠SCNT胚胎Kdm4d和Kdm5b(2種特異性去甲基化酶)的表達水平在胚胎發育中發揮重要作用,Kdm5b與胚胎4-細胞到8-細胞階段的發育速率明顯相關[18],Kdm4d可調控SCNT胚胎在2-細胞階段基因組的正常激活[22]。
組蛋白乙酰化對基因轉錄激活具有重要的調控作用,與SCNT胚胎的體外成熟與發育能力密切相關。檢測SCNT胚胎發現,異常的組蛋白乙酰化會導致胚胎2-細胞期的基因組異常激活[23]。與豬體外受精胚胎相比,SCNT胚胎1-細胞與2-細胞期組蛋白H3第18位和組蛋白H4第8位賴氨酸位點乙酰化(H3K18ac、H4K8ac)水平均顯著降低[24]。與豬受精胚胎相比,豬SCNT胚胎在基因組激活后H3K27ac出現異常[25]。綜上說明,組蛋白甲基化和乙酰化的動態修飾模式對于維持正常的胚胎發育至關重要。
此外,X染色體失活異常也是導致SCNT胚胎發育異常的重要表觀遺傳修飾障礙。SCNT胚胎X染色體失活異常不僅與印記基因Xist 的調控密切相關,也與DNA甲基化以及組蛋白修飾相關。張寧等[26]研究發現,發育異常的SCNT胚胎Xist 基因的DNA 甲基化水平普遍高于正常胚胎,且其DNA甲基化水平與囊胚率之間存在顯著負相關。研究表明,Xist 基因的調控與母源組蛋白甲基化有關,H3K27me3可抑制母源Xist 基因在X染色體失活中發揮的作用,導致SCNT胚胎發育阻滯,而胚胎中X染色體失活通常伴隨著H3K9甲基化的發生[2728]。另外,Xist 基因異常活化可導致胚胎致死或者受體母豬流產,而敲除供體細胞的Xist 基因或利用非編碼RNA干擾胚胎中Xist 基因的異常表達均可顯著提高豬SCNT胚胎發育率[2930]。
2 提高豬體細胞克隆胚胎發育率的方法
2.1 選擇合適的供體細胞
在豬SCNT研究中,多種類型體細胞被用作核移植的供體細胞,至少有10種細胞已被證實了具有重編程能力,目前應用較廣泛的是豬胎兒成纖維細胞和豬腎成纖維細胞[31]。不同類型供體細胞的克隆效率存在差異。Wei等[32]比較了用于SCNT的PFF、新生豬成纖維細胞和成年豬成纖維細胞的重編程能力,結果表明,PFF 和新生豬成纖維細胞SCNT胚胎的卵裂率、囊胚率和妊娠率均高于成年豬成纖維細胞。此外,Jiao等[33]比較了供體細胞大小對SCNT胚胎發育的影響,結果表明,小于13 μm體細胞的卵裂率顯著高于13~18 μm,囊胚率和囊胚細胞數同樣顯著高于13 μm以上的體細胞,說明直徑小于13 μm的PFF更有利于SCNT胚胎發育。
干細胞(stem cell,SC)是具有自我復制能力、可分化成多種功能細胞的多潛能細胞,在現代生物育種(干細胞育種)中展現出顯著的應用優勢,作為供體細胞可顯著提高SCNT重編程效率。Lee等[34]比較了精原干細胞(spermatogonial stem cell,SSC)和PFFs的SCNT效率,發現SSC作為供體細胞的SCNT胚胎具有更高的囊胚率,是生產豬SCNT胚胎的理想供體細胞類型,用脫氨膽堿處理核供體SSC可進一步提高克隆胚胎的生產效率。另有研究發現,BMSC-NT胚胎具有更活躍的表觀遺傳標記和更少的抑制性表觀遺傳標記,胚胎卵裂率和囊胚率接近IVF胚胎,且顯著高于FF-NT胚胎;進一步用RRBS-seq 發現,在BMSC-NT 胚胎中,NANOG 和POU5f1 基因啟動子區域DNA 甲基化水平低于FF-NT[16]。另外,BMSC的RNA N6-甲基腺苷(m6A)修飾水平比豬胚胎成纖維細胞高,更有利于SCNT胚胎發育[35]。以上說明,供體細胞的初始表觀遺傳狀態差異對SCNT胚胎重編程有一定影響,具有開放染色質狀態的干細胞更有利于供體細胞核重編程,可促進SCNT胚胎的發育。
2.2 優化卵母細胞體外成熟體系、去核及激活方式
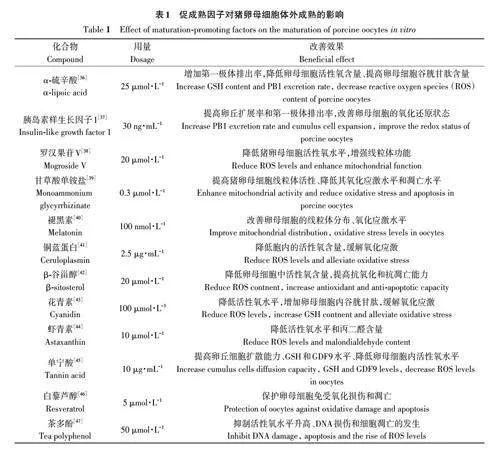
優質卵母細胞是SCNT的基礎,IVM培養液是影響卵母細胞質量的關鍵因素。諸多研究表明,IVM培養液中添加促成熟因子可有效改善卵母細胞的成熟質量(表1)。
卵母細胞的去核是否完全是影響核移植效率關鍵因素之一。卵母細胞去核方法有多種,包括盲摘法、化學藥物誘導去核法、DNA染色熒光去核法等,其中大部方法步驟繁瑣且需要借助顯微操作儀才能完成。相比以上方法,手工克隆技術(handmade cloning,HMC)不需要借助顯微操作儀等昂貴設備,借助顯微切割刀去除極體下面的少量胞質即可達到去核目的,無需用Hoechst 33342染色以及紫外光檢測,避免了紫外線照射對胚胎發育產生的不利影響[48]。任子利等[49]研究表明,用脫羰秋水酰堿輔助去核,可提高去核率和克隆胚胎囊胚率。HMC得到的胚胎無透明帶,在胚胎體外培養液(invitro culture,IVC)容易暴露于有毒物質中,且需要2個卵母細胞重構1個胚胎,需要大量的卵母細胞,同時會帶來線粒體異質性問題。因此,Lee等[50]建立了一種改良手工克隆技術,用1枚卵母細胞構建1個重構胚來解決卵母細胞去核過程中卵母細胞損耗和線粒體異質性的問題。此外,得益于人工智能的快速發展,一種無標記機器人精準去核技術可減少SCNT去核過程中的細胞質丟失,去核成功率達95%,來自機器人去核卵母細胞的克隆胚胎卵裂率是盲摘法的2倍,并顯著提高了克隆效率[51]。
供體細胞與去核卵母細胞融合后,需要進一步激活重構胚才能使其正常發育。當前應用于豬SCNT重構胚激活方法可分為物理激活、化學激活和聯合激活3大類。目前應用最為普遍的是聯合激活,與單純化學激活和物理激活相比,聯合激活對重構胚的激活效率更高。石俊松等[52]比較了2 種電激活方式(同步融合激活法和延遲激活法),發現延遲激活雖然會降低重構胚的融合率,但能夠顯著提高克隆胚胎的卵裂率和囊胚率。
2.3 添加小分子化合物促進重構胚發育
諸多研究人員使用表觀遺傳修飾相關小分子化合物用于處理SCNT 供體細胞,以改善異常DNA 甲基化提高胚胎發育率。研究發現,0.25~0.50 μmol·L?1的5-氮雜-2’脫氧胞苷(5-Aza-CdR)處理PFF 72 h,可提高豬克隆胚胎囊胚發育率[53];用5 μmol·L?1 非核苷類 DNA 甲基轉移酶(DNAmethyltransferase,DNMT)抑制劑RG108 處理PFF72 h可改善其核重編程,降低PFF基因組的DNA甲基化的時間依賴性和印記基因 h19的甲基化水平,改善豬SCNT胚胎發育,提高SCNT效率[54]。謝穎瑜等[55]研究表明,0.1 mmol·L?1的S-腺苷高半胱氨酸處理豬成纖維細胞24 h,可降低DNMT轉錄水平和整體DNA甲基化水平,具有誘導成纖維細胞分化、改善克隆效率的潛能。
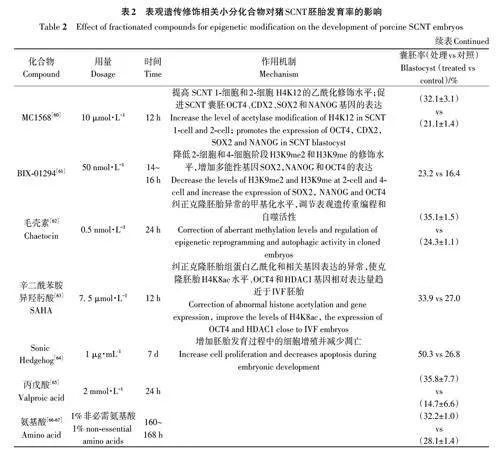
越來越多的研究表明,在IVC中添加表觀遺傳修飾小分化合物培養克隆胚胎,可糾正表觀重編程錯誤,調控胚胎發育相關基因的表達,從而提高豬SCNT胚胎發育率(表2)。
3 展 望
近年來,隨著高通量多組學測序技術(如DNA測序、轉錄譜、ChiIP-Seq等)在全基因組水平上的快速發展和廣泛應用,克隆胚胎發育過程中的重編程障礙機制逐漸被發現。利用DNA甲基轉移酶抑制劑、組蛋白去乙酰化酶抑制劑等改善表觀重編程的策略,在提高克隆胚胎發育的研究中取得了較大進展,但克隆動物的出生率和健仔率依然很低。
在未來的研究中,提高SCNT 胚胎的發育率仍然是體細胞克隆研究的重點方向。隨著研究人員對克隆胚胎發育機制的研究逐步加深,更多調控SCNT胚胎發育的特異性靶點逐漸被發現,有待開發出更多、更有效的特異性表觀遺傳修飾相關小分子化合物、基因特異性干擾RNA及其組合方法,聯合最新測序技術和最新基因編輯技術,快速解析表觀遺傳重編程機制,克服SCNT胚胎發育過程中的重編程障礙,從而大幅提高克隆胚胎的發育率。當前微量細胞測序技術已應用于解析SCNT異常機制,小鼠SCNT胚胎發育率得到很大改善,囊胚率達80%以上[23]。豬SCNT可以借鑒相應技術,進一步改善豬體細胞克隆胚胎的發育率。
參考文獻
[1] WILMUT I, SCHNIEKE A E, MCWHIR J, et al .. Viable offspring derived from fetal and adult mammalian cells [J].Nature, 1997,385: 810-813.
[2] LIU Z, CAI Y J, WANG Y, et al .. Cloning of macaque monkeys by somatic cell nuclear transfer [J]. Cell, 2018,172(4):881-887.
[3] PRATHER R S, SIMS M M, FIRST N L. Nuclear transplantation in early pig embryos [J]. Biol. Reprod., 1989,41(3):414-418.
[4] POLEJAEVA I A, CHEN S H, VAUGHT T D, et al .. Cloned pigs produced by nuclear transfer from adult somatic cells [J].Nature, 2000,407:86-90.
[5] RYU J, PRATHER R S, LEE K. Use of gene-editing technology to introduce targeted modifications in pigs [J/OL]. J.Anim. Sci. Biotechnol., 2018, 9:5 [2024-02-20]. https://doi.org/10.1186/s40104-017-0228-7.
[6] SPIZZO T, DENNER J, GAZDA L, et al .. First update of the International xenotransplantation association consensus statement on conditions for undertaking clinical trials of porcine islet products in type 1 diabetes--chapter 2a: source pigs--preventing xenozoonoses [J]. Xenotransplantation, 2016,23(1):25-31.
[7] ZHANG X L, GAO S R, LIU X Y. Advance in the role of epigenetic reprogramming in somatic cell nuclear transfermediated embryonic development [J/OL]. Stem Cells Int., 2021,2021:6681337 [2024-02-20]. https://doi.org/10.1155/2021/6681337.
[8] SCHMIDT M, WINTHER K D, SECHER J O, et al .. Postmortem findings in cloned and transgenic piglets dead before weaning [J].Theriogenology,2015,84(6):1014-1023.
[9] ATSUO O, SHOGO M, KIMIKO I. 25th anniversary of cloning by somatic-cell nuclear transfer: epigenetic abnormalities associated with somatic cell nuclear transfer [J]. Reproduction(Camb. Engl.), 2021,162(1):45-58.
[10] TELFER E E, ANDERSEN C Y. In vitro growth and maturation of primordial follicles and immature oocytes [J].Fert. Ster., 2021,115(5):1116-1125.
[11] YE M, YANG Z Y, ZHANG Y,et al .. Single-cell multiomic analysis of in vivo and in vitro matured human oocytes [J]. Hum.Reprod., 2020,35(4):886-900.
[12] KIRILLOVA A, SMITZ J, SUKHIKH G T, et al .. The role of mitochondria in oocyte maturation [J/OL]. Cells, 2021, 10(9):92484 [2024-02-20]. https://doi.org/10.3390/cells10092484.
[13] 邢青華,鄒超霞,魏耀昶,等.不同年齡水牛成纖維細胞DNA甲基化與組蛋白乙酰化水平分析[J].中國畜牧雜志,2021,57(8):102-106.
[14] 羅嬋. 不同個體水牛體細胞克隆效率差異的分子機制研究[D].南寧:廣西大學,2018.
LUO C. Studies related to the mechanism of different somatic cell cloning efficiencies in different buffalo individuals [D].Nanning: Guangxi University, 2018.
[15] 趙鑫.水牛體細胞繼代克隆及卵胞質對供體細胞核重編程作用的初步研究[D].南寧:廣西大學,2019.
ZHAO X. A preliminary study of buffalo serial somatic cell nuclear transfer and the effect of oocyte cytoplasm on reprogramming of donor cell [D]. Nanning: Guangxi University,2019.
[16] ZHAI Y, LI W, ZHANG Z, et al .. Epigenetic states of donor cells significantly affect the development of somatic cell nuclear transfer (SCNT) embryos in pigs [J]. Mol. Reprod.Dev., 2018,85(1):26-37.
[17] 曹嘉程,薛麗娥,藍群,等.表觀遺傳修飾影響哺乳動物體細胞核移植效率的研究進展[J]. 中國畜牧雜志,2023,59(3):7-15.
CAO J C, XUE L E, LAN Q, et al .. Research progress on the effect of epigenetic modification affecting the efficiency of mammalian somatic cell nuclear transfer [J]. Chin. J. Anim.Sci., 2023,59(3):7-15.
[18] LIU W Q, LIU X Y, WANG C F, et al .. Identification of key factors conquering developmental arrest of somatic cell cloned embryos by combining embryo biopsy and single-cell sequencing [J/OL]. Cell Discov., 2016, 2:16010 [2024-02-20].https://doi.org/10.1038/celldisc.2016.10.
[19] MATOBA S, WANG H H, JIANG L, et al .. Loss of H3K27me3 imprinting in somatic cell nuclear transfer embryos disrupts post-implantation development [J]. Cell Stem Cell, 2018,23(3):343-354.
[20] CANOVAS S, IVANOVA E, ROMAR R, et al .. DNA methylation and gene expression changes derived from assisted reproductive technologies can be decreased by reproductive fluids [J/OL]. Elife, 2017, 6:23670 [2024-02-20]. https://doi.org/10.7554/eLife.23670.
[21] BU G, ZHU W, LIU X, et al .. Coordination of zygotic genome activation entry and exit by H3K4me3 and H3K27me3 in porcine early embryos [J]. Genome Res., 2022, 32(8): 1487-1501.
[22] HIROSE M, HADA M, KAMIMURA S, et al .. Aberrant imprinting in mouse trophoblast stem cells established from somatic cell nuclear transfer-derived embryos [J]. Epigenetics,2018,13(7):693-703.
[23] YANG G, ZHANG L F, LIU W Q, et al .. Dux-mediated corrections of aberrant H3K9ac during 2-cell genome activation optimize efficiency of somatic cell nuclear transfer [J]. Cell Stem Cell, 2021,28(1):150-163.
[24] YAMANAKA K, SUGIMURA S, WAKAI T, et al .. Acetylation level of histone H3 in early embryonic stages affects subsequent development of miniature pig somatic cell nuclear transfer embryos [J]. J. Reprod. Dev., 2009,55(6):638-644.
[25] ZHOU N R, CAO Z B, WU R H, et al .. Dynamic changes of histone H3 lysine 27 acetylation in pre-implantational pig embryos derived from somatic cell nuclear transfer [J]. Anim.Reprod. Sci., 2014,148(3/4):153-163.
[26] 張寧,余波,石俊松,等.印記基因XIST和H19DNA甲基化水平與豬克隆胚胎發育效率關聯分析[J].華南農業大學學報,2021,42(3):9-16.
ZHANG N, YU B, SHI J S, et al .. Correlation between DNA methylation levels of imprinted genes XIST and H19 and developmental efficiency of porcine cloned embryo [J]. J. South China Agric. Univ., 2021,42(3):9-16.
[27] CHEN Z Y, ZHANG Y. Maternal H3K27me3-dependent autosomal and X chromosome imprinting [J]. Nat. Rev. Genet.,2020,21:555-571.
[28] FURLAN G, GALUPA R. Mechanisms of Choice in XChromosome Inactivation [J/OL]. Cells, 2022, 11(3):535 [2024-02-20]. https://doi.org/10.3390/cells11030535.
[29] RUAN D G, PENG J Y, WANG X S, et al .. XIST derepression in active X chromosome hinders pig somatic cell nuclear transfer [J].Stem Cell Rep., 2018,10(2):494-508.
[30] YANG X, WU X, YANG Y, et al .. Improvement of developmental competence of cloned male pig embryos by short hairpin ribonucleic acid (shRNA) vector-based but not small interfering RNA (siRNA) -mediated RNA interference (RNAi) of Xist expression [J]. J. Reprod. Dev., 2019, 65(6):533-539.
[31] LIU H B, LV P R, ZHU X X, et al .. In vitro development of porcine transgenic nuclear-transferred embryos derived from newborn Guangxi Bama mini-pig kidney fibroblasts [J]. Vitro Cell. Dev. Biol. Anim., 2014,50(9):811-821.
[32] WEI H J, QING Y B, PAN W R, et al.. Comparison of the efficiency of Banna miniature inbred pig somatic cell nuclear transfer among different donor cells [J/OL]. PLoS One, 2013, 8(2):e57728 [2024-02-20]. https://doi.org/10.1371/journal.pone.0057728.
[33] JIAO D, CHENG W, ZHANG X, et al .. Improving porcine SCNT efficiency by selecting donor cells size [J].Cell Cycle,2021,20(21):2264-2277.
[34] LEE J, LEE Y, LEE G S,et al .. Comparative study of the developmental competence of cloned pig embryos derived from spermatogonial stem cells and fetal fibroblasts [J]. Reprod.Domest. Anim., 2019,54(9):1258-1264.
[35] ZHANG M, ZHAI Y H, AN X L, et al .. DNA methylation regulates RNA m(6) A modification through transcription factor SP1 during the development of porcine somatic cell nuclear transfer embryos [J/OL]. Cell Prolif, 2023: e13581 [2024-02-20]. https://doi.org/10.1111/cpr.13581.
[36] 高悅悅,顧浩,陳礬,等.α-硫辛酸對豬卵母細胞體外成熟及孤雌胚胎發育的影響[J]. 中國畜牧雜志, 2023, 59(11):204-209.
[37] 劉子嶷,李凱揚,王鵬,等.添加IGF-1對體外培養不同直徑豬卵泡中卵母細胞成熟率的影響[J]. 中國畜牧雜志,2022,58(11):189-194.
[38] NIE J Y, YAN K, SUI L M, et al .. Mogroside V improves porcine oocyte in vitro maturation and subsequent embryonic development [J]. Theriogenology, 2020,141:35-40.
[39] 張碧菡,趙寶寶,高靜,等.甘草酸單銨鹽對豬卵母細胞體外成熟及胚胎發育能力的影響[J].中國獸醫學報,2023,43(11):2361-2367.
ZHANG B H, ZHAO B B, GAO J, et al .. Effects of monoammonium glycyrrhizinate on oocyte maturation and embryonic development in porcine [J]. Chin. J. Vet. Sci., 2023,43(11):2361-2367.
[40] YANG L, WANG Q K, CUI M S, et al .. Effect of melatonin on the in vitro maturation of porcine oocytes, development of parthenogenetically activated embryos, and expression of genes related to the oocyte developmental capability [J/OL]. Animals (Basel), 2020, 10(2):209 [2024-02-20]. https://doi.org/10.3390/ani10020209.
[41] 荊煥松,周榮,羅綠花,等.豬卵母細胞體外成熟過程中添加銅藍蛋白對成熟率和孤雌胚胎發育能力的影響[J].廣東畜牧獸醫科技,2023,48(6):28-33.
JING H S, ZHOU R, LUO L H, et al .. Effects of ceruloplasmin on maturation rate and embryonic development of porcine oocytes cultured in vitro [J]. Guangdong J. Anim. Vet. Sci.,2023,48(6):28-33.
[42] 藍昕蕊,趙寶寶,張碧菡,等.β-谷甾醇對豬卵母細胞體外成熟和胚胎發育的影響[J]. 畜牧獸醫學報,2024,55(4):1629-1637.
LAN X R, ZHAO B B, ZHANG B H, et al .. Effects of β -Sitosterol on porcine oocyte maturation and embryonic development in vitro [J]. Acta Vet. Zootechnica Sin., 2024,55(4):1629-1637.
[43] HICKS E, MENTLER M, ARENA H A, et al .. Cyanidin improves oocyte maturation and the in vitro production of pig embryos [J].Vitro Cell. Dev. Biol. Anim., 2020,56(7):577-584.
[44] 許建春,汪浩鑫,自永宏,等.蝦青素對豬卵母細胞體外成熟的影響[J].中國獸醫學報,2022,42(12):2549-2554.
XU J C, WANG H X, ZI Y H,et al ..Effects of astaxanthin on maturation of porcine oocytes in vitro [J]. Chin. J. Vet. Sci.,2022,42(12):2549-2554.
[45] 孫婧陶,姜超前,劉佳慧,等.單寧酸對豬卵母細胞體外成熟及胚胎發育能力的影響[J].中國畜牧獸醫,2021,48(10):3708-3714.
SUN J T, JIANG C Q, LIU J H, et al.. Effects of tannin acid on the in vitro maturation and embryonic development of porcine oocytes[J]. China Anim. Husb. Vet. Med., 2021,48(10):3708-3714.
[46] WANG X, ZHU X, LIANG X, et al .. Effects of resveratrol on in vitro maturation of porcine oocytes and subsequent early embryonic development following somatic cell nuclear transfer [J]. Reprod. Domest. Anim., 2019,54(9):1195-1205.
[47] ZHOU C, ZHANG X, SHIYANG X,et al .. Tea polyphenol protects against cisplatin-induced meiotic defects in porcine oocytes [J]. Aging, 2019,11(13):4706-4719.
[48] LIN Q Y, AIHARA M, SHIRAI A,et al .. Porcine embryo development and inactivation of microorganisms after ultraviolet-C irradiation at 228 nm [J]. Theriogenology, 2023,197:252-258.
[49] 任子利,趙彥玲,楊小淦,等.豬卵母細胞化學輔助手工去核及手工核移植胚胎發育能力因素的研究[J].畜牧獸醫學報,2011,42(7):921-931.
REN Z L, ZHAO Y L, YANG X G,et al .. Studies on factors affecting chemical assisted handmade enucleation of porcine oocytes and developmental capacities of handmade somatic cells nuclear transfer embryos [J]. Acta Vet. Zootechnica Sin.,2011,42(7):921-931.
[50] LEE E J, JI K B, LEE J H, et al .. Application of the modified handmade cloning technique to pigs [J]. J. Anim. Sci. Technol.,2021,63(2):281-294.
[51] ZHAO Q, QIU J, FENG Z,et al .. Robotic label-free precise oocyte enucleation for improving developmental competence of cloned embryos [J]. IEEE Trans. Bio Med. Eng., 2021,68(8):2348-2359.
[52] 石俊松,羅綠花,周榮,等.延遲激活對豬克隆胚胎體外、體內發育效率的影響[J].中國生物工程雜志,2019,39(4):16-23.
SHI J S, LUO L H, ZHOU R, et al .. Delayed activation can improve in vitro and in vivo developmental capacity of pig cloned embryos [J]. China Biotechnol., 2019,39(4):16-23.
[53] 呂玲燕,陸杏蓉,孫俊銘,等. 5-Aza-CdR對德保黑豬手工克隆重構胚胎體外發育效果的影響[J]. 中國畜牧獸醫,2018,45(11):3144-3152.
LYU L Y, LU X R, SUN J M, et al .. Effect of 5-Aza-CdR on the in vitro developmental potency of reconstructed embryos of Debao black pig handmade cloner [J]. China Anim. Husb. Vet.Med., 2018,45(11):3144-3152
[54] WU C F, ZHANG D F, ZHANG S, et al .. Optimizing treatment of DNA methyltransferase inhibitor RG108 on porcine fibroblasts for somatic cell nuclear transfer [J]. Reprod.Domest. Anim., 2019,54(12):1604-1611.
[55] 謝穎瑜,曹嘉程,宋紅兵,等.SAH對豬成纖維細胞體外增殖及甲基化水平的影響[J].中國畜牧雜志,2022,58(8):87-93.
[56] JIN L, GUO Q, ZHU H Y, et al .. Quisinostat treatment improves histone acetylation and developmental competence of porcine somatic cell nuclear transfer embryos [J]. Mol. Reprod.Dev., 2017,84(4):340-346.
[57] 朱彥賓,龍川,馮沖,等.Scriptaid處理可提高近交系五指山豬克隆胚胎的發育能力和克隆效率[J].基因組學與應用生物學,2011,30(3):268-273.
ZHU Y B, LONG C, FENG C, et al .. Improving the developmental potency of cloned embryos and cloning efficiency in Wuzhishan inbred pig by scriptaid treatment [J].Genom. Appl. Biol., 2011,30(3):268-273.
[58] JIN L, ZHU H Y, GUO Q, et al .. Effect of histone acetylation modification with MGCD0103,a histone deacetylase inhibitor,on nuclear reprogramming and the developmental competence of porcine somatic cell nuclear transfer embryos [J]. Theriogenology,2017,87:298-305.
[59] 侯黎明.組蛋白去乙酰化酶抑制劑Oxamflatin對豬體細胞克隆胚胎體外發育率的影響[D].武漢:華中農業大學,2016.
HOU L M. The effect of histone deacetylase inhibitor Oxamflatin in vitro developmental efficiency of porcine somatic cell nuclear transfer embryos [D]. Wuhan: Huazhong Agricultural University, 2016.
[60] WANG H, CUI W, MENG C, et al .. MC1568 enhances histone acetylation during oocyte meiosis and improves development of somatic cell nuclear transfer embryos in pig [J]. Cell.Reprogramming, 2018,20(1):55-65.
[61] HUANG J, ZHANG H, YAO J, et al .. BIX-01294 increases pig cloning efficiency by improving epigenetic reprogramming of somatic cell nuclei [J]. Reproduction, 2016,151(1):39-49.
[62] JEONG P S, SIM B W, PARK S H, et al .. Chaetocin improves pig cloning efficiency by enhancing epigenetic reprogramming and autophagic activity [J/OL]. Int. J. Mol. Sci., 2020,21(14):E4836 [2024-02-20]. https://doi.org/10.3390/ijms21144836.
[63] 孫俊銘,崔奎青,李志鵬,等. SAHA處理對豬手工克隆胚胎體外發育潛能的影響[J].黑龍江畜牧獸醫, 2018(5):104-108.
SUN J M, CUI K Q, LI Z P, et al .. Effects of SAHA on the developmental potential of porcine handmade cloned embryos in vitro [J]. Heilongjiang Anim. Sci. Vet. Med., 2018(5):104-108.
[64] NGUYEN N T, LIN D P C, SIRIBOON C, et al .. Sonic Hedgehog improves in vitro development of porcine parthenotes and handmade cloned embryos [J].Theriogenology, 2010,74(7):1149-1160.
[65] 羅綠花,周榮,麥然標,等.丙戊酸處理對豬體細胞克隆胚胎體外、體內發育效率的影響[J].黑龍江畜牧獸醫, 2021(5):64-68.
LUO L H, ZHOU R, MAI R B, et al .. Effects of valproic acid treatment on developmental capacity of porcine cloned embroys in vitro and in vivo [J]. Heilongjiang Anim. Sci. Vet.Med., 2021(5):64-68.
[66] 呂玲燕,陳寶劍,吳永紹,等.氨基酸對豬手工克隆重構胚胎發育效果的影響[J].湖北農業科學,2018,57(6):108-110.
LYU L Y,CHEN B J,WU Y S,et al ..Effects of developmental potency of reconstructed embryos on pig handmade clone of amino acid [J]. Hubei Agric. Sci., 2018,57(6):108-110.
[67] LIU T, LI J, DOU H, et al .. Low-concentration essential amino acids in PZM-3 improve the developmental competence of porcine embryos produced by handmade cloning [J]. Cell.Reprogramming, 2020,22(6):282-290.

