GB/T 19634—2021和GB/T 19634—2005版本變化解讀
摘 要:本文對GB/T 19634《體外診斷檢驗系統 自測用血糖監測系統通用技術條件》2021年版本和2005年版本差異進行解析,旨在闡述兩個版本之間的主要變動,包括適用范圍、定義、修改血糖儀和血糖試條系統準確度、紅細胞壓積要求、血糖儀安全要求、血糖儀電磁兼容要求、血糖儀和血糖試條系統準確度試驗血糖樣品要求、紅細胞壓積試驗方法、血糖儀安全試驗方法、電磁兼容試驗方法等。對以上多個方面的變化進行解讀,有助于對血糖儀相關檢測技術進行更深入的了解及應用。
關鍵詞:糖尿病,體外診斷檢驗系統,自測用血糖監測系統
DOI編碼:10.3969/j.issn.1002-5944.2024.19.031
0 引 言
糖尿病是臨床最為常見的慢性疾病,且現在糖尿病逐漸趨向于年輕化,當糖尿病患者的血糖水平持續性地無法得到有效控制,長期保持在較高濃度水平時,將會引起嚴重的并發癥,包括視網膜病變、腎功能損傷、血管病變、神經損傷、高血壓以及心臟病等。因此,使用自測用血糖儀來測定患者的血糖濃度水平,根據檢測數據及時采取相應的治療措施,對于患者保持血糖水平穩定,防止并發癥的發生極其重要[1]。
GB/T 19634—2021《體外診斷檢驗系統 自測用血糖監測系統通用技術條件》(以下簡稱“新標準”)已于2023年5月1日起開始正式執行,與GB/ T19634—2005相比,新標準在內容上進行了一些調整,增加、修改了部分條款,同時還對某些術語給出了新的定義;與ISO 15197: 2013相比,新版標準進行技術性差異的調整,以便適應我國國情。
1 標準內容的主要變化
1.1 適用范圍
新標準新增了適用范圍里不適用情形:
——以診斷糖尿病為目的的血糖濃度測定;
——具有等級測定值的測定程序(如可視性半定量測定程序)、無創性血糖監測系統、連續血糖監測系統[2]。
目的是將自測用血糖監測系統與大型全自動生化分析儀等可實現血糖濃度測定的檢測系統區別開,也說明標準中提到的自測用血糖監測系統不同于可視性半定量測定程序、無創性血糖監測系統及連續血糖監測系統(CGM)。
1.2 規范性引用文件
新標準“規范性引用文件”更改為GB/ T 191《包裝儲運圖示標志》,GB/ T 14710《醫用電器環境要求及試驗方法》,GB / T 18 2 6 8 .1和GB / T18268.26《測量、控制和實驗室用的電設備 電磁兼容性要求 第26部分:特殊要求 體外診斷(IVD)醫療設備》,以及GB/T 29791.4《體外診斷醫療器械 制造商提供的信息(標示)第4部分:自測用體外診斷試劑》及GB/T 29791.5《體外診斷醫療器械制造商提供的信息(標示)第5部分:自測用體外診斷儀器》。
1.3 術語和定義
新標準在“術語和定義”中新增了“自測”的定義,明確說明了自測是指由非專業人員進行的用于評估個體健康狀況的檢驗,并修改了“準確度”“精密度”“重復性”“批”“標簽”的定義,做了更準確的解釋。
1.4 血糖儀和血糖試條系統準確度
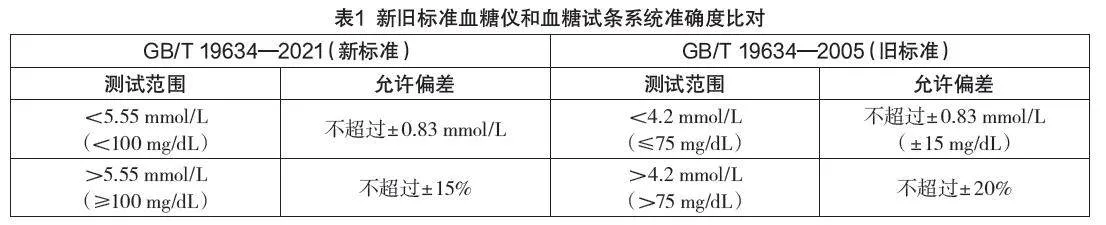
新標準對于“血糖儀和血糖試條系統準確度”要求做了修改,主要針對測試范圍和允許偏差的內容做了較大更改,如表1所示。
從表1可以看出,新標準分界點的血糖濃度水平由舊標準的4.2 mmol/L改為5.55 mmol/L,<5.55mmol/L的范圍允許絕對偏差與原來的4.2 mmol/L保持一致,≥5.55 mmol/L的范圍允許相對偏差更為嚴格,提高至±15%[3]。新標準血糖儀和血糖試條系統準確度與血糖儀和血糖試條測量重復性測試范圍保持一致。將血糖濃度分界點提高,說明從標準層面對血糖濃度測定的準確度要求更為嚴格,尤其是低值部分,更精確的葡萄糖檢測結果能提升測試的可靠性,進而使糖尿病患者通過做出明智的治療選擇,更好地掌控他們的疾病管理[4]。
1.5 紅細胞壓積的要求
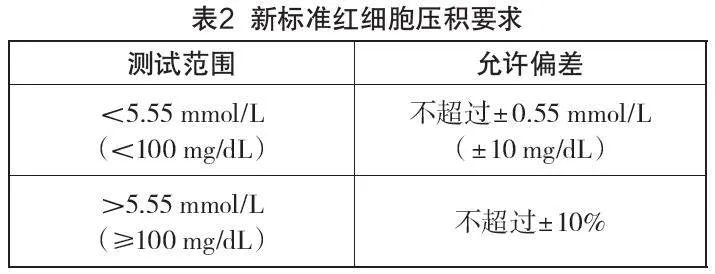
新標準增加了紅細胞壓積的要求,如表2所示。
新標準中對于紅細胞壓積的試驗樣品、實驗程序、樣本準備、評價程序、數據分析和結果呈現都做了詳細說明,新增這個指標的目的是確定紅細胞壓積對于血糖監測系統測量值的影響,一般正常健康男性的紅細胞壓積在40%~50%,健康女性在35%~45%。紅細胞壓積范圍與血糖儀的關系就在于,一些同時患有糖尿病和貧血、慢性心肺疾病的患者以及孕婦,其紅細胞壓積會出現增多或減少的情況,而市面上大部分血糖儀的紅細胞壓積范圍僅能覆蓋正常值。上述患者若使用常規血糖儀,其檢測結果可能會出現一定偏差,上述患者對血糖濃度檢測的依賴性遠高于正常人。為了覆蓋到這部分人,使得這部分人的血糖濃度的測定準確,新版標準增加了紅細胞壓積指標,以驗證不同紅細胞壓積情況對血糖儀血糖濃度檢測值的影響。
紅細胞壓積(HCT)是指血液經過抗凝處理并離心后,紅細胞在全部血液中所占的體積比例。不同群體的血細胞比容(HCT)數值存在差異,一般情況下,男性的HCT正常范圍會高于女性的正常范圍,新生兒的HCT水平會高于一般人群的正常值。使用全血在末梢毛細血管進行的血糖檢測中,紅細胞里的葡萄糖比血漿里同等體積的少。這可能導致由于HCT的不同,使得血糖檢測系統得到的結果有誤差。為確保血糖監測系統測試精度,血液樣本中HCT值必須在產品說明書指定的范圍內。
(1)其中試驗樣品應符合的要求
a)靜脈血,樣本可以是1個或多個供者提供;
b)樣本需在23℃±5℃溫度下平衡,在評價過程中,溫度變化不超過±3℃;
c)血糖監測系統和參考分析方法測量應在樣本收集24 h內進行。
(2)試驗流程
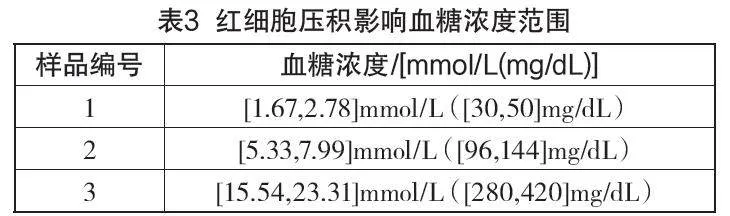
a)評價紅細胞壓積影響效應,至少需要滿足5個壓積水平和3個血糖濃度的樣本。血糖濃度劃分間隔見表3。評價試驗也可以擴展包括其他血糖濃度和紅細胞壓積。
b)多因素設計(紅細胞壓積×血糖濃度)優先考慮。其他試驗設計有統計學依據的也可以接受。
c)選擇精密度和正確度符合要求的參考測量方法和/或參考儀器(一般選擇已經上市的同種類產品作為參考儀器),用來測量血糖和壓積的參考值。
(3)樣本準備
a)將血液進行血漿、血細胞分離,然后通過調整血漿、血細胞混合比例來得到所需紅細胞壓積樣本。
b)最高和最低紅細胞壓積應當覆蓋血糖監測系統所標稱的紅細胞壓積范圍。樣本中間壓積值應為42%±2%。
(4)具體操作步驟
a)調節血糖濃度以得到所需血糖值樣本;
b)將混合血液樣本平均分成5等份;
c)離心每份血;
d)搜集血漿;
e)重新將血細胞加入不同體積血漿以得到一系列樣本,包括最高和最低紅細胞壓積水平;
f)將每一壓積樣本用參考測量方法和/或參考儀器進行測量;
g)將每一壓積樣本平均分成3等份。
(5)評價程序
在進行測量之前,每個樣本都需要溫和且充分的混合。以下是具體的執行步驟:
a)參考測量方法測量2次,計算平均值;
b)計算血糖監測系統的10次測量結果的平均值;
c)儀器測量結束后,用參考測量方法測試2次;
d)對比步驟a)和c)中的測量結果,以確認血液樣本在評估期間是否保持穩定,目的是排除樣本本身不穩定的因素。如果結果超出預先規定的要求[第一次結果和最后一次結果之間的差異在血糖濃度≤5.55 mmol/L(100 mg/dL)時gt;0.22 mmol/L(4mg/dL)或在血糖濃度gt;5.55 mmol/L(100 mg/dL)時gt;4%],那么這個樣本的測量值將不被采用,需要使用另一樣本重新進行測量評估,這里對測量值的要求是如果在規定血糖濃度范圍內,絕對偏差或相對偏差超過固定值要求時,所測得血糖濃度的結果若產生異常偏差,無法判定是血糖樣本穩定性造成的還是不同紅細胞壓積造成的,所以要遵循單一變量原則,首先要保證血液樣本的穩定性,再去評估不同紅細胞壓積對血糖濃度測定值的影響。
(6)數據分析和結果呈現
分析每個血糖濃度和紅細胞壓積所得測量數據,按照下列要求進行分析。具體操作步驟如下:
a)對于每一樣本,計算血糖監測系統測量的血糖值的平均值及參考測量方法測量值的平均值;
b)對于每一樣本,計算血糖監測系統測量值(指血糖監測系統測量的血糖值的平均值)與參考值(指參考測量方法測量值的平均值)的絕對偏差和相對偏差,必須滿足新標準表格2中血糖和血糖試條系統的精確度規定;
c)計算每個樣本血糖偏倚平均值與中間水平血糖偏倚平均值的偏差,以確定紅細胞壓積對于血糖監測系統測量值的影響。
1.6 血糖儀環境試驗
舊標準環境試驗要求規定了具體年份,引用的是GB/T 14710—1993,新標準未指定具體年代號,未做特殊說明則可在引用時直接引用最新適用版本。
1.7 安全要求
舊標準安全要求引用的是GB 9706.1—1995和/或GB 4793.1—1995,新標準更改為GB 4793.1、YY 0648〔體外診斷(IVD)醫用設備的專用要求〕、GB 9706.1中的適用規定。新標準未指定具體年代號,未做特殊說明則可在引用時可直接引用最新適用版本。
1.8 電磁兼容
關于電磁兼容,舊標準未做任何要求,新標準新增血糖儀電磁兼容要求,需要遵循的標準包含GB/T 18268.1、GB/T 18268.26以及YY 0505等三個標準。
1.9 血糖儀和血糖試條系統準確度血糖樣品要求
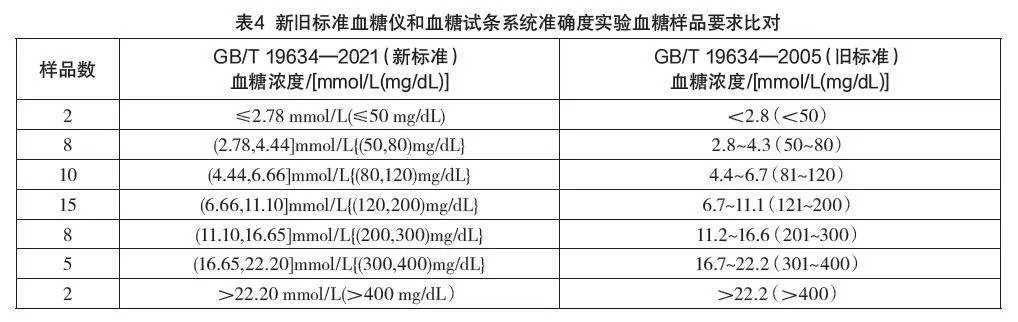
新標準血糖儀和血糖試條系統準確度實驗中血糖樣品要求更加具體,與舊版相比如表4所示。
由表4可以看出新標準對于濃度范圍的分割更加清晰,且數據都精確到了小數點后兩位,對樣品要求更加明確細致。
2 其他變化
除以上描述的變化以外,新標準還有一些細節變化。例如將舊標準5.1條款中的“d)”進行了刪除,不再需要具有溯源性的血糖參考物質;
新標準5.3條款中獲得低濃度血樣品的試驗方法不止放置過夜,新增了可“使用制造商定義的孵育條件”進行獲取,適用性更強;
血糖儀和血糖試條系統準確度的試驗方法中刪除了“回收試驗”;
血糖試條批間差所使用的血糖試條由舊標準的“2個不同批號”改為了“3個不同批號”。
以上細節的變化都使得新標準在實際應用過程中更加清晰合理。
3 結 語
綜上所述,新版標準在舊版標準的基礎上結合國際標準ISO 15197[5]的內容,根據國內醫療器械發展情況,在內容上進行了優化修改,新增了部分舊標準未加入的性能測試指標,在樣本要求方面更加明確清晰,有助于自測用血糖監測系統技術條件和國際標準的統一,加強了自測用血糖監測系統性能評估試驗方法的適用性,使得血糖監測系統的性能評估更加全面和安全有效,有助于提高用戶血糖自測準確率,同時也有利于自測用血糖監測系統在檢測技術方面的發展。
參考文獻
[1]楊青.無創及微創血糖儀研究進展[J].中國醫療器械信息,2019,25(12):23-24.
[2]體外診斷檢驗系統 自測用血糖監測系統通用技術條件:GB/T 19634—2021[S].2021.
[3]體外診斷檢驗系統 自測用血糖監測系統通用技術條件:GB/T 19634—2005[S].2005.
[4]In Vitro diagnostic test system—Requirements for bloodglucose monitoring systems for self-testing in managing diabetes mellitus: ISO 15197: 2013[S].2013.
[5]王煜非.解讀I SO 1519 7: 2 013標準[J ].中國糖尿病雜志,2014,22(12):1149-1152.
作者簡介
阮仕環,本科,工程師,主要從事醫療器械產品檢測及法規研究工作。
余良清,本科,高級工程師,主要從事醫療器械產品檢測及法規研究工作。
(責任編輯:張瑞洋)

