不同單克隆抗體聚集與斷裂行為的多維分析

關鍵詞:單克隆抗體;聚集;斷裂;脫酰胺;氧化
聚集和斷裂被認為是評估蛋白類藥物純度和完整性的關鍵質量屬性[1-2],它們會減弱蛋白質的生物活性,并影響藥代動力學、藥效學特性和免疫原性[3-5]。聚集和斷裂是抗體藥物中常見的現象,許多因素會影響其聚集和斷裂。因此,對抗體藥物的聚集和斷裂行為進行檢測和分析,在抗體藥物的開發、生產和儲存過程中具有重要意義。
翻譯后修飾(Post-TranslationalModifications,PTMs)在蛋白質加工和成熟中起著關鍵作用,它們可以改變蛋白質的物理和化學性質,并影響蛋白質的空間構象、疏水性和穩定性[6]。一些非理想的PTMs,如氧化和脫酰胺修飾,在抗體藥物的發酵、純化、制備和儲存過程中很容易發生,其對產品的質量和功能產生很多負面影響[7-8]。甲硫氨酸(Met)和色氨酸(Trp)殘基的氧化會導致抗體藥物結構完整性、構象穩定性、安全性的變化[9]。研究表明,單克隆抗體(Monoclonalantibodies,mAbs)的Fc區和互補決定區(ComplementarityDeterminingRegion,CDR)中Met或Trp殘基的氧化會導致分子空間占用增加和穩定性下降,從而引起聚集和斷裂的發生[10-11]。天冬酰胺(Asn)的脫酰胺是生物制藥生產和儲存中最常見、最難控制的PTMs之一,它會改變蛋白質的親水性和表面電荷分布,造成折疊結構的變化和疏水殘基的暴露,從而影響抗體的聚集行為[12-13]。此外,CDR的脫酰胺可能引起抗體-抗原相互作用,導致免疫原性問題[14]。
尺寸排阻色譜法(SizeExclusionChromatography,SEC)為生物制藥工業檢測藥物中聚體和碎片的常用方法,其原理是根據分子大小和形狀分離樣品。盡管SEC廣泛應用于抗體藥物分子大小變異體的定量分析,但它仍然存在部分局限性。首先,SEC在分析過程中存在蛋白質和色譜柱之間的非特異性相互作用[15];其次,SEC分析過程中不可避免地涉及樣品的稀釋,這可能會使弱可逆相互作用形成的聚體解離而形成單體[16];最后,較大的聚體也可能在色譜過程中被過濾掉[17]。
目前美國食品藥品監督管理局(FDA)要求使用正交方法來分析抗體藥物的分子大小變異體,用以彌補當前SEC的局限性,從而對抗體藥物進行更全面的分析[18]。分析型超速離心法(Analyticalultracentrifugation,AUC)是分析溶液中大分子的一種通用方法,它廣泛用于抗體藥物聚集的表征分析[19]、制劑篩選[20]、批次一致性分析[21]、可逆相互作用分析[22]以及小分子和治療蛋白篩選[23]等。沉降速率(SedimentationVelocity,SV)模式在高離心力場下測量樣品的不同SV來確定樣品的組成,基于樣品中不同組分的分子質量和形狀差異,可以形成一個獨特的邊界,并以特有的速度沉降,它可以在不受溶劑或基質干擾的條件下測定蛋白質的分子量、純度、聚集狀態和分子相互作用,以獲得最接近自然條件的樣品組成[24-25]。總之,AUC中SV分析模式(AUC-SV)在表征抗體藥物方面比SEC具有顯著優勢。
本文旨在通過SEC、AUC的聯用,對兩種處于研發階段的新型mAbs(ZG154和ZG187)在加速穩定性實驗(40℃)中產生的聚集與斷裂現象進行正交檢測分析,并且利用液相色譜-質譜聯用儀(LCMS)、圓二色光譜(CircularDichroism,CD)、動態光散射和示差掃描熒光技術等從多個方面探究造成ZG154和ZG187產生分子大小變異體的原因。
1實驗部分
1.1實驗原料
本研究使用的ZG154和ZG187抗體屬于IgG1類,由上海臻格生物技術有限公司提供,樣品通過標準色譜過程進行純化,在40℃的培養箱中避光放置。氯化鈉(NaCl)、二水合磷酸二氫鈉(NaH2PO4·2H2O),國藥集團化學試劑有限公司;二硫蘇糖醇(DTT)、碘代乙酰胺(IAM)、三羥甲基氨基甲烷(Tris)、鹽酸胍、尿素,美國Sigma-aldrich公司;胰蛋白酶(Trypsin),普洛麥格生物技術有限公司;乙腈(ACN)、超純水和甲酸(FA),美國賽默飛世爾科技公司。所有試劑均為分析純,未經純化直接使用。
1.2實驗方法
1.2.1SEC測定分子大小變異體純度 采用Agilent1260型液相色譜儀(美國安捷倫科技公司)進行分析:樣品用流動相稀釋至2mg/mL后進樣,進樣體積為30μL,使用TSKgelG3000SWXL凝膠色譜柱(7.8mm×300mm×5μm);流動相為50mmol/LNaH2PO4,300mmol/LNaCl,pH7.0;流速為0.5mL/min,等度洗脫,洗脫時間為35min,柱溫箱溫度為25℃,紫外檢測波長為280nm。
1.2.2AUC測定分子大小變異體純度 對樣品ZG154和ZG187(質量濃度2mg/mL)進行SV分析。在20℃下平衡2h后,使用An-60Ti型轉子在OptimaAUC型離心機(美國貝克曼庫爾特有限公司)中以40000r/min和20℃條件下分析。吸收光學系統在280nm的波長條件下以120s的間隔掃描260次。數據分析使用軟件SEDFIT15.01b,分布模型使用Continuousc(s),分析置信水平(F-ratio)為0.68。ZG154的溶劑密度設定為1.0097g/mL,溶劑黏度為1.069mPa·s;ZG187的溶劑密度為1.0287g/mL,溶液黏度為1.256mPa·s;SEC流動相密度為1.0166g/mL,黏度為1.067mPa·s。
1.2.3蛋白質PTMs測定方法 取樣品500μg,加入變性緩沖液(8mol/L鹽酸胍,250mmol/LTris,pH7.5±0.2)188μL、500mmol/LDTT8μL,加超純水使體積至250μL,混勻,37℃水浴30min。待水浴完成后在樣品中加入500mmol/LIAM25μL進行烷基化,混勻,室溫避光反應30min。隨后使用NAP-5柱對樣品進行脫鹽處理。取NAP-5柱收集液100μL加入Trypsin酶(0.5mg/mL)8μL,吹打混勻,37℃水浴4h。水浴完成后加入1μLFA終止反應后上樣分析。采用Q-Exactive型液質聯用儀(美國賽默飛世爾科技公司)進行樣品分析,使用電噴霧離子源(ESI)、靜電場軌道離子阱質量分析器(Orbitrap),ACQUITYUPLCPeptideBEHC18色譜柱(186003687;1.7μm,2.1×150mm),流動相A為FA/H2O(FA體積分數為0.1%),流動相B為FA/ACN(FA體積分數0.1%)。采用梯度洗脫模式,90min內流動相B從2%到40%,流速為0.3mL/min,柱溫為60℃。在正離子模式下分析樣品,并使用BioPharmaFinder4.1進行數據分析。
1.2.4蛋白質二級與三級結構測定方法 采用ChirascanTMVX型圓二色光譜儀(英國應用光物理有限公司)在室溫下對樣品的圓二色性進行測定:將樣品稀釋到0.2mg/mL后加入到0.5mm比色皿中進行二級結構測定,將樣品稀釋到5mg/mL后加入到1.0mm比色皿中進行三級結構檢測;遠紫外光譜測量范圍為190~260nm,近紫外光譜測量范圍為250~340nm,步進為1nm,設置單個數據點采樣時間為1.0s。溶劑圓二色光譜(CD)信號和樣品CD信號重復測定3次取平均值,減去溶劑CD信號后得到最終結果。
1.2.5蛋白質熔融溫度檢測方法 采用PrometheusNT.PlexDSF型蛋白穩定性分析儀(德國諾坦普科技有限公司)對樣品熔解溫度(Tm)進行測定:使用毛細管吸取樣品至完全充盈,且毛細管中部區域無明顯氣泡,調節熒光激發強度使樣品的最高峰值在15000處;起始溫度為20℃,終止溫度為95℃,加熱速率為1.0℃/min;通過分析熒光相對于溫度的一階導數來確定蛋白質的Tm。
1.2.6蛋白質擴散相互作用系數檢測方法 使用制劑緩沖液將樣品分別稀釋到5、4、3、2、1mg/mL,在11000r/min下離心5min,離心后將樣品加入384孔板中,每個微孔中加入樣品40μL。使用PlateReaderⅢ型高通量動態光散射儀(美國懷雅特技術公司)對樣品擴散系數進行測定,25℃時在每秒產生約1×106次計數的激光功率下測量10s。每個樣品平行測定3次,并取平均值,根據公式(1),計算出樣品的擴散相互作用系數。
2結果與討論
2.1SEC分析樣品聚集與斷裂行為
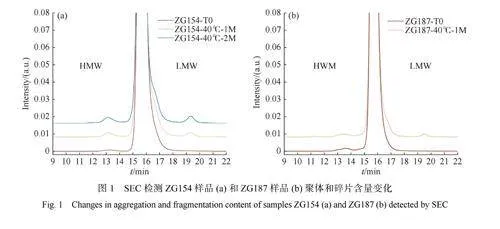
40℃時樣品聚體和碎片含量變化如圖1所示。由圖1(a)可得,ZG154樣品中高分子量物質(HMW)隨放置時間的延長明顯增加,由峰面積計算可得,ZG154樣品在初始時刻(ZG154-T0)、40℃放置一個月后(ZG154-40℃-1M)和40℃放置兩個月后(ZG154-40℃-2M)的聚體含量分別為0.4%(質量分數,下同)、1.1%和2.2%,低分子量物質(LMW)含量分別為0.1%、3.4%和5.2%。值得注意的是,ZG154樣品的聚集與斷裂行為在40℃放置下同時發生。由圖1(b)可得,在40℃放置一個月后ZG187樣品(ZG187-40℃-1M)的HMW含量變化可忽略不計(ZG187-T0樣品為1.3%,ZG187-40℃-1M樣品為1.4%)。然而,在相同的持續時間內,LMW含量卻從0.2%增加到2.1%,表明ZG187分子在40℃放置下只發生斷裂行為。上述結果發現了兩種mAbs對40℃環境的反應存在差異。因此,AUC-SV的后續分析對于更全面了解蛋白的聚集和斷裂行為至關重要。
2.2AUC-SV分析樣品的聚集與斷裂行為
相較于SEC,AUC-SV更有助于對樣品的原生狀態進行表征,測試結果如圖2所示。由圖可得,ZG154樣品在40℃放置時不僅聚體含量明顯增加,同時聚體沉降系數逐漸降低,特別是在40℃放置過程中二聚體沉降系數從9.969S下降到9.140S,最終達到8.675S(圖2(a)、(b)、(c)),這可能是由于ZG154分子的聚集行為發生了變化,形成聚體的結構不同導致的[26]。ZG187樣品在40℃下放置一個月后,ZG187樣品的聚體含量幾乎沒有變化,而ZG187-40℃-1M樣品的AUC-SV分析未檢測到任何片段(圖2(e))。將ZG187樣品在SEC流動相中測試,如圖2(f)和2(g)所示,發現ZG187樣品在SEC流動相中的沉降系數分布顯著變寬,同時ZG187-40℃-1M樣品中出現了相關碎片峰(圖2(g))。這一現象是由于SEC流動相的高鹽濃度會導致蛋白的構象發生變化[15],從而影響ZG187分子的沉降行為和碎片之間的非共價相互作用。此外,通過AUC-SV測量的ZG154和ZG187的聚體含量都超過了SEC法測定的結果,該現象是由于SEC分析中使用的流動相會在色譜過程中引起樣品稀釋而導致聚體的解離[18]。
2.3蛋白翻譯后修飾變化
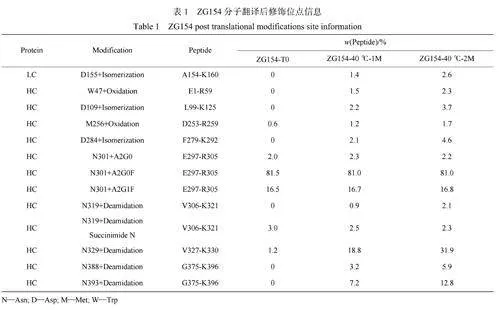
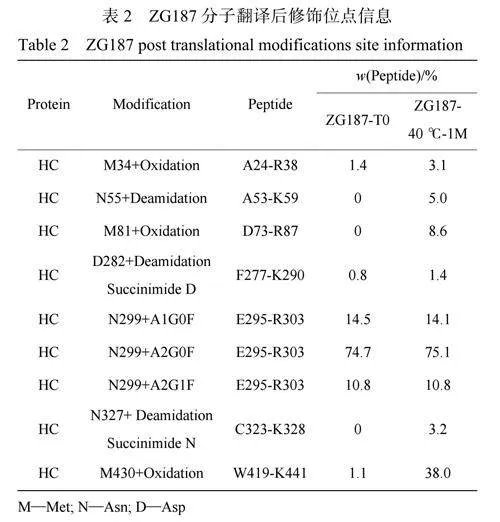
蛋白質的PTMs變化通常是導致其發生聚集和斷裂行為的重要因素,為了更深入地探究ZG154和ZG187抗體在40℃放置過程中表現出不同聚集和斷裂行為的原因,對其PTMs進行了分析。如表1所示,在40℃放置1個月后,ZG154分子重鏈(HeavyChain,HC)上Asn329位點發生脫酰胺修飾的比例僅增加了17.6%,發生相對較少的脫酰胺修飾可能不足以說明其對ZG154樣品聚集與斷裂行為的影響,因此對ZG154樣品進行了為期2個月的加速穩定性實驗。結果表明,在40℃放置2個月后,HC上Asn329位點發生脫酰胺修飾的比例增加了30.7%。此外,在40℃放置過程中HC上Asn388和Asn393位發生脫酰胺的比例也有所增加,輕鏈(Lightchain,LC)上天冬氨酸(Asp)155位點以及HC上Asp109和284位點也發生少量的異構化修飾。脫酰胺會引起蛋白質的疏水性變化,許多發生脫酰胺的抗體藥物更容易產生聚集行為[13,27]。同時ZG154分子的脫酰胺是在接近中性的條件下發生(樣品緩沖液pH值為6.8),該反應首先形成中間體琥珀酰亞胺,隨后迅速水解為Asp和異天冬氨酸(iso-Asp)[28],琥珀酰亞胺親水性低于Asn和Asp,從而容易引發蛋白質聚集。此外,琥珀酰亞胺的存在也會導致蛋白質斷裂[29]。然而對于ZG187樣品的PTMs變化(表2),在40℃放置一個月后,ZG187分子HC上Met430位點發生氧化修飾的比例增加了36.9%,Met430位點氧化修飾比例的大量增加足以滿足接下來探究其對ZG187樣品斷裂行為的影響。此外,HC上Met81位點也發生了少量氧化修飾。Met氧化通常會導致mAbs的構象穩定性發生變化,許多研究均表明Met氧化對mAbs聚集與斷裂有顯著影響,造成抗體分子間形成共價結合以及鄰近修飾位點的抗體斷裂,但其對不同mAbs的影響具有特異性[12,30]。
2.4不同修飾對蛋白二級與三級結構的影響
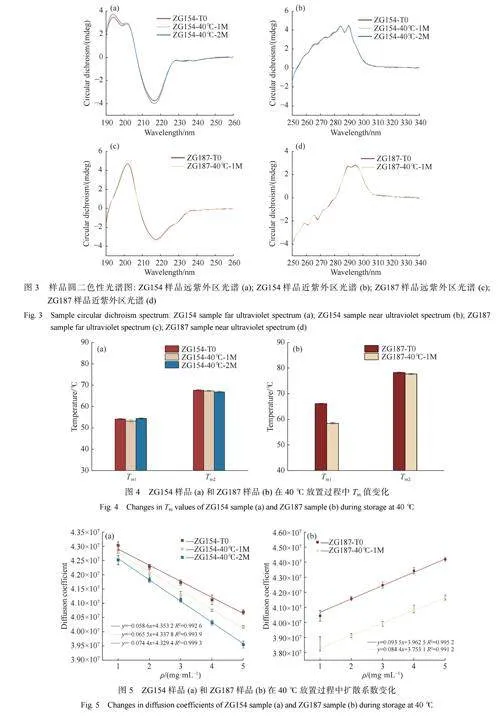
蛋白質的二級與三級結構的變化通常會導致蛋白質的疏水區域暴露,造成蛋白質聚集行為的發生。CD通過蛋白質對左右圓偏振光的吸收差來分析溶液中蛋白質的二級與三級結構。有研究表明,Asn脫酰胺的主要產物iso-Asp,可能導致蛋白質局部結構更靈活,從而暴露埋藏在蛋白質中的疏水殘基,致使蛋白質的三級結構發生輕微變化[27]。而氧化修飾通常會影響mAbs的CH2結構域的構象,從而改變mAbs的二級與三級結構,但其取決于蛋白質的糖基化狀態[31]。相較于因發生脫酰胺或氧化修飾導致二級與三級結構的變化的抗體藥物,在本研究中40℃條件下放置前后的ZG154和ZG187樣品的CD圖譜沒有發生明顯變化(圖3),說明ZG154分子Asn329位點的脫酰胺修飾和ZG187分子Met430位點發生的氧化修飾沒有導致分子二級和三級結構的變化。ZG154和ZG187分子的N-糖基化修飾在40℃放置過程中也基本沒有發生變化,其對蛋白質構象的穩定維持起著重要的作用,表明ZG154和ZG187分子在40℃放置中發生的聚集與斷裂行為不是由于蛋白二級和三級結構變化引起的。
2.5不同修飾對蛋白穩定性的影響
Tm是衡量蛋白質熱穩定性的一個重要指標,mAbs的不同結構域對應不同的Tm,一般Tm值越高,蛋白質穩定性越好。脫酰胺和氧化修飾可能通過破壞蛋白質折疊穩定性來加速蛋白質聚集和斷裂[14,27]。結果表明,在40℃放置后,ZG154分子的各個結構域Tm值基本沒有發生變化(圖4(a)),然而ZG187分子的Tm1卻顯著下降(ZG187-T0樣品Tm1為66.3℃,ZG187-40℃-1M樣品Tm1為58.6℃),Tm2未發生明顯變化。這些結果表明ZG154分子在40℃放置時發生的聚集和斷裂行為不取決于結構域穩定性的變化,進一步證明其斷裂行為的發生與琥珀酰亞胺的形成有關。相反,ZG187分子在Met430位點發生的氧化修飾會顯著降低ZG187分子單個結構域的穩定性,造成ZG187分子斷裂行為的發生。
2.6不同修飾對蛋白分子間相互作用的影響
kD是描述溶液中溶質分子之間相互作用力的一個度量,蛋白質的聚集行為通常是由于蛋白質分子間相互吸引的作用所引起的。如圖5所示,根據式(1)計算出ZG154-T0、ZG154-40℃-1M和ZG154-40℃-2M樣品的kD值分別為?1.34×10?2、?1.51×10?2mL/mg和?1.72×10?2mL/mg;ZG187-T0和ZG187-40℃-1M樣品的kD值分別為2.36×10?2mL/mg和2.25×10?2mL/mg。ZG154樣品的kD值為負,表明ZG154分子間存在相互吸引作用,其在40℃下放置發生的聚集行為與分子間相互吸引作用有關,同時Asn329位點的脫酰胺修飾通過化學殘基的變化來改變蛋白質疏水性,從而增加了蛋白分子間相互吸引作用,加速了ZG154分子的聚集,并且致使聚體結構變化,造成ZG154樣品在40℃放置過程中二聚體沉降系數變小。然而,ZG187分子的kD值為正值,并且在Met430位點發生氧化修飾后,ZG187分子的kD仍顯示出高度正值,說明在40℃放置過程中,ZG187分子間總是表現出相互排斥的作用,因此ZG187分子沒有發生聚集行為。
3結論
ZG154分子HC上Asn329位點發生脫酰胺修飾的比例增加了30.7%,脫酰胺修飾增加了ZG154分子間相互吸引作用,加速了分子聚集,并因琥珀酰亞胺的產生而導致斷裂的發生。而ZG187分子HC上Met430位點發生氧化修飾的比例增加了36.9%,氧化修飾導致ZG187分子單個結構域穩定性下降,使其發生了斷裂行為,但ZG187分子間始終呈現相互排斥作用,因而未發生聚集行為。該研究為ZG154和ZG187抗體的進一步分子優化設計和制劑篩選提供了理論依據。

