梭魚和青鳉魚ERα介導的雌激素活性比較研究
郝麗妮 ,趙硯彬 ,彭 輝 ,黃 崇 ,陳樹林 ,胡建英 * (.西北農林科技大學動物醫學院,陜西 楊凌700;.北京大學城市與環境學院,北京 0087)
環境雌激素類物質(EES)能夠模擬魚體內激素的作用模式,干擾魚類內分泌系統的正常功能,從而影響魚類的性腺分化,導致多種魚雌雄同體現象發生[1-3].EES的一種重要的作用模式是通過與雌激素受體(ER)結合,調控生長發育相關基因的表達[4].其中雌激素受體(ER)介導的化學物質如 17β-雌二醇(E2)、雌酮(E1)、雌三醇(E3)、17α-炔雌醇(EE2)等天然和人工合成的ER均能在實驗室暴露中誘導模式魚類如青鳉魚雌雄同體的發生[5-6].然而在野外調查中發現,許多魚類在低于實驗室暴露濃度的條件下就發生雌雄同體現象,其中可能的的原因有:(1)實際環境中的暴露是多物質多途徑的暴露過程;(2)實驗動物和野生魚類對污染物的敏感性不同[7].
關于 ER物種敏感性差異的問題,已有較多研究[7-13].Matthews等[8]研究發現雙酚A、t-辛基酚(OP)及o, p-DDT與虹鱒ERα的結合能力約比人和老鼠ERα受體高10倍,Hiroshi等[9]發現壬基酚(NP)、OP與鳉(Mummichog)的ERα結合活性是人的50倍.基于這些研究背景,最近 OECD正考慮將不同魚類 ERs的體外試驗方法列入內分泌干擾物質的環境管理和風險評價中[14].梭魚(So-iuy mullet,Mugil soiuy)是沿海地區一種重要的經濟魚類,對我國遼東灣野生梭魚的性腺切片觀察統計發現其雌雄同體的發生率高達54.5%,遠高于其他調查魚種[15].因此有必要建立梭魚ER物種特異性的體外測試方法,從ER物種敏感性差異的角度對遼東灣梭魚雌雄同體現象高發的成因進行解析.
酵母雙雜交技術是一套采用報告基因來檢測蛋白質間相互作用的技術[16].與哺乳動物細胞試驗相比,酵母細胞培養成本低,穩定性好,是OECD推薦使用的一種比較理想的高通量環境污染物初篩工程菌[14].因此本研究通過克隆梭魚 ERα(sERα),建立了 sERα活性物質物種特異性的酵母雙雜交篩選方法.并在此酵母系統中比較了4種環境中普遍存在的典型雌激素活性物質(E1,E2,E3和 EE2)對 sERα和青鳉魚ERα(mERα)誘導活性的差異, 以期從雌激素受體物種敏感性差異的角度探討梭魚雌雄同體發生率高的原因.
1 材料與方法
1.1 材料與試劑
實驗用梭魚為遼東灣野生梭魚;Y190酵母菌株、pGAD424-TIF2質粒、改造多克隆位點的pGBT9 質粒(EcoR I, Sac I, Bam I, Nde I, Hind Ⅲ,Cla I, Not I, Pst I)、青鳉魚 ERα-TIF2 酵母由日本Gifu Pharmaceutical大學 Tsuyoshi Nakanishi 教授惠贈;雌激素E1、E2、E3、EE2均購買于日本東京化成,測試前用二甲基亞砜(DMSO,ACS級,AMRESCO)配成100mmol/L儲備液備用.
1.2 梭魚ERα DEF片段的分子克隆
1.2.1 梭魚 ERα基因 cDNA部分片段的克隆快速分離梭魚肝臟組織,利用 Trizol法提取梭魚肝臟總 RNA.以所提總 RNA為模板,oligo(dT)15為逆轉錄引物,使用 MMLV(INVOTROGEN)反轉錄酶,反轉錄得到梭魚 cDNA.根據與梭魚在形態學分類上相近的其他魚種的己知ERα基因序列,在 ERα 基因 DBD(DNA-binding domain)區和LBD(Ligand-binding domain)區分別選擇氨基酸保守區設計簡并引物 sER1,sER1′及 sER2,sER2′(引物序列見表 1).以反轉錄的cDNA 為模板,使用 KOD PLUS高保真DNA聚合酶(TOYOBO),用 sER1,sER1′引物進行 PCR 擴增,反應條件為:94℃ 2min,然后94℃ 15s、53℃30s,68℃ 1min進行35個循環,反應體積為 50μL.以上述PCR產物為模板,sER2,sER2′為引物,再次進行 PCR擴增,反應條件同上,退火溫度變為58°C.用 1%瓊脂糖凝膠電泳鑒定擴增產物,切膠回收、純化約820bp的片段,測序.

表1 梭魚ERα基因擴增及測序引物Table 1 PCR and sequencing primers for cloning of So-iuy mullet sequences
1.2.2 梭魚ERα基因3′端cDNA擴增 在己測序的梭魚ERα基因序列中設計2個3′-RACE上游引物 sER3-1和sER3-2,下游引物記為SER3′由試劑盒提供(3′-Full RACE Core Set, Takara ).首先以加接頭的oligodT-3′為引物反轉錄梭魚總RNA,并以轉錄出的cDNA為模板,sER3-1,sER3′為引物進行第一輪PCR,接著以第一輪PCR的產物為模板,sER3-2、sER3′為引物,進行第二輪擴增,兩輪PCR反應的條件均為:94°C 2min,然后94°C 15 s,55°C 30 s,68°C 2min循環35次.1%瓊脂糖凝膠電泳鑒定擴增產物,切膠回收約840bp的片段,測序.
1.2.3 梭魚ERα基因DEF片段擴增 根據己測序的梭魚ERα基因的序列,設計引物sER4, sER4′及加接頭引物 sER5,sER5′.用兩對引物依次進行PCR擴增,反應條件為:94°C 2min,然后94°C 15 s,退火溫度(第一輪 53°C,第二輪 62°C) 30 s,68°C 1.5 min做35個循環,PCR純化試劑盒(碧云天生物試劑公司)純化第二輪擴增出的片段,得到約1100bp的梭魚ERα基因 DEF片段.用EcoR I和Cla I內切酶(NEB)在37°C下雙酶切5h后,純化得到帶黏性末端的梭魚ERα基因DEF片段.
1.2.4 PCR產物的鑒定及序列分析 需要測序的PCR產物經1%瓊脂糖凝膠電泳鑒定,純化后,連接到平端載體上(pEASY-Blunt Cloning Vector,全式金生物技術公司)并轉化 Trans1-T1感受態細胞, 用涂有X-GAL、IPTG的氨芐抗性平板篩選陽性克隆.選取 10個菌落,擴增接入片段時所對應用的引物,HSTMTaq DNA聚合酶(東盛生物)進行菌落PCR擴增(反應條件為:首先預變性 94°C 10min,然后94°C 30s, 55°C 30s,72°C 1min(擴增時間按 900~1000bp/min 算)循環45次,最后72°C延伸10min),進一步鑒定陽性克隆,并選3個克隆提取質粒測序.
1.3 pGBT9-sERα DEF和pGAD424-TIF2雙雜交酵母的構建
1.3.1 pGBT9-sERα DEF誘餌質粒的構建 首先,用EcoR I和Cla I內切酶雙酶切pGBT9 載體(37°C,反應 5h),酶切產物經 1%瓊脂糖凝膠電泳分離后,切膠回收(膠回收試劑盒, Promega公司)約5500bp的片段,并連接(T4 DNA連接酶,NEB )此回收產物與 sERα-DEF片段,載體片段比例約為0.03pmol:0.3pmol,25°C 反應 15min.最后用10μL連接產物轉化感受態大腸桿菌 DH5α,測序鑒定.
1.3.2 pGAD424-TIF2靶質粒的鑒定 用 1μL靶質粒 pGAD424-TIF2轉化感受態大腸 DH5α,篩選陽性克隆,并用P3、P3′引物測序鑒定.
1.3.3 雙質粒依次轉染酵母Y190細胞Y190酵母感受態細胞的制備及轉染方法參考 Clontech PT3024-1酵母操作手冊.首先用pGBT9-sERα質粒轉化 Y190酵母感受態細胞,取 200μL轉化溶液涂布于色氨酸缺陷(SD/-Trp)選擇平板上,于30°C培養2~3天待長出菌落后PCR鑒定轉化菌株[17].從平板上挑取1~8號克隆至SD/-Trp液體培養基中,于 30°C,250r/min 培養 16~18h 后,取1mL 菌液,以12000r/min離心1min棄上清,并在沉淀中加入20μL含2.5mg/mL溶菌酶的Z buffer溶液,震蕩混勻,37°C靜置反應 5min;取其中2μL做模板,以S5,S5′為引物,PCR 反應條件:預變性94°C 10min;然 后94°C 30s,55°C 30 s,72°C 1.5min做 50個循環,最后72℃延伸 10min.擴增得到長約1100bp片段的克隆,記為S1.
同上制備S1酵母感受態細胞,將pGAD424-TIF2質粒轉入S1細胞中,轉染液涂布于色氨酸、亮氨酸雙陷平板(以下簡稱為SD/-Trp-Leu)上,30°C 培養 2~3d 后,用 P2,P2′引物做 PCR 鑒定陽性克隆.
1.4 酵母雙雜交測試方法
具體操作按照文獻報道的方法進行[18]. EC50值用Graphpad Prism 4.0軟件計算.
2 結果與討論
2.1 梭魚ERα的分子克隆及鑒定
利用RT-PCR和RACE 技術,PCR擴增得到1113bp的基因片段,測序結果在 NCBI (http://www.ncbi.nlm.nih.gov/)上比對,證明所擴片段是梭魚的ERα基因片段(圖1).采用Krust等[19]的劃分方法,所擴梭魚ERα基因片段可劃分為DEF區.氨基酸序列同源比對結果表明,梭魚ERα的DEF區與鯔魚,青鳉魚,人的同源性分別為92%,79%,50%.其中E/F區與青鳉魚的同源性為82%(人為56%),D區與青鳉魚的同源性僅為72% (人為36%)(圖2),說明序列上的差異可能導致梭魚、青鳉魚和人ERα功能的差異.

圖1 梭魚ERα DEF區 cDNA序列與對應的氨基酸Fig.1 Nucleotide sequence of So-iuy mullet estrogen receptor DEF fragments and the deduced amino acid sequence
2.2 sERα-TIF2雙雜交酵母的構建及誘導活性測試
酵母雙雜交系統已廣泛應用于內分泌干擾物質的受體結合活性測試[14],目前在關于受體LBD區的劃分上仍然存在分歧,如將D區、E區和部分F 區劃入受體的LBD區[8],或者只將E區劃入LBD區[19].本研究中,首先僅將E/F區片段接入sERα-TIF2酵母系統,測試發現陽性對照物E2對此酵母并沒有誘導活性,而改將DEF區接入酵母后,用E2測試具有良好的劑量-效應關系.所以本實驗中所構建的sERα-TIF2酵母插入的是梭魚ER的DEF區,關且通過測試所購建的酵母可以用于環境樣品的篩選.
2.3 梭魚和青鳉魚ERα介導的雌激素活性比較研究
用E1、E2、E3、EE2分別暴露sERα-TIF2和青鳉魚-TIF2(mERα-TIF2)雙雜交酵母,測試 4種雌激素活性物質對兩種酵母β-半乳糖苷酶的誘導活性,劑量-效應關系如圖3所示.
sERα與4種物質結合的EC50分別為3.7,2.4,1.2,1699nmol/L(表2).其中EE2的相對雌激素活性(RBA)最高,為E2的2倍,E1和E3分別為E2的0.66,0.0014倍. mERα與4種物質結合的EC50分別為17,5.7,5858,4.0nmol/L(表2),與sERα相比這4種目標物質同mERα的結合活性相對較低,分別是梭魚EC50的4.6,2.3,3.4,3.3倍.這表明與青鳉魚相比,梭魚ERα與某些雌激素活性物質可能具有更高的結合活性,所以sERα敏感性是使梭魚在青鳉魚不能發生雌雄同體的野外暴露濃度下,雌雄同體高發生的可能原因之一.
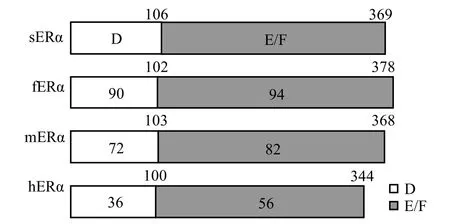
圖2 梭魚、鯔魚、青鳉魚、人ERα 基因 DEF區氨基酸序列同源比對分析Fig.2 Comparison of So-iuy mullet ERα DEF amino acid sequence with flathead mullet, medaka and human
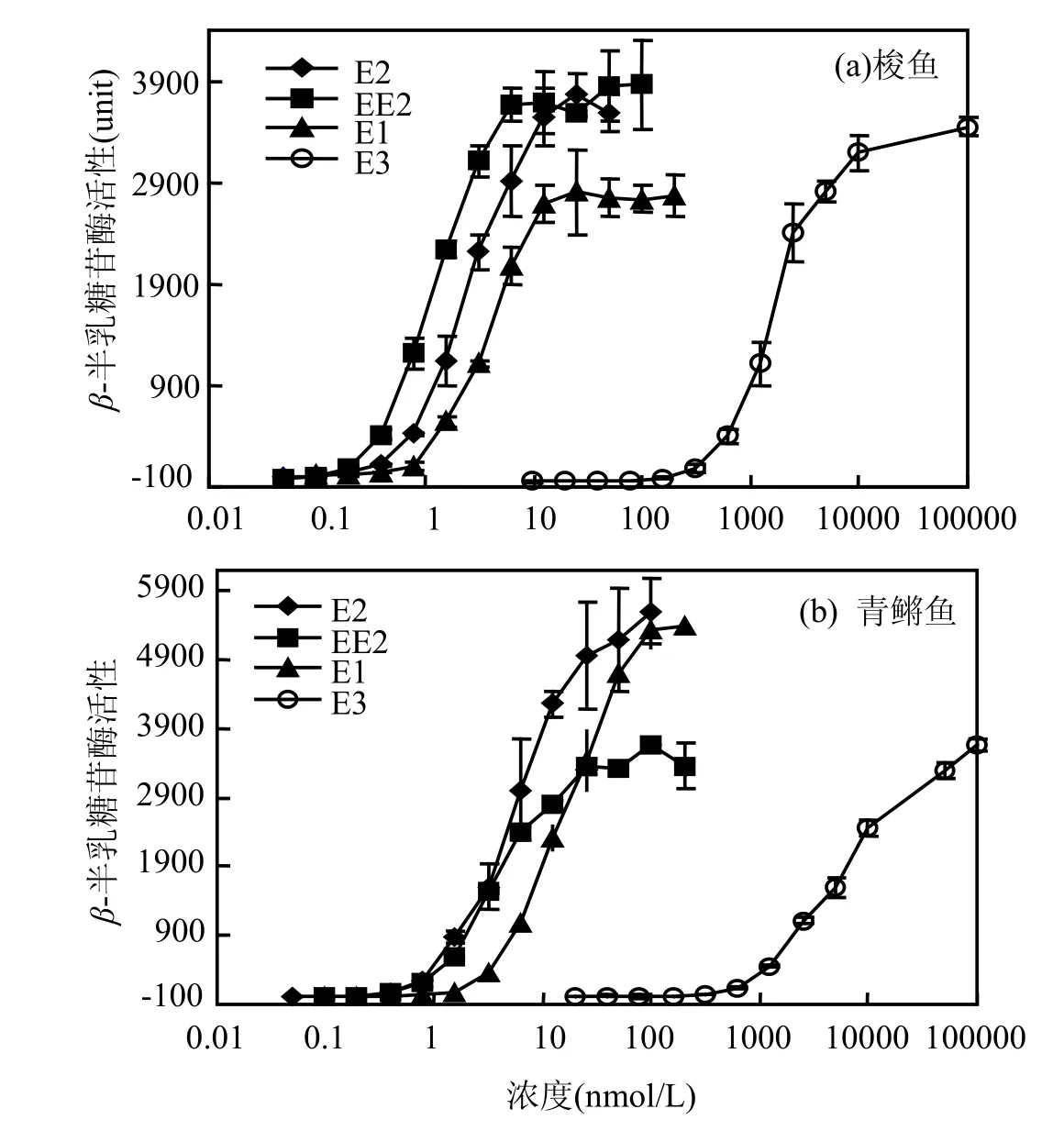
圖3 酵母系統中梭魚和青鳉魚ERα介導的雌激素活性比較(n=3)Fig.3 Comparison of ERα-mediated estrogenic binding activity between So-iuy mullet and medaka in yeast(n=3)

表2 4種雌激素的梭魚、青鳉魚ERα誘導活性的比較Table2 Comparison of estrogenic activities of four estrogens mediated by sERα and mERα in yeast two-hybrid system
為研究mERα與sERα結合活性的差異,本文在構建雙雜交酵母時使用的是人的TIF2共激活因子[18,20],此系統可以在一定程度上反映不同雌激素活性物質與mERα和sERα結合活性的差異.但生物體本身是一個復雜的系統,體內 ER的轉錄激活功能需要多種共激活因子的參與[18],所以為模擬魚類體內的真實環境,需要進一步采用魚類細胞報告基因測試方法、原代細胞培養甚至活體暴露等方法,最終證明 ER物種敏感性與梭魚雌雄同體高發率的關系.本酵母雙雜交體系中幾種典型雌激素物質與sERα和mERα結合活性差異性結果為深化該研究提供了基礎數據.
3 結語
通過構建梭魚ERα酵母雙雜交篩選系統,證明了E1、E2、E3、EE2和梭魚ERα的結合活性均高于青鳉魚ERα,這一結果為探索遼東灣野生梭魚雌雄同體高發生率的原因提供了重要的信息.
[1]Orn S, Holbech H, Madsen T H, et al. Gonad development and vitellogenin production in zebrafish (Danio rerio) exposed to ethinylestradiol and methyltestosterone [J]. Aquatic Toxicology,2003,65(4):397-411.
[2]Sumpter J P. Endocrine disrupters in the aquatic environment: An overview [J]. Acta Hydrochimica Et Hydrobiologica, 2005,33(1):9-16.
[3]Rempel M A, Schlenk D. Effects of environmental estrogens and antiandrogens on endocrine function, gene regulation, and health in fish [J]. International Review of Cell and Molecular Biology,2008, 267:207-252.
[4]伍吉云,萬祎,胡建英.環境中內分泌干擾物的作用機制 [J]. 環境與健康雜志, 2005,22(6):494-496.
[5]Kishi K, Kitagawa E, Iwahashi H, et al. Advanced Environmental Monitoring [M]. Springer Netherlands, 2008:363-375.
[6]Metcalfe C D, Metcalfe T L, Kiparissis Y, et al. Estrogenic potency of chemicals detected in sewage treatment plant effluents as determined by in vivo assays with Japanese medaka (Oryzias latipes) [J]. Environ Toxicol Chem, 2001, 20(2):297-308.
[7]Scholz S, Kluver N. Effects of Endocrine Disrupters on Sexual,Gonadal Development in Fish [J]. Sexual Development, 2009,3(2/3): 136-151.
[8]Matthews J, Celius T, Halgren R, et al. Differential estrogen receptor binding of estrogenic substances: a species comparison[J]. Journal of Steroid Biochemistry and Molecular Biology,2000,74(4):223-234.
[9]Urushitani H, Nakai M, Inanaga H, et al. Cloning and characterization of estrogen receptor alpha in mummichog,Fundulus heteroclitus [J]. Molecular and Cellular Endocrinology,2003,203(1/2): 41-50.
[10]Tollefsen K E, Mathisen R, Stenersen J. Estrogen mimics bind with similar affinity and specificity to the hepatic estrogen receptor in Atlantic salmon (Salmo salar) and rainbow trout(Oncorhynchus mykiss) [J]. Gen. Comp. Endocrinol., 2002, 126:14-22.
[11]Sumida K, Ooe N, Saito K, et al. Limited species differences in estrogen receptor alpha-mediated reporter gene transactivation by xenoestrogens [J]. Steroid Biochem. Mol. Biol., 2003,84:33-40.
[12]Nishizuka M, Heitaku S, Maekawa S, et al. Development of standardized in vitro assay system to estrogen receptors and species specificity of binding ability of 4-nonylphenol and p-octylphenol [J]. Health Sci., 2004,50:511-517.
[13]Denny J S, Tapper M A, Schmieder P K, et al. Comparison of relative binding affinities of endocrine active compounds to fathead minnow and rainbow trout estrogen receptors [J]. Environ.Toxicol. Chem., 2005,24:2948-2953.
[14]Draft detailed review paper on environmental endocrine disruptor screening: the use of receptor binding and transactive assays in fish [R]. OECD Environment, Health and Safety Publications,2010.
[15]安立會.鯽魚和梭魚卵黃蛋白原(Vitellogenin, Vtg)生物檢測方法建立與應用 [D]. 北京:中國科學院生態環境研究中心, 2006.
[16]Brückner A, Polge C, Lentze N, et al. Yeast two-hybrid, a powerful tool for systems biology [J]. International Journal of Molecular Sciences, 2010,10(6),2763-2788.
[17]Ling M F, Merante F, Robinson B H. A rapid and reliable DNA preparation method for screening a large number of yeast clones by polymerase chain reaction [J]. Nucleic Acids Research,1995,23(23):4924-4925.
[18]Nishikawa J, Saito K, Goto J, et al. New screening methods for chemicals with hormonal activities using interaction of nuclear hormone receptor with coactivator [J]. Toxicology and Applied Pharmacology, 1999,154:76-83.
[19]Krust A, Green S, Argos P, et al. The chicken oestrogen receptor sequence: homology with v-erbA and the human oestrogen and glucocorticoid receptors [J]. EMBO J, 1986,5(5):891-897.
[20]Voegel J J, Heine M J, Zechel C et al. TIF2, a 160 kDa transcriptional mediator for the ligand-dependent activation function AF-2 of nuclear receptors [J]. EMBO J, 1996,15(14):3667-3675.
致謝:感謝 Tsuyoshi Nakanishi 教授惠贈 Y190酵母菌珠,pGAD424-TIF2質粒和pGBT9質粒.

