三氟甲磺酸鋅催化下酰基疊氮化合物的合成*
孔黎春, 胡潔玲, 張龍峰
(浙江師范大學 化學與生命科學學院,浙江 金華 321004)
有機疊氮化合物很早就引起了人們的極大注意,原因在于它的合成和性質都有顯著特點:合成方法多而新穎,產率頗高,用途極其廣泛.一方面它可以用于合成多種雜環化合物[1]及其他化合物;另一方面,有些疊氮化合物本身就可作為重要的藥物,例如ATZ(3′-疊氮-3-脫氧胸苷)[2]等是目前抗艾滋病的優良藥物,全世界推廣使用,發展極為迅速.而酰基疊氮化合物是重要的有機疊氮化合物之一,是一種重要的有機合成中間體,可用于制備酰胺、合成雜環化合物,經Curtius重排形成異氰酸酯并由其合成胺、氨基甲酸酯和脲等,這些化合物的重要應用之一是作為肽鍵形成的活化劑[3].
三氟甲磺酸鋅作為一種高效的Lewis酸催化劑在近年來也有廣泛的應用.例如:在沙坦類藥物關鍵中間體2-(1-氫-四唑)-4′-甲基聯苯的合成過程中作為催化劑的使用,使反應溫度降低,反應時間大大縮短[4];在手性化合物(2R,6R)-2,6-二羥乙基吡啶合成過程中作為重要催化劑的使用[5];在其他一些旋光性化合物的合成中也有所應用[6].
2007年Katritzky等[7]報道了一種新的合成酰基疊氮化合物的方法,即用酰基苯并三唑、疊氮化鈉與溶劑的混合體系在室溫下攪拌一定的時間制取相應的酰基疊氮化合物.但該方法反應時間過長,反應不充分,需要用柱色譜分離提純產物,而酰基疊氮化合物在分離過程中極易分解.筆者嘗試加入Lewis酸——三氟甲磺酸鋅作催化劑以提高該反應的效率,使其更具有應用價值.
1 實驗部分
1.1 儀器與試劑
Electrothermal型數字熔點測定儀(溫度計未校正);NEXUS 670-FTIR型紅外光譜儀,KBr壓片或鹽窗; Bruker AV 400型核磁共振儀(CDCl3或D2O為溶劑,TMS為內標).
GF254薄層層析用硅膠(青島海洋化工有限公司);各種酰基苯并三唑自制;其他試劑均為分析純試劑.
1.2 酰基疊氮化合物的合成
反應流程見圖1.
1 2
圖1 酰基疊氮化合物的合成
以苯甲酰基疊氮(2a,見表1)的合成為例:
圓底燒瓶中加入苯甲酰基苯并三唑(1a)223 mg(1 mmol)和三氟甲磺酸鋅22 mg(0.06 mmol),用乙酸乙酯溶解后,放在磁力攪拌器上攪拌;另取疊氮化鈉195 mg(3 mmol),溶入2 mL水中,攪拌下逐滴加入苯甲酰基苯并三唑溶液中,之后攪拌一定時間至反應完全(用薄層色譜法跟蹤檢測).反應完全后減壓蒸除大部分溶劑,加入約30 mL無水乙醚萃取,依次用稀碳酸鈉溶液、飽和NaCl溶液洗,再用無水硫酸鈉干燥,在旋轉蒸發儀上減壓蒸除乙醚,即得到苯甲酰基疊氮(2a).
分別以1b-1j(見表1)代替1a,用類似的方法合成產物2b-2j.產物結構經紅外光譜(IR)、核磁共振氫譜(1H NMR)確定.
實驗原料1a-1j均以文獻[9-10]的方法制備.
2 結果與討論
實驗結果如表1所示.
產物2a-2j的IR和NMR數據如下:
2a IRν(KBr)/cm-1:3 041,2 927,2 135,1 697,1 600,1 241.1H NMRδ/ppm:8.04(2H,d,J=7.6 Hz),7.60~7.64(1H,m),7.44~7.48(2H,m).
2b IRν(KBr)/cm-1:3 008,2 925,2 856,2 134,1 693,1 609,1 255.1H NMRδ/ppm:7.91(2H,d,J=8.0 Hz),7.25(2H,d,J=8.0 Hz),2.42(3H,s).
2c IRν(KBr)/cm-1:2 924,2 848,2 138,1 681,1 600,1 250.1H NMRδ/ppm:7.99(2H,d,J=8.4 Hz),6.91(2H,d,J=8.4 Hz),3.86(3H,s).
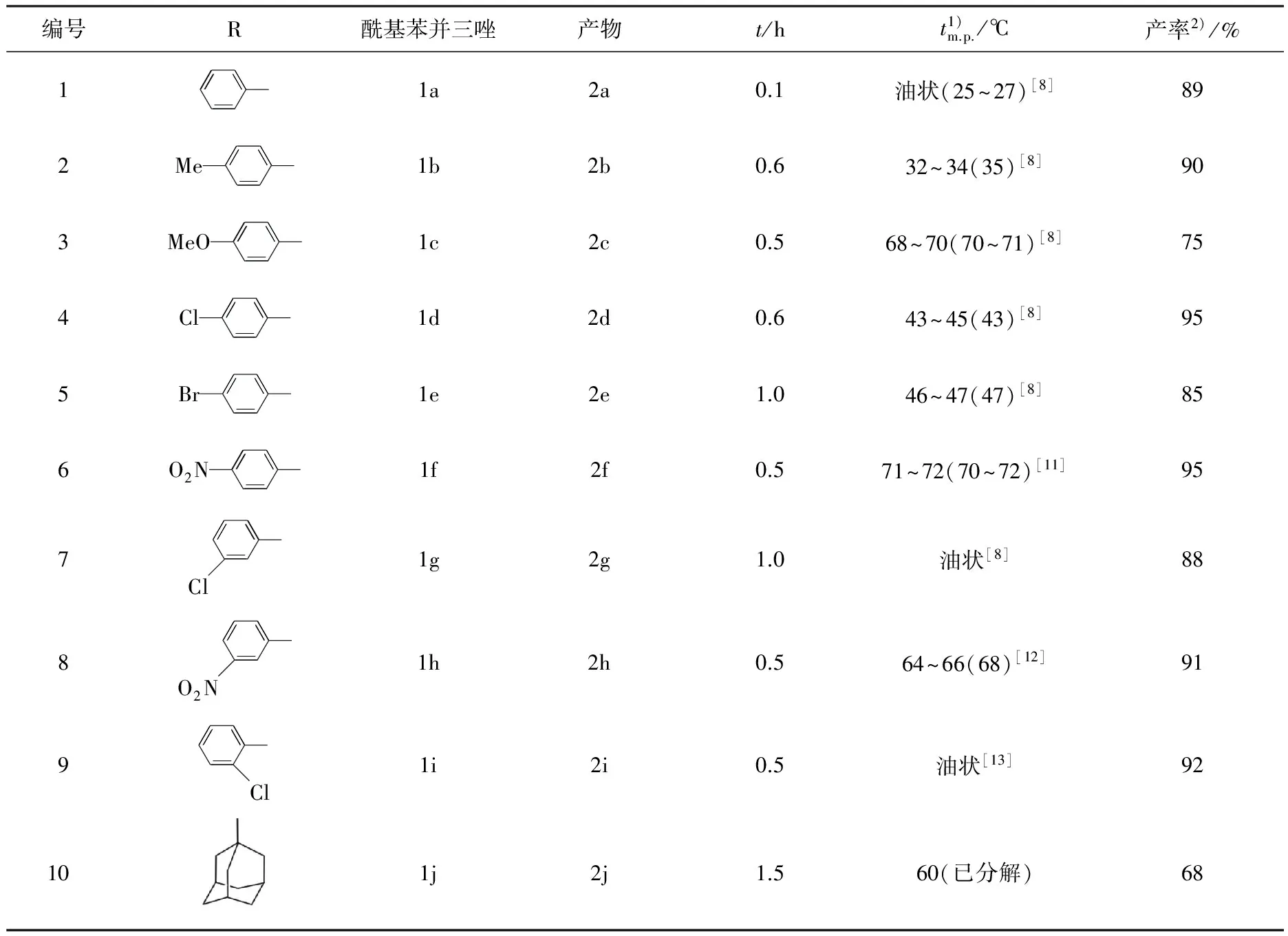
表1 酰基苯并三唑與疊氮化鈉反應合成酰基疊氮化合物
2d IRν(KBr)/cm-1:2 918,2 177,2 135,1 681,1 650,1 637,1 259.1H NMRδ/ppm:7.96(2H,d,J=8.8 Hz),7.44(2H,d,J=8.8 Hz).
2e IRν(KBr)/cm-1:3 028,2 136,1 681,1 636,1 610,1 250.1H NMRδ/ppm:7.92(2H,d,J=8.4 Hz),7.63(2H,d,J=8.4 Hz).
2f IRν(KBr)/cm-1:3 090,2 918,2 141,1 695,1 638,1 606,1 235.1H NMRδ/ppm:8.32(2H,d,J=8.8 Hz),8.20(2H,d,J=8.8 Hz).
2g IRν(KBr)/cm-1:3 025,2 854,2 140,1 697,1 636,1 586,1 238.1H NMRδ/ppm:8.01(1H,s),7.90~7.92(1H,m),7.57~7.58(1H,m),7.39~7.43(1H,m).
2h IRν(KBr)/cm-1:3 092,2 846,2 204,2 145,1 686,1 617,1 530,1 260.1H NMRδ/ppm:8.87(1H,s),8.47~8.49(1H,m),8.36~8.39(1H,m),7.67~7.72(1H,m).
2i IRν(KBr)/cm-1:3 092,2 846,2 204,2 145,1 686,1 617,1 530,1 260.1H NMRδ/ppm:8.87(1H,s),8.47~8.49(1H,m),8.36~8.39(1H,m),7.67~7.72(1H,m).
2j IRν(KBr)/cm-1:3 067,2 926,2 325,2 127,1 595,1 371.1H NMRδ/ppm:2.01~2.07(3H,m),1.83~1.86(6H,m),1.64~1.74(6H,m).13C NMR(100 MHz)δ/ppm:185.3,45.2,38.5,36.3,27.8.
2.1 反應介質對反應的影響
本實驗用二氯甲烷和水混合溶劑時,長時間的反應不利于產物的生成.而選用乙酸乙酯和水混合溶劑,不僅經濟易得,而且反應效果好.
2.2 反應溫度對反應的影響
該反應在室溫下進行即可.筆者也曾根據文獻[7]嘗試在5~10 ℃水浴條件下進行反應,發現這樣反應時間很長,但產率并沒有很大地提高.因此,室溫條件更加優越.
2.3 催化劑對反應的影響
實驗發現,三氟甲磺酸鋅對該反應的催化效果很好,它不僅大大地加快了反應速率、提高了反應產率,更使一些原來難以用此路線合成的酰基疊氮化合物也能很好地合成.例如:三氟甲磺酸鋅的加入,使原來制取苯甲酰疊氮需要16 h[7]縮短為5 min;其他一些酰基疊氮化合物的制取也分別由十幾小時縮短至1 h以內,而且反應更為完全;鄰氯苯甲酰基苯并三唑由于羰基與氯相鄰,空間位阻較大,難以通過不加催化劑的方法合成目標產物,而加了催化劑后就可以很好地得到相應的酰基疊氮化合物.以苯甲酰基疊氮 (2a)的合成為例比較三氟甲磺酸鋅的催化效果,實驗結果見表2.

表2 三氟甲磺酸鋅對合成酰基疊氮化合物的影響
筆者推測該反應速度加快的機理為:三氟甲磺酸鋅中的鋅離子與酰基苯并三唑的羰基氧的孤對電子絡合,使羰基碳上的電子云密度降低,因此疊氮負離子更容易進攻羰基碳,從而使反應速率大大加快.
3 結 論
以三氟甲磺酸鋅為催化劑,用酰基苯并三唑與疊氮化鈉反應,這種新方法實現了酰基疊氮化合物的制備.該方法具有原料易制備和保存、產率高、反應速度快、反應條件溫和及后處理簡單等特點.
[1]曾煥杰,李淑璉.疊氮化合物在雜環化合物合成中的應用[J].化學試劑,1994,16(1):27-34.
[2]沈治怡,高由松.簡介抗艾滋病藥物的研究[J].中國藥學雜志,1990,25(7):421-422.
[3]Klausner Y S,Bodansky M.The azide method in peptide synthesis[J].Synthesis,1974,153(8):549-559.
[4]常瑜,相會明,宋廣慧.2-(1-氫-四唑)-4′-甲基聯苯的合成[J].太原理工大學學報,2008,39(2):189-191.
[5]Panosyan F B,Chin J.Autocatalytic asymmetric reduction of 2,6-Diacetylpyridine[J].Org Lett,2003,5(21):3947-3949.
[6]Zucchero A J,Wilson J N,Bunz U H F.Cruciforms as functional fluorophores:Response to protons and selected metal ions[J].J Am Chem Soc,2006,128(36):11872-11881.
[7]Katritzky A R,Widyan K,Kirichenko K.Preparation of polyfunctional acyl azides[J].J Org Chem,2007,72(15):5802-5804.
[8]Chen Dajun,Chen Zhenchu.Hypervalent Iodine in Synthesis-Part 54-One-Step Conversion of Aryl Aldehydes to Aroyl Azides Us[J].Tetrahedron Lett,2000,41(38):7361-7363.
[9]Katritzky A R,Shobana N,Pernak J,et al.Sulfonyl derivatives of benzotriazole[J].Tetrahedron,1992,48(37):7817-7822.
[10]Katritzky A R,He Haiying,Suzuki K.N-acylbenzotriazoles:neutral acylating reagents for the preparation of primary,seconday,and tertiary amides[J].J Org Chem,2000,65(24):8210-8213.
[12]Yukawa Y,Tsuno Y.The Curtius Rearrangement.Ⅰ.The Decomposition ofm- andp-Substituted Benzazides in Toluene[J].J Am Chem Soc,1957,79(20):5530-5534.
[13]Subhas B D,Narsimha R A V.Dess-martin periodinane mediated efficient one-pot oxidation of aldehydes to acyl azides[J].Tetrahedron Lett,2003,44(17):3543-3545.

