海洋中海藻糖產生菌的篩選及發酵條件優化
趙玉巧,仲美榮,顧玲玲,類登昌
(淮海工學院海洋學院,江蘇連云港 222005)
海藻糖是由2個葡萄糖分子組成的1個非還原性雙糖[1],它有3種異構體,分別是α、α-海藻糖、α、β-海藻糖和β,β-海藻糖,天然存在的異構體是α,α型海藻糖[2],廣泛存在于各種生物體中,包括細菌、酵母、真菌和藻類以及一些昆蟲、無脊椎動物和植物中。它不僅是作為一種碳水化合物類的能源物質,還可防御如高溫、冷凍、脫水和高滲透壓等不利環境因素,該特性已被廣泛運用于食品、化妝品、醫藥等行業[3]。海藻糖的生產方法較多,有微生物抽提法、從發酵液中提取、酶轉化法和基因重組法[4],目前海藻糖的生產方法主要為從發酵液中提取和酶轉化法,由于海藻糖提取與純化步驟的復雜性,當海藻糖的含量小于原料干重的15%時不適合產業化規模生產[5]。本文研究從海洋中篩選出高產海藻糖菌株,并對菌株培養條件進行優化,以期降低海藻糖的生產成本,使菌株具有一定的工業應用價值。
1 材料與方法
1.1 材料
1.1.1 菌種 從連云港近海海域采集的新鮮海水、海泥及海洋魚貝類中分離篩選產生海藻糖的菌株,并進行編號。
1.1.2 培養基 ①液體富集培養基:葡萄糖20 g,蛋白胨10 g,酵母膏5 g,KH2PO45g,MgSO4·7H2O 2 g,鏈霉素30 mg,補煮沸過濾陳海水至1 000 mL,pH 6.3~6.5;②平板富集培養基:蔗糖15 g,葡萄糖5 g,蛋白胨10 g,酵母膏5 g,KH2PO45 g,MgSO4·7H2O 2 g,鏈霉素30 mg,瓊脂20 g,補煮沸過濾陳海水至1 000 mL,pH 6.3~6.5;③PDA培養基:馬鈴薯200 g,蔗糖20 g,瓊脂20 g,補煮沸過濾陳海水至1 000 mL,pH自然;④發酵培養基:蔗糖31 g,酵母膏9.9 g,蛋白胨9.9 g,NH4Cl 2.2 g,KH2PO40.4 g,Na2HPO40.4 g,MgSO40.2 g,CaCl20.2 g,FeCl30.2 g,補煮沸過濾陳海水至1 000 mL,pH 5.5。
1.2 方法
1.2.1 酵母菌株的分離及產海藻糖菌株的初篩
海水樣品在5 000 r/min離心15 min得海水沉淀物(海泥取適量,海洋魚貝類取內臟),接種到液體富集培養基中培養,培養條件為30℃,160 r/min 72 h。液體富集培養菌懸液在平板富集培養基上劃線分離單菌落,培養條件為30℃48 h。將分離得到的單菌落接種到發酵培養基中,于搖床中160 r/min,30℃培養60 h,用紙層析法確定產海藻糖酵母100余株,編號后保存在PDA斜面培養基上。
1.2.2 產海藻糖菌株的復篩 將斜面保存的菌種分別接種到發酵培養基的三角瓶中,在30℃,160 r/min的搖床中培養24 h作為種子,在裝有發酵培養基的三角瓶中按5%的接種量接入種子,在30℃,160 r/min的條件下,搖瓶培養60 h,取發酵液離心收集菌體測干重并測定海藻糖含量。
1.2.3 海藻糖產生菌2-14的形態特征及生理生化特征 對菌株進行假菌絲、子囊孢子、擲孢子、糖發酵、碳源同化、氮源同化、DBB、尿酶等實驗[6-7]。
1.2.4 細胞生長量的測定 采用細胞干重法。
1.2.5 海藻糖的測定方法 ①紙層析法:展開劑為正丁醇:丙酮:水:醋酸=l0:3:6:2(體積比),顯色劑A液:AgNO3的水-丙酮飽和溶液,水:丙酮=1:200(體積比);B液:將l gNaOH溶于100 g乙醇水溶液中,乙醇:水=1:1(質量比)[8];②硫酸-蒽酮法:見參考文獻[9]。
1.2.6 發酵條件對海藻糖產生的影響 ①初始pH對紅酵母產海藻糖的影響:分別選擇初始pH 3.0、4.0、4.5、5.0、5.5、6.0、7.0,其他發酵條件為:溫度28℃,裝液量為250 mL三角瓶裝50 mL培養基,發酵時間60 h;②發酵溫度對紅酵母產海藻糖的影響:發酵溫度選擇22、25、28、30、37℃,初始pH 5.5,裝液量為250 mL三角瓶裝50 mL培養基,發酵時間60 h;③裝液量對紅酵母產海藻糖的影響:在250 mL三角瓶中裝液量分別為25、50、75、100、125 mL,發酵溫度28℃,初始pH5.5,發酵時間60 h;④菌體生長及海藻糖產生曲線:在5 L小型發酵罐中裝3.5 L發酵培養基,恒28℃;pH 5.5左右,發酵時間60 h。
2 結果與討論
2.1 產海藻糖酵母的篩選結果
對180余份海水及海泥等樣品的初篩得到100余株產海藻糖菌株,對其中60余株海藻糖產量較高的菌株進行復篩,其中10株產量高的菌株復篩結果見圖1。
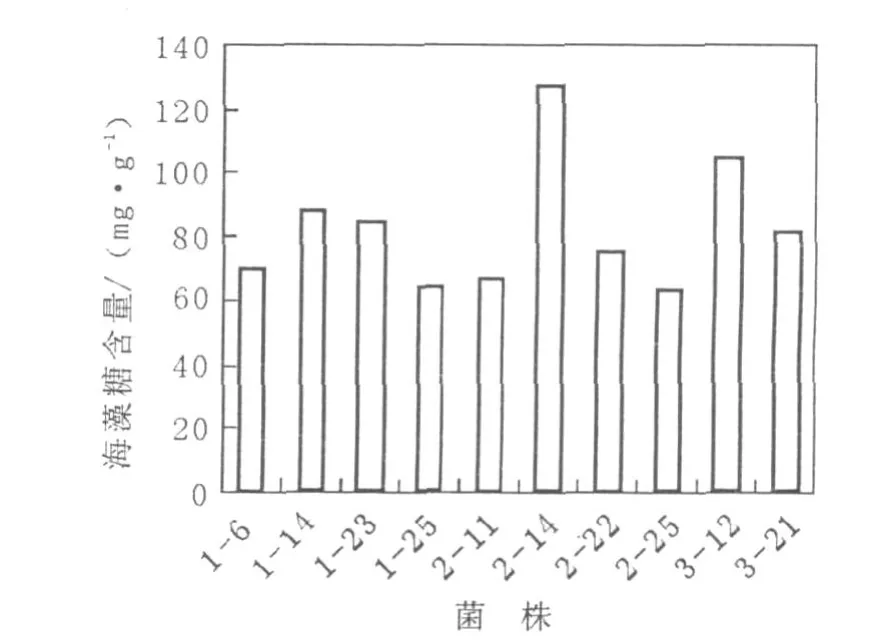
圖1 10株產海藻糖菌株搖瓶復篩結果Fig.1 The results of trehalose production from 10 strain
由圖1可見,編號為2-14的菌株海藻糖含量最高,為127.9 mg/g cell,其次菌株3-12海藻糖含量為105.1 mg/g cell,這2株菌均有一定的應用價值。
2.2 菌株2-14的鑒定
2.2.1 形態特征 由圖2可見,菌株2-14細胞呈圓形或橢圓形,其大小約為5.1~7.2μm,繁殖方式為芽殖,無假菌絲、子囊孢子及擲孢子形成。發酵液清,表面無醭、無環、無氣泡、無沉淀。菌落飽滿潮濕,顏色為紅色,邊緣整齊,無褶皺。
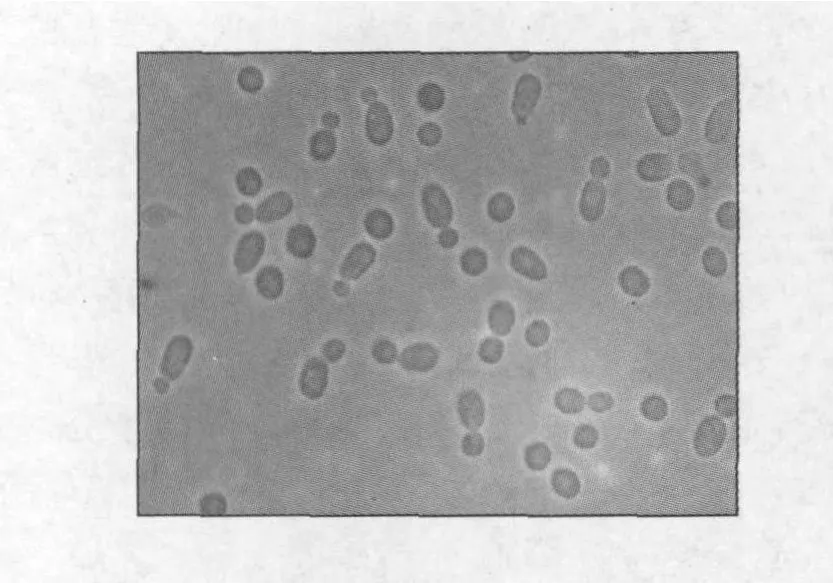
圖2 菌株2-14的細胞形態Fig.2 The morphological character of strain 2-14
2.2.2 糖發酵試驗 菌株2-14對乳糖、半乳糖、可溶性淀粉、L-山梨糖、D-木糖、D-果糖、L-鼠李糖、麥芽糖、海藻糖、甘露醇、核糖、葡萄糖、蔗糖、琥珀酸、檸檬酸均不發酵。
2.2.3 碳源同化試驗 由于菌株2-14對糖、醇及酸均不發酵,選擇14種碳源進行同化試驗,結果見表1。由表1可見,該菌株不同化淀粉、乳糖、山梨糖及琥珀酸。
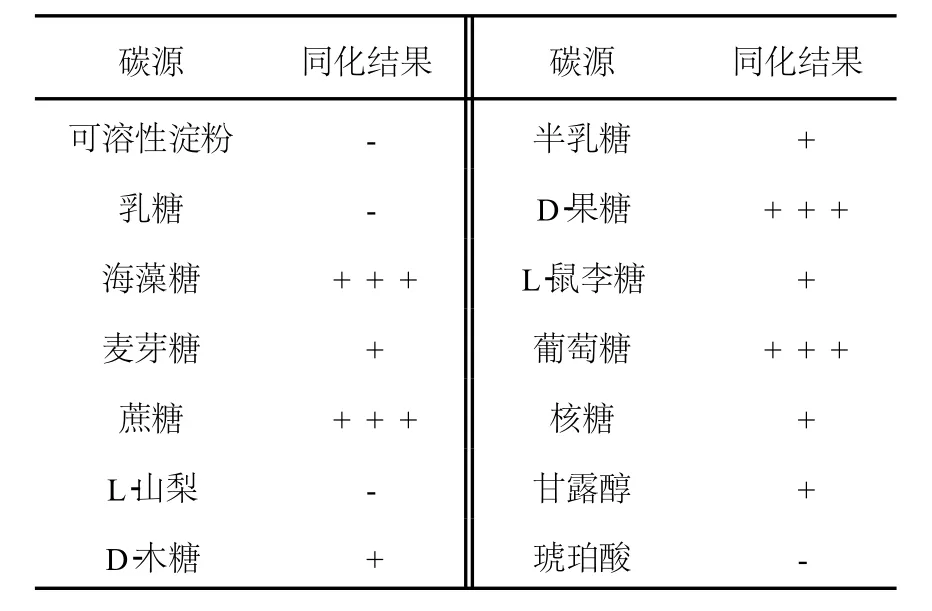
表1 菌株2-14碳源同化試驗結果Table 1 The results of strain 2-14 on differents carbon sources
2.2.4 氮源同化試驗結果 由表2可見,菌株2-14對所選擇的5種氮源均同化。
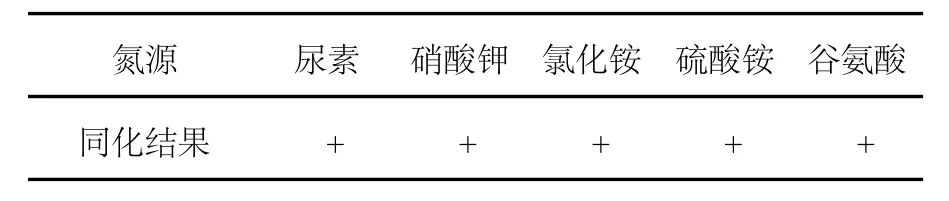
表2 菌株2-14氮源同化試驗結果Table 2 The results of strain 2-14 on differents nitrogen sources
2.2.5 其他生理生化試驗 菌株2-14不液化明膠,脲酶陽性,葡萄糖氧化陰性,DBB陽性,類淀粉化合物形成結果為陰性,石蕊牛奶試驗產堿,在37℃條件下能正常生長。根據菌株2-14的形態特征、培養特征及生理生化特征,該菌株與《酵母的特征與鑒定手冊》中紅酵母屬(Rhodotorula)的分類特征最相符,所以初步鑒定菌株2-14為紅酵母屬。
2.3 初始pH對紅酵母產海藻糖的影響
由圖3可見,隨著初始pH的增大,紅酵母細胞中海藻糖產量快速增加,至初始pH 5.5時達到最高,當初始pH大于5.5時紅酵母細胞中海藻糖產量則快速降低,紅酵母細胞干重受初始pH的影響結果與產海藻糖的結果一致。上述結果說明該紅酵母生長及海藻糖的積累均對初始pH敏感,在發酵過程中,應該嚴格控制初始pH以及發酵過程pH。
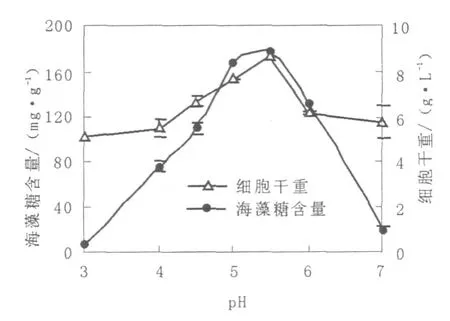
圖3 pH對紅酵母海藻糖產量的影響Fig.3 Effect of pH on trehalose production
2.4 發酵溫度對紅酵母產海藻糖的影響
由圖4可以看出,隨著溫度的升高紅酵母細胞干重及海藻糖產量均較快增加,均在28℃達到最高,當發酵溫度為37℃時紅酵母細胞的生長量仍較大,但該溫度下細胞中海藻糖產量下降較多。
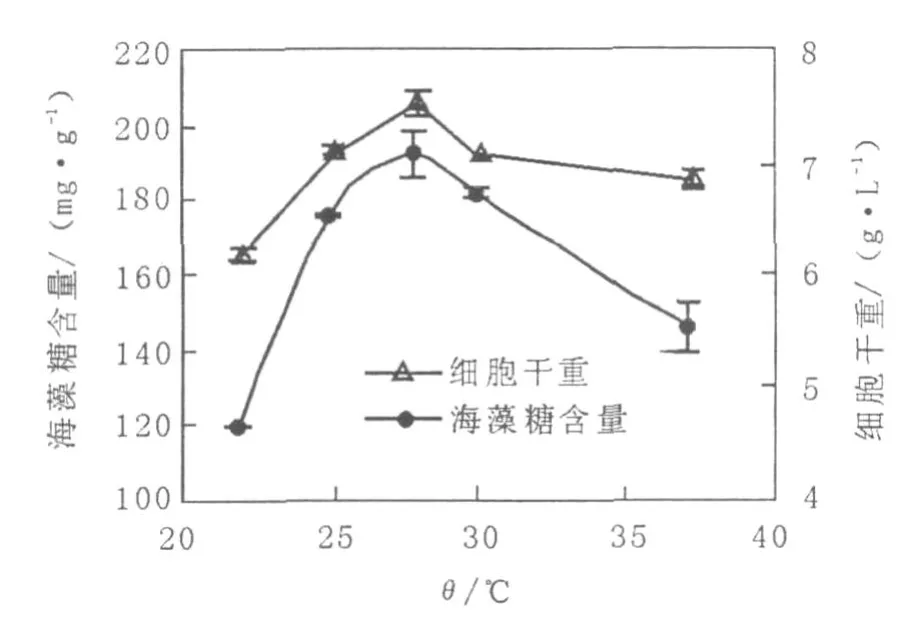
圖4 溫度對紅酵母海藻糖產量的影響Fig.4 Effect of tempersture on trehalose production
2.5 裝液量對紅酵母產海藻糖的影響
由圖5可以看出,雖然紅酵母細胞干重及海藻糖產量的最高點均為裝液量75 mL(250 mL三角瓶中),但裝液量對該酵母生長的影響不太大,對海藻糖的產生影響卻較明顯。采用優化前發酵條件紅酵母海藻糖產量為132.1 mg/g cell,由圖5可知,裝液量75 mL時紅酵母海藻糖產量為193.3 mg/g cell,優化后的結果是優化前的1.46倍。
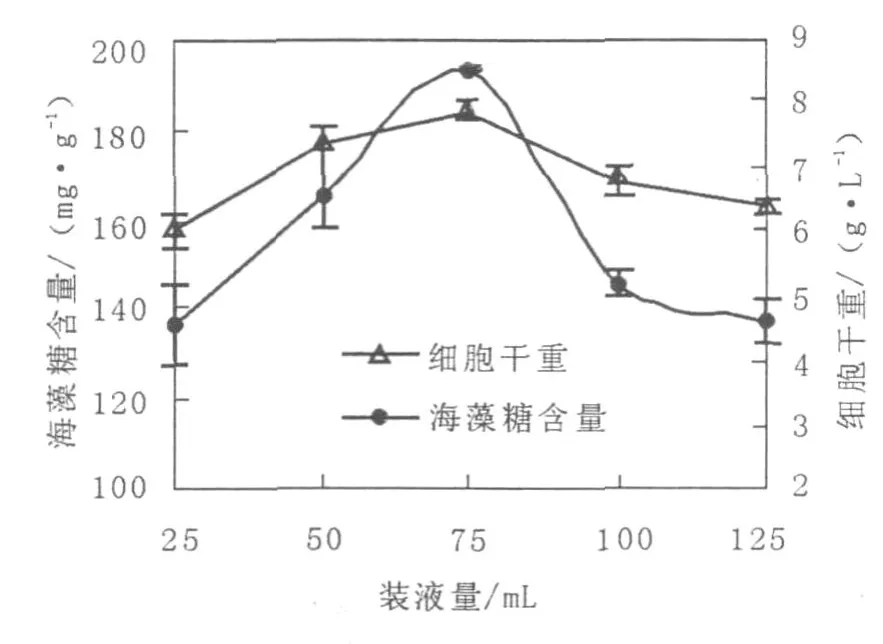
圖5 裝液量對紅酵母海藻糖產量的影響Fig.5 Effect ofmedium on trehalose production
2.6 菌體生長及海藻糖產生曲線
紅酵母在5 L發酵罐中發酵,結果見圖6。由圖6可見,發酵時間20 h前培養基中蔗糖濃度快速降低,隨著蔗糖濃度的降低,細胞增殖較快并在20 h接近穩定期,細胞中海藻糖在20 h前有一定量的積累但不多。發酵時間20 h后,隨著培養基中蔗糖的耗竭,細胞中海藻糖產量逐漸提高,至54 h達到最高,為190.3 mg/g cell,54 h后細胞中海藻糖產量快速下降,原因是培養基中蔗糖及其他成分的嚴重缺乏,使得細胞中的海藻糖水解酶開始水解海藻糖以維持細胞的活力。54 h時發酵液中海藻糖含量為2.50 g/L,由圖5可知pH 5.5時搖瓶發酵液中海藻糖含量為1.52 g/L,發酵罐培養每升發酵液中海藻糖含量為搖瓶培養的1.6倍,確定54 h為最佳發酵時間。
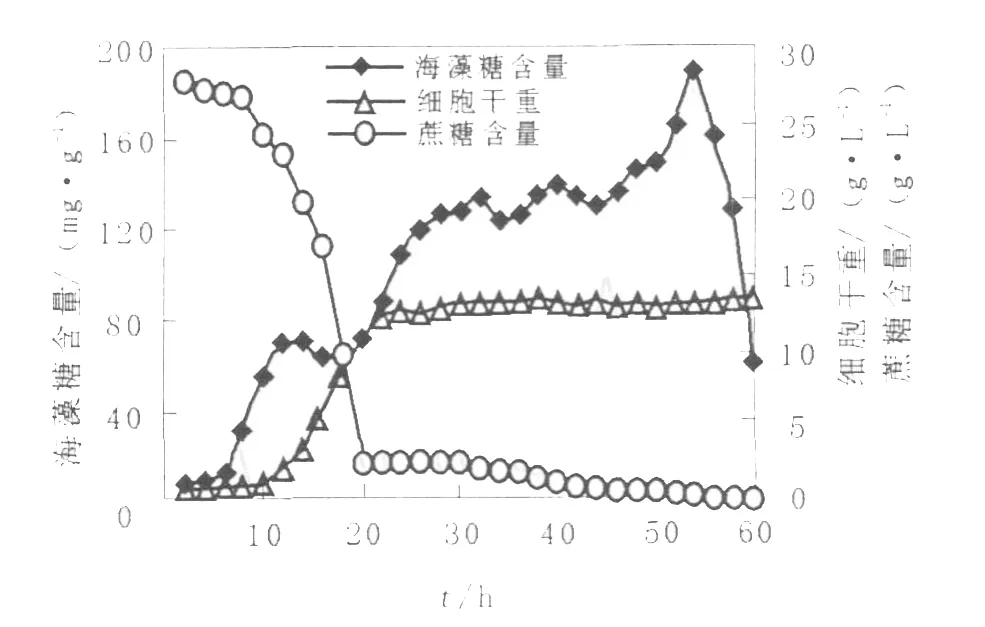
圖6 紅藻酵母生長和海藻糖積累曲線Fig.6 Progress curves of cell growth and trehalose production
3 討 論
由于大多數酵母在適當的條件下可產生海藻糖,故在篩選培養基中加入了鏈霉素,篩選出的菌株大多數為酵母,從其中產量較高的10株菌的海藻糖含量可以發現,從海洋中篩選產量較高的海藻糖產生菌比較容易。
根據菌株2-14的形態特征、培養特征及生理生化特征,依據《酵母的特征與鑒定手冊》中有關酵母菌的分類特征,菌株2-14與紅酵母屬最相符,初步鑒定菌株2-14為紅酵母屬(Rhodotorula)。本實驗采用傳統的菌種分類鑒定方法,該方法工作量大,過程繁瑣,盡管部分試驗多次重復但還是不能排除個別試驗結果的誤差。
對紅酵母搖瓶發酵條件試驗發現,該酵母生長及海藻糖的積累均對初始pH敏感,原因可能是該紅酵母中海藻糖合成酶的最適pH范圍小,在pH 5.5附近。紅酵母發酵溫度高于28℃對細胞生長影響不大,但對紅酵母產生海藻糖有較大的影響,可能與海藻糖對細胞的保護及海藻糖合成酶的最適溫度有關。紅酵母生長及積累海藻糖的最佳裝液量均為75 mL(250 mL三角瓶中),說明該酵母對氧的需要量適中,這與大多數酵母對氧需要量相似。在5 L發酵罐中發酵的結果表明,該酵母在進入穩定生長期后海藻糖開始快速積累,特別是當蔗糖耗竭時海藻糖增長更快,說明該酵母碳源缺乏后可刺激海藻糖的產生。在發酵罐中培養雖然細胞中海藻糖含量沒有提高,但細胞干重提高較多,達到13 g/L,而在搖瓶中細胞干重最高僅為8.6 g/L,可見在發酵罐中培養效果優于搖瓶培養。
[1] Tarek El-Bashiti,Haluk Hamamci,Huseyin A.oktem,et al.Biochemical analysis of thehalose and its metabolizing enzymes in wheat under abiotic stress conditions[J].Plant Science,2005,169:47-54.
[2] Attilio Cesaro,Ornela De Giacomo,Fabiana Sussich.Water interplay in trehalose polymorphism[J].Food Chemistry,2008,106:1318-1328.
[3] Youn Jeung Cho,Oh Jin Park,Hyun Jae Shin. Immobilization of thermostable trehalose synthase for the production of trehalose[J].Enzyme andMicrobial Technology,2006,39:108-113.
[4] 趙曉峰,吳榮書.海藻糖的功能特性及其應用[J〗.廣州食品工業科技,2004,20(2):151-154.
[5] Chiara Schiraldi,Isabella Di Lernia and Mario De Rosa.Trehalose Production:exploiting novel approaches[J].TRENDS in Biotechnology,2002,20(10):420-425.
[6] 東秀珠,蔡妙英.常見細菌系統鑒定手冊[M].北京:科學出版社,2001:364-387.
[7] J.A.巴尼特著,亞羅,胡瑞卿譯.酵母菌的特征與鑒定手冊[M].青島:青島海洋大學出版社,1991:17-164.
[8] 王蘭,肖冬光.紙層析分離洗脫法定量測定海藻糖[J].生物技術,2002,12(3):27-29.
[9] 譚海剛,梅英杰,關鳳梅,等.蒽酮-硫酸法測定酵母中海藻糖的含量[J].現代食品科技,2005,22(1):125-128.

