參麥注射液對腦出血大鼠腦組織 HSP70表達的影響及其神經保護作用機制的實驗研究
黃仁發,康 雷,何澤云,滕久祥
(1.廣西中醫學院附屬瑞康醫院,廣西南寧 530011;2.湖南中醫藥大學第一附屬醫院,湖南長沙 410007;3.北京中醫藥大學東直門醫院,北京 100700)
腦出血(intracerebral hemorrhage,ICH)是神經內科常見的危重急癥,具有高發病率、高致死率和高致殘率的特點。如何保護腦血腫周圍神經細胞免于凋亡是降低腦出血高致殘率的重要手段。既往我們體內外的研究表明,參麥注射液通過抑制血腫周圍腦組織缺氧誘導因子-1α的表達及抗細胞凋亡等機制發揮神經保護作用[1、2]。本研究進一步探討腦出血血腫周圍腦組織熱休克蛋白 70(heatshock protein 70,HSP70)的表達以及參麥注射液對其的影響,為參麥注射液應用于腦出血的治療提供理論依據。
1 材料與方法
1.1 材料
1.1.1 動物 清潔級 SD大鼠 50只,雌雄各半,體重 200g±20g,購自湖南中醫藥大學實驗動物中心。
1.1.2 藥物 參麥注射液(SM,20mg/支)正大青春寶藥業有限公司生產,批號 0307136。
1.1.3 儀器和試劑 SN-3腦立體定位儀、微量注射器、AO-8205型輪轉切片機、LHB11800型組織修整機、OPTON多功能光學顯微鏡、H-600透射電子顯微鏡(日本)、Ⅶ型膠原酶(sigma公司)、兔抗鼠 HSP70多克隆抗體(武漢博士德生物公司)、羊抗兔二體、SP試劑檢測盒(sigma公司)、DAB顯色試劑盒(武漢博士德公司)。
1.2 方法
1.2.1 動物造模 按 Rosenberg[3]法造大鼠腦出血模型:大鼠腹腔注射 10%水合氯醛(400mg/kg)麻醉后,俯臥位固定于立體定位儀上,局部剪毛,75%酒精皮膚消毒,頭皮正中切口,暴露顱骨。使用《大鼠腦立體定位圖譜》進行蒼白球定位:前囟后1.4mm,中線右側旁開 3.2mm,深 5.6mm。手術刀鉆孔,用固定于立體定位儀上的微量注射器器緩慢抽取含 0.4UⅦ型膠原酶的滅菌生理鹽水(0.2u/μl)2μl,校準后垂直進針 5.6mm,緩慢注射,留針5min后拔出針頭,縫合皮膚,放回籠中飼養。假手術組以此方法注入等量滅菌生理鹽水。
1.2.2 分組與及給藥方法 按完全隨機方法將 50只大鼠分為 4組:正常組 5只,普通飼養,自動飲水,不做任何處理;模型組 20只,組內隨機分成腦出血后 1d、3d、5d、7d共 4個時間點,術前 24h以2m l生理鹽水腹腔注射,術后仍用生理鹽水注射(每天 1次),直至處死為止;參麥組 20只,動物分配及用藥方法均同模型組,參麥注射液 2m l腹腔注射。假手術組 5只,普通飼養,動物分配及用藥方法均同模型組,術前 24 h以 2ml生理鹽水腹腔注射,術后仍用生理鹽水 2m l注射,每天 1次,直至第 3天處死為止。
1.2.3 評估 造模大鼠清醒后即觀察神經系統病態,后按時間點觀察爬桿記分。神經系統病態包括軀體傾斜,立行欲倒,旋轉爬行,活動遲緩,易激惹。爬桿長 2m,寬 2.4cm,厚 4.4 cm,一端抬高 45°,術前 3d訓練大鼠由低向高爬行。計分方法為:將木條等分為 4段,每段計 6分,4段總分相加共 24分,不能爬計 6分,患肢拖行計 5分,跌下或滑倒 >3次計 4分,跌下或滑倒 <2次計 3分,四肢軟弱無力計2分,四肢支撐變寬計 1分。其中 24分為大鼠爬行記分的最高分,分數越高,表示肢體功能越差。
1.2.4 肉眼觀察 將實驗大鼠以 10%水合氯醛腹腔注射麻醉后,放血處死大鼠,迅速開顱取腦組織,生理鹽水輕輕洗凈血污后,觀察鼠血腫吸收情況。
1.2.5 組織形態學電鏡觀察 按上述方法取出大鼠出血側腦組織。1%鋨酸固定,0.1M PBS漂洗,梯度丙酮脫水,Epon-812包埋,在 LHB11800型組織修整機上切片,醋酸鈾-醋酸鉛雙重染色,H-600型透射電子顯微鏡觀察、攝像。
1.2.6 免疫組化檢測血腫周圍區 HIF1-α的表達 將空白切片常規脫蠟和水化,按試劑盒提供的使用方法檢測 HSP70的表達。左側非出血側大腦半球作為對照。HSP70表達陽性的細胞在光鏡下細胞漿呈棕黃色顆粒。陽性細胞計數:在 40倍光學顯微鏡下,觀察每張切片出血中心區、出血周圍區、出血側海馬區和皮質部位的每個網格(光學顯攝鏡 40倍下為 125μm×125μm)的 HSP70陽性細胞數。每個部位各觀察 5個視野,計數各視野內的 HSP70陽性細胞,取其均值作為出血中心區、出血周圍區、海馬和皮質部位的陽性細胞數。
2 結果
2.1 術后大鼠神經系統病理體征
表1顯示,大鼠術后平均 45min麻醉清醒,假手術組大鼠清醒后未見明顯神經系統病態。模型組和參麥組大鼠清醒后均出現活動遲緩、易激惹、站立不穩,病灶對側肢體無力、步伐增寬,爬行時軀體偏向病灶對側,2組大鼠術后神經系統病態差異無統計學意義(P>0.05)。

表1 大鼠術后神經系統病態
2.2 大鼠爬桿計分結果
表2顯示,正常組和假手術組均未見明顯缺陷。模型組和參麥組均在第 1天計分最高,隨著時間的延長,計分逐漸下降,但參麥組大鼠 1d、3d、5d計分明顯低于模型組相應時間點,差異有統計學意義(P<0.01)。
表2 術后大鼠爬桿計分
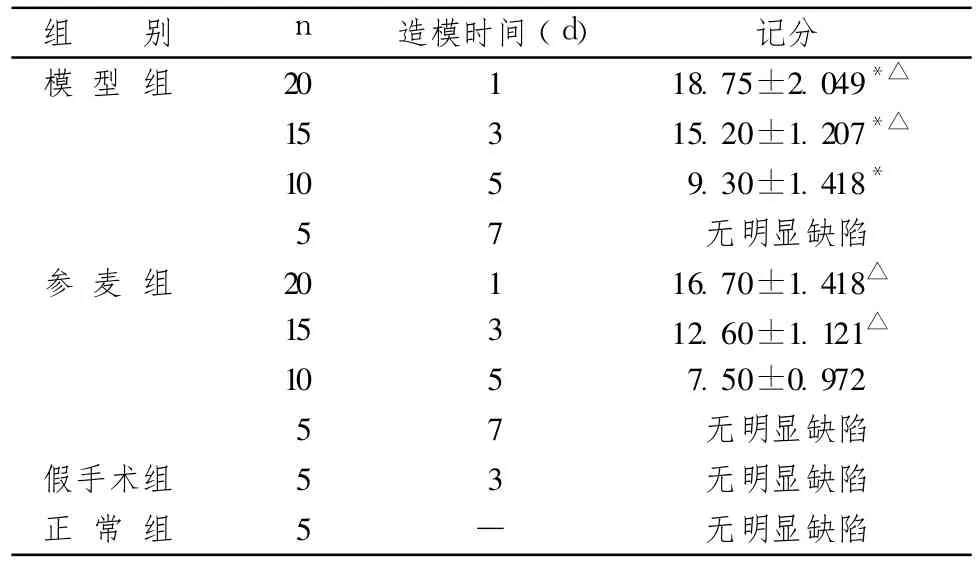
表2 術后大鼠爬桿計分
注:模型組、參麥組大鼠術后 1d、3d、5d時爬桿計分比較:*P<0.01;模型組、參麥組組內各時間點爬桿計分比較:P<0.01
組 別 n 造模時間(d) 記分模 型 組 20 1 18.75±2.049*15 3 15.20±1.207*10 5 9.30±1.418*5 7無明顯缺陷參 麥 組 20 1 16.70±1.41815 3 12.60±1.12110 5 7.50±0.972 5 7無明顯缺陷假手術組 5 3 無明顯缺陷正 常 組 5 — 無明顯缺陷
2.3 肉眼觀察
模型組和參麥組大鼠術后第 1天可見手術側腦腫脹,均出現血腫,說明造模成功,血腫面積見表3,2組比較無顯著性差異(P>0.05);術后第 3天血腫有所吸收,從第 5天起出血明顯減輕,術后 7d明顯吸收,但參麥組相對吸收明顯,模型組出血灶內尚可見棕紅色的凝血塊,而參麥組則只見吸收后形成的中風囊。
2.4 電鏡觀察組織形態學變化
電鏡下觀察,正常組和假手術組海馬 CA1區錐體細胞核呈圓形、胞體內細胞器豐富;模型組和參麥治療組 1d海馬 CA1區均出現了凋亡小體,模型組術后 3d凋亡小體增多,持續到術后 7d,細胞器結構不完整(圖1),參麥組 7d時海馬 CA1區毛細血管和膠質細胞水腫(圖1);參麥組術后 3d凋亡小體增多,但比模型組要少(圖2),7d時仍可看到凋亡小體,但細胞器結構較完整;模型組 7d時,海馬 CA1區毛細血管和膠質細胞水腫嚴重,參麥組 7d時海馬CA1區毛細血管和膠質細胞輕度水腫(圖2)。
表3 2組大鼠術后 1d血腫面積比較(±s,n=5)

表3 2組大鼠術后 1d血腫面積比較(±s,n=5)
注:參麥組與模型組術后 1d血腫比較:t=0.53,★P>0.05
組 別 n 血腫面積(mm2)模型組 5 12.84±1.29★參麥組 5 13.37±1.68
2.5 大鼠腦出血后血腫中心區、缺血半暗帶區、術側海馬區和皮層區 HSP70的表達
正常組和假手術組大鼠海馬區和皮層區均有少量的 HSP70陽性信號表達(圖3和圖4),假手術組比正常組稍多,但二者比較差異有統計學意義(P>0.05)。模型組術后第 1天于血腫中心區幾乎未見陽性信號表達,3d后可見少量的陽性細胞,5d時稍增多,而血腫周圍區、術側海馬區和皮層區陽性信號術后 1d時即增多,3d時達到高峰(圖5),以后逐漸下降,7d仍有陽性信號,各個表達部位的陽性細胞數以海馬區最多,手術對側海馬區和皮層區陽性信號也有所增加;參麥組血腫周圍區、術側海馬區和皮層區術后 1d時即增多,3d時達到高峰(圖6),以后逐漸下降,7d仍有較多的陽性信號,比模型組要多。模型組和參麥組各時間點于各部位的陽性細胞數與假手術組、正常組相比差異有統計學意義(P<0.05);參麥組各時間點于血腫周圍區、海馬區和皮層區的陽性細胞數比模型組要多,2組比較差異有統計學意義(P<0.05),而 2組血腫中心區的陽性細胞數于 1d、3d、5d時差異有統計學意義(P>0.05),于 7d時模型組陽性細胞數要多,2組比較差異有統計學意義(P<0.05,見表4)。
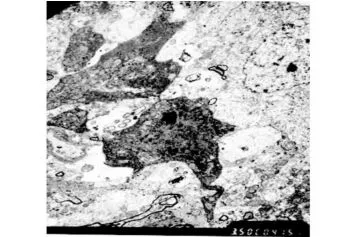
圖1 模型組第 3天(電鏡 ×3500)
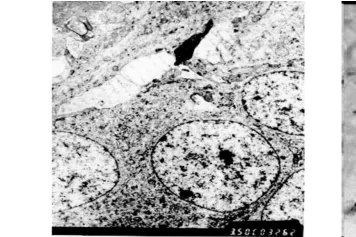
圖2 參麥組第 3天(電鏡 ×3500)
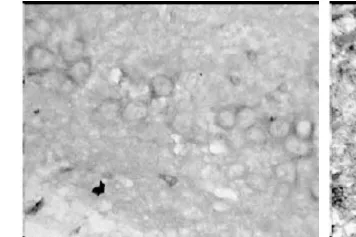
圖3 正常組第 3天(×400)
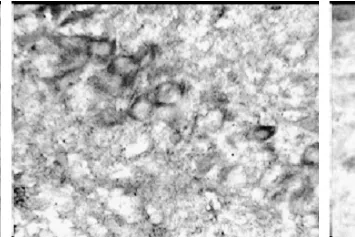
圖4 假手術組(×3500)
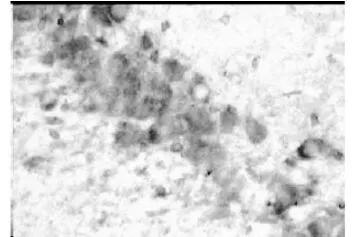
圖5 模型組第 3天(×400)
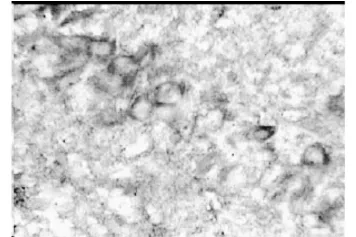
圖6 參麥組第 3天(×400)
3 討論
HSP又稱“分子伴侶”,是一種進化上高度保守的蛋白,具有 4個家族[4]。熱休克蛋白 70(heat shock proteins 70,HSP70)是 HSPs中最保守、最主要、含量最豐富的一類,在應激后生成最為顯著,它作為分子伴侶不僅參與細胞內蛋白質的折疊、裝配、降解和修復過程,以維護蛋白的自穩系統,在細胞的信息傳遞、生長、分化中具有重要的調控作用。同時它又可以作為一種內源性保護物質對臟器損傷產生自身保護作用[5、6]。近年對腦缺血大鼠模型的研究發現,HSP70可增加細胞耐缺氧能力,通過增加神經細胞 B細胞淋巴瘤/白血病-2(B cell lymphoma/leukmia-2,bcl-2)的表達來抑制神經細胞凋亡,從而發揮神經保護作用。
表4 大鼠腦出血后各部位 HSP 70陽性細胞數比較(±s,n=5)
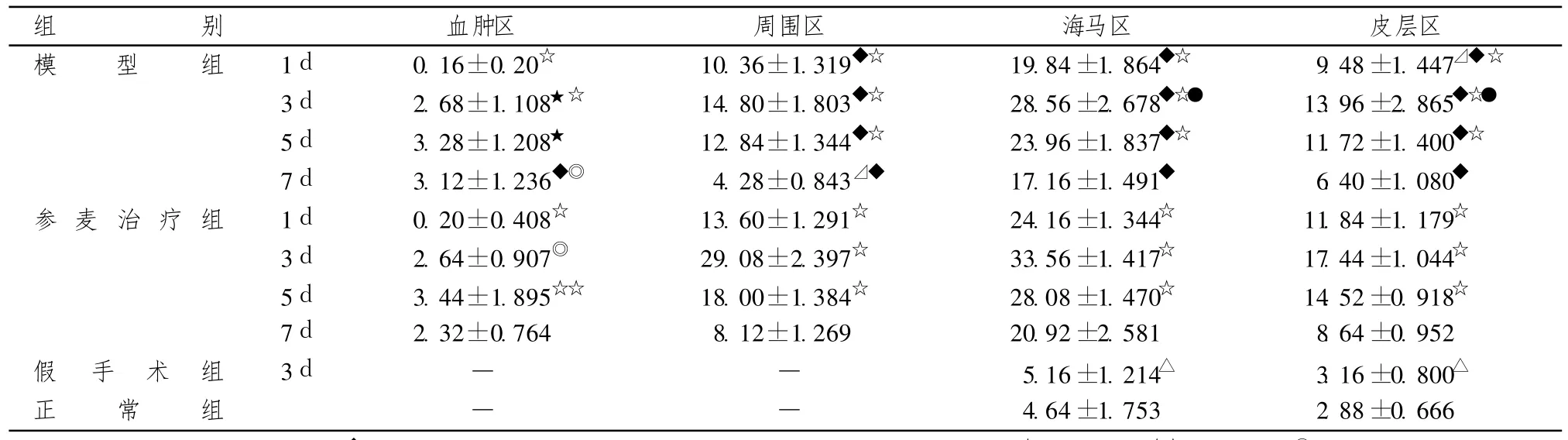
表4 大鼠腦出血后各部位 HSP 70陽性細胞數比較(±s,n=5)
注:與模型組各同時間段比較:◇P<0.01,★P>0.05;參麥組與模型組組內各同時間段比較:☆P<0.01,☆☆P<0.05,●P>0.05;模型組 3d時與假手術組比較:○P<0.01;假手術組與正常組比較:P>0.05
組別血腫區 周圍區 海馬區 皮層區模 型 組 1d 0.16±0.20☆ 10.36±1.319◇☆ 19.84±1.864◇☆ 9.48±1.447 ◇☆3d 2.68±1.108★☆ 14.80±1.803◇☆ 28.56±2.678◇☆○ 13.96±2.865◇☆○5d 3.28±1.208★ 12.84±1.344◇☆ 23.96±1.837◇☆ 11.72±1.400◇☆7d 3.12±1.236◇● 4.28±0.843 ◇ 17.16±1.491◇ 6.40±1.080◇參 麥 治 療 組 1d 0.20±0.408☆ 13.60±1.291☆ 24.16±1.344☆ 11.84±1.179☆3d 2.64±0.907● 29.08±2.397☆ 33.56±1.417☆ 17.44±1.044☆5d 3.44±1.895☆☆ 18.00±1.384☆ 28.08±1.470☆ 14.52±0.918☆7d 2.32±0.764 8.12±1.269 20.92±2.581 8.64±0.952假 手 術 組 3d — — 5.16±1.214 3.16±0.800正 常 組 — — 4.64±1.753 2.88±0.666
眾所周知,腦出血后存在廣泛的繼發性缺血性損害,其血腫周圍存在一個繼發性缺血半暗帶(ischamic Penumbra,IP),這個區域由于尚存在側支循環,神經細胞出現的是大量的凋亡而不是壞死,且早期僅神經功能降低而依然能維持離子平衡而存活,如血流立即恢復,半暗帶區域的神經細胞可恢復正常,但缺血時間過長或血流量繼續下降,則神經細胞不可避免地發生壞死。腦出血無疑是一種應激狀態,血腫周圍組織作為對應激的反應,必將在殘存的神經細胞內合成 HSP70增多,甚至有學者認為這些區域是 IP區存在的標志。而最近國內的學者也證實,腦出血大鼠血腫周圍組織 HSP70的表達增加。
參麥注射液源于《干金要方》之生脈散,主要藥物為人參、麥冬,其主要功效為益氣養陰固脫。現代藥理研究表明,參麥注射液通過抗凋亡的作用而減輕神經細胞缺血損傷,已在臨床上廣泛應用于治療腦梗死,且取得較好的臨床療效。本人既往體內外的實驗研究結果顯示,參麥注射液可能通過促進血腫吸收、抑制血腫周圍區HIF1-α表達及抑制神經細胞凋亡而發揮神經保護作用。有關參麥注射液對ICH后 HSP70表達的影響,國內尚未見報道,但王曉霞等的研究表明,參麥注射液能增加心肌缺血再灌注損傷模型心肌細胞 HSP70的表達,而減少心肌梗死面積,抑制心肌細胞的凋亡,并推測參麥注射液的保護作用系通過提高垂體-腎上腺系統的活性來增加心肌細胞 HSP70的表達而發揮增強機體抗應激能力。我們在本次實驗中觀察到,正常組和假手術組大鼠海馬區和皮層區均有少量的 HSP70表達,模型組和參麥組術后第 1天,血腫中心區幾乎不表達 HSP70,而血腫周圍區、海馬區和皮層區陽性信號增多,3d時增多達到高峰,7d時仍有陽性信號;同時免疫組化結果表明,血腫中心區在 3d后可見少量的陽性細胞,5d~7d時稍增多,推測這是第 3天時血腫開始吸收,神經膠質細胞及新的毛細血管增生,缺氧誘導膠質細胞和血管內皮細胞表達 HSP70,從而產生保護作用并促進機體恢復。同時我們還發現,ICH后陽性細胞數以海馬區最多,結合電鏡下海馬CA1區同期出現凋亡小體,說明上述區域的繼發性缺血可逆損傷可能通過誘導 HSP70的表達增多,從而增加神經細胞對缺氧的耐受性,發揮神經細胞保護作用。參麥組周圍區、海馬區和皮層區神經細胞于各時間點神經細胞的 HSP70表達明顯比模型組多,提示參麥注射液可能通過增強 HSP70的表達,提高機體應激能力,增加細胞耐缺氧能力,抑制細胞凋亡,挽救繼發性缺血損傷的神經細胞來促進神經功能的恢復。我們的研究為參麥注射液廣泛應用于腦出血的治療提供了理論依據。
[1]黃仁發,何澤云,史偉.參麥注射液對腦出血后大鼠神經細胞保護作用的實驗研究[J].山東中醫雜志,2007,26(1):42-45.
[2]黃仁發,何澤云,史偉.參麥注射液對腦出血大鼠缺氧誘導因子 1-α表達的影響[J].遼寧中醫雜志,2008,35(3):453-455.
[3]Rosenberg GB.Collgenose-induced intracerebral hemorrhage in rat[J].Stroke,1990;21:801.
[4]Snoeckx Luc HEH,Comelussen RN,Nieuwenhoven FAV,et al.Heat shock proteins and cardiovascular pathophysiology[J].Physiol Rev,2001,81(5):1461-1497.
[5]Matsushita K,Meng W X,et al.Evidence for apoptosis after hemorrhage in rat striatum[J].Cerebral Blood Flow Metab,2000,20(2):396.
[6]Shogo N,Waro T,Yoshiliko U,et al.Ischemic tolerance due to the induction of HSP70 in a rat ischemic recirculation mold[J].Brain Res,1993,615:281-288.

