N-甲基亞硝基脲誘導小鼠胸腺淋巴瘤TCR基因重排分析
黃榕芳,余英豪,李 博
(1.南京軍區(qū)福州總醫(yī)院病理科,福州 350025;2.南京軍區(qū)福州總醫(yī)院實驗科,福州 350025)
自20世紀80年代末分子生物學技術被應用于淋巴瘤研究以來,分子生物學和分子細胞遺傳學特征已成為非霍奇金淋巴瘤(non-hodgkin lymphoma,NHL)診斷和研究中不可缺少的部分[1]。PCR是目前最常用于檢測人類T-NHL克隆性T細胞受體(T-cell receptor,TCR)重排的方法,技術上相對成熟[2,3]。采用N-甲基亞硝基脲(N-methyl-N-nitrosourea,MNU)腹腔分次注射的方法,本實驗室成功誘導了67.5%(27/40)實驗組小鼠產(chǎn)生胸腺淋巴瘤[4]。光學顯微鏡下胸腺結構破壞,代之以彌漫分布的中等大小的淋巴樣腫瘤細胞。免疫組織化學瘤細胞表達CD3和TdT。形態(tài)學和免疫組織化學結果證實27例胸腺腫瘤均為T淋巴母細胞淋巴瘤[5]。本部分以TCRβ和TCRγ基因重排為分子標志,應用高靈敏度的巢式PCR技術,對MNU誘導的小鼠胸腺T細胞淋巴瘤形成過程中發(fā)生的單克隆性基因重排變化進行探究性檢測,旨在組織病理和免疫分型的基礎上進一步確定MNU誘導腫瘤是否屬T細胞克隆性增生。
1 材料和方法
1.1 標本采取
選用6~8周齡SPF級C57BL/6小鼠52只[SCXK(滬)2003-0003],隨機分為實驗組40只和對照組12只。實驗組于第0、8周分次腹腔注射MNU誘導液(50mg/kg體重);對照組腹腔注射等量生理鹽水。第22周所有小鼠頸椎脫位法處死。采集實驗組胸腺淋巴瘤組織8例和對照組胸腺組織4例,迅速放入液氮罐內,后置入-70℃冰箱凍存。
1.2 基因組DNA提取
使用Universal Genomic DNA Extraction Kit Ver.3.0試劑盒(Takara公司),按說明書提取DNA,并用紫外分光光度儀和1.0%瓊脂糖凝膠電泳檢驗提取DNA質量。
1.3 巢式PCR
1.3.1 引物設計:引物設計參照文獻[6](表1)。

表1 PCR擴增和測序引物Tab.1 Oligonucleotide sequences for primers used in PCR assays and DNA sequence analysis
1.3.2 PCR擴增:50μL反應體系,含10×Ex Taq Buffer 5μL、dNTP Mixture 0.2mmol、引物各0.02μmol、模板DNA 200ng、Ex Taq酶2.5U(Takara公司)。經(jīng)30個循環(huán),循環(huán)開始前95℃預變性4min,循環(huán)結束后72℃延伸10min,然后保持在10℃。每一循環(huán)由變性95℃/15s、退火/15s(表1)和延伸72℃/30s三相組成。第一輪以提取的基因組DNA為模板,選用外側引物;第二輪以第一輪擴增產(chǎn)物為模板,選用內側引物。每次擴增均設立無DNA模板的空白陰性對照。
1.3.3 PCR產(chǎn)物檢測:取PCR擴增產(chǎn)物行1.5%瓊脂糖凝膠(含溴化乙啶)電泳,紫外透射分析儀上判讀結果。
1.3.4 結果判定標準:與標準DNA分子量(Fermentas公司)對照,出現(xiàn)1~2條清晰、不連續(xù)的電泳條帶為TCR陽性。3條以上、涂抹狀散發(fā)性條帶(smear)或無特異性條帶者為陰性。
1.4 PCR產(chǎn)物膠回收及測序
TCRγ PCR產(chǎn)物按常規(guī)在1.5%瓊脂糖凝膠上進行電泳,用DNA膠回收試劑盒(上海生工生物工程技術服務有限公司),按說明書操作回收DNA,委托Invitrogen公司測定序列。
2 結果
2.1 巢式PCR擴增
8例胸腺淋巴瘤巢式PCR均顯示TCRβ、TCRγ單克隆性重排,兩步反應陽性結果均呈現(xiàn)單一特異性條帶。TCRβ基因第一輪擴增產(chǎn)物大小約為331bp,第二輪擴增基因重排帶位于190~242bp范圍內。TCRγ基因第一輪擴增帶片段大小約242~331bp,第二輪片段大小約190~242bp。對照組胸腺組織和空白陰性對照二次擴增均未出現(xiàn)特異性條帶(圖1~圖4)。
2.2 DNA序列分析
TCRγ基因內側引物的PCR產(chǎn)物片段正反向序列分析結果顯示,8例TCRγ基因的PCR陽性標本(產(chǎn)物1至產(chǎn)物8)分別為199~207bp不等的尖銳單峰。8例均含TCRGV3S1/TCRGJ1基因連接區(qū)、TCRGV3S1及TCRGJ1序列。表2所示為PCR產(chǎn)物1至產(chǎn)物8的TCRGV3S1/TCRGJ1基因重排區(qū)域片段與TCRγ胚系基因序列比對結果,其中V、J連接區(qū)插入核苷酸序列0~7bp大小。

圖1 TCRβ基因重排第一輪擴增結果Fig.1 The primary PCR reaction of TCRβ gene rearrangement

圖2 TCRβ基因重排第二輪擴增結果Fig.2 The secondary PCR reaction of TCRβ gene rearrangement
3 討論
2008年WHO造血與淋巴組織腫瘤分類的診斷標準強調,淋巴組織腫瘤應結合形態(tài)學、免疫表型、遺傳學以及臨床特點等信息界定每一種疾病實體[8,9]。目前,分子生物學技術已在 NHL的診斷應用上受到較為廣泛的重視,為NHL的傳統(tǒng)診斷方法(組織形態(tài)觀察、免疫組織化學)提供了新的技術手段輔助診斷,是對傳統(tǒng)診斷方法的重要補充。

圖3 TCRγ基因重排第一輪擴增結果Fig.3 The primary PCR reaction of TCRγ gene rearrangement
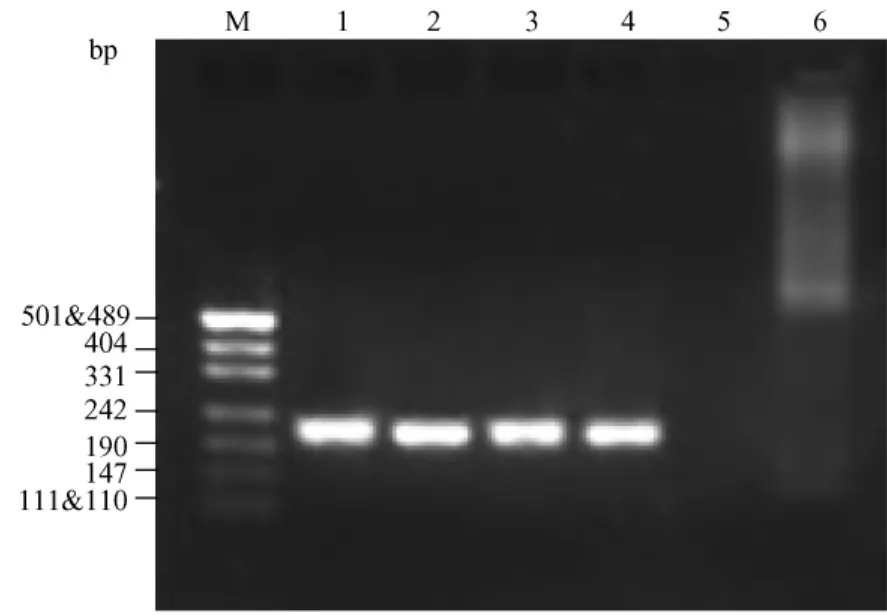
圖4 TCRγ基因重排第二輪擴增結果Fig.4 The secondary PCR reaction of TCRγ gene rearrangement
PCR技術是一種體外酶促合成特異性DNA片段的方法,其分析T-NHL基因重排的原理基于所用引物特異性結合TCR基因的V區(qū)和J區(qū)。TCR由分隔在胚系基因組染色體上的多個基因編碼,只有當基因發(fā)生重排使分隔的V區(qū)與J區(qū)靠近時,才能得到有效擴增。正常生理狀態(tài)下,胸腺組織T淋巴細胞發(fā)育過程中,TCR基因結構不斷發(fā)生隨機重排,而且V-(D)-J結合區(qū)域隨機插入不同數(shù)量的堿基形成完整的基因,故使每個T淋巴細胞均具有特異的結構基因,呈多克隆性。其PCR擴增產(chǎn)物片段長短不一,基因序列不同,電泳后表現(xiàn)為染色均勻的彌漫帶(smear)或彌漫片狀多克隆背景上相對較強的單克隆條帶。胸腺T細胞淋巴瘤則為T淋巴細胞某個分化階段發(fā)生突變的惡性克隆性增殖所致,瘤細胞為同一基因結構,屬于單克隆性。經(jīng)PCR擴增后,電泳呈一窄帶。這就是PCR檢測TCR基因重排的分子生物學基礎。本研究對Lista等[6]的研究方法作了相應改進,選用單純的巢式PCR擴增和電泳技術鑒定小鼠淋巴瘤的克隆性質。實驗過程采用兩組不同的V區(qū)引物和J區(qū)引物進行兩步反應,一方面提高了靈敏度和檢出率,另一方面也增加了反應的特異性。
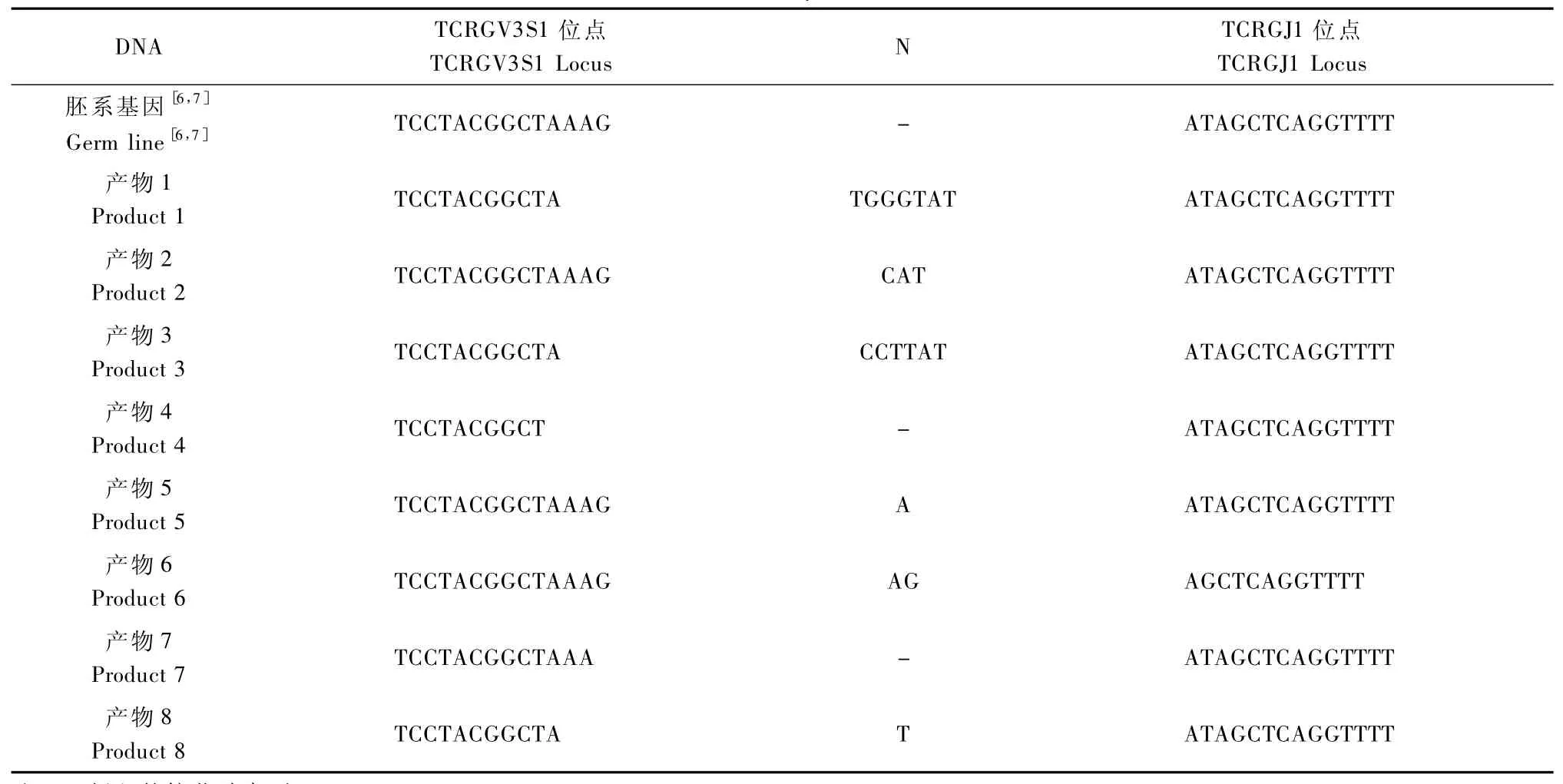
表2 TCRγ基因重排V-J結合區(qū)DNA序列Tab.2 DNA sequence of TCRγ rearrangement VJ junctions
用PCR方法分析淋巴增生性疾病的TCR基因重排的研究,以前主要集中在TCRβ基因的V、D、J片段上。由于小鼠TCRβ鏈(6號染色體)V區(qū)片段眾多,有20個基因片段[10],通用引物可能降低檢測的陽性率,家族特異性引物因引物數(shù)量太多而操作復雜。本研究引用的TCRBV5S1/TCRBJ2引物僅覆蓋1個V區(qū)基因片段,可能僅能識別胸腺組織的小部分TCRBVJ重排[6]。然而,位于13號染色體上的TCRγ基因重排發(fā)生在T細胞分化的早期,參與重排的片段數(shù)量相對有限,僅含有7個V區(qū)、4個J區(qū)和4個C區(qū)基因片段[11],其引物可能擴增出TCRγ基因所有V-J重排。另據(jù)報道,人類基因水平的TCRγ V-J基因重排出現(xiàn)在幾乎所有的T細胞淋巴瘤及T淋巴細胞中[12]。基于以上考慮,我們聯(lián)合選用針對TCRβ和TCRγ的巢式引物,以增強特異性,提高檢出率。
本實驗使用的模板DNA來自實驗動物體內的原發(fā)性腫瘤,而非經(jīng)過培養(yǎng)的細胞系,故能真實反映淋巴瘤在體內的惡性轉化過程。研究結果顯示,在確診的8例胸腺淋巴瘤中全部檢出TCRβ和TCRγ克隆性基因重排,陽性率均為100%。二者第二輪擴增帶片段大小近似,均位于190~242bp范圍內。4例對照組胸腺組織DNA中無一例出現(xiàn)陽性條帶。不同處理組檢出陽性率差異有顯著意義,說明TCRβ和TCRγ基因重排在小鼠胸腺T細胞淋巴瘤中具有很高的發(fā)生頻率,對其克隆性和細胞源性的確定有重要價值。實驗中未出現(xiàn)假陽性或假陰性結果,分析主要原因是巢式PCR方法的高度特異性;另一方面加樣量、PCR反應條件、電泳條件等各項實驗條件的優(yōu)化,也可能有效避免了假陽性或假陰性結果的出現(xiàn)。
送檢的8例TCRγ重排PCR產(chǎn)物均得到了測序結果。將測序結果與TCRγ胚系基因[6,7]作比較,分別得出TCRGV3S1/TCRGJ1基因連接區(qū)、TCRGV3S1及TCRGJ1序列,驗證了擴增產(chǎn)物即為TCRγ基因V區(qū)與J區(qū)的克隆性重排片段。8例基因重排連接區(qū)為0~7bp大小不等片段。片段大小的差異,考慮與每一例13號染色體上V區(qū)和J區(qū)的斷裂點不同和所插入的N-區(qū)域核苷酸序列的多少有關[13],這同時也解釋了8例DNA序列并不完全相同的原因。雖然我們未對第一輪擴增產(chǎn)物作DNA序列測定,但第二輪反應產(chǎn)物片段(190~242bp)略小于第一輪(242~331bp)符合理論推算,也間接說明了結果的可靠性。
本研究有力說明了所使用的TCRβ、TCRγ基因巢式引物對胸腺T細胞淋巴瘤的克隆性和細胞源性的確定是相當敏感而特異的,結合形態(tài)學和免疫組織化學結果[5],再次證實MNU誘導的小鼠胸腺淋巴瘤的形成過程實際上是單個T淋巴細胞TCR基因重排后,在MNU的作用下發(fā)生惡性轉化,并單克隆性增生,最終取代胸腺內正常細胞,是屬于T細胞來源的腫瘤。
[1]楊文濤.惡性淋巴瘤的細胞遺傳學及分子生物學[M].見:許良中.現(xiàn)代惡性淋巴瘤病理學.上海:上海科學技術文獻出版社,2002:191-138.
[2]Svachova M,Tichy M.PCR analysis of immunoglobulin heavy chain and TCR gene rearrangements in diagnosis of lymphoproliferative disorders on formalin-fixed,paraffinembedded tissues[J].Neoplasma,2008,55(1):36-41.
[3]王萍,王瑞年,盧健,等.非霍奇金淋巴瘤的IgH和TCRδ基因重排[J].臨床與實驗病理學雜志,2002,18(1):21-23.
[4]黃榕芳,余英豪,吳在增.小鼠胸腺淋巴瘤動物模型的建立[J].中國實驗血液學雜志,2009,17(5):1220-1223.
[5]黃榕芳,余英豪,吳在增,等.N-甲基亞硝基脲誘導胸腺淋巴瘤病理形態(tài)學及超微結構研究[J].中國實驗血液學雜志,2009,17(6):1448-1452.
[6]Lista F,Bertness V,Guidos CJ,et al.The absolute number of trans-rearrangements between the TCRG and TCRB loci is predictive of lymphoma risk:a severe combined immune deficiency(SCID)murine model[J].Cancer Res,1997,57(19):4408-4413.
[7]Lafaille JJ,DeCloux A,BonnevilleM,etal.Junctional sequences of T cell recaptor gamma delta genes:implications for gamma delta T cell lineages and for a novel intermediate of V-(D)-J joining[J].Cell,1989,59(5):859-870.
[8]Harris NL,Campo E,Jaffe ES,et al.Introduction to the WHO classification of tumors of haematopoietic and lymphoid tissues[M].In:Swerdlow SH,CampoE,HarrisNL.WHO classification of tumors of haematopoietic and lymphoid tissues.Lyon:LARC Press,2008:14-15.
[9]余英豪,郭文煥.對造血系統(tǒng)腫瘤及淋巴組織腫瘤2001年WHO分類的再認識[J].實用癌癥雜志,2005,7(4):429-430.
[10]Arden B,Clark SP,Kabelitz D,et al.Mouse T-cell receptor variable gene segment families[J].Immunogenetics,1995,42(6):501-530.
[11]Raulet DH.The structure,function,andmolecular genetics of the γ/δ T cell receptor[J].Annu Rev Immunol,1989,7:175-207.
[12]Khalil SH,Hamadah IR.The applicability of T-cell receptor gamma gene rearrangement as an adjuvant diagnostic tool in skin biopsies for cutaneous T-cell lymphoma[J].Saudi Med J,2006,27(7):951-954.
[13]孫文佶,林茂芳,Parwaresch R.外套細胞淋巴瘤bcl-1基因重排的分析[J].中華血液學雜志,2003,24(4):200-202.

