辣椒SRAP分子標記的優化及在航椒4號種子純度檢測中的應用
扈新民,李亞利,2,趙丹,高彥輝,羅愛玉,唐瑞勇,李紅民
(1.甘肅省航天育種工程技術研究中心,天水,741030;2.甘肅省天水市蔬菜產業開發辦公室)
辣椒SRAP分子標記的優化及在航椒4號種子純度檢測中的應用
扈新民1,李亞利1,2,趙丹1,高彥輝1,羅愛玉1,唐瑞勇1,李紅民1
(1.甘肅省航天育種工程技術研究中心,天水,741030;2.甘肅省天水市蔬菜產業開發辦公室)
為了對SRAP分子標記在辣椒中的應用進行優化,試驗采用正交設計L16(45),在4個水平上對影響辣椒SRAP反應體系的Taq酶濃度、Mg2+含量、模板DNA用量、dNTP濃度及引物用量等5個因素進行了優化,并用單因素完全隨機試驗篩選各反應因素的最佳水平,建立了辣椒SRAP分子標記的最佳體系。結果表明,在10 μL反應體系中,Taq酶最適濃度為1.5 U、Mg2+最適濃度為1.5 mmol/L、模板DNA最適用量為100 ng、dNTP最適用量為0.3 mmol/L、引物最適濃度為0.1 μmol/L。利用20個辣椒材料來驗證此反應體系,6%變性聚丙烯酰胺凝膠電泳檢測結果顯示,擴增產物在350~750 bp之間多態性高,且反應體系的穩定性和重復性好。通過優化的SRAP分子標記對F1代辣椒種子航椒4號進行純度檢測,檢測結果為98%,與其田間檢測結果100%十分接近。表明了SRAP分子標記技術是鑒定辣椒一代雜種純度的有效方法,具有準確、可靠、快速的特點,在辣椒雜交種子純度室內快速檢測中有很大的應用前景。
辣椒;SRAP;體系優化;正交分析法;完全隨機試驗;純度檢測
近十幾年來,分子標記技術發展異常迅速,已相繼開發出了多種分子標記技術,如RFLP、RAPD、SCAR、AFLP、ISSR、SRAP等[1]SRAP標記(Sequence-Related amplified polymorphism,相關序列擴增多態性)是由Li等[2]開發出的一種分子標記技術,該標記具有多態性高、信息量豐富、技術簡便、結果穩定和成本較低等特點,適用于基因定位、基因克隆、生物多樣性分析[3]、遺傳圖譜構建[4]、雜種優勢預測以及比較基因組學[5]等多個研究領域。目前SRAP標記已經應用于水稻、蘋果、柑橘、櫻桃、大蒜、萵苣、棉花、西瓜、油菜、蓮藕、甘薯等作物的研究中[6~10]。SRAP標記是基于PCR技術的一種標記技術,同其他標記一樣,SRAP反應條件受多種因素的影響,如PCR反應中模板DNA濃度、Taq酶、引物濃度、Mg2+濃度以及dNTP的濃度等,且不同物種對反應條件的要求也存在一定的差異。因此有必要對辣椒SRAP反應體系中各個組分的濃度、用量以及組合效應進行篩選。本研究利用正交設計分析法[11]結合單因素完全隨機試驗,對PCR反應中幾個影響試驗結果的主要因素進行優化,以期找到最佳反應體系。
F1代雜交種子純度直接影響到農業生產,因此種子純度的檢測是種子質量的關鍵。在中華人民共和國國家標準 《農作物種子檢驗規程》(GBJT3543-1995)中,種子真實性和純度是必檢項目。傳統上F1代雜種的純度主要是通過田間檢測來完成,也有一些是采用形態學鑒定法和同工酶分析法,但就種子而言,田間檢測和形態學鑒定均存在一定的缺點。例如田間鑒定需要的時間較長,而幼苗鑒定受外界環境條件影響較大,如水分、光照、溫濕度等,觀察時,由于數量性狀較多,質量性狀的差異比較難找,在一定程度上也影響了鑒定的可靠性和準確性。籽粒形態法鑒定時,因雜交種往往同其母本種子形態相似,而反交種又不易和正交種的父本種子區別,且親本同源組合種形態亦相似;另外,在種子成熟過程中,氣候、水肥等外界因素影響均可能改變種子的大小、顏色,所以形態學鑒定法難以真正鑒別大多數品種,只適合少數品種。同工酶分析法存在的主要問題是有限酶類的分析會帶來一定的偏差,因為所選酶的所有基因未必都表達在酶譜上,同時酶變異也未必都和形態變異有關,這就不易區別有些品種的雜交種及親本。另外,種子的發育階段或外界因素也會對酶譜分析帶來一些影響。而基于DNA基礎的分子標記不受環境限制和影響、無表型效應,具有客觀、穩定、快速、高效等特點,因此分子標記技術在種子純度檢測中得到了迅速的應用[12~14]。本試驗就是為了優化SRAP分子標記反應體系,為今后其在辣椒雜交種航椒4號進行純度檢測中的應用提供依據。
1 材料與方法
1.1 試驗材料
試驗所用的辣椒材料均取自甘肅省航天育種技術研究工程中心研發基地。2009年10月溫湯浸種后,播于溫室營養缽,常規管理。用于SRAP-PCR反應的Taq酶、dNTP、Mg2+均購于西安鼎國生物公司,引物購于北京三博遠志公司,標準分子量(Marker)DL2000購于西安鼎國生物公司。
1.2 試驗方法
①辣椒DNA的提取與濃度的測定 試驗材料辣椒雜交種航椒4號及其父母本各育苗200株,待幼苗長出2~3片真葉時,剪取真葉,采用改良CTAB法[15]提取DNA。用Eppendorf公司生產的BioPhotometer核酸檢測儀檢測DNA溶液濃度與純度,并將其稀釋為100 ng/μL,-20℃下保存待用。
②PCR反應因素水平的初步確定與正交表的設計 為了確定PCR反應中5個因素 (Taq DNA聚合酶,Mg2+,模板DNA,dNTP,引物)的最佳水平,初步采用正交設計L16(45),在4個水平上進行試驗,共16個組合,L16(45)設計方案見表1。試驗設3次重復,再分別進行5個水平的單因素完全隨機試驗,逐個優化其他反應成分的終濃度,以確定相對較優的因素組合。
③SRAP-PCR擴增 引物設計參照Li等[2,5]、Ferriol等[3]發表的引物序列的報道,選用上游19個引物和下游20個引物。PCR擴增程序參照Li等[2]的方法:94℃預變性5 min,94℃變性1 min,35℃復性1 min,72℃延伸1 min,共5個循環;然后,再94℃變性1 min,50℃復性1 min,72℃延伸1 min,共35個循環;最后72℃延伸10 min,4℃保存。
④PCR產物的檢測 采用6%的變性聚丙烯酰胺凝膠,160 V電壓電泳,待二甲苯氰移動至膠板2/3處時停止,銀染顯色。最后在凝膠迷你成像系統中照相并記錄分析。
⑤SRAP最佳反應體系的驗證 利用20個辣椒品種對優化確定的辣椒SRAP-PCR反應體系及反應參數的穩定性進行驗證。
⑥航椒4號辣椒雜交F1代純度的檢測 利用所優化的辣椒SRAP-PCR體系對辣椒品種航椒4號雜種一代進行純度檢測。
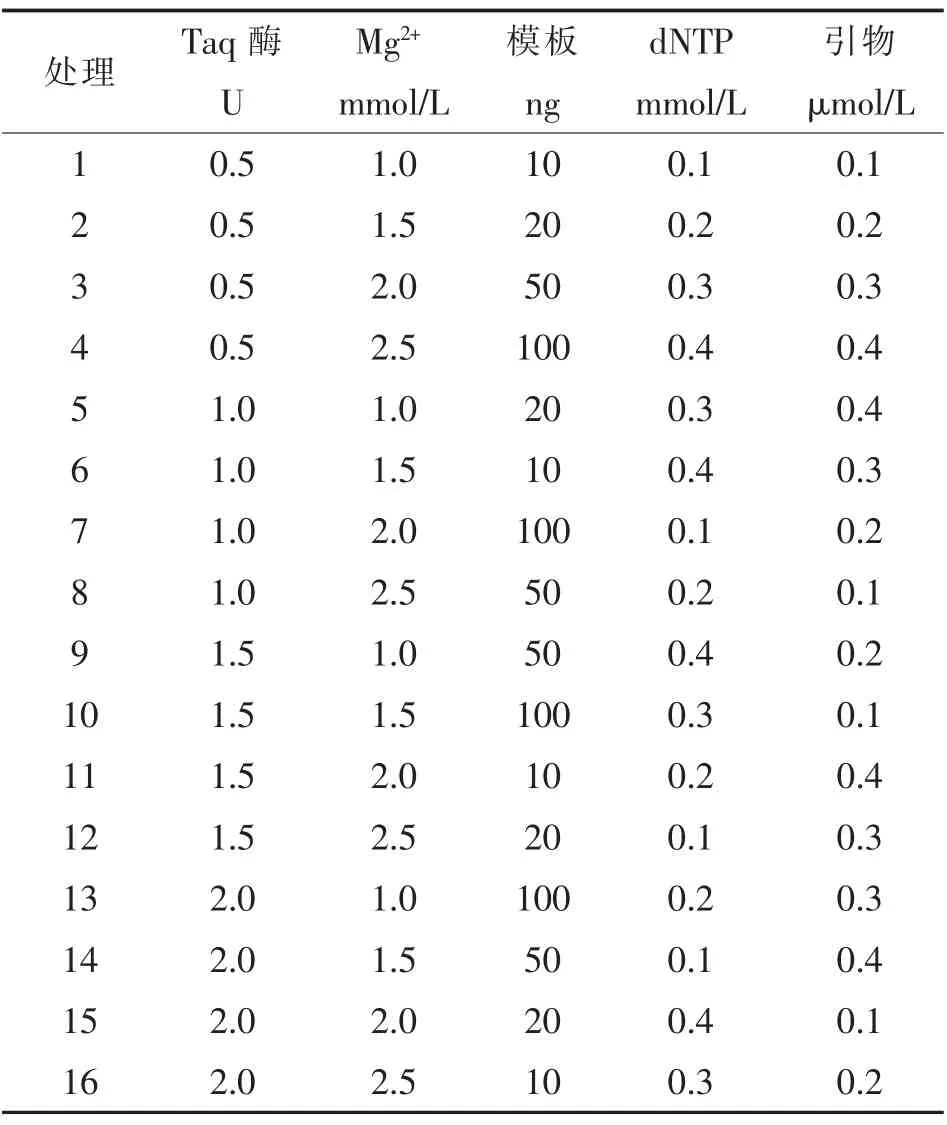
表1 PCR反應正交試驗L16(45)設計
2 結果與分析
2.1 利用正交設計和完全隨機試驗優化辣椒SRAP反應體系
①正交設計分析確定辣椒SRAP反應體系的關鍵影響因素 按表1設計的16個處理進行PCR反應后,將得到的產物進行電泳,結果如圖1。從圖1中可以直觀看出,在16個處理組合中由于Taq DNA聚合酶,Mg2+,模板DNA,dNTP,引物5個因素濃度組合的不同,擴增的效果存在明顯差異。處理1,6,11模板DNA濃度過低,擴增產物模糊、帶微弱,不易觀察。處理4,9,15的dNTP濃度高與游離Mg2+結合對PCR有抑制作用,背景色深,帶形彌散并有拖帶現象。處理3,12,16的Mg2+和dNTP濃度均高,背景色深,不易觀察。綜合考慮各因素,處理10擴增的條帶清晰,航椒4號的父本和母本都得到很好的擴增結果,為最佳組合。即在10 μL的反應體系中,Taq DNA聚合酶,Mg2+,模板DNA,dNTP,引物的濃度分別為1.5 U,1.5 mmol/L,100 ng,0.3 mmol/L,0.1 μmol/L。
②Mg2+濃度對辣椒SRAP標記的影響 利用單因素完全隨機試驗,以引物Em18OD3研究辣椒PCR反應體系中Mg2+濃度(0.5~2.5 mmol/L)對擴增結果的影響。當一種PCR組分進行試驗時,其他組分濃度不變。擴增結果如圖2所示,在Taq酶為1.0 U反應體系中,Mg2+濃度為0.5,1.0 mmol/L時擴增條帶弱;濃度為1.5~2.0 mmol/L時條帶比較清晰,但濃度為1.5 mmol/L時最清晰,擴增效果最好;當濃度達到2.5 mmol/L時擴增的特異性降低,條帶彌散。確定 Mg2+的最終濃度為1.5 mmol/L。

圖1 辣椒SRAP-PCR正交試驗結果
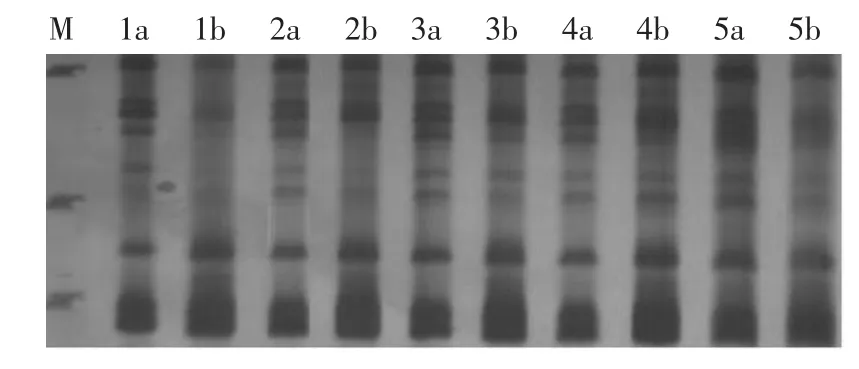
圖2 辣椒Mg2+濃度對辣椒SRAP標記的影響

圖3 辣椒模板DNA用量對辣椒SRAP標記的影響
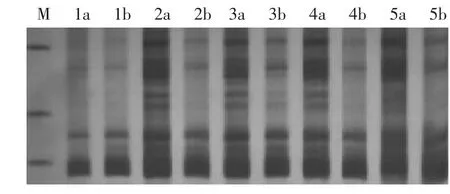
圖4 dNTP濃度對辣椒SRAP標記的影響
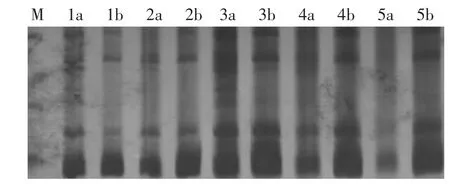
圖5 Taq酶濃度對辣椒SRAP標記的影響

圖6 引物濃度對辣椒SRAP標記的影響
③DNA濃度對辣椒SRAP標記的影響 利用單因素完全隨機試驗,以EM18OD3為引物,研究辣椒PCR反應體系中模板DNA(50~250 ng)濃度對擴增結果的影響。結果如圖3所示,在Taq酶為1.5 U反應體系中,DNA在100~200 ng均能產生清晰的條帶,所以DNA終濃度選為100 ng。
④dNTP濃度對辣椒SRAP標記的影響 擴增結果如圖4所示,dNTP濃度為0.1 mmol/L時,擴增出來的條帶較淺,當dNTP濃度大于0.3 mmol/L時,由于dNTP能與游離Mg2+結合,降低了Mg2+濃度,從而影響PCR擴增產物,使擴增條帶亮度變弱。所以dNTP濃度在0.2~0.3 mmol/L擴增效果最佳。
⑤Taq酶濃度對辣椒SRAP標記的影響 擴增結果如圖5所示,當 Taq酶濃度為0.5 U和1.0 U時,擴增出來的條帶較弱且條帶較少,當濃度超過2.0 U時擴增出來的條帶較模糊不夠清晰,Taq酶濃度為1.5 U時出現明亮清晰的條帶,所以Taq酶最適濃度為1.5 U。
⑥引物濃度對辣椒SRAP標記的影響 擴增結果如圖6所示,當引物濃度在0.1~0.3 μmol/L時,擴增的效果較好;當引物濃度在0.4~0.5 μmol/L時,出現非特異性擴增,所以最佳引物濃度在0.1~0.3 μmol/L。
2.2 最佳反應體系穩定性檢測結果
應用上述最佳反應體系,運用兩對不同引物對10份辣椒DNA進行SRAP擴增,結果如圖7所示。引物對每份DNA樣品均擴增出清晰的條帶,說明該體系穩定,為辣椒SRAP分子標記最佳反應體系。
2.3 F1雜交種純度的檢測
從本次純度檢測SRAP分子標記電泳結果中,我們得到3種結果,也就是說引物通過擴增出現3類情況:第一類,對其親本F1代擴增沒有差異條帶;第二類,偏母本型,F1代與母本有共有帶,與父本沒有;第三類,偏父本型,F1代與父本有共有帶,與母本沒有。在這3類結果中,第一類不能用于F1代雜種純度鑒定,只有把偏父本型與偏母本型結合使用才能準確鑒別F1代雜交種的純度[17,18]。對33株辣椒品種航椒4號進行SRAP分子標記純度檢測,發現32株有父母本的特異條帶,其純度為98%(圖8,9)。與田間對其航椒4號辣椒的純度進行農藝性狀調查驗證結果為100%非常接近,證明了SRAP分子標記技術是鑒定辣椒一代雜種純度的有效方法,具有準確、可靠、快速的特點,在辣椒雜交種子純度室內快速檢測中有很大的應用前景。

圖7 最佳反應體系對10份辣椒品種的聚丙烯酰胺擴增結果
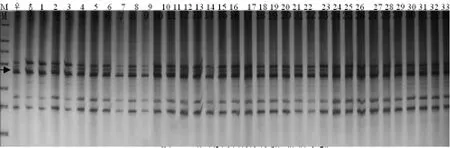
圖8 F1雜交種純度的檢測(偏母本型)
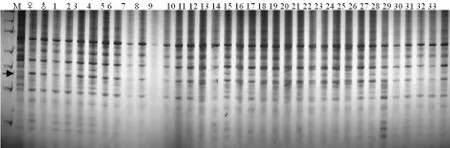
圖9 F1雜交種純度的檢測(偏父本型)
3 結論與討論
本研究利用正交試驗設計和單因素完全隨機試驗對辣椒SRAP-PCR反應體系進行了優化。在PCR反應體系中各個因素間互相都產生作用,Taq酶受Mg2+濃度的影響,而Mg2+的最終反應濃度主要受到dNTP的影響,當dNTP濃度過高時游離Mg2+被吸附從而使Mg2+濃度降低。本試驗利用正交試驗設計進行PCR反應體系優化的方法可以綜合考慮觀察各個因素間的互相作用,再結合較少因素的完全隨機試驗可逐步篩選其他成分的最佳濃度水平。通過篩選得到最佳反應體系為:10 μL體系中,模板DNA 100 ng、Mg2+1.5 mmol/L、dNTP 0.3 mmol/L,引物0.1 μmol/L,Taq酶1.5 U。
利用SRAP分子標記進行種子純度的鑒定已經在花生[19]、西瓜[20,21]等作物中應用,但在辣椒種子純度鑒定中的應用尚未見報道。本試驗利用SRAP分子標記檢測雜交種子航椒4號辣椒種子純度為98%,與其田間農藝性狀的檢測結果100%非常接近,所以通過本次試驗充分說明利用SRAP分子標記可以在DNA水平上檢測辣椒種子純度,還可運用于辣椒分子標記輔助育種,從而提高育種的效率,加快育種進程,促進辣椒育種工作的發展。
[1]黎裕,賈繼增,王天宇.分子標記的種類及其發展[J].生物技術通報,1999(4):19-22.
[2]Li G,Quiros C F.Sequence-related amplified polymorphism(SRAP),a new marker system based on a simple PCR reaction:its application to mapping and gene tagging in Brassica[J].Theor Appl Genet,2001,103:455-461.
[3]Ferriol M,Pico B,Nuez F.Genetic diversity of a germplasm collection of Cucubita pepo using SRAP and AFLP markers [J].Theor Appl Genet,2003,107:271-282.
[4]Lin Z X,Zhang X L,Nie Y C,et al.Construction of a genetic linkage map for cotton based on SRAP[J].Science Bulletin,2003,48(19):2 063-2 067.
[5]Li G,Gao M,Yang B,et al.Gene for gene alignment between the Brassica and Arabidopsis genomes by direct transcriptome mapping[J].Theor Appl Genet,2003,107(1): 168-180.
[6]柳李旺,龔義勤,黃浩,等.新型分子標記——SRAP與TRAP及其應用[J].遺傳,2004,26(5):777-781.
[7]林忠旭,張獻龍,聶以春.新型標記SRAP在棉花F2分離群體及遺傳多樣性評價中的適用性分析 [J].遺傳學報,2004,31(6):622-626.
[8]李嚴,張春慶.西瓜雜交種遺傳多態性的SRAP標記分析[J].園藝學報,2005,32(4):643-647.
[9]文雁成,王漢中,沈金雄,等.用SRAP標記分析中國甘藍型油菜品種的遺傳多樣性和遺傳基礎[J].中國農業科學,2006,39(2):246-256.
[10]吳潔,譚文芳,何俊蓉,等.甘薯 SRAP連鎖圖構建淀粉含量 QTL檢測[J].分子植物育種,2005,3(6):841-845.
[11]張春華,周永志,閻隱.數理統計方法[M].濟南:山東大學出版社,1992:151.
[12]張穎,曹棟棟,黃歆賢,等.應用分子標記進行蔬菜品種和種子純度鑒定的研究進展[J].種子,2008,27(5):51-55.
[13]柳李旺,侯喜林,龔義勤,等.分子標記技術在蔬菜作物品種鑒定與純度檢測中的應用[J].分子植物育種,2004,2(4):563-568.
[14]張菊平,張興志,王得元.分子標記鑒定蔬菜作物種子純度的研究進展[J].河南科技大學學報,2003,23(1):54-58.
[15]Clark M S著.顧紅雅,等譯.植物分子生物學——實驗手冊[M].北京:高等教育出版社,1998.
[16]Li G,Gao M,Yang B,et al.Gene for gene alignment between the Brassica and Arabidopsis genomes by direct transcriptome mapping[J].Theor Appl Genet,2003,107:168-180.
[17]孫敏,喬愛民,王和勇,等.黃瓜雜交種子純度的RAPD鑒定[J].西南師范大學學報:自然科學版,2003,28(1):103-107.
[18]王得元,李乃堅,殷秋秒,等.DNA分子標記鑒定蔬菜作物種子純度的原理分析 [J].湖北農學院學報,1999,19(3):220-223.
[19]張建成,王傳堂,焦坤.SRAP標記技術在花生種子純度鑒定中的應用[J].中國農學通報,2005,21(12):35-39.
[20]劉澤發,孫小武,董亞靜.SRAP標記鑒定西瓜種子純度方法研究[J].中國瓜菜,2009(1):5-8.
[21]王從彥,李曉慧,胡小麗.SRAP技術在西瓜種子純度鑒定中的應用[J].河南農業大學學報,2008,42(5):491-495.
Optimization of SRAP Marker in Pepper and Its Application in Purity Testing of Hangjiao No.4 Seeds
HU Xinmin1,LI Yali1,2,ZHAO Dan1,GAO Yanhui1,LUO Aiyu1,TANG Ruiyong1,LI Hongmin1
(1.Space Breeding Engineering Research Center of Gansu Province,Tianshui 741030; 2.Vegetable Industry Development Office of Tianshui)
The experiment was conducted to investigate the impact of Taq enzyme concentration,Mg2+content,amount of template DNA,concentration of dNTP and amount of primer on SRAP reaction system for pepper by using ofL16(45)orthogonal design.The fully random single factor experiment design was used to select the optimum level for each factor to optimize the SRAP amplification system.The results showed that in the 10 μL reaction system,the optimum concentration of Taq enzyme,Mg2+,template DNA,dNTP and primers are 1.5 U,1.5 mmol/L,100 ng,0.3 mmol/L and 0.1 μmol/L,respectively.The established amplification system was tested on 20 pepper strains and 6%denaturing polyacrylamide gel electrophoresis results showed that the amplified products were in the range of 350-750 bp polymorphism,and the reaction system was proved in good stability and reproducibility.Using the optimized SRAP markers to test seeds of Hangjiao No.4,the results was 98%,and the purities were very close to the purities field tested 100%,which indicated that SRAP markers would have a wide range of application in rapid lab test of seed purities of watermelon hybrid cultivars.
Pepper;SRAP markers;Optimization system;Orthogonal design analysis; Completely ran-domized design; Purity Testing
10.3865/j.issn.1001-3547.2010.22.003
“十一五”國家科技支撐計劃(2008BAD97B06-2),甘肅省科技孵化器項目(094TTPA0016)
扈新民(1982-),男,碩士研究生,研究方向為蔬菜育種與生物技術,E-mail:hxm821219@126.com
李亞利,通信作者,碩士研究生,研究方向為蔬菜育種與生物技術,E-mail:chairsh@126.com
2010-06-30

