兩種血管緊張素轉(zhuǎn)化酶抑制肽作用于靶標(biāo)的分子機理
郭慧青,毛 慧,趙 波,潘道東,2,*
(1.南京師范大學(xué) 國家乳品加工技術(shù)研發(fā)分中心,江蘇 南京 210097;2.寧波大學(xué)生命科學(xué)與生物工程學(xué)院,浙江 寧波 315211)
兩種血管緊張素轉(zhuǎn)化酶抑制肽作用于靶標(biāo)的分子機理
郭慧青1,毛 慧1,趙 波1,潘道東1,2,*
(1.南京師范大學(xué) 國家乳品加工技術(shù)研發(fā)分中心,江蘇 南京 210097;2.寧波大學(xué)生命科學(xué)與生物工程學(xué)院,浙江 寧波 315211)
采用脫脂乳為原料,利用四步反相高壓液相色譜從Lactobacillus helveticus和Lactobacillus casei subsp. casei制作的酸乳中分離到兩種血管緊張素轉(zhuǎn)化酶Ⅰ(angiotensin Ⅰ-converting enzyme,ACE)抑制肽VPP和IPP,測得它們抑制ACE活性的IC50分別為8.89μmol/L和5.17μmol/L。根據(jù)氨基酸序列分析的結(jié)果,構(gòu)建VPP和IPP的分子結(jié)構(gòu),通過分子柔性對接方法研究它們與ACE相互作用的分子機理,確定它們的作用位點、作用力類型及相互作用能。結(jié)果表明:VPP、IPP和ACE的活性口袋之間均形成3個氫鍵,且存在疏水,親水等作用力,IPP與ACE之間的結(jié)合較VPP更穩(wěn)定,與IPP比VPP具有較低的IC50值的實驗結(jié)果相一致。
VPP;IPP;ACE抑制肽;分子模擬
血管緊張素轉(zhuǎn)化酶Ⅰ(angiotensinⅠ- converting enzyme,ACE,EC 3.4.15.1)是一種哺乳動物組織中普遍存在的Zn2+依賴型梭二肽酶,為膜整合的單鏈糖蛋白。它能將無升壓活性的血管緊張素Ⅰ(Asp-Arg-Va-Tyr-Ile-His-Pro-Phe-His-Leu)末端的二肽(His-Leu)切割下來,使之轉(zhuǎn)變?yōu)橛休^強血管收縮調(diào)節(jié)活性的血管緊張素Ⅱ(Asp-Arg-Val-Tyr-Ile-His-Pro-Phe);同時,該酶還能使緩激肽失活,轉(zhuǎn)變?yōu)闆]有活力的緩釋肽,從而使血管平活肌收縮,導(dǎo)致血壓升高[1-6]。ACE抑制肽是經(jīng)蛋白質(zhì)分解酶的作用而產(chǎn)生的一類具有抑制ACE活性的多肽物質(zhì),
它通過抑制ACE的活性,阻止血管緊張素Ⅰ轉(zhuǎn)化為血管緊張素Ⅱ反應(yīng)的發(fā)生以及緩激肽的裂解,從而起到降低高血壓的作用。
乳蛋白是一種全價蛋白質(zhì),除了作為人類主要的膳食蛋白外,還是多種生物活性物質(zhì)的主要來源。近年來,國內(nèi)外的研究表明,乳源性ACE抑制肽具有安全性高、無副作用等優(yōu)點[4]。對乳源性ACE抑制肽的研究也因此成為了一個新的熱點,但研究多集中在ACE抑制肽的生產(chǎn)方法和分離途徑上,對ACE抑制肽的構(gòu)效關(guān)系和抑制機理鮮有報道。
本研究從具有較強蛋白分解酶系統(tǒng)的Lactobacillus helveticus JCM 1004和 Lactobacillus casei subsp. casei ATCC393所制作的酸乳中分離出具有較強抗高血壓作用的活性肽VPP和IPP,進行氨基酸序列分析并測試它們的抑制ACE活性的IC50;根據(jù)氨基酸序列分析的結(jié)果,采用分子模擬的方法,構(gòu)建VPP和IPP的分子結(jié)構(gòu),研究其與ACE作用的分子機理,這方面的研究對于了解其關(guān)鍵結(jié)構(gòu),設(shè)計活性更高的抑制劑都具有重要的意義。
1 材料與方法
1.1 材料與試劑
脫脂乳粉 市售;Lactobacillus helveticus JCM 1004、Lactobacillus casei subsp. casei ATCC393實驗室篩選保藏菌株;hippuryl-l-histidyl-l-leucine (HHL)、angiotensin-Ⅰ converting enzyme (ACE、) 4-(2-hydroxyerhyl) piperazine-1-erhanesulfonic acid (HEPES) Sigma公司;其他試劑購自于南京生興生物技術(shù)有限公司。
1.2 儀器與設(shè)備
超凈工作臺 上海上凈凈化食品有限公司;PHS-3C精密pH 計 上海雷磁儀器廠;722可見分光光度計 上海棱光技術(shù)有限公司;CL-22M高速冷凍離心機 賽特湘儀離心機儀器有限公司;立式壓力蒸汽滅菌器 上海博迅實業(yè)有限公司醫(yī)療設(shè)備廠;μBondasphere C18(3.9mm×150mm)色譜柱 美國Waters公司;YMC-Pack ODS-AP-303(4.6mm×250mm)色譜柱 、TSK- Octadecyl 4PW(3.9mm×150mm)色譜柱、YMC-Pack ODS-100S (3.9mm×150mm)色譜柱 日本YMC公司;Discovery Studio 2.1 (DS 2.1)軟件包 創(chuàng)騰科技有限公司。
1.3 方法
1.3.1 酸乳的制備及預(yù)處理
取10g/100mL脫脂乳在90℃條件下殺菌15min,殺菌結(jié)束后冷卻到37℃,無菌操作條件下,接種體積分?jǐn)?shù)4.0%的Lactobacillus helveticus JCM1004和 Lactobacillus casei subsp. casei ATCC393所制作的發(fā)酵劑,在40℃條件下培養(yǎng)發(fā)酵10h,培養(yǎng)發(fā)酵結(jié)束后用50%的乳酸將其pH值調(diào)節(jié)至3.4~3.6,8000r/min離心10min,收集上清液,再用10g/100mL的氫氧化鈉溶液調(diào)pH8.3,8000r/min離心10min,收集上清液冷凍干燥后,用于抑制ACE活性及多肽含量的測定。多肽含量的測定采用Church等[7]的方法。
1.3.2 抗高血壓肽的分離[8]
將酸乳凍干粉溶于洗脫液A(乙腈-水-三氧乙酸的體積比100:900:1),再用孔徑為0.2μm的過濾膜過濾,除去大分子物質(zhì),濾液再經(jīng)四步反相高壓液相色譜[8]分離精制得抗高血壓活性肽。將1.0mL上述濾液通過以下4個色譜柱,μBondasphere C18采用梯度洗脫,在0~40min洗脫時間內(nèi),洗脫液B(乙腈-水-三氧乙酸體積比100:900:1)的體積分?jǐn)?shù)從0%上升至45%,在41~70min洗脫時間內(nèi),B的體積分?jǐn)?shù)從45%升至75%,在71~90min洗脫時間內(nèi),B的體積分?jǐn)?shù)從75%升至100%。YMCPack ODS-AP-303、YSK-Octadecyl 4PW色譜柱的洗脫液、洗脫梯度同上。將第3個色譜柱所得活性較高樣品溶于洗脫液A(乙腈-水-三氟乙酸體積比100:900:0.8),過YMC-Pack ODS-100S色譜柱,洗脫液B(乙腈-水-三氟乙酸體積比100:900:0.8)梯度如下,在0~45min洗脫時間內(nèi),從0%升至40%,在46~75min洗脫時間內(nèi),從41%升至70%,在76~90min洗脫時間內(nèi),從71%升至100%。各階段洗脫液的流速均為1.0mL/min,檢測波長為215nm,收集各個峰的洗脫液,冷凍干燥后進行抑制ACE活性實驗。
1.3.3 抑制ACE活性測定
抑制ACE活性的測定采用Cushman等[9]的方法做適當(dāng)改進[6,10]。用含有0.3mol/L NaCl的0.1mol/L硼酸鹽緩沖液(pH8.3)將Hip-His-Leu配成5.0mmol/L的溶液。在10mL試管中分別加入200μL的5mmol/L Hip-His-Leu溶液和80μL的酸乳上清液(或溶于蒸餾水的多肽溶液),于37℃條件下保溫3min后,再加入20μL ACE溶液(溶解于蒸餾水中,活力為0.1U/mL),混勻后在37℃下保溫30min,再加入250μL的1.0g/100mL鹽酸溶液以終止反應(yīng),再加入1.7mL醋酸乙酯,經(jīng)15s振蕩混勻后,靜置5min,用移液管吸取1.0mL的醋酸乙酯層,真空冷凍干燥后,加入1.0mL蒸餾水,混勻后在228nm波長處測定吸光度。在上述條件下,抑制50%的ACE活性(IC50)為樣品的一個活性單位。IC50為抑制50%的ACE活性所需抑制劑的濃度。

式中:A為含有酸乳乳清(或溶于蒸餾水的多肽溶液)和ACE溶液的吸光度;B為不含發(fā)酵乳乳清(或溶于蒸餾水的多肽溶液)樣品,但含有ACE溶液;C為含脫脂乳乳清(或蒸餾水)和ACE溶液。
1.3.4 肽的氨基酸組成及序列測定
將多肽溶解于6g/100mL HCl中,在真空下于110℃條件下水解24h,用高壓液相色譜系統(tǒng)測定其氨基酸的組成,肽的氨基酸序列分析采用序列分析儀。
1.3.5 分子模擬方法
分子力學(xué)與分子動力學(xué)模擬采用Discovery Studio 2.1 (DS 2.1)軟件包,在CHARMm力場下完成[11-16]。ACE結(jié)構(gòu)來自PDB結(jié)構(gòu)數(shù)據(jù)庫(PDB code: 1UZE.pdb),將ACE配合物中的抑制劑分子依那普利(enalaprilat)和水分子去掉,保留輔因子Zn+和Cl-得到ACE對接結(jié)構(gòu)。將小肽對接范圍設(shè)定為8A,用Flexible Docking工具將配體(VPP,IPP)柔性對接到受體ACE中,通過比較對接結(jié)果的打分值來獲得最終的穩(wěn)定構(gòu)象,最后計算配體-受體配合物的相互作用結(jié)合能。
2 結(jié)果與分析
2.1 酸乳中ACE抑制肽的分離鑒定
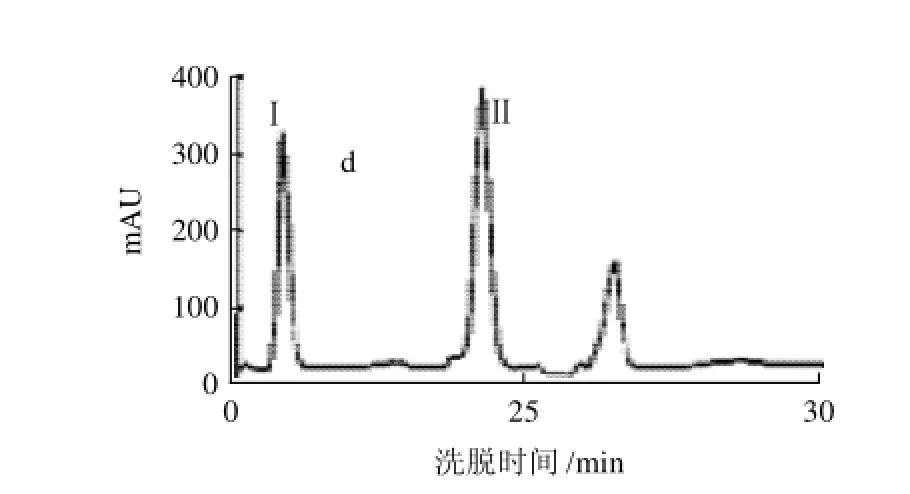
圖1 酸奶中ACE抑制肽的反相高壓液相色譜圖Fig.1 Reversed-phase HPLC elution profiles detected at 215 nm of sour milk
酸乳中抗高血壓肽的分離結(jié)果如圖1所示。上述四步色譜柱分離進行完畢后,色譜圖上呈現(xiàn)3個單獨吸收峰,經(jīng)測定,其中峰Ⅰ和峰Ⅱ具有較強的抗ACE活性功能,將這兩個峰的收集液分別用其他色譜柱分離均顯示單一吸收峰,這表明,經(jīng)上述四步反相高壓相色譜分離得到的樣品已比較純凈。且峰Ⅰ和峰Ⅱ的ACE抑制活性分別為419U和496U,而原凍干酸乳粉為1342U,峰Ⅰ和峰Ⅱ抗ACE活性回收率之和占原分離樣品(酸乳粉)抗ACE活性的68.18%,由此表明酸乳的抗ACE活性主要是峰Ⅰ和峰Ⅱ所含活性肽所起的作用。

表1 ACE活性抑制物質(zhì)的氨基酸序列及其IC50值Table 1 Amino acid sequence of angiotensin I-converting enzyme (ACE) inhibitor and the concentration of ACE inhibitor need to inhibit 50% of the ACE activity (IC50)
由表1肽的氨基酸組成及序列分析可知,峰Ⅰ的氨基酸組成為Val 1.0和Pro 1.95,峰Ⅰ為Val-Pro-Pro (VPP);峰Ⅱ的氨基酸組成為Ile 1.0和Pro 2.06,它為Ile-Pro-Pro(IPP)。VPP和IPP的IC50值分別為8.89μmol/L和5.17μmol/L。VPP和IPP的分子結(jié)構(gòu)如圖2所示。
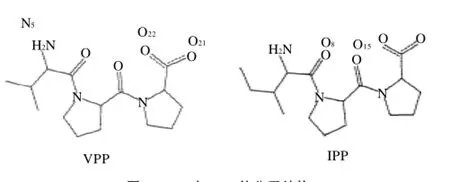
圖2 VPP與IPP的分子結(jié)構(gòu)Fig.2 Chemical structural formula of VPP and IPP
2.2 ACE抑制肽的分子模擬
為了在分子水平上了解ACE抑制肽與ACE相互作用的機理,用DS 2.1軟件包Flexible Docking模塊,采用分子動力學(xué)柔性對接的方法模擬相互作用的具體情況。對接結(jié)果以LibDockScore、LigScore1、LigScore2、PLP1、PLP2、Jain、PMF、PMFO4等打分函數(shù)的打分,同時綜合考慮配體與受體形成氫鍵的數(shù)目以及二者相互作用能量的高低,來判斷最穩(wěn)定的構(gòu)象。經(jīng)計算總共獲得了64種不同構(gòu)象,以打分最高的前20種構(gòu)象為研究對象,選取最穩(wěn)定的構(gòu)象(VPP和IPP)如圖3、4所示。

圖3 VPP與ACE的相互作用圖Fig.3 Interaction schemes of VPP and ACE
研究表明,VPP與ACE活性口袋周圍的氨基酸殘基存在氫鍵、疏水、親水等作用。在VPP與ACE的對接結(jié)果中,按LibDockScore降序排列,再綜合比較各個打分函數(shù)的打分值,構(gòu)象10是最優(yōu)構(gòu)象,如表2所示。

表2 VPP與ACE之間形成氫鍵的鍵長與鍵角Table 2 Length and angle of hydrogen bond between VPP and ACE
VPP與ACE活性口袋之間形成3個氫鍵,ACE 356位的丙氨酸與VPP的N5原子通過H32形成氫鍵,鍵長2.810A,鍵角127.0°;522位的精氨酸的NH1與VPP的O22原子通過HH12形成氫鍵,鍵長2.859A,鍵角115.6°;精氨酸的NH1與VPP的O21原子通過HH12也形成氫鍵,鍵長2.793A,鍵角167.8°,可以看出,3個氫鍵中,通過O21原子形成的氫鍵鍵長最短,鍵角最大,作用力最強,在VPP與ACE的相互作用中起著關(guān)鍵作用。總之,VPP與ACE所形成的氫鍵較強。VPP中的纈氨酸、脯氨酸都為疏水性氨基酸,與ACE活性口袋周圍的疏水性氨基酸形成疏水作用力。VPP分子中的親水性基團(氨基、羰基、羧基)與ACE活性口袋周圍的大量親水性氨基酸形成很強的親水作用力。氫鍵、親水、疏水等作用力共同穩(wěn)定了VPP與ACE復(fù)合物的構(gòu)象(圖4)。
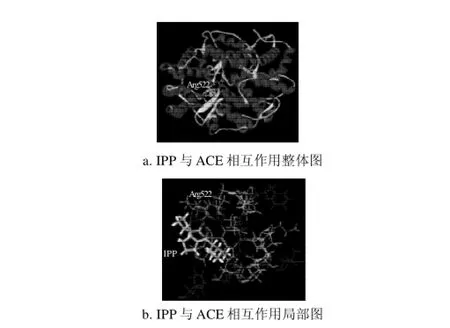
圖4 IPP與ACE的相互作用圖Fig.4 Interaction schemes of IPP and ACE
在IPP與ACE的對接結(jié)果中,按LibDockScore降序排列,再綜合比較各個打分函數(shù)的打分值,構(gòu)象11是最優(yōu)構(gòu)象。

表3 IPP與ACE之間形成氫鍵的鍵長與鍵角Table 3 Length and angle of hydrogen bond between IPP and ACE
如表3所示,IPP與ACE活性口袋之間也形成3個氫鍵,ACE 522位精氨酸的NH1與IPP的O8原子通過HH12形成氫鍵,鍵長2.729A,鍵角99.8°;同時,精氨酸的NH1還通過HH12與O15形成氫鍵,鍵長2.939A,鍵角144.7°;精氨酸的NH2通過HH22與O15形成氫鍵,鍵長3.039A,鍵角139.5°。3個氫鍵中,綜合鍵長鍵角的情況,NH1與O15原子形成的氫鍵作用力最強,在IPP與ACE的相互作用中起著關(guān)鍵作用。總之,IPP與ACE形成的氫鍵作用較強。IPP中的異亮氨酸和脯氨酸均為疏水性氨基酸,與ACE活性口袋周圍的疏水性氨基酸形成了疏水作用力。IPP分子中的親水性基團(氨基、羰基、羧基)也與ACE活性口袋周圍的大量親水性氨基酸形成了很強的親水作用力。氫鍵、親水、疏水等作用力共同穩(wěn)定了IPP與ACE復(fù)合物的構(gòu)象。
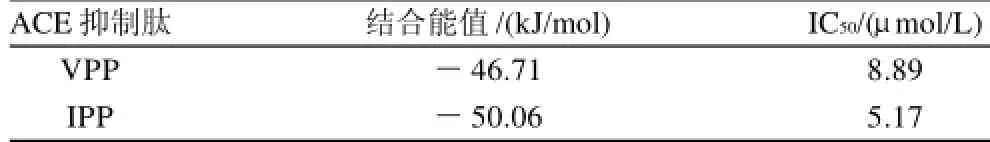
表4 生物活性肽與ACE活性位點相結(jié)合,通過分子對接所產(chǎn)生的最穩(wěn)定構(gòu)象的結(jié)合能值Table 4 Affinity energy values for the best poses obtained by automated molecular docking of bioactive peptides (VPP and IPP) at the ACE-binding site
VPP與IPP都為三肽,無論在體內(nèi)還是體外,都具有較強的ACE抑制活性。它們只有第一個氨基酸殘基是不同的,結(jié)構(gòu)極其相似(圖2),這就決定了它們與ACE作用的相似性,它們都與ACE 522位的精氨酸形成很強的氫鍵,可見ACE 522位的精氨酸為其活性口袋內(nèi)的關(guān)鍵氨基酸,在配體與受體的結(jié)合中起著重要的作用。VPP與IPP結(jié)構(gòu)中,IPP第一個氨基酸中比VPP多一個甲基,這可能是其性質(zhì)略有差異的主要原因。另外,結(jié)合能是衡量一組配體和目標(biāo)受體結(jié)合強弱的最重要的參數(shù),如表4所示,VPP最穩(wěn)定構(gòu)象(構(gòu)象10)的結(jié)合能為-46.71kJ/mol,IPP最穩(wěn)定構(gòu)象(構(gòu)象11)的結(jié)合能為-50.06kJ/mol,表明配體VPP、IPP與受體ACE之間均有很強的相互作用。但IPP的結(jié)合能值較VPP更低,表明IPP與ACE的結(jié)合比VPP與ACE的結(jié)合更穩(wěn)定。這也與實驗中所得出的IPP比VPP具有較低的IC50的實驗結(jié)果相一致。
3 結(jié) 論
以脫脂乳為原料,通過四步反相高壓液相色譜從Lactobacillus helveticus和Lactobacillus casei subsp. casei制作的酸乳中分離到兩種抗高血壓肽VPP和IPP。經(jīng)測定,它們抑制ACE活性的IC50分別為8.89mol/L和5.17mol/L;根據(jù)氨基酸序列分析的結(jié)果,構(gòu)建了VPP和IPP的分子結(jié)構(gòu),通過分子柔性對接方法研究了它們與ACE相互作用的分子機理,確定了它們的作用位點、作用力類型及相互作用能。結(jié)果表明,VPP、IPP和ACE的活性口袋之間均形成三個氫鍵,且存在較強的疏水、親水等作用力,相互作用的結(jié)合能分別為-46.71、-50.06kJ/mol,IPP與ACE之間的結(jié)合較VPP更穩(wěn)定,與IPP比VPP具有較低的IC50值的實驗結(jié)果相一致。
[1]吳煒亮, 吳國杰, 梁道雙, 等. ACE抑制肽的生理功能和研究進展[J].現(xiàn)代食品科技, 2006, 22(3): 251-254.
[2]張艷, 胡志和. 乳蛋白源ACE抑制肽的研究進展[J]. 食品科學(xué), 2008, 29(10): 634-640.
[3]FITZGERALD R J, MEISEL H. Milk protein-derived peptide inhibitors of angiotensin-I-converting enzyme[J]. British Journal of Nutrition, 2000, 84(Suppl1): 33-37.
[4]趙樹平. 乳桿菌發(fā)酵乳中ACE抑制活性和γ-氨基丁酸的研究[D]. 呼和浩特: 內(nèi)蒙古農(nóng)業(yè)大學(xué), 2008.
[5]HAQUE E, CHAND R. Antihypertensive and antimicrobial bioactive peptides from milk proteins[J]. Eur Food Res Technol, 2008, 227(1): 7-15.
[6]郭宇星. 微生物發(fā)酵法水解乳清粉制備生物活性肽的研究[D]. 天津:天津商業(yè)大學(xué), 2006.
[7]CHURCH F C, SWAISGOOD H E, PORTER D H, et al. Spectrophotometric assay usingo-phthalaldyhyde for determination of proteolysisin milk an disolated milk protein[J]. J Dairy Sci, 1983, 66(6): 1219-1227.
[8]潘道東. 酸乳中抗高血壓肽的分離及其特性研究[J]. 食品科學(xué), 2005, 26(1): 205-210.
[9]CUSHMAN D W, CHEUNG H S. Spectrophotometric assay and properties of the angiotensin-converting enzyme of rabbit lung[J]. Biochem Pharmacol, 1971, 20(7): 1637-1648.
[10]田俊英, 潘道東, 郭宇星. 瑞士乳桿菌蛋白酶水解酪蛋白制備血管緊張素轉(zhuǎn)化酶抑制肽的條件優(yōu)化[J]. 食品科學(xué), 2009, 30(11): 170-174.
[11]毛慧, 蔡炳鋒, 趙波, 等. 5-硝基-1H-吲哚-2-羧酸與牛血紅蛋白相互作用的分子模擬與光譜研究[J]. 化學(xué)研究與應(yīng)用, 2009, 21(5): 675-679.
[12]毛慧, 蔡炳鋒, 趙波, 等. 蘇丹紅Ⅱ與肌紅蛋白相互作用的分子模擬與實驗[J]. 應(yīng)用化學(xué), 2009, 26(11): 1332-1335.
[13]PINA A S, ROQUE A C. Studies on the molecular recognition between bioactive peptides and angiotensinconverting enzyme[J]. Mol Recognit, 2009, 22(2): 162-168.
[14]趙鈺嵐, 許傳蓮. 血管緊張素轉(zhuǎn)換酶的結(jié)構(gòu)功能及相關(guān)抑制劑[J]. 生物工程學(xué)報, 2008, 24(2): 171-176.
[15]王偉, 沈生榮, 馮鳳琴, 等. 基于藥效團的血管緊張素轉(zhuǎn)換酶抑制肽的結(jié)構(gòu)優(yōu)化[J]. 中國科學(xué), 2008, 38(4): 357-364.
[16]鄭清川, 楚慧郢, 牛瑞娟, 等. 人類乙酰膽堿酯酶(AChE)與抑制劑小分子的對接研究[J]. 中國科學(xué)B輯: 化學(xué), 2009, 39(11): 1454-1460.
Molecular Mechanism Study of Targeting of Two Angiotensin-converting Enzyme Inhibitory Peptides
GUO Hui-qing1,MAO Hui1,ZHAO Bo1,PAN Dao-dong1,2,*
(1. Branch Center of National Dairy Processing Technology Developing, Nanjing Normal University, Nanjing 210097, China;2. Faculty of Life Science and Biotechnology, Ningbo University, Ningbo 315211, China)
Two angiotensin-converting enzyme inhibitory peptides VPP and IPP were purified from the sour milk fermented with Lactobacillus helveticus JCM1004 and Lactobacillus casei subsp. casei ATCC393 by using four-step reverse-phase HPLC. VPP and IPP had 50% inhibition of ACE (IC50) of 8.89μmol/L and 5.17μmol/L, respectively. According to their amino acid sequence, the molecular structure of VPP and IPP were simulated, and the molecular mechanism for the function position, type and energy of the interaction between ACE inhibitory peptides and ACE were investigated by the flexible molecule docking technology. It was shown from the theoretical calculation that the three hydrogen bonds existed between the bioactive peptides poses of VPP and IPP. Hydrophobic and hydrophilic interactions also existed between residues at the ACE active site and the peptide poses. The binding between IPP and ACE was more stable than VPP with ACE. This is in good agreement with the experimental result that the IC50value of IPP is lower than that of VPP.
VPP;IPP;ACE inhibitory peptides;molecular modeling
Q518.3
A
1002-6630(2010)23-0001-05
2010-03-18
國家“863”計劃項目(2007AA10Z320);江蘇省自然科學(xué)基金項目(BK2009403);寧波市自然科學(xué)基金項目(2009A610180)
郭慧青(1983—),女,碩士研究生,主要從事乳品科學(xué)研究。E-mail:qqnjnu@163.com
*通信作者:潘道東(1964—),男,教授,博士,主要從事乳品科學(xué)研究。E-mail:daodongpan@163.com

