馬鈴薯莖尖培養部分無機鹽濃度對黃化苗發生的影響
黃 萍,馬朝宏,顏 謙
(1.貴州省生物技術研究所,貴州 貴陽 550006;2.貴州省農業科學院科技開發處,貴州 貴陽 550006)
馬鈴薯莖尖培養又叫分生組織培養,是包括馬鈴薯在內的許多植物脫除病毒的重要手段。自1955年,法國人Moral和Martin通過莖尖培養,獲得了無PVX、PVA和PVY的馬鈴薯植株后,這項技術快速發展,為解決馬鈴薯病毒危害提供了有效途徑。
但是在馬鈴薯莖尖組織培養過程中,因品種差異,會出現培養莖尖在誘導過程中黃化苗發生嚴重的現象,影響了莖尖培養試管苗的構建。關于如何控制馬鈴薯莖尖誘導過程中黃化苗的發生還未見詳細報道。本項目組多年來從事馬鈴薯的莖尖剝離培養工作,并開展了莖尖培養黃化苗發生的相關研究,以下是這一研究結果的報道。
1 材料與方法
1.1 試驗材料
試材是貴州省馬鈴薯研究所選育的馬鈴薯新品種B01-31-9。
1.2 試驗方法
1.2.1 馬鈴薯幼芽的獲取
在田間篩選無病蟲害感染、無損傷、健壯的薯塊用于室內自然催芽,待芽長至2~5 cm時,切下幼芽。
1.2.2 消毒
將幼芽上的幼葉剝去,用70%酒精滅菌30 s、再用10%次氯酸鈉溶液浸泡10~15 min后,無菌水清洗3~5次,備用。
1.2.3 莖尖剝離
將清洗干凈的幼芽置于40倍雙目解剖鏡下,用解剖針去掉未展開幼葉,直至露出半圓形光滑生長點,用解剖刀從0.3mm處切下,將切下的莖尖接種在裝有莖尖誘導培養基的試管或三角瓶內,每管接1個剝離后的莖尖(三角瓶內接4個),放入光照培養箱內培養(培養條件為2000lx,22℃,光照12h)。
1.2.4 莖尖誘導培養基類型
以MS作為馬鈴薯莖尖誘導的基本培養基,將MS培養基中的大量元素(NH4NO3、MgSO4·7H2O、CaCl2·2H2O及鐵鹽)作單因素試驗(表1),其它因素仍為MS培養基中的使用濃度。外源激素濃度均為0.5 mg·L-16-BA和0.1 mg·L-1NAA,培養基pH值為6.0。每種培養基接種20個莖尖,重復3次。

表1 各因素試驗設計(mg·L-1)Table 1 Experiment designs of inducing factors
1.2.5 方差分析
對各因素處理下莖尖培養過程中黃化率及成苗率情況用DPS數據處理系統軟件進行新復極方差(SSR)分析,多重比較。
2 結果與分析
2.1 NH4NO3濃度改變對黃化苗的影響
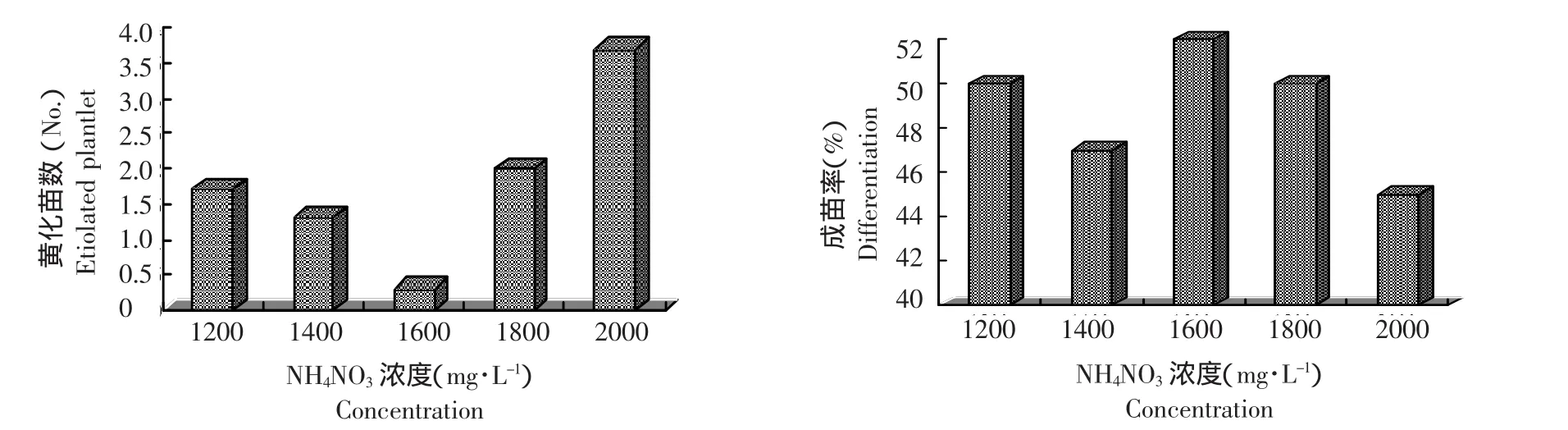
圖1 NH4NO3濃度改變對黃化苗數及成苗率的影響Figure 1 Influence of concentration of NH4NO3on the etiolation and differentiation
由圖1可見,NH4NO3濃度大于或小于1 600 mg·L-1時,莖尖培養出現黃化苗的數量均較高,其中以濃度為2 000 mg·L-1形成黃化苗的平均數最高,達到3.8株,高出最低值3.4。但不同濃度處理對莖尖分化成苗數的影響差異不顯著。方差分析結果證明:NH4NO3不同濃度間在黃化率上的差異達到顯著水平(F=4.16,F0.05=3.48,F0.01=5.99),在莖尖成苗系數上的差異沒有達到顯著水平(F= 0.47,F0.05=3.48,F0.01=5.99)。經SSR的多重比較,NH4NO3濃度為1 600 mg·L-1與2 000 mg·L-1和1 800 mg·L-1的黃化率有顯著差異(1 600 mg·L-1與2 000 mg·L-1,P=0.0045;1 600 mg·L-1與1 800 mg·L-1,P=0.095)。
2.2 MgSO4·7H2O濃度改變對黃化苗的影響
由圖2可見,MgSO4·7H2O的濃度在600 mg·L-1時,莖尖培養出現黃化苗的比例最高;其次則是200 mg·L-1和500 mg·L-1;當濃度是400 mg·L-1時黃化苗數最低。在所試濃度范圍內,400 mg·L-1最利于莖尖分化成苗,此時成苗率最高,是43%;當低于400 mg·L-1時,莖尖培養成苗率最低,為37%。
據方差分析表明,各濃度處理間在對馬鈴薯莖尖培養黃化苗發生的影響上達到了顯著水平(F=5.42,F0.05=3.48,F0.01=5.99),而對莖尖分化成苗的影響差異未達到顯著水平(F=0.59,F0.05= 3.48,F0.01=5.99)。由多重比較可知,400 mg·L-1與600 mg·L-1濃度雖對成苗率的影響差異不顯著,但對黃化苗數的影響差異達到了極顯著水平,此時P=0.0021。
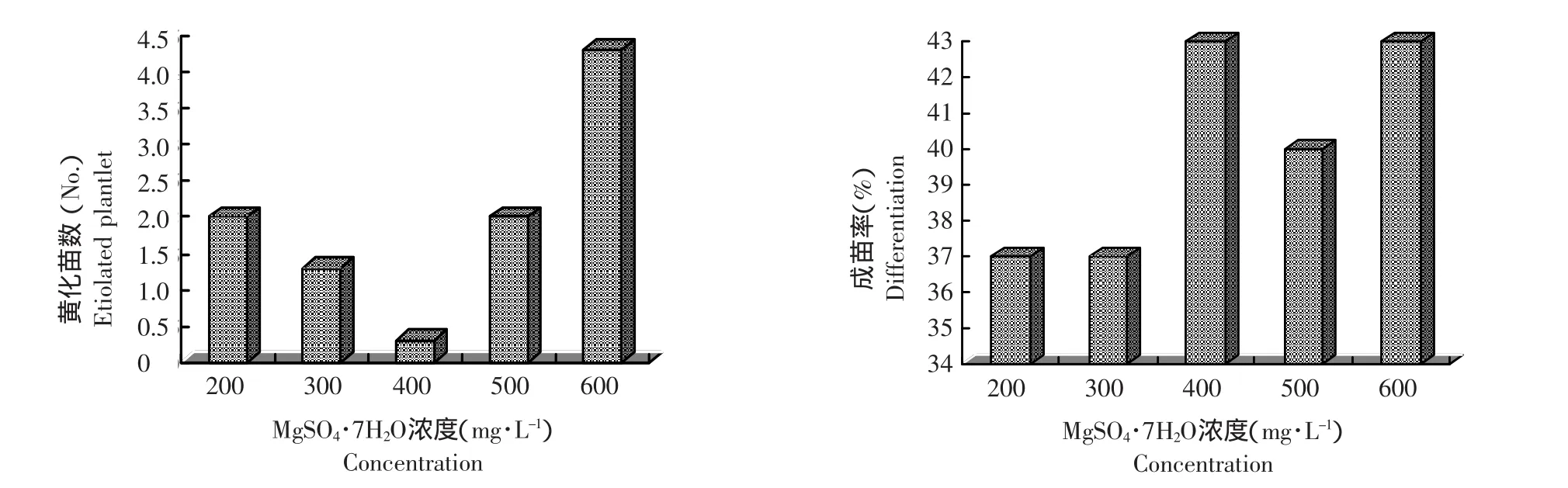
圖2 MgSO4·7H2O濃度改變對黃化苗數及成苗率的影響Figure 2 Influence of concentration of MgSO4·7H2O on etiolation and differentiation
2.3 鐵鹽濃度改變對黃化苗的影響
從圖3可知,隨著鐵鹽濃度的增加,黃花苗的發生降低,降低的幅度達3.4株。經方差分析,不同濃度處理和黃化苗發生的F值是20.3,遠大于F0.05=4.07(F=20.3,F0.05=4.07,F0.01=7.59),表明鐵鹽的不同濃度處理間在黃化苗的發生上的差異達到了顯著水平。各濃度處理下莖尖培養成苗的比例以13.9 mg·L-1和83.4 mg·L-1處理下最高(是42%),高出最低值5%,但經方差分析,各濃度處理對莖尖培養成苗影響的差異并不顯著,F值是0.062,小于 4.07(F=0.062,F0.05=4.07,F0.01=7.59)。
在以上4種處理濃度中,當MS培養基中鐵鹽濃度只有13.9 mg·L-1(1/2倍)時,發生黃化苗的比例最高,與其它3個處理濃度達到了極顯著差異(1/2倍與1倍,P=0.0011;1/2倍與2倍,P=0.0003<0.001;1/2與 3倍,P=0.0002<0.001)。

圖3 鐵鹽濃度改變對黃化苗數及成苗率的影響Figure 3 Influence of concentration of iron salt on the etiolation and differentiation
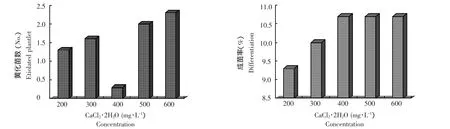
圖4 CaCl2·2H2O濃度改變對黃化苗數及成苗率的影響Figure 4 Influence of concentration of CaCI2·2H2O on the etiolation and differentiation
2.4 CaCl2·2H2O濃度改變對黃化苗的影響
在所試CaCl2·2H2O的各濃度處理中,低于或高于400 mg·L-1的濃度范圍內黃化苗出現的比例均高出400 mg·L-1的,其中以600 mg·L-1的濃度下黃化苗的發生率最高;在200 mg·L-1至400 mg·L-1的濃度范圍內,隨CaCl2·2H2O濃度的增加,成苗率有增高的趨勢,以后CaCl2·2H2O濃度再增加對成苗率的變化影響不大(圖4)。據方差分析,CaCl2·2 H2O的各濃度處理對莖尖培養過程中黃化苗發生的均方比 F值是 2(F0.05=3.48,F0.01=5.99,P= 0.171),各濃度處理對莖尖培養成苗率的均方比值F=0.64(F0.05=3.48,F0.01=5.99,P=0.65),表明各處理因子對黃化苗發生及成苗率的影響均未達到顯著水平,即本試驗所設的各處理濃度對黃化苗的發生及分化的影響不大。
3 討論
馬鈴薯莖尖組織培養過程中易出現苗黃化現象,嚴重時白化、甚至死苗,極不利于試管苗的構建和增殖。為緩解莖尖培養過程中黃化苗的發生,本試驗設置了4種因子的不同濃度處理研究,結果證明:鈣濃度對馬鈴薯莖尖培養過程中黃化苗的發生及成苗率的改變無顯著影響;鎂、氮和鐵鹽的濃度改變雖對莖尖成苗影響不明顯但對莖尖培養過程中黃化苗的發生有顯著的抑制作用;當鎂和氮的使用濃度過高和過低時都會導致較高的黃化率發生,適當的使用濃度能明顯地降低黃化率,此濃度范圍與MS培養基中的接近;同時也證明高濃度的鐵鹽顯著降低了黃化苗的發生機率,其中以3倍于MS培養基中的鐵鹽濃度的效果最佳,降幅達16%。
關于植物黃化苗研究的大田試驗報道較多[1-2],主要原因是土壤營養元素(如氮、磷、鉀等)的缺乏引起。武建林等[3]報道了土壤氮、磷、鉀養分狀況對植物缺鐵黃化發生的重要影響,認為硝態氮的吸收和還原所產生或釋放的氫氧根離子可引起植物體外pH升高,使鐵的有效性降低,從而導致黃化[4]。萬惠恩[5]在對黃瓜葉片黃化發生的研究中也提出,適當地調節氮、磷、鉀濃度對于植物正常生長有明顯促進作用,缺氮和氮過剩都會引起葉片黃化。以上報道的部分結論在我們的試驗中得到了進一步的驗證,證明在馬鈴薯莖尖培養過程中,增加鐵鹽濃度可明顯降低黃化苗的發生,缺氮、鎂和氮、鎂過剩都會提高黃化率。但前面報道的有些結論,如大田試驗中pH、磷、鉀等因子也會引起植株黃化苗的發生,這是否適用于馬鈴薯的莖尖組織培養過程及最佳的使用濃度情況如何,還有待于以后的試驗研究得出結論。
[1]潘佑找,費永俊.果樹缺鐵性黃化的原因及防治技術[J].森林病蟲通訊,2000,19(4):30-31.
[2]蔣代華,李昆志,顧明華,等.銀杏幼樹黃化原因的探討[J].廣西農學報,2002,3(增刊):119-123.
[3] 武建林,李有文,李立平,等.植物黃化與氮磷鉀營養的關系[J].西北農業學報,2004,13(1):104-108.
[4] Lucena J.Effects of bicarbonate,nitrate and other environmental factors on iron deficiency chlorosis:A review[J].Journal of Plant Nutrition,2000,23(11-12):1591-1606.
[5]萬惠恩.溫室黃瓜葉片八種黃化的識別與診斷措施[J].農業科技與信息,2004,21(1):39.

