15 N標記L-亮氨酸
張 亮,杜曉寧,李良君,李 杰
(上海化工研究院上海穩定同位素工程技術研究中心,上海 200062)
穩定性同位素15N示蹤技術,在研究多肽和蛋白質結構測序與合成、氨基酸和蛋白質在生物體內的代謝機理、藥物動力學機理等方面有著不可替代的作用[1]。其中,15N標記L-亮氨酸作為示蹤劑,已被廣泛應用于醫學、生物、化工等行業[2]。發酵法制備L-亮氨酸的技術已經比較成熟。Tsuchida等[3]采用亞硝基胍(NTG)誘變等方法處理乳糖發酵短桿菌2256,最終選出一株L-亮氨酸高產菌(34號菌,Ile-+2-TAr+β-HLr),可在13%葡萄糖培養基中積累L-亮氨酸達34 g/L。張素鑫等[4]選育出鈍齒棒桿菌 L-421可產L-亮氨酸達20 g/L。但是,現有發酵技術由于其含有豐富的天然有機氮源營養,不適用于生產高豐度的15N標記L-亮氨酸,因此,需要對菌種進行馴化,并研究特殊培養技術,使其適應于低有機氮源營養環境并能高水平產酸,從而提高15N同位素的利用率,保證產品的高品質。本研究擬探索適用于15N標記L-亮氨酸生產的實驗配方、發酵工藝、提純工藝,以制備高品質15N標記L-亮氨酸,提高其經濟效益。
1 主要實驗材料
1.1 主要儀器
SCS-24型巡回式自動搖瓶機:上海市離心機械研究所;LRH-250A型生化培養箱:廣東省醫療器械廠;LS-B50L型高壓蒸汽滅菌鍋 :上海醫用核子儀器廠;756MC型紫外-可見分光光度計:上海精密科學儀器有限公司;SBA40C型生物傳感儀:山東省科學院生物研究所;ALPHA1-2 LD型凍干機:德國CHRIST公司;同位素質譜計:美國 Thermos公司。
1.2 主要試劑
15N-硫酸銨、15N-尿素:上海化工研究院生產;732H+型陽離子交換樹脂:上海樹脂廠提供;AS1.542誘變株:中國科學院微生物研究所提供。
2 實驗方法
2.1 菌種馴化與保存
以AS1.542誘變株為出發菌,馴化培養得到黃色短桿菌 TLU53-8,帶有5種遺傳標記:Met-、Ile-、SGr、а-ABr、β-HLr,凍干保存。
2.2 培養基配方
活化斜面培養基:葡萄糖 1 g/L,蛋白胨10 g/L,牛肉膏 10 g/L,酵母膏 5 g/L,NaCl 2.5 g/L,瓊脂條20 g/L,p H7.0~7.2。
種子培養基:葡萄糖5 g/L、蛋白胨10 g/L、牛肉膏 10 g/L、NaCl 2.5 g/L、p H 7.0~7.2。
最佳發酵培養基(針對豐度實驗):葡萄糖100 g/L、15N-尿素 2 g/L、15N-硫酸銨 20 g/L、K2HPO42 g/L 、MgSO40.5 g/L 、FeSO40.02 g/L、MnSO40.02 g/L、生物素 0.000 3 g/L、VB10.000 3 g/L、蛋白胨1 g/L、高豐度菌體水解液10 g/L 、p H7.0~7.2。
2.3 搖瓶發酵工藝
斜面活化培養:將黃色短桿菌 TLU53-8置恒溫培養箱中,30℃恒溫培養20~24 h。
斜面二次活化培養:取一環培養20~24 h的TLU53-8菌轉接到活化斜面培養基。
種子液培養:取一環活化后的 TLU53-8菌體接入裝有25 mL種子培養基的500 mL三角瓶中,九層紗布封口,30℃下置于巡回式搖瓶柜,200 r/min培養15 h。
搖瓶發酵培養:用移液槍取3 mL上述培養好的種子液接入裝有20 mL發酵培養基的500 mL三角瓶中,九層紗布封口,28℃下置于巡回式搖瓶柜,220 r/min開始培養,中間檢測殘糖,殘糖<1%時,停止發酵反應,一般需78~90 h。
2.4 提取方法
采用離子交換法分離產品[5]。發酵液經除菌和除蛋白預處理,用草酸調p H至3~4,過732氫型樹脂柱,水洗至中性,分別用0.05、0.10和0.20 mol/L的氯化銨進行梯度洗脫,去除發酵液中的雜酸;將收集到的亮氨酸單斑溶液濃縮,再次過732氫型樹脂柱,水洗至中性后,用氨水洗脫。氨水洗脫液經濃縮、趕氨、活性炭脫色后,無水乙醇結晶過夜;將晶體濾出,烘干,可得純白色晶體。通過氯化銨、氨水兩步洗脫法進行提純,總提取收率達80%。得到的15N標記L-亮氨酸純度>99%,15N豐度>98%。
Fmax代表了群體當中的最大適應度值,Favg代表了群體當中的平均適應度值。由上式可知,群體最大適應度和平均適應度差值越大,Pc和Pm的值相應會越小,而K1和K2在這個過程代表著自適應調節力度的大小。通過自適應參數算法的引入,在遺傳過程根據實際情況及時調整Pm和Pc,遺傳算法將具有更好的靈活性,收斂速度提高,并且陷入局部最優解的可能性降低。
2.5 分析方法
發酵液產酸測定:采用氨基酸自動分析儀。
菌體光密度測定:菌體稀釋 20倍,采用756MC分光光度計在620 nm處測定光密度。
葡萄糖測定:采用SBA-40A型葡萄糖-谷氨酸分析儀測定。
L-亮氨酸純度測定:采用凱氏定氮法測定。15N豐度測定:采用同位素質譜測定。
p H的測定:采用6.4~8.0精密試紙測定。
3 結果與討論
3.1 溫度對發酵的影響
發酵前期菌體的生長對溫度敏感,發酵中后期溫度對菌體產酸影響較大。由種子培養溫度實驗可知,TLU53-8菌株的最佳生長溫度為28 ℃。因此 ,發酵實驗選取 24、26、28、30、32、34 ℃進行,結果示于圖1。由圖1可知,在28~30℃時,吸光度較高,表明菌體生長好,菌體濃度大,L-亮氨酸產量較高,28℃發酵產酸達到實驗最大值23.53 g/L。溫度太低菌體生長緩慢,難以完成對原料的轉化;溫度太高,菌體易衰老、后勁不足,不利于產酸。基于以上考慮,L-亮氨酸發酵溫度控制在28℃為宜,最高不宜超過30℃。
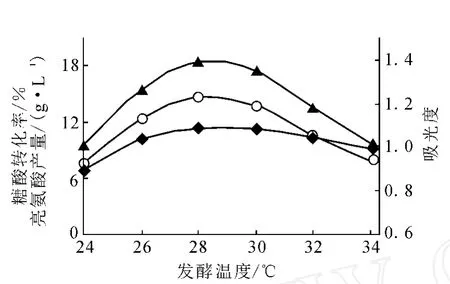
圖1 溫度對L-亮氨酸發酵的影響▲——L-亮氨酸;○——糖酸轉化率;◆——吸光度
3.2 p H對發酵的影響
對搖瓶分批發酵而言,欲控制全發酵過程始終維持某一恒定的p H十分困難。添加一定量的碳酸鈣可以使p H不致于劇烈下降,以防止發酵液酸度過大。培養基的組成和配制時初始p H不同,在滅菌過程中p H降低的程度也不同。因此,在接種前用滅菌的5 mol/L NaOH溶液重調p H,并在發酵過程每隔4 h調p H至所需值 6.0、6.5、7.0、7.5、8.0,誤差范圍 ±0.1,并在所調的各p H處測定糖酸轉化率和亮氨酸產量。實驗在同一搖床上進行,發酵72 h結束,結果示于圖2。由圖2得知,發酵過程控制p H 7.0有利于菌體生長和發酵產酸。p H對發酵前期的菌體生長和中后期發酵產酸影響較大。p H 7.0時菌體生長較快,發酵結束時,L-亮氨酸產量可達18.65 g/L。p H過低或過高,菌體生長緩慢,培養基p H長時間偏高或偏低,會使代謝途徑上的酶偏離最適酶活力狀態,導致菌體生長不佳,代謝產酸減少。
3.3 優化條件與初始條件的搖瓶分批發酵比較
綜合考慮培養基組成、裝液量、種齡和接種量等因素對TLU53-8菌株發酵產酸的影響。對發酵條件進行優化,優化前后的參數列于表1。采用表1中所列優化條件與初始條件,分別同時進行5瓶平行的分批發酵實驗。取樣分析L-亮氨酸產量、殘糖量,殘糖量降至約5 g/L即結束發酵。測殘液量,計算L-亮氨酸得率、糖酸轉化率,結果列于表2。由表2可知,優化條件與初始條件相比較,L-亮氨酸產量、L-亮氨酸產率、糖酸轉化率分別提高了19.25%、27.81%、28.00%。
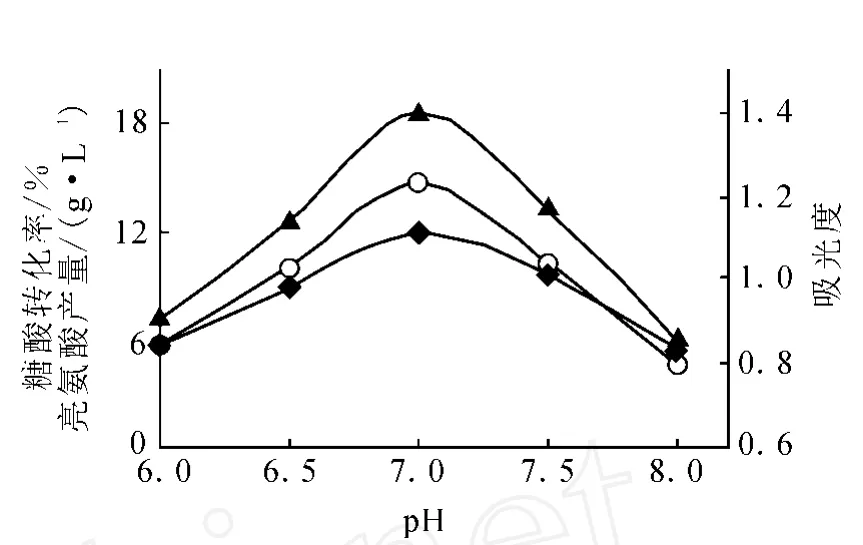
圖2 p H對L-亮氨酸發酵的影響▲——L-亮氨酸產量;○——糖酸轉化率;◆——吸光度

表1 L-亮氨酸搖瓶分批發酵條件(n=5)
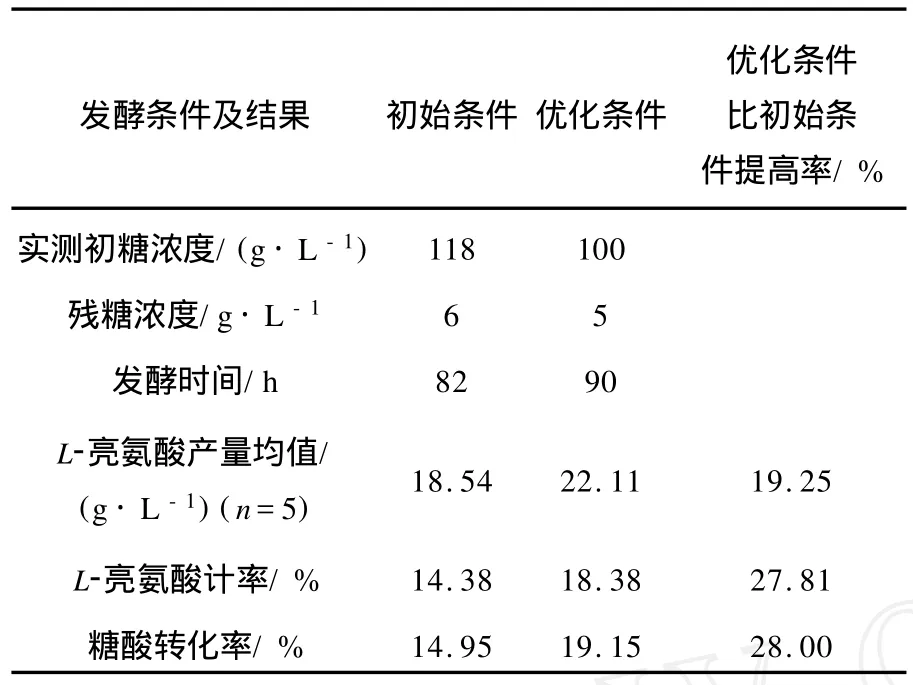
表2 優化條件與初始條件的搖瓶分批發酵實驗結果比較
3.4 菌體水解液添加量的確定
通過低豐度實驗可知:采取常規發酵中添加玉米漿的方法很難做到既保證豐度不被稀釋,又能保證產酸水平。主要原因是玉米漿中含有的大量有機氮物質(天然豐度)會通過細胞代謝,稀釋終產品豐度。因此實驗中采取用高豐度菌體水解液代替玉米漿的方法來解決以上問題。實驗結果顯示,在保證產品產酸量的條件下,終產品豐度稀釋很少,完全能符合產品要求。
高豐度菌體水解液的制備:離心收集高豐度發酵產生的菌泥,用3 mol/L的硫酸對菌泥進行酸水解40 h,得到高豐度的菌體水解液。經過質譜分析,此菌體水解液15N豐度為97.6%。通過多次發酵實驗,此菌體水解液能代替發酵過程所使用的玉米漿,且終產品豐度幾乎不稀釋。在相同的發酵培養基下(其中原料15N-硫酸銨同位素豐度99.9%,原料15N-尿素同位素豐度99.9%),對高豐度菌體水解液添加量做梯度實驗,分析不同高豐度菌體水解液添加量對發酵產酸、產品15N豐度的影響,結果示于圖3。由圖3可知,添加自制高豐度菌體水解液,可以有效防止產品豐度的稀釋,尤其是添加10 g/L菌體水解液對菌體產酸及豐度最佳。
3.5 生物素含量確定
為進一步減輕培養基中有機氮營養源對15N豐度的影響,所用的種子和發酵培養基中的蛋白胨含量相對較低,為保證菌體生長良好,可通過添加高生物素實現強制發酵。
發酵使用篩選培養基配方為:菌體水解液10 g/L、VB1200μg/L,改變生物素含量做梯度實驗,其它配方同2.2節中的發酵培養基,結果示于圖4。由圖4可知,添加高生物素對生長有明顯的促進作用,控制1 000μg/L對產酸最為有利。
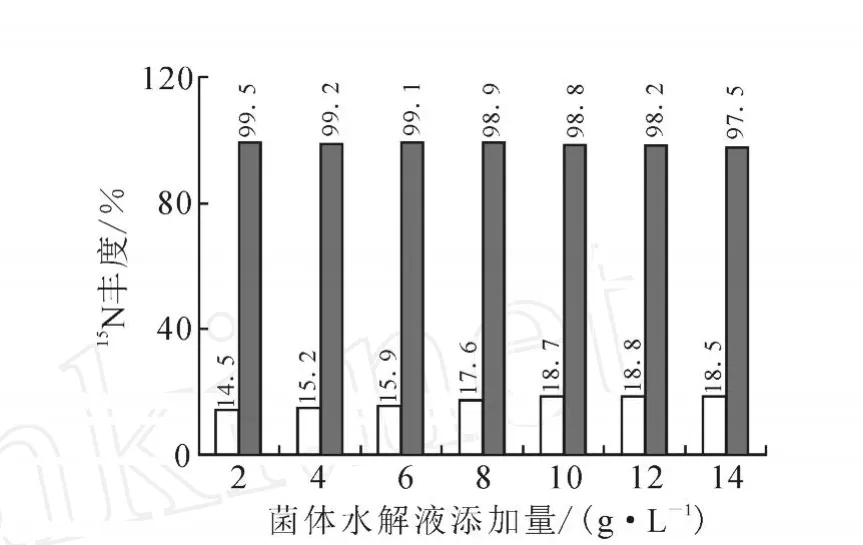
圖3 菌體水解液添加量對發酵產酸、產品豐度影響□——產酸量(g·L-1);■——產品豐度(%)
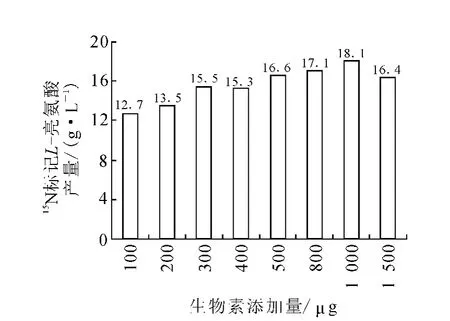
圖4 生物素含量對發酵產酸量的影響
3.6 15 N原料及15 N副產物的回收
發酵過程完畢后,發酵液中含有大量未反應完的15N無機鹽、15N-雜酸以及15N菌泥。根據工藝特性將回收分為兩個階段:發酵階段回收及分離提取階段回收。
發酵階段主要回收15N菌泥。向菌泥中加入NaOH,在200℃下水解2 h,待菌泥中15N有機物變為15N-氨氣時,用硫酸吸收,最后變為15N-硫酸銨。分離提取階段主要回收15N無機鹽、15N-雜酸。離子交換法分離氨基酸過程中會產生帶有15N無機鹽、15N-雜酸的水洗液和洗脫液,將其合并起來,減壓濃縮,再加入NaOH,于200℃下水解,用硫酸吸收。計算15N回收率。由于15N原料價格昂貴,因此需要將未反應的15N原料及15N副產物進行回收,結果列于表3。由表3可見,用此工藝制備15N-L-亮氨酸,15N回收率約為76%,可大大節約15N原料成本。
3.7 同位素15 N豐度實驗
3.7.1 低豐度實驗
考察針對TLU53-8菌種的發酵配方和發酵工藝對15N標記L-亮氨酸的生產實用性,需要進一步進行低豐度15N實驗,驗證豐度下降規律和產酸水平。將TLU53-8菌株從斜面接種于種子培養液中,28℃搖床培養24 h,之后接入發酵培養基中(250 mL三角瓶,裝量25 mL),30℃、220 r/min于巡回式搖床上培養約72 h,直到發酵終止,計算平均產酸量。將上述發酵液合并處理,提取得到15N標記 L-亮氨酸白色晶體,分析提取收率。采用同位素質譜計分析原料15N-硫酸銨同位素豐度,原料15N-尿素同位素豐度,產品15N標記L-亮氨酸豐度;采用高效液相色譜分析產品純度。
結果表明,發酵平均產酸為22 g/L。15N-L-亮氨酸提取收率為70.49%。經質譜分析:原料15N-硫酸銨同位素豐度為10.22%,原料15N-尿素同位素豐度為10.26%,產品15N-L-亮氨酸豐度為9.82%,產品純度經高效液相色譜分析為99.7%。
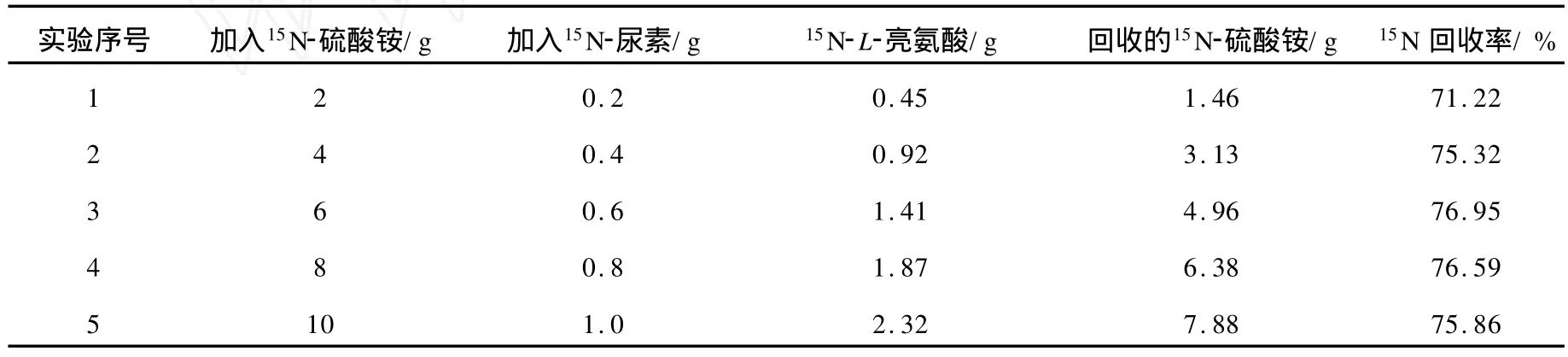
表3 15 N回收率實驗結果
3.7.2 高豐度實驗
所用實驗條件和處理方法與低豐度實驗相同。
結果顯示,15N標記 L-亮氨酸提取收率為68.22%。經質譜分析:原料15N-硫酸銨同位素豐度99.9%,原料15N-尿素同位素豐度99.9%,產品15N標記L-亮氨酸豐度98.41%,產品純度經高效液相色譜分析為99.70%。此結果表明:黃色短桿菌 TLU53-8在最佳工藝條件下,可發酵得到高品質15N-L-亮氨酸。
4 結 語
本研究以選育獲得的突變株黃色短桿菌TLU53-8(帶有 5 種遺傳標記:Met-、Ile-、SGr、а-ABr、β-HLr)出發 ,研究了適用于15N 標記 L-亮氨酸生產的實驗配方、發酵工藝以及提取工藝,通過低豐度和高豐度實驗進一步確認選育的TLU53-8菌株可應用于15N標記L-亮氨酸的生產,發酵產酸>18 g/L,產品15N豐度>98%,純度>99%。優化后的工藝適用于制備高品質15N標記L-亮氨酸。在不受氮源限制的普通發酵過程中,此菌株產酸能達25 g/L。
采取用高豐度菌體水解液代替玉米漿的方法能解決豐度稀釋問題,且能夠保證產酸水平>18 g/L。此法具有通用性,其他同位素標記氨基酸的生產也可借鑒此法。
對發酵及分離提取過程中產生的未反應完的15N原料及15N副產物的回收,可大幅節約15N原料成本。
[1] 張煒明.穩定核素的應用[M].北京:科技出版社,1983:67-203.
[2] 劉占峰,岳海艷,袁其朋,等.同位素標記氨基酸的應用研究進展[J].核技術,2004,27(9):681-686.
[3] Tsuchida T,Momose H.Improvement of an L-leucine-producing mutant of brevibacterium lactofermentum 2256 by genetically desensitizing It to α-acetohydroxy acid synthetase[J].Appl Environ Microbiol,1986,51(5):1 024-1 026.
[4] 張素鑫,宛蘭翠.產L-白氨酸突變株的選育及發酵條件的研究[J].微生物學報,1979,19(2):180-186.
[5] 金妙仁,王水英.L-亮氨酸精制純化技術研究[J].發酵科技通訊,2003,10(4):12-13.
[6] 周德慶.微生物教程[M].北京:高等教育出版社,1997:99-141.

