小檗堿對Toll樣受體2信號通路和炎癥因子的影響
李最瓊(南華大學附屬南華醫院,衡陽市 421002)
小檗堿(Ber)又名黃連素,是一種從黃連植物中提取的苯并異喹啉類季銨型生物堿[1]。Ber可作為一種廣譜抗菌藥物,對多種革蘭陰陽菌、真菌、霉菌、病毒、原蟲和線蟲等具有抑制殺滅的作用,已在臨床上應用多年,常用于治療感染性分泌性腹泄、消化性潰瘍及胃炎、霉菌感染和慢性膽囊炎等,其療效確切,但作用機制還不明確[2]。Toll樣受體2(TLR2)屬于模式識別受體,能識別多種病原微生物的成分,如革蘭陰性和陽性菌的肽聚糖、真菌的酵母聚糖、原蟲的黏蛋白和病毒的包膜糖蛋白等[3]。因此,以TLR2的細菌脂蛋白(BLP)刺激RAW264.7細胞,研究小檗堿對TLR2信號通路和炎癥因子表達情況的影響,不但完善了小檗堿抗菌消炎的機制,而且可為擴大其臨床應用范圍提供理論依據。
1 材料
1.1 儀器
680型酶標儀、PowerPac Basic電泳儀(美國Bio-Rad公司);IX70型倒置顯微鏡(日本Olympus公司);2300型CO2細胞培養箱(美國Sheldon公司);SW-CJ-IF型潔凈工作臺(蘇州凈化設備廠);Megafuge 1.0R型低溫離心機(德國Herculeus公司);DNA/RNA測定儀(英國Pharmarcia公司);GBox-HR DNA/蛋白質凝膠成像系統(英國Syngene公司)。
1.2 試藥
BLP(采用人工合成的細菌脂蛋白Pam3CSK4·3HCl,美國Alexis公司,批號:ALX-165-066-M002);鹽酸小檗堿(美國Sigma公司,批號:D046);抗β肌動蛋白單克隆抗體(Anti-beta-actin mAb)、抗核因子κB 抑制性蛋白(IκB)磷酸化抗體、羊抗鼠IgG、酶聯免疫吸附法(ELISA)干擾素-γ(IFN-γ)、干擾素-α(TNF-α)、白介素-10(IL-10)、白介素-13(IL-13)試劑盒(美國R&D公司);Trizol試劑、DNA marker、預染蛋白marker(美國 Invitrogen公司);TLR2、β-actin引物(上海捷瑞生物工程有限公司);RT-PCR試劑盒(美國Fermentas公司);Premix Taq(大連寶生物工程有限公司);DMEM培養基低糖(干粉)、胎牛血清(美國Gibco-BRL公司);其余試劑均為國產分析純。
1.3 細胞
RAW264.7細胞系購自中國典型培養物保藏中心。
2 方法
2.1 細胞培養
RAW264.7細胞用DMEM培養基培養至對數生長期,用含0.25%胰酶消化,20℃下125 r·min-1離心5 min,收集細胞,調整細胞密度為每1 L含4×108個,并接種于24孔細胞培養板,每孔定容1 mL,于37℃下5%CO2培養箱培養。
2.2 分組和處理
實驗分為3組,即對照、BLP、Ber(100 mol·L-1)+BLP組。對照組加 10 μL PBS;BLP 組加 10 μL BLP(終濃度 1 μg·mL-1);Ber(100 μmol·L-1)+BLP 組先加 10 μL Ber(終濃度 100 μmol·L-1),孵育2 h后再加10 μL BLP(終濃度1 μg·mL-1),每一組均培養至6、12、24、48 h后收集細胞。
2.3 RT-PCR法檢測TLR2 mRNA表達
于對應的時間點(6、12、24、48 h)收集細胞,以Trizol試劑抽提RNA。測定RNA濃度后,取2 μg總RNA,按照試劑盒說明書加試劑,在20 μL體積下,用下列條件:65℃、5 min,65℃、42 min,70℃、5 min進行逆轉錄反應,接著進行聚合酶鏈反應。TLR2引物序列為:上游5′-GCGTTACATCTTGG AACTGTCGGA-3′,下游 5′-AGGAAGACCTTGCTGTTCTCTACTGT-3′;β-actin 引物序列為:上游5′-ATCATTGCTCCTCCTGAGCGCA-3′,下 游 5′-ACTCATCGTACTCCTGCTTGCTGA-3′。按照說明書加試劑,在20 μL體積下,用下列反應條件:94 ℃、3 min,94 ℃、40 s,55 ℃、40 s,72 ℃、1 min,72℃、10 min,30個循環進行聚合酶鏈反應。TLR2、β-actin的擴增產物分別為231、109 bp。經1.5%瓊脂糖凝膠電泳,凝膠分析系統對擴增產物條帶進行掃描,并以TLR2灰度值/β-actin灰度值作為TLR2 mRNA的半定量值。
2.4 Westren-blot檢測IκB的磷酸化水平
于對應的時間點(6、12、24、48 h)收集細胞,PBS 洗2次,裂解液裂解,離心,收集上清液,即細胞總蛋白,用二喹啉甲酸(BCA)法定量測蛋白濃度,用等量蛋白和蛋白上樣緩沖液混合,煮沸,進行十二烷基硫酸鈉-聚丙稀酰胺凝膠電泳(SDS-PAGE),電泳后轉硝酸纖維素膜(NC膜),依次孵抗體,即抗磷酸化IκB抗體和辣根過氧化酶標志的羊抗鼠IgG,發光顯影定影后,用Quantity one分析軟件計算條帶灰度值。
2.5 ELISA檢測炎癥因子的表達
于對應的時間點(6、12、24、48 h)收集細胞培養上清,按照ELISA試劑盒說明書操作,具體的步驟如下:將50 μL稀釋液和50 μL 細胞培養上清分別加入包被有IFN-γ、TNF-α、IL-10和IL-13抗體的96孔板內,封板,室溫孵育2 h,吸出上清后將板拍干,洗板4次,再加100μL辣根過氧化酶偶聯的抗鼠IFN-γ、TNF-α、IL-10 和IL-13抗體,封板,室溫孵育2 h,徹底洗板4次,加入100 μL四甲基聯苯胺(TMB)底物,室溫避光孵育30 min,加入100 μL終止液終止反應,即刻讀取450 nm波長處吸光度。
2.6 統計學方法
3 結果
3.1 Ber對TLR2 mRNA表達的影響
在BLP的刺激下,RAW264.7細胞顯著性高表達TLR2,并隨著刺激時間的延長而增高,具有時間依賴性;100 mol·L-1Ber在6、12 h促進BLP誘導的RAW264.7細胞表達TLR2,但在24、48 h抑制BLP誘導的RAW264.7細胞表達。Ber對TLR2 mRNA表達的影響見圖1。
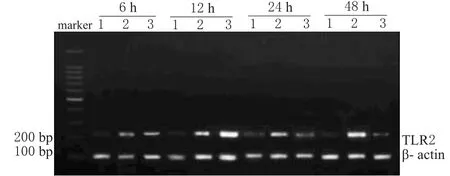
圖1 Ber對TLR2 mRNA表達的影響1.對照組;2.BLP組;3.Ber+BLP組Fig 1 Effect of Ber on TLR2 mRNAexpression1.control group;2.BLP group;3.Ber+BLP group
3.2 Ber對IκB磷酸化水平的影響
在BLP的刺激下,RAW264.7細胞內IκB磷酸化水平顯著增高,并具有時間依賴性;100 μmol·L-1Ber在6、12 h 促進BLP誘導的IκB磷酸化,但在24、48 h抑制BLP誘導的IκB磷酸化。Ber對IκB磷酸化水平的影響見圖2。
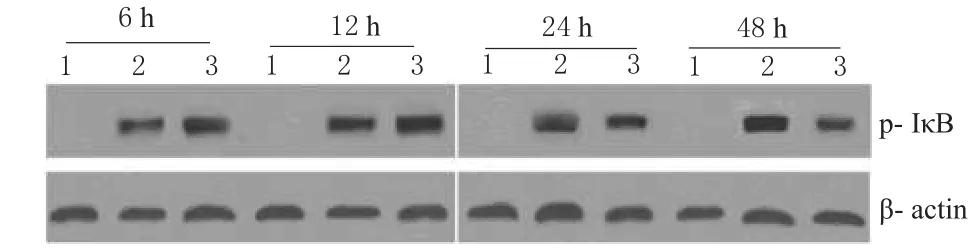
圖2 Ber對IκB磷酸化水平的影響1.對照組;2.BLP組;3.Ber+BLP組Fig 2 Effect of Ber on the level of phosphorylation of IκB1.control group;2.BLP group;3.Ber+BLP group
3.3 Ber對炎癥因子表達的影響
在BLP的刺激下,RAW264.7細胞顯著性高表達IFN-γ和TNF-α(P<0.01),而100 μmol·L-1Ber在 6、12 h 顯著促進IFN-γ和TNF-α表達,但在24、48 h 顯著抑制IFN-γ和TNF-α表達(P<0.01或P<0.05);BLP的刺激不能顯著增加RAW 264.7細胞表達IL-10 和IL-13,但100 μmol·L-1Ber顯著增加BLP刺激的RAW264.7細胞表達IL-10和IL-13(P<0.01或P<0.05)。Ber對炎癥因子表達的影響見圖3。
4 討論
Toll樣受體(TLR)屬于模式識別受體,主要識別病原相關分子模式(PAMP),激活相應的信號通路,誘導炎癥因子的釋放,并激活獲得性免疫系統,最終清除侵入的病原微生物。
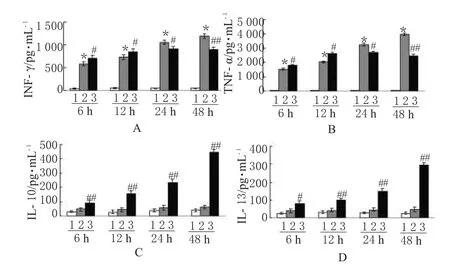
圖3 Ber對炎癥因子表達的影響A.IFN-γ;B.TNF-α;C.IL-10;D.IL-13;1.對照組;2.BLP組;3.Ber+BLP組;與對照組比較:*P<0.01;與BLP組比較:#P<0.05,##P<0.01Fig 3 Effect of Ber on the expression of inflammatory cytokinesA.IFN-γ;B.TNF-α;C.IL-10;D.IL-13;1.control group;2.BLP group;3.Ber+BLP group;vs.control group:*P<0.01;vs.BLP group:#P<0.05,##P<0.01
TLR2是TLRs家族中表達范圍最廣、識別病原微生物及其產物種類最多的分子,可以在細菌、病毒、真菌及其他一些病原體感染中發揮天然免疫作用,并通過其胞內信號轉導而激活獲得性免疫[4]。本研究用Ber作用于BLP刺激的RAW 264.7 細胞,RT-PCR 檢測的結果表明,100 μmol·L-1Ber在6 h和12 h能夠促進BLP刺激的RAW264.7細胞表達TLR2,但在24 h和48 h反而起到抑制的作用。這暗示著Ber可能具有雙向調節的作用。
核因子κB(NF-κB)是細胞內參與多種細胞反應的轉錄因子,如TLR2信號通路的傳導。NF-κB通過與抑制蛋白IκB的結合,以非活性的形式處在胞漿中。當IκB被蛋白激酶磷酸化并降解后,NF-κB釋放,轉移到細胞核內,并結合于特定的DNA位點,啟動相應基因的表達,如各種炎癥因子[5]。本研究中100 μmol·L-1Ber在6 h和12 h 促進BLP 誘導的IκB 磷酸化,但在24 h和48 h卻抑制BLP誘導的IκB磷酸化。結果表明,100 μmol·L-1Ber在早期(6 h和12 h)能夠促進BLP誘導的NF-κB激活,但晚期(24 h和48 h)卻起抑制的作用。
炎癥因子主要分為促炎細胞因子和抗炎細胞因子。促炎細胞因子主要包括IFN-γ和TNF-α等,其過度升高是過度炎癥反應的主要原因;抗炎細胞因子主要包括IL-10和IL-13等。研究表明,感染機體內促炎細胞因子的過度升高,可刺激機體分泌抗炎細胞因子,從而減輕炎癥反應,起到負反饋調節的作用[6,7]。本研究ELISA結果表明,100 μmol·L-1Ber在早期能夠促進IFN-γ和TNF-α的分泌,而晚期卻抑制IFN-γ和TNF-α的分泌,但在后期(12 h、24 h和48 h)顯著性促進抗炎因子IL-10和IL-13的分泌。這可能是過度促炎因子的分泌刺激了抗炎因子的表達,或者是Ber能促進抗炎因子的分泌。但BLP的刺激能誘導促炎因子IFN-γ和TNF-α的分泌,卻不能誘導抗炎因子IL-10和IL-13的分泌,表明IL-10和IL-13的分泌不是由負反饋調節誘導,而是由Ber促進的。
本研究表明,Ber在BLP刺激的早期,能夠促進TLR2的表達、NF-κB的激活和促炎因子IFN-γ和TNF-α的分泌,加強TLR2信號通路的激活,增強TLR2抗病原微生物的作用;但在BLP刺激的晚期,可能是過度炎癥反應時期,Ber反而抑制TLR2的表達、NF-κB的激活和促炎因子IFN-γ和TNF-α的分泌,抑制TLR2信號通路的激活,抑制過度炎癥反應。并且,Ber具有促進抗炎因子的分泌從而能抗菌消炎的作用,但其具體機制有待進一步的研究。
[1]葉寶娜,郝滿良,劉 萍,等.小檗堿的抗炎作用機制[J].中國獸醫雜志,2008,44(3):85.
[2]鄭洪艷,徐為人.小檗堿藥理作用研究進展[J].中草藥,2004,35(6):708.
[3]Trine H,Mogensen.Pathogen recognition and inflammatory signaling in innate immune defenses[J].Clinical Microbiolgy,2009,22(2):2240.
[4]楊芳芳,陳成水.Toll樣受體2的研究進展[J].醫學綜述,2008,14(11):1636.
[5]歐和生,廖端芳,唐朝樞.蛋白磷酸化對胞核因子κB活化的調節[J].中國動脈硬化雜志,1999,7(1):80.
[6]于永洲,王占科,潘小清.可溶性白細胞分化抗原14對嚴重燙傷內毒素血癥小鼠血清促炎和抗炎細胞因子的影響[J].中國藥房,2009,20(4):250.
[7]de Mello LM,Bechara MI,Solé D,et al.TH1/TH2 balance in concomitant immediate and delayed-type hypersensitivity diseases[J].Immunol Lett,2009,124(2):88.

