DL-乙硫氨酸誘導大鼠肝細胞脂肪變性病理模型研究
高 穎,汪恩強,馬玉忠,徐麗娜
(河北農業大學動物科技學院,河北保定071001)
肝臟所含脂質絕大部分為甘油三酯(triglyceride,TG),各種致病因素可導致肝細胞內 TG異常堆積而導致脂肪肝(fatty liver,FL)的發生,同時伴隨肝臟功能紊亂[1]。脂肪肝的發病機制是極其復雜的,它的發生與肝臟TG輸出的相對不足和絕對不足而導致肝臟脂質大量堆積有關[2-3],至今尚不完全清楚。為更好的研究脂肪肝,首先要建立理想的研究模型。目前,對動物脂肪肝的研究主要采用動物體內模型,存在個體差異較大,試驗條件不易控制,整體影響因素眾多、周期較長等缺點,而細胞模型試驗卻可以很好的克服上述缺點,并且能針對性探究脂肪肝發病的細胞機理[4-5]。本文利用DL-乙硫氨酸誘導大鼠肝細胞,對藥物導致肝細胞脂肪變性病理模型進行研究。
1 材料與方法
1.1 實驗動物 SD大鼠,雄性,體重100~150g,清潔級,由河北省實驗動物中心提供。
主要試劑和儀器:預灌流液、細胞洗液,參照參考文獻[6]配制;RPMI-1640培養基(Gibco公司);胎牛血清(杭州四季青生物工程材料有限公司);膠原酶Ⅳ(Sigma公司);DL-乙硫氨酸(北京恒業中遠公司);油紅O(分析純)(上海化學試劑采購供應站分裝廠);蘇木色精(北京化工廠);丙氨酸氨基轉移酶(ALT)試劑盒、天門冬氨酸氨基轉移酶(AST)試劑盒、甘油三酯(TG)試劑盒(中生北控生物科技股份有限公司)。二氧化碳恒溫培養箱(日本SANYO公司);超凈工作臺(德國Heraeus公司);倒置相差顯微鏡成像系統(OLYMPUS公司);光學顯微鏡成像系統(JVC公司);6孔細胞培養板(NUNC公司);A-6型半自動生化分析儀(北京松上技術有限公司)。
1.2 原代肝細胞分離培養[7-9]按二步灌流法獲取肝細胞后,用200目尼龍網布過濾,收集過濾液,以800 r/min離心3 min,去掉上清液,加入 RPMI-1640培養基使細胞重新懸浮,吹打幾次混勻,再離心,如此重復2次。計數細胞總數和細胞活力,稀釋細胞密度至1.5×105個/mL,鋪于6孔板中,每孔放置一塊滅菌的蓋玻片,置于二氧化碳恒溫培養箱中,培養24 h。
1.3 DL-乙硫氨酸處理大鼠肝細胞 待細胞貼壁,培養24 h后,用倒置相差顯微鏡觀察細胞生長情況。將貼壁生長良好的肝細胞分為對照組,5.0 mmol/L DL-乙硫氨酸處理模型組,不換液培養48 h。
1.4 脂肪變性肝細胞染色和分析 培養48 h后,吸掉培養基,取出蓋玻片,同時用冷的 PBS(pH 7.2)沖洗蓋玻片3次,10%中性甲醛固定30 min,用油紅O染色,光學顯微鏡成像系統觀察拍照。按Wada方法進行脂質染色半定量分析,每一塊玻片計數100個細胞。所有數據均以表示,采用SPSS 13.0軟件進行單因子方差分析(One-Way ANOVA),0.01<P<0.05有統計學差異,P<0.01有極顯著性差異。
1.5 生化指標測定 利用生化分析儀分別測定對照組和模型組48h細胞培養基上清液中的ALT,AST活性以及細胞裂解液中的TG含量,方法參照各試劑盒操作說明書進行測定。所有數據均以±S表示,采用SPSS 13.0軟件進行單因子方差分析。
2 結果
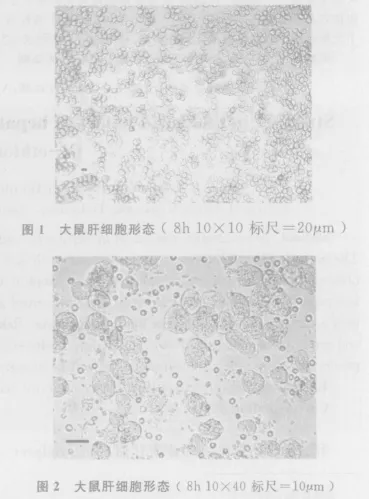
2.1 肝細胞分離與培養 倒置顯微鏡下,新分離的肝細胞呈圓形或橢圓形,胞漿透亮,多成單個分散狀態,少量成團。用0.4%臺盼藍拒染計數顯示,95%細胞排斥染色。細胞接種數小時后,開始貼壁,生長良好,細胞為球形,邊界輪廓清晰(圖1,圖2)。
2.2 脂肪變性肝細胞染色與分析 光學顯微鏡下觀察,對照組細胞邊緣清晰、核大、細胞內少見橘紅色脂滴,顏色淺(圖3);模型組細胞內可見許多橘紅色的脂滴存在,且大部分細胞內含多個脂滴,有的地方染色后模糊成片,顏色深,有的細胞膜邊緣已不完整,與對照組比較有顯著差異(圖4)。Wada方法進行脂質染色半定量分析統計結果(表1),統計數據代表細胞脂滴的面積等于或大于細胞核的面積的細胞,模型組與對照組比較有極顯著差異(P<0.01)。
2.3 DL-乙硫氨酸作用48 h后ALT,AST活性與TG含量 用DL-乙硫氨酸處理貼壁培養的大鼠肝細胞后,均出現不同程度的細胞損傷。肝細胞培養基上清液中生化指標測定結果顯示,作用48 h時,
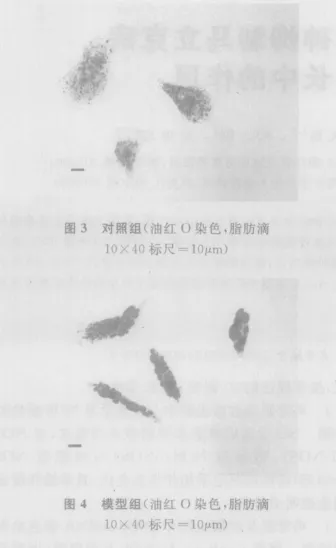
表1 DL-乙硫氨酸對培養的肝細胞作用48 h后Wada方法分析結果(±S,n=6)

表1 DL-乙硫氨酸對培養的肝細胞作用48 h后Wada方法分析結果(±S,n=6)
**:差異極顯著,P<0.01
?
模型組ALT,AST活性升高,與對照組比較差異顯著(P<0.01,P<0.05)。模型組細胞裂解液中TG含量升高,與對照組比較差異極顯著(P<0.01)(表2)。
3 討論
脂肪肝模型建立是否成功,主要看其肝細胞的病理形態與TG含量的變化。在培養基中添加DL-乙硫氨酸培養大鼠肝細胞,發現細胞模型都有一個共同特征:細胞內的TG含量增加了,油紅O染色在光學顯微鏡下顯示為橘紅色脂肪滴顆粒,符合脂肪化肝細胞特點,表明DL-乙硫氨酸作用于肝細胞,能夠使肝細胞脂質代謝紊亂,從生化指標數據看出,TG從0.179 mmol/L增加到1.361 mmol/L,說明細胞內有大量TG聚集,造模成功。細胞膜完整性受到破壞,轉氨酶就會從受損的肝細胞內釋放到培養基中。模型組培養基中ALT,AST的活性比對照組的活性明顯增高,說明DL-乙硫氨酸破壞細胞膜完整性,這在細胞染片中也可反映出來。
生物膜是細胞的基本結構,具有保護細胞的作用。在本細胞水平試驗中,模型組培養基中ALT,AST的活性比正常組的活性明顯增高,說明各濃度DL-乙硫氨酸對肝細胞有一定損傷,同時出現細胞內TG積聚現象,與動物水平的試驗性脂肪肝基本一致,相對動物試驗而言,細胞試驗的影響因素少,可行性高。故認為,細胞水平的試驗可以作為動物水平試驗的補充,二者的有機結合,將為進一步研究脂肪肝的發病機制以及臨床治療藥物的篩選提供有效的途徑。
總之,DL-乙硫氨酸可誘導肝細胞脂肪變性,引起細胞漿中脂肪滴含量增加,從而建立大鼠脂肪肝藥物損傷的體外模型,為在細胞水平篩選治療脂肪肝藥物提供參考模型。
表2 DL-乙硫氨酸對培養的肝細胞作用48 h后ALT、AST和TG的影響(±S,n=6)

表2 DL-乙硫氨酸對培養的肝細胞作用48 h后ALT、AST和TG的影響(±S,n=6)
*:差異顯著,0.01<P<0.05;**:差異極顯著,P<0.01
?
[1]周紅宇,陽學風.瘦素對肝細胞三酰甘油沉積的影響[J].臨床軍醫雜志,2006,3:265-268.
[2]Chitturi S,Farre1l G C.Etio,Pathogenes is of nona1eoholic steatohepatitis[J].Semin Liver Dis,2001,21:27-41.
[3]楊麗英.復方茵陳制劑對動物保肝作用機理的研究[D].福州:福建農林大學,2006.
[4]林青,李立紀,曹東.抗脂肪肝研究的思考[J].云南中醫學院學報,2002,25:41-42.
[5]李儀奎.中藥藥理實驗方法學[M].上海:上海科學技術出版社,1991:462.
[6]徐叔云,卞如濂,陳修,等.實驗藥理方法學[M].北京:人民衛生出版社,2002:5812-5841.
[7]Seglen P O.Solation of hepatocy tes by collagenase perfusion methods[J].Toxicol,1993,1:2312-2341.
[8]徐哲,白雪帆,滕光菊,等.大鼠肝細胞分離、原代培養及生物學特性研究[J].醫學研究生學報,2003,16:342-351.
[9]Pichard L,Raulet E,Fabre G,et al.Human hepatocyte culture[J].Methods in Molecular Biology,2006,320:283-293.

