噻環乙胺及小型豬復合麻醉劑對大鼠不同腦區乙酰膽堿含量的影響
張 燕,王洪斌,范宏剛,盧德章
(東北農業大學動物醫學學院,黑龍江哈爾濱150030)
乙酰膽堿(ACh)是中樞神經系統中重要的興奮性神經遞質,與自主神經系統的調節、肌肉運動、大腦意識與思維、學習與記憶等都有廣泛聯系,對激活并維持腦電和行為的覺醒有重要作用。大量的動物研究表明,抑制ACh在中樞的釋放和傳遞是全麻藥產生中樞麻醉作用的機制之一[1-4]。
噻環乙胺(鹽酸乙胺噻酚環己酮,tiletamine hydrochloride),又名替來他明,為苯環己哌啶類靜脈全麻藥。近年來噻環乙胺逐漸被引入到國內動物臨床麻醉中,但是由于其中樞作用機制不是很清楚,影響了其在國內動物醫學領域的深度開發和廣泛應用。
小型豬復合麻醉劑(XFM)是東北農業大學外科教研室于2007年根據平衡麻醉的原理和小型豬的生理特點,用噻環乙胺復合噻拉嗪和強痛靈等幾種麻醉劑,研制出的一種小型豬專用復合麻醉制劑XFM[5]。
本試驗目的在于通過研究噻環乙胺及XFM麻醉下,大鼠不同腦區ACh的變化情況,探討噻環乙胺及小型豬復合麻醉劑(XFM)麻醉中樞作用的可能機制。
1 材料與方法
1.1 試驗材料及動物 鹽酸噻環乙胺購自法國維克公司(純度99.83%),小型豬復合麻醉劑(XFM)由東北農業大學獸醫外科教研室研制(批號:090425);大鼠專用乙酰膽堿檢測試劑盒購自美國Sigma公司;TGL-16G高速冷凍離心機(上海安亭科學儀器廠),318MC型酶標儀(上海三科儀器有限公司)。Wistar大鼠56只,購自黑龍江中醫藥大學,雌雄各半,體重 200±20 g。
1.2 試驗動物分組 Wistar大鼠56只,先隨機抽取8只為對照組。其余隨機均分為噻環乙胺組和XFM 組,每組又隨機均分為麻醉組、恢復Ⅰ組和恢復Ⅱ組3個亞組,每組8只。對照組大鼠:腹腔注射(ip)生理鹽水2 mL/kg,噻環乙胺組:ip噻環乙胺2 mL/kg,XFM組:ip XFM 2 mL/kg。對照組在注射后5 min斷頭取材,麻醉組、恢復Ⅰ組和恢復Ⅱ組分別在大鼠翻正反射消失即刻、翻正反射恢復即刻和翻正反射恢復后可直線爬行時斷頭取材,投入液氮快速冷凍,在生理鹽水冰面上迅速分離雙側大腦皮層、海馬、丘腦、小腦和腦干,分別稱重后立即-80℃冷凍保存。
1.3 ACh含量的測定 將不同腦區的腦組織投入裝有9倍容積(1/9,W/V)新鮮冷10%三氯乙酸的玻璃勻漿器中,冰浴下勻漿;勻漿液于,10 000 r/min(4℃)離心15 min,取上清液待測。本試驗采用ELISA檢測。
1.4 統計分析 采用SAS 6.12數據統計軟件進行統計學處理,試驗數據以均數±標準差()表示,各組均數的比較采用方差分析。
2 結果與分析
2.1 大鼠麻醉情況 大鼠ip噻環乙胺2 mL/kg后,逐漸表現為行動遲緩、共濟失調、后肢無力、最后倒臥不動、翻正反射消失,進入麻醉期;翻正反射恢復時,大鼠呼吸增快、頭與四肢擺動,努力翻身;恢復反正反射的大鼠,先轉圈或斜線緩慢爬行,最后可直線爬行,但行為依然緩慢。
大鼠ip XFM 2 mL/kg后,麻醉情況與噻環乙胺組基本一致,但麻醉期明顯短于噻環乙胺組,且蘇醒迅速,翻正反射恢復后,很快可以直線爬行。
從噻環乙胺與XFM麻醉全過程可見,噻環乙胺麻醉誘導期短且平穩(無興奮現象),麻醉時間長,蘇醒緩慢;與噻環乙胺比較,XFM麻醉誘導期短且平穩(無興奮現象)(P>0.05)、麻醉時間適宜(P<0.05)、蘇醒迅速(P<0.01)等特點,結果見表1。
2.2 噻環乙胺及XFM對大鼠不同腦區ACh含量的影響 大鼠ip噻環乙胺2 mL/kg后,在麻醉組中,大腦皮層、海馬和丘腦內ACh含量均顯著降低,與對照組比較,分別降低了34.02%(P<0.01)、31.24%(P<0.01)和49.5%(P<0.01);在恢復Ⅰ組中,除了大腦皮層中ACh含量仍未恢復(P<0.05)外,海馬和丘腦中ACh含量均顯著恢復(P>0.05);在恢復Ⅱ組中,上述各腦區內ACh含量均顯著恢復(P>0.05);同時與麻醉組比較,差異顯著或極顯著(P<0.05或P<0.01)。而各組中小腦和腦干內ACh含量均無顯著變化(P>0.05)。
表1 大鼠麻醉情況,n=48) (min)

表1 大鼠麻醉情況,n=48) (min)
**:P<0.01,差異極顯著;*:P<0.05,差異顯著
?
大鼠ip XFM 2 mL/kg后,在麻醉組中,大腦皮層和丘腦內ACh含量均顯著降低,與對照組比較,分別降低了38.47%(P<0.01)和56.42%(P<0.01);在恢復Ⅰ組和恢復Ⅱ組中,上述腦區內ACh含量均顯著恢復(P>0.05),同時與麻醉組比較,差異顯著或極顯著(P<0.05或P<0.01)。而各組中海馬、小腦和腦干內ACh含量均無顯著變化(P>0.05)。結果見表2。
表2 噻環乙胺及XFM對大鼠不同腦區 ACh含量的影響,n=8) (pmol/mg濕組織)
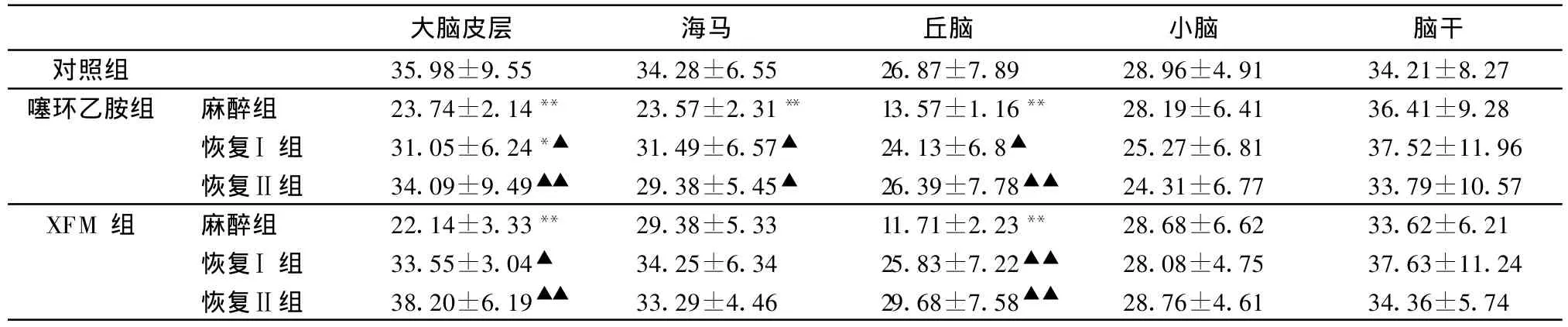
表2 噻環乙胺及XFM對大鼠不同腦區 ACh含量的影響,n=8) (pmol/mg濕組織)
與對照組比較,**:P<0.01,差異極顯著;*:P<0.05,差異顯著。與麻醉組比較,▲▲:P<0.01,差異極顯著;▲:P<0.05,差異顯著
?
從表2中可以看出,在噻環乙胺組中,大腦皮層、海馬和丘腦中ACh含量的變化趨勢與大鼠行為學變化情況基本一致;而小腦和腦干中ACh含量變化趨勢不明顯,與大鼠行為學變化情況無規律可循。在XFM組中,大腦皮層和丘腦中ACh含量的變化趨勢與大鼠行為學變化情況基本一致;而海馬、小腦和腦干中ACh含量變化趨勢不明顯,與大鼠行為學變化情況無規律可循。
3 討論
3.1 由于 ACh本身很不穩定,釋放后極易被AChE水解,而且ACh和膽堿的分子中都沒有生色團、熒光團和電活性基團,因而對ACh的測定很困難[6]。有人應用 ACh合成酶-膽堿乙酰化酶(ChAT)或AChE的活力間接地表示的ACh含量,但AChE主要分布在突觸后膜,并不能準確的代表ACh的分布狀況,而Houser經試驗證實ACh和ChAT的分布在基底前腦、海馬等部位是一致的,但在大腦皮質和丘腦上部等部位則不一致[7]。目前已有不少方法來直接測定ACh,如放射免疫法,靈敏度、特異性高,但需要制備抗ACh,且操作過程繁瑣,重現性不太好;熒光分光測定法,操作簡便,但靈敏度不高;高效液相法,組織樣本處理簡單,靈敏度、特異性強,但測定時需制備成衍生物,且對色譜柱、檢測器電極等的要求高,設備昂貴[9]。本試驗采用ELISA檢測腦組織中ACh的含量,本法操作簡便,靈敏度高(可達pmol水平),特異性強,且對操作人員健康無危害。
3.2 目前還未見有關噻環乙胺及其復合制劑對中樞ACh含量影響的報道,僅有少量關于其同類藥氯胺酮的研究,結果顯示氯胺酮麻醉下丘腦內ACh含量顯著下降[1];孫緒德、袁紅、葛曉群等的研究顯示,安氟醚、水合氯醛、嗎啡均能降低中樞 ACh的含量[3-4,11]。這與本試驗結果基本一致。本實驗結果顯示,大鼠ip臨床相關劑量的噻環乙胺后,大腦皮層、海馬和丘腦內ACh含量顯著降低,而小腦和腦干內ACh含量未見明顯變化;ip XFM 后,大腦皮層和丘腦內ACh含量顯著降低,而海馬、小腦和腦干內ACh含量未見明顯變化。噻環乙胺和XFM麻醉全過程中,ACh含量變化趨勢與大鼠麻醉情況基本一致。這說明噻環乙胺和XFM對中樞神經系統各腦區的作用具有選擇性,大腦皮層、海馬和丘腦可能是噻環乙胺中樞麻醉作用的靶位腦區;大腦皮層和丘腦可能是XFM中樞麻醉作用的靶位腦區。抑制ACh在中樞的釋放和傳遞可能是噻環乙胺和XFM全麻作用的重要機制。XFM對海馬內ACh產生抑制,但并不顯著,分析原因,可能是單獨使用噻環乙胺是可以引起ACh顯著下降,但比較大腦皮層和丘腦,下降程度要小;而噻環乙胺作為XFM 的一種成分與其他幾種麻醉劑復合使用時,其含量沒有單獨使用時多,這樣不足以引起海馬內ACh的顯著下降。
4 結語
試驗結果表明,ACh參與了噻環乙胺和XFM的全麻中樞作用機制。噻環乙胺對大腦皮層、海馬和丘腦內ACh的抑制、XFM對大腦皮層和丘腦內ACh的抑制可能是其產生全身麻醉作用的重要機制之一。
[1]SUN Xu-De,GAO Chang-Jun,ZHANG Hui,et al.Effects of ketamine anesthesia on neurotransmitter metabolism of cerebral gang lion in dogs[J].J Fourth Mil M ed Univ,2008,29(22):2038-2040.
[2]JIA Jing,XU Man-ying.Influence of acetylcholine,atropine,and pilocarpine on the morphologies of neuronsin locus ceruleus of rats in the algesic modulation[J].Journal of Harbin Medical University,2007,41(2):109-111.
[3]葛曉群.嗎啡抑制呼吸與腦中乙酰膽堿含量間的關系[J].徐州醫學院報,1989,2:83.
[4]孫緒德,張惠,徐禮鮮,等.安氟醚麻醉下犬丘腦內神經遞質的變化[J].臨床麻醉學雜志,2006,22(5):365-366.
[5]范宏剛.小型豬復合麻醉劑的研制及其全麻機理的研究[D].哈爾濱:東北農業大學博士學位論文,2008:1-11.
[6]王俏.腦乙酰膽堿分析技術的研究進展[J].浙江省醫學科學院學報,2006,9:32-36.
[7]XU Shao-fen.Neurobiology[M].2nd ed.Shanghai:Fu Dan U-niversity Publishing House,1999:116.
[8]Fujii T,Harada H,Koyama T,et al.Effects of physostigmine and calcium on acetylcholine efflux from the hippocampus of freely moving rats as determined by in vivo microdialysis and a radioimmunoassay[J].Neurosci Lett,2000,289:181-184.
[9]Hanin I.Methods for the analysis and measurement of ACh[J].M odern Methods in Pharmacology,1982,2:9.
[10]YUAN Hong,ZHENG Chun-xiu,XU Jian-lan,et al.Investigation of the changes between the power of neurotransmitter and entropyunder different dose of anesthetization[J].Chinese Journal of physical fitness medicine,2008,10(4):271.

