杉木木質素合成酶基因CCR的克隆和序列分析
陳 喜,童再康,黃華宏,林二培,程龍軍
(浙江農林大學 林業與生物技術學院,浙江 臨安 311300)
木質素(lignin)是一種由肉桂醇等單體聚合而成的酚類多聚體,是維管植物細胞壁的重要組成成分,在木材植物中含量較高,一般約占干重的15% ~ 35%,為地球上僅次于纖維素的有機組分[1]。木質素的生物合成是在一系列酶催化下使苯丙氨酸或酪氨酸逐步轉化為木質素單體,最終聚合成木質素的過程。肉桂酰CoA還原酶(Cinnamyol Co-A Reductase,CCR)是影響木質素合成的一個關鍵酶,負責將各種羥基肉桂酰—輔酶A(CoA)酯最終還原成各種木質素單體,對木質素的合成與代謝也起關鍵作用。木質素總含量和單體組成對植物體的最終用途起著決定性作用。CCR基因除了影響木質素合成,還影響木材的微纖夾角(Microfibral Angle,mfa或MFA),進而導致材質密度和硬度的變異[2],因此對CCR基因進行克隆和研究具有重要的實際意義[3~4]。
杉木(Cunninghamia lanceolata)屬杉科(Taxodiaceae)杉木屬(Cunninghamia),是我國特有的常綠針葉樹種之一。杉木生長快,木材紋理直,結構細,耐腐力強,用途廣泛,又因其萌芽力強,成林迅速,故成為重要的商品用材和造林樹種。建國后,我國加強了杉木科研工作,并取得了重要和豐碩成果[5~8],涉及杉木森林培育、經營、遺傳育種、計測、木材加工利用等領域[9~11],其中杉木遺傳改良研究最為活躍,研究成果及報道文獻最多。
對杉木的CCR基因進行克隆,并與近緣屬樹種進行對比分析發現CCR基因變異情況,以期為杉木育種、遺傳進化及轉基因研究提供基礎遺傳學數據。本文應用RACE(Rapid Amplification of cDNA Ends)等分子生物學方法,獲得杉木木質素生物合成酶CCR基因的全長cDNA序列,并進行生物信息學分析,為CCR的進一步研究奠定基礎。
1 材料與方法
1.1 材料
1.1.1 實驗材料 杉木材料采集于浙江林學院教學實習基地杉木種子園內。樣品采集后,直接于液氮速凍,帶回實驗室,用于mRNA的提取。
1.1.2 試劑 Taq DNA聚合酶、T4 DNA連接酶、DNA凝膠回收試劑盒、RNA逆轉錄試劑盒、克隆載體均購自TaKaRa公司;RACE試劑盒購自Clontech公司;其他試劑為進口或國產分析純;宿主菌為E.coli DH5α,為本實驗室保存。測序由南京金思特公司完成。
1.2 方法
1.2.1 杉木RNA的提取 參考相關的文獻,采用改良的CTAB法進行提取[12~16],具體方法如下:取1 g杉木莖和葉,液氮研磨后用藥匙將粉末加入到65℃水浴的700μL提取液中,用手搖動混勻。然后65℃水浴20 min后冷卻至室溫。加等體積(700μL)的氯仿/異戊醇(24:1),混勻,10 000 r/min,4℃離心10 min。小心吸取上清液,重復上述步驟,直至中間層無白色絮狀沉淀。吸取上清液,加1/4體積的10M LiCl混合,4℃沉淀過夜,然后10 000 r/min離心20 min。棄上清液,用500μL SSTE溶解沉淀,加等體積氯仿/異戊醇混勻(24:1),10 000 r/min,4℃離心10 min。離心吸取上清液,加2倍體積的無水乙醇,-70℃沉淀至少30 min,或-20℃下沉淀2 h。12 000 r/min,4℃,離心20 min,去上清液,用75%的乙醇洗2次12 000 r/min,4℃離心5 min,小心棄上清液,吹干沉淀。用40μL DEPC處理的水溶解沉淀,得到RNA樣品。
1.2.2 CCR基因cDNA部分序列的克隆 cDNA合成:按照反轉錄TaKaRa PrimscriptTM RT-PCR Kit試劑盒(TaKaRa)的說明進行總RNA的反轉錄反應,獲取cDNA。
1.2.2.1 RT-PCR擴增 ①引物設計。根據GenBank中各種植物的CCR基因的核酸序列進行同源性比較,找出保守的區段,依據同源性高和簡并性低的原則,設計一對簡并引物:
引物由上海生工合成;②進行RT-PCR擴增,擴增體系為20μL體系,其中cDNA 2μL,10×PCR buffer 2 μL,2.5 mM dNTP Mixture 0.8μL,5 U/μL TaKaRa Ex Taq HS 0.1μL,10μM Forward Primer 0.2μL,10μM Reverse Primer 0.2μL,ddH2O14.7μL。擴增條件采用Touchdown PCR進行,反應程序:94℃預變性5 min;94℃變性30 s,54℃ 30 s,72℃延伸1 min,共14個循環,每個循環下降1℃;94℃變性30 s,54℃ 30s,72℃延伸1 min,30個循環;最后72℃延伸10 min。RT-PCR產物經1%瓊脂糖凝膠電泳檢測,將回收產物進行目的片斷的克隆和重組子篩選,并將目的基因片段測序鑒定。
1.2.3 杉木CCR基因cDNA片段3’端和5’端的擴增 RACE采用BD SMARTTM RACE cDNA Amplification Kit(BD Biosciences Clontech),方法按照說明書再稍加改良。①RACE引物設計及擴增。反應利用Primer 5.0軟件設計基因特異引物 GSP1:5’>TGCTGGCATTGATGGCAGATGCAG<3’,用于 3’-RACE;GSP2:5’>GGTACGCCGTGTGGTGTTTACATCT < 3’,用于5’-RACE。按Clontech Smart RACE試劑盒說明操作,首先制備RACE-cDNA,然后進行RACE-PCR。用1%瓊脂糖凝膠電泳檢測PCR結果。②RACE產物的克隆測序和cDNA全長獲得。3’RACE產物、5’RACE產物分別用pGEM-T載體連接,經Amp抗性篩選、X-gal/IPTG藍白斑顯色篩選、重組質粒酶切鑒定后,送生物技術公司測序。將3’RACE產物測序結果和5’RACE產物測序結果拼接為杉木CCR基因全長cDNA序列,將此cDNA序列GenBank數據庫進行核苷酸同源性比較分析。利用DNA-STAR軟件分析測序結果的序列與拼接結果的序列,最終將所得到的序列在NCBI的Blast進行比對,核苷酸序列的相似性比對在NCBI的Blastn(http://www.ncbi.nlm.nih.gov/blastn)中分析,并確定開放閱讀框分析(ORF),將其推導相應的氨基酸序列。蛋白質氨基酸相似性比對在NCBI的Blastp中分析;同樣,運用Mega3.0軟件對推導的氨基酸序列與已知報道植物推導的氨基酸序列進行系統進化分析。
2 結果與分析
2.1 杉木次生木質部總RNA的提取
采用CTAB-LiCl法提取杉木次生木質部總RNA,經瓊脂糖凝膠電泳檢測,測得結果見圖1。從圖1中可以看出,提取的RNA質量較好,測定OD260/280為1.87,無DNA污染、無降解,具有清晰的兩條帶,分別是總RNA的28SrRNA和18SrRNA。說明提取的總RNA純度較高,可以用于雙鏈cDNA的合成。
2.2 RT-PCR擴增
以杉木次生木質部cDNA為模板,以CCR-D-U、CCR-D-L為引物進行RT-PCR擴增,產物經1%瓊脂糖凝膠電泳、溴化乙錠染色后觀察(圖2),在750 bp處有一條亮帶,450 bp處有一條較淺的帶,分別將2條帶切膠回收后,克隆出長約750 bp的片段。
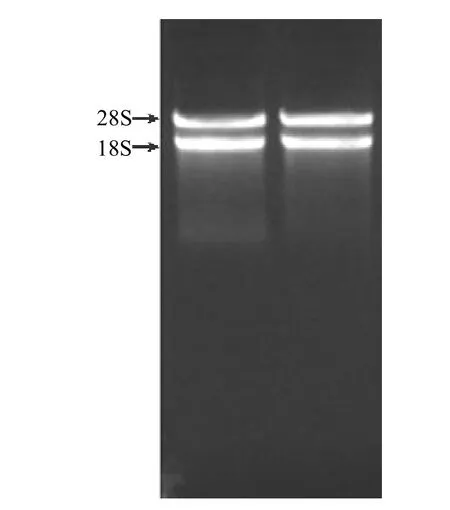
圖1 杉木總RNA的瓊脂糖凝膠電泳分析Figure l Electrophoretic analysis of total RNA isolated from C. lancoealata

圖2 杉木CCR cDNA RT-PCR產物瓊脂糖電泳分析鑒定Figure 2 Identification of the RT-PCR product of C. lancoealata CCR cDNA by DNA agar gel electrophoresis
2.3 RACE產物的分析
利用擴增出的杉木CCR部分序列設計5’端RACE特異引物GSP1和3’端RACE特異引物GSP2,分別用于基因5’端和3’端序列的擴增。經5’和3’RACE分別獲得大小約為800 bp和1 100 bp的PCR產物(圖3),克隆測序發現,5’和3’端序列與已獲得的杉木CCR編碼序列有重疊,為CCR基因mRNA的5’和3’端序列,3個序列經軟件拼接,得到杉木CCR基因完整的cDNA序列,共1 379 bp。然后以拼接得到的CCR全長cDNA設計引物,通過PCR擴增,凝膠電泳分析(圖4)、測序,也驗證了所獲基因的準確性。
2.4 生物信息學分析
2.4.1 杉木CCR基因cDNA全長核苷酸序列的分析 對測序所得到的5’RACE、3’RACE cDNA及中間核苷酸序列進行拼接,得到杉木CCR的全長cDNA,其長度為1 379 bp,該序列的5’端存在57 bp的非翻譯區(UTR),其中975 bp的開放閱讀框(ORF),3’端非翻譯區(UTR)長度為347 bp,其中包括38 bppoly(A)尾巴,該基因編碼324個氨基酸的蛋白(圖5),分子量約為35.71 KD,等電點為6.164。將此cDNA全長序列在NCBI上用BLAST工具進行序列比對,結果表明:該全長序列與己知的松科植物歐洲云杉(Picea abies, AM260972.1)肉桂酰輔酶A還原酶(CCR)基因有83%的最高相似性,與火炬松(Pinus taeda, AY064169.1)、馬尾松(P.massoniana, EU753854.2)等植物的肉桂酰輔酶A還原酶(CCR)基因具有82%的較高相似性,表明了所克隆基因確為杉木的肉桂酰輔酶A還原酶(CCR)基因。

圖3 杉木CCR基因cDNA 5’,3’RACE產物的瓊脂糖電泳分析鑒定Figure 2 Identification of the 5’,3’ RACE product of C.lancoealata CCR cDNA by DNA agrose gel electrophore
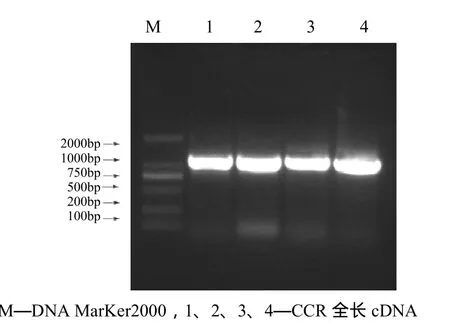
圖4 杉木CCR全長cDNA PCR產物瓊脂糖電泳分析鑒定Figure 4 Identification of the PCR product of C. lancoealata CCR full-length cDNA by DNA agar gel

圖5 杉木CCR基因cDNA全長的核苷酸序列及其推導的氨基酸序列Figure 5 Nucleotide sequence and deduced amino acid sequence of the CLCCR full-length cDNA
2.4.2 杉木CCR基因核苷酸序列與推導的氨基酸序列同源性及系統進化分析 將推測的杉木CCR基因編碼的324個氨基酸序列在GenBank中進行Blast結果表明:該CCR氨基酸序列與數據庫中其它植物的CCR氨基酸序列有高度相似性,其中與己知松科植物的歐洲云杉(CAK18610.1)、馬尾松(ACE76870.3)、火炬松(AAL47684.1)CCR基因氨基酸序列分別具有 87%、84%、84%的相似性;與其他的被子植物如樺木科的光皮樺(Betula luminifera)、楊柳科的楊樹(Populus canadensis)、桃金娘科的桉樹(Eucalyptus robusta)、茄科的有絲茄(Solanum lycopersicum)等的CCR基因氨基酸序列,也有較高的相似性。這表明所克隆基因為杉木的CCR基因。多序列比對結果也進一步表明(圖6),杉木CCR蛋白氨基酸序列與其它高等植物的CCR蛋白氨基酸序列在系統進化上具有高度保守性。
將CCR基因推導的酶蛋白氨基酸序列與其他植物已報道的相應序列用MAGA3.0軟件進行多序列比較,并構建系統進化樹(圖 7)。結果顯示:杉木與松科植物歐洲云杉、馬尾松、火炬松聚為一類,同源性較高,表明同為裸子植物的杉科植物與松科植物在進化上有較近的親緣關系;與模式植物十字花科的擬南芥(Arabidopsis thaliana)以及禾本科植物的水稻(Oryza Sativa)、玉米(Zea Mays)、高粱(Sorghum bicolor)、小麥(Triticum aestivum)同源性次之,但不聚為一類;與楊柳科的楊樹、樺木科的光皮樺、豆科的大豆、葡萄科的葡萄(Vitis vinifera)同源性相對較低,親緣關系較遠。

圖6 杉木CCR氨基酸序列與其他植物的CCR氨基酸序列的多重比較Figure 6 Multiple comparisons of the deduced amino acid sequences of CCR from C. lanceolata and from other plant
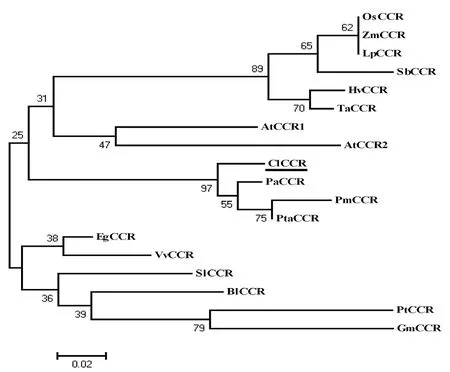
圖7 植物CCR的系統進化樹Figure 7 Phylogenetic tree based on amino acid sequences of CCR from different plants
3 討論
(1)高質量RNA的提取是開展分子生物學研究的最基本也是最重要的基礎步驟,特別是要分離克隆出完整的全長cDNA,獲得完整的、未被降解的大量的RNA顯得尤為關鍵,因為RNA的質量決定著可被反轉錄為cDNA最大的序列信息。
在RNA提取中防止RNA酶對RNA的降解極為重要。在提取RNA過程中要嚴格防止RNA酶的污染,所有塑料制品要用DEPC水處理并滅菌,玻璃器皿干熱滅菌,所用試劑均要做無RNA酶處理。在剝取植物組織時速度要快,盡量減少直接暴露于空氣中的時間,立即投入液氮中研磨。
(2)通過GenBank聯機檢索,根據已報道的CCR基因序列的高度保守區用Primer Primier 5設計簡并引物,再用Oligo6驗證。基因的高度保守區在不同物種中個別堿基的差異給簡并引物的有效使用帶來了困難。雖然在引物設計時考慮到諸多因此,但是究竟能否有效擴增目的片段畢竟還是需要將每一對引物,通過反復優化PCR條件的方法來驗證。因此,得到一對有效的引物可以大大地提高工作效率。
(3)木質素由不同的木質素單體聚合而成。近年來,人們利用分子生物學的手段對參與木質素合成的一些關鍵酶基因進行了研究,對木質素合成過程的關鍵酶進行了克隆,并進一步通過轉基因的實驗對這些關鍵酶對于改變木質素的含量或木質素的組成及化學結構的影響進行了研究。參與木質素合成的酶有許多,CCR作為木質素生物合成的關鍵酶,對于木質素生物合成具有重要作用。本文從杉木木質部中克隆了木質素合成酶CCR基因,通過對該基因的生物信息學分析證明了我們克隆到的基因就是CCR基因,為后續的CCR結構功能鑒定和研究打下了基礎。我們期望通過克隆、鑒定杉木木質素合成基因,能對通過基因工程改變杉木木質素含量以及改良杉木材性方面起到一定的作用。
[1] Zhong R Q,Morrison W H,Himmelsbach D S,et al. Essential role of caffeoyl coenzyme A O-methyltransferase in lignin biosynthesis in woody poplar plants[J]. Plant Physiol,2000(124):563-578.
[2] Hillis W E. Wood quality and growing to meet market requirements[A]. IUFRO. The Future Of Eucalyptus For Wood Products[C]. 2000,Launceston, Tasmania, Australia, 2000. 256-264.
[3] Chen L,Auh C K,Dowling P,et al. Improved forage digestibility of tall fescue (Festuca arundinacea ) by transgenic down-regolation of cinnamyl alcohol dehydrogenase [J]. Plant Biotechnol J,2003,1(6):437-449.
[4] He X,Hall M B,Gallo-Meagher M,et al. Improvement of forage quality by downregulation of maize O-Methyltransferase[J]. Crop Sci,2003,43(6):2 240-2 251.
[5] 陽含熙. 杉木營林的研究[A]. 中國林業科技30年[M]. 北京:中國林業科學院,1979. 164-175.
[6] 俞新妥. 中國杉木研究[J]. 福建林學院學報,1988,8(3):203-220.
[7] 丁蘊一. 中國杉木研究動態[J]. 世界林業研究,1990,3(1):67-74.
[8] 施季森. 杉木文獻引讀及檢索[M]. 上海:上海科學文獻出版社,1992.
[9] 吳火和,葉功富,俞新妥. 杉木栽培制度的基本特征及其可持續發展探討[J]. 福建林業科技,2002,29(1):58-60.
[10] 程朝陽. 杉木人工林無節材培育技術研究[J]. 林業科學研究,2005,18(5):530-534.
[11] 楊玉盛,陳光水,王小國. 皆伐對杉木人工林土壤呼吸的影響[J]. 土壤學報,2005,42(4):584-590.
[12] 宋蓓,趙錦,劉孟軍,等. 改良CTAB-LiCl法提取棗總RNA建立[J]. 中國農學通報,2007,23(7):79-83.
[13] 劉曉菊,洪海波,李敏,等. 改良法提取核桃總RNA試驗[J]. 山東農業科學,2008(1):97-99.
[14] 李菁芳,黃劭毅,田仁鵬,等. 一種適用于RT-PCR的杉樹類植物中總RNA提取的方法[J]. 武漢植物學研究,2004,22(6):551-556.
[15] 李標,王伯初,唐坤,等. 鐵皮石RNA提取及RT-PCR檢測[J]. 中草藥,2006,37(4):585-588.
[16] Jaakola L,Pirttila A M,Halonen M,et al. Isolation of high quality RNA from bilberry fruit[J]. Molecular Biotechnol,2001,19(2):201-203.

