大腸桿菌氨基酰化酶工程菌的固定化研究
大腸桿菌氨基酰化酶(ACY1)工程菌能特異性催化水解N-乙酰-L-氨基酸,主要用于氨基酸的手性拆分。ACY1廣泛存在于動物肝腎組織中和一些微生物體內,這與其生理功能密切相關。目前,普遍認為ACY1在生物體內執行蛋白質代謝后的氨基酸挽救功能。
工業上用于氨基酸拆分的ACY1主要來源于豬腎和黑曲霉,其中豬腎ACY1酶活力較高,但需要從豬腎組織中提取,其來源有限、成本較高。為了擴大豬腎ACY1的酶源,作者運用分子生物學的方法成功構建了大腸桿菌工程菌,能高效表達活力和天然酶相當的重組豬腎ACY1。在此對該工程菌進行了固定化研究,為重組豬腎ACY1在氨基酸生產工業中的大規模應用奠定基礎。
1 實驗
1.1 菌種與培養基
大腸桿菌氨基酰化酶工程菌ROSETTA (DE3)/ pET28a-pacy1,自行構建并保存。
LB培養基( g·L-1):酵母粉5,蛋白胨 10,氯化鈉 10,pH值7.0。
1.2 試劑與儀器
氯化鈉、硼酸、無水氯化鈣、醋酸、醋酸鈉、N-乙酰-L-蛋氨酸、茚三酮、正丁醇、冰乙酸、磷酸二氫鈉、磷酸氫二鈉、葡萄糖、尿素、95%乙醇、FeSO4·7H2O、MgSO4·7H2O、MnSO4·5H2O,分析純;聚乙烯醇(PVA)、海藻酸鈉(SA)、瓊脂,化學純。
2HWY-2112B型恒溫振蕩器;TGL-16C型離心機,上海安亭科學儀器廠;320-S型pH計; U-3000型分光光度計,日本 Hitachi公司;HL-2S型蠕動泵,上海滬西分析儀器廠有限公司;HH-2型數顯恒溫水浴鍋,國華電器有限公司。
1.3 方法
1.3.1 菌懸液的制備
接種重組菌ROSETTA (DE3)/pET28a-pacy1的單菌落于LB 液體培養基中,于37℃、250 r·min-1振蕩培養過夜,次日將過夜培養物繼續于37℃、300 r·min-1振蕩培養至OD600=0.8,加入誘導劑IPTG至終濃度0.2 mmol·L-1,繼續培養3 h,離心收集菌體,并用0.1 mol·L-1磷酸緩沖溶液 (pH值7.0)清洗。于3000 r·min-1、4℃離心3次,洗滌,重懸,制得一定濃度菌懸液,立即使用。
1.3.2 固定化細胞的制備
1.3.2.1 PVA固定化細胞的制備[1]
取9 g PVA加入90 mL水,加熱至沸騰并不斷攪拌至充分溶解,冷卻至室溫,加水定容至100 mL,滅菌,冷卻至40℃,按1∶10的菌膠比將一定濃度的菌懸液加入到PVA溶液中,充分混勻。然后用蠕動泵滴入5%硼酸(用低濃度氫氧化鈉溶液調pH值至7.0)中,固定化24 h。用生理鹽水洗凈,備用。
1.3.2.2 SA固定化細胞的制備
取2 g SA加入100 mL水,在60℃恒溫水浴鍋中加熱溶解,冷卻至室溫,加水定容至 100 mL,滅菌,冷卻至40℃,按1∶10的菌膠比將一定濃度的菌懸液加入到SA溶液中,充分混勻。然后用蠕動泵滴入2%氯化鈣溶液中,固定化24 h。用生理鹽水洗凈,備用。
1.3.2.3 PVA-SA固定化細胞的制備
取11 g PVA和1 g SA,加入100 mL蒸餾水,水浴加熱至溶解并混勻,滅菌,冷卻至40℃,與15 mL菌懸液混合。然后用蠕動泵滴入飽和硼酸-2%氯化鈣溶液中,固定化24 h。用生理鹽水洗凈,備用。改變PVA、SA質量分數及固定劑用量進行固定化。
1.3.3 固定化細胞顆粒機械強度及粒徑測定
1.3.3.1 機械強度測定[2]
機械強度以球徑變化率(X)表征,變化率高則機械強度低。取粒徑相當的多個固定化凝膠顆粒,用干凈濾紙吸去表面的水,均勻置于兩片平面玻片之間,用游標卡尺測玻璃片間距r0,再將50 g的砝碼均勻放置在玻璃片上,用游標卡尺測變化后的玻璃片間距r。球徑變化率X=[(r0-r)/r0]×100%。
1.3.3.2 固定化顆粒體積和平均直徑的測定
取經充分浸潤的固定化凝膠顆粒,用濾紙吸干其表面附著水分,先在量筒內加入一定體積蒸餾水V1,再加入顆粒,此時,總體積為V2。所測的顆粒體積V=V2-V1。
取20粒固定化凝膠顆粒排列成直線,測其總長度,計算固定化凝膠顆粒的平均直徑[3]。
1.3.4 酶活力的測定
ACY1酶活測定采用酸式茚三酮法[4]。(1)吸取2 mL 0.04 mol·L-1N-乙酰-L-蛋氨酸溶液(pH值7.0)加入到試管中,加入0.2 mol·L-1磷酸鉀緩沖溶液(pH值7.0)2 mL,于37℃恒溫水浴中保溫至平衡。(2)在試管中加入1 mL酶液,搖勻,每隔3 min吸取0.5 mL反應液加入已有0.5 mL 0.5%三氯乙酸的試管中,立即搖勻終止反應。(3)各試管中分別加入1 mL醋酸緩沖溶液(pH值5.4)和1 mL 0.5%茚三酮溶液,搖勻后放入90~100℃熱水中,反應15 min,用自來水冷卻約5 min至室溫。(4)每管加入3 mL 60%乙醇,稀釋搖勻,測定OD570值。(5)利用已知濃度的Met溶液繪制標準曲線,根據標準曲線可知反應液中產物的濃度,從而計算相應時間段的酶反應速度。
酶活力定義:在25℃,每分鐘水解1 μmol·L-1N-乙酰-L-蛋氨酸所需的酶量為一個酶活力單位。
2 結果與討論
2.1 固定化載體的選擇
采用不同的固定化載體固定ACY1工程菌,結果見表1。
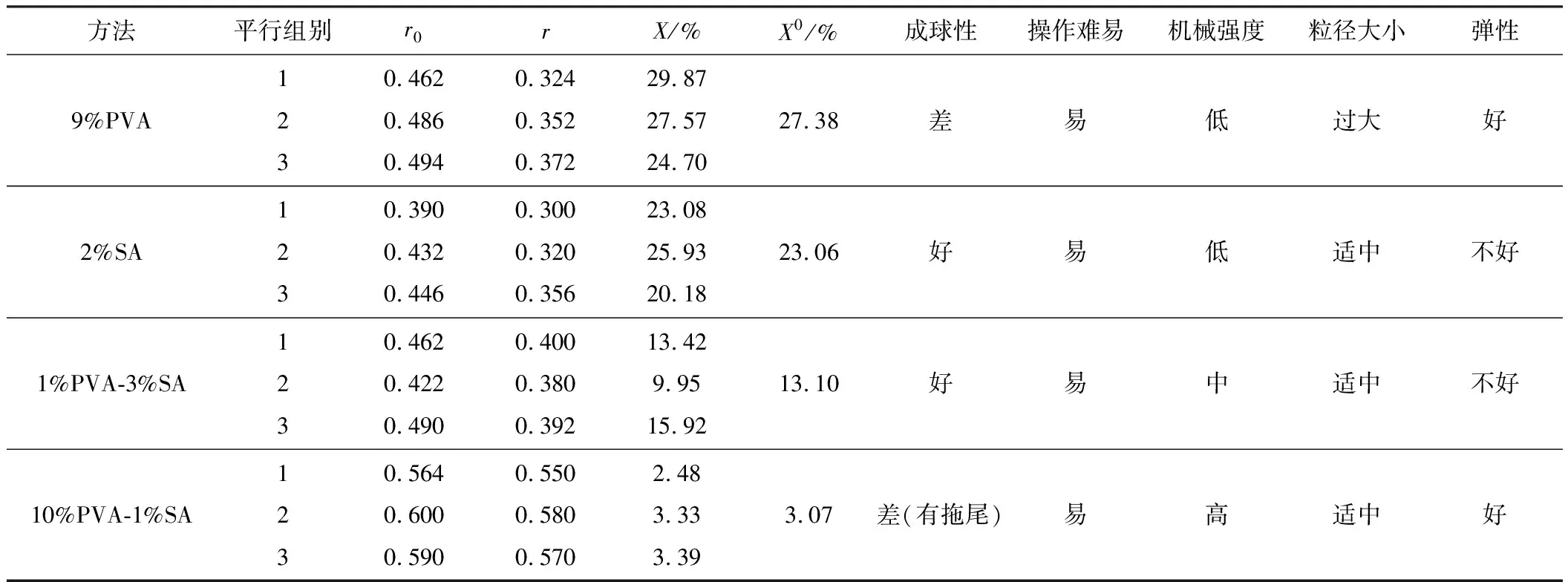
表1 不同固定化載體的固定化效果
由表1可知,9%PVA 固定化細胞顆粒彈性好,但是平均變化率最高,即機械強度最低,且其成球性差,顆粒粒徑過大;2%SA及1%PVA-3%SA固定化顆粒的粒徑大小適中,成球性好,但是彈性不好,其中2%SA固定化顆粒的機械強度也低、1%PVA-3%SA固定化顆粒的機械強度大幅提高;10%PVA-1%SA固定化顆粒的平均變化率為3.07%,其機械強度明顯高于其它三種,彈性也好,受壓后易于恢復,粒徑大小也適中,但其成球性不是很好(出現拖尾),這可以通過改變PVA比例來改善。綜合考慮,選擇PVA-1%SA復合載體來制備固定化顆粒。PVA所占比例較高,可提高彈性,有利于提高機械強度;適當加入少量的SA可使成球性變好,粘連降低,小球機械強度和活性提高;粒徑越小,固定化收率和酶活越高,這是因為較小的顆粒具有良好的擴散性。
2.2 PVA質量分數對PVA-1%SA復合載體固定化效果的影響[5](表2)
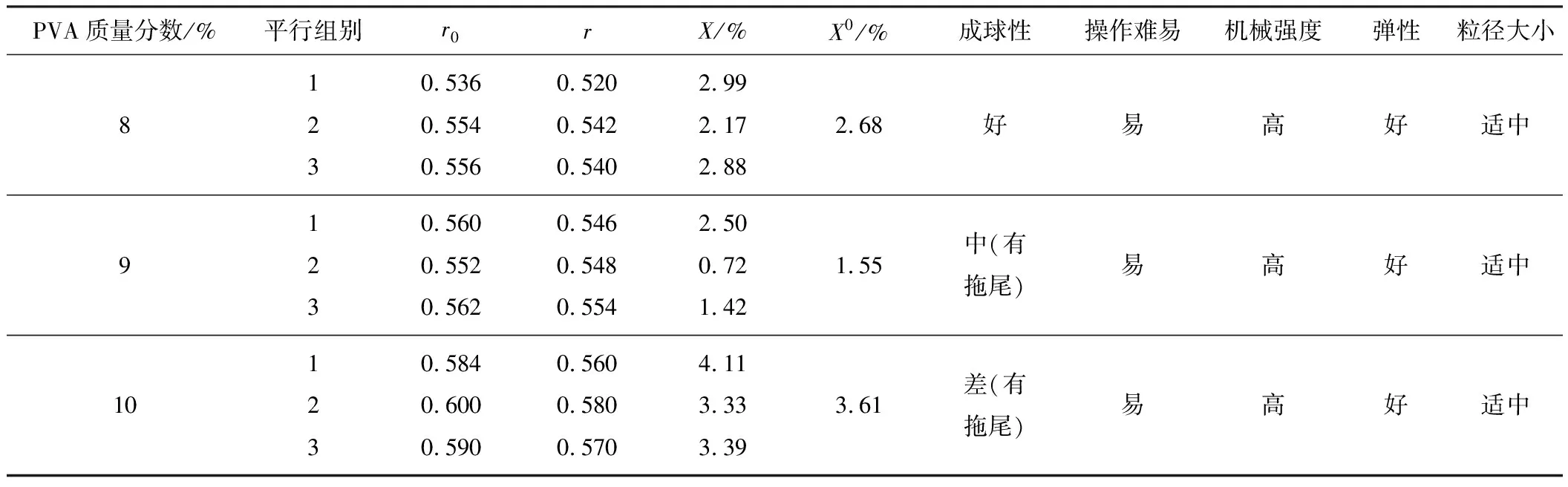
表2 PVA質量分數對PVA-1%SA復合載體固定化效果的影響
由表2可知,PVA質量分數為8%時復合載體的固定化效果最好,因此,選擇8%PVA-1%SA為適宜的固定化材料(分別采用不同質量分數的PVA溶液及1%SA作載體,包埋相同濃度的菌懸液時,當PVA質量分數低于8%時,固定化細胞的機械強度較差,不易成球,在使用過程中容易潰破,所以這里不予考慮)。
2.3 固定劑用量及pH值的選擇
改變固定劑用量及pH值制備固定化顆粒,結果見表 3。
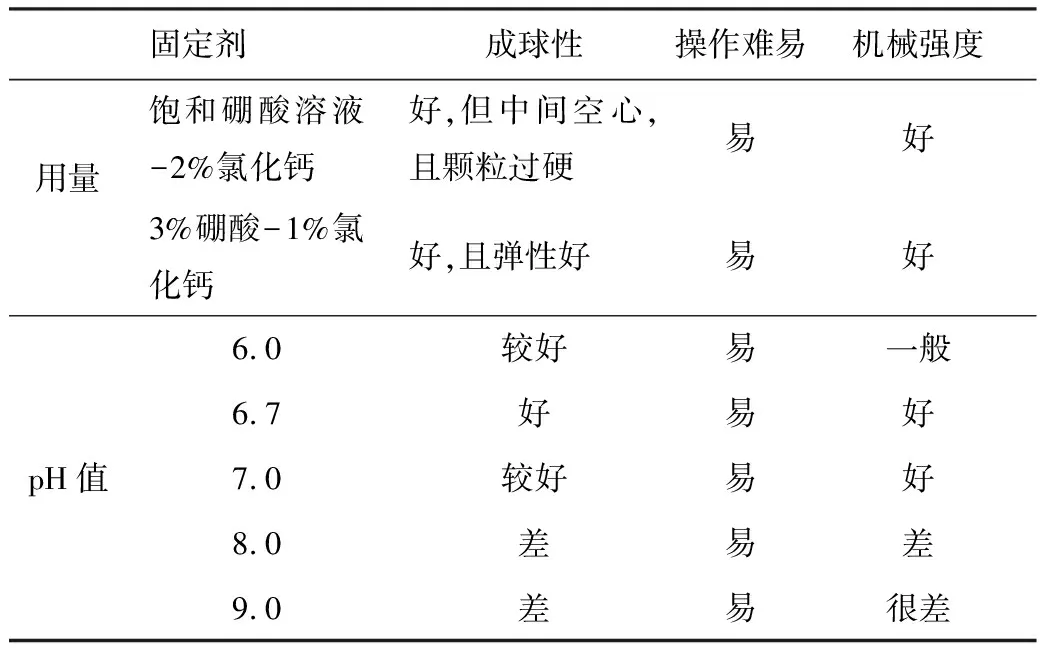
表3 固定劑用量及pH值對固定化效果的影響
由表3可知,適宜固定劑為pH值6.7的3%硼酸-1%氯化鈣。
2.4 固定化細胞與游離細胞酶活力的比較
將相同菌比的固定化細胞和游離細胞按1.3.4方法測定其OD570(本實驗以OD570值表征酶活力大小,其值越高,L-半胱氨酸含量越高,則單位時間內轉化的產物量越高即酶活力越高)。不同保存條件下固定化細胞與游離細胞的OD570測定結果見表4。
據表4中的OD570平均值繪制曲線,以直觀比較固定化細胞和游離細胞的酶活力,結果見圖1。
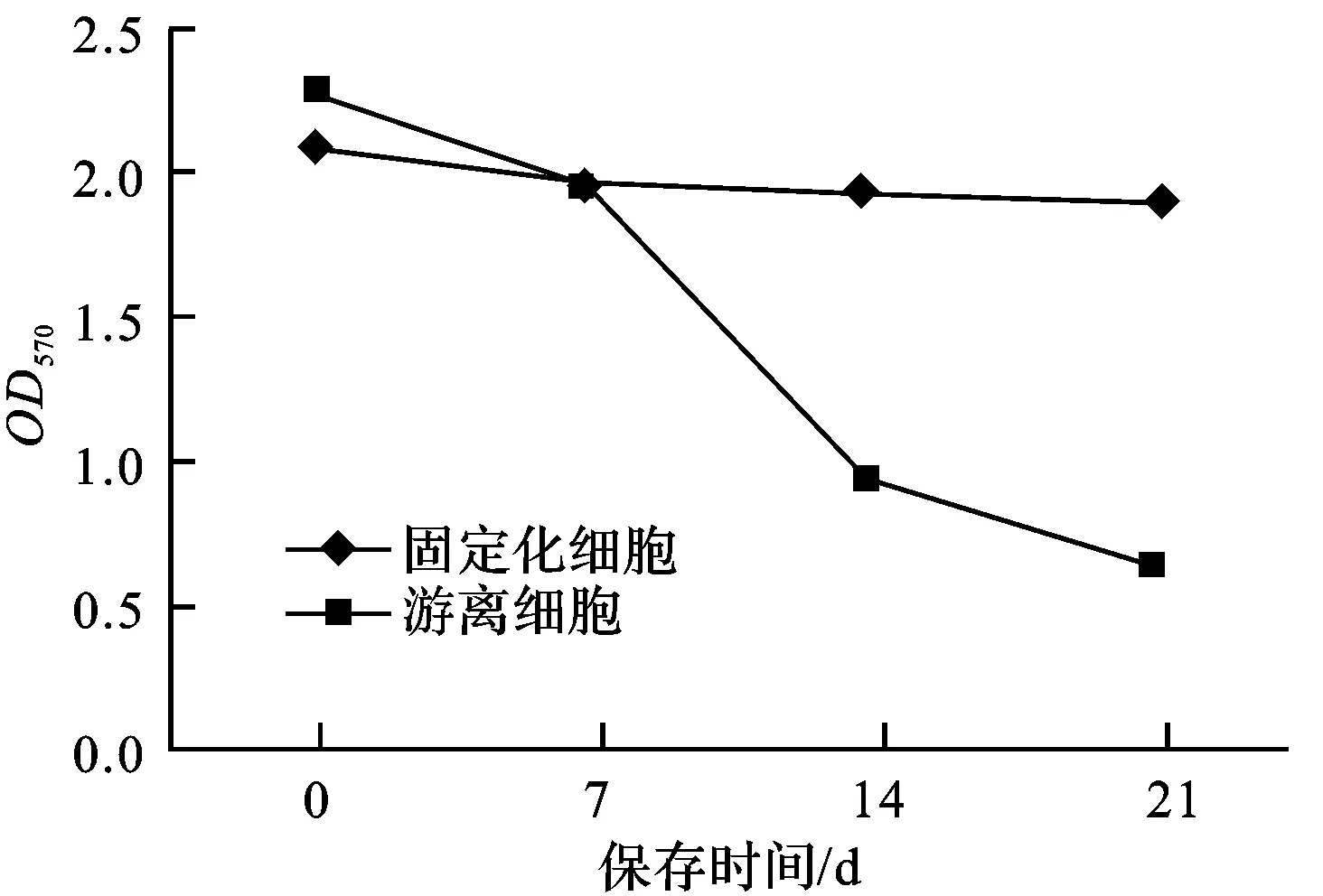
圖1 保存時間對固定化細胞與游離細胞酶活力的影響
由圖1可知,當固定化細胞剛制備出來時,酶回收率(固定化細胞酶活與游離細胞酶活之比)高達91.46%;4℃下保存7 d后,固定化細胞和游離細胞的酶活力均有所下降,但是下降幅度不大,分別為5.37%和13.50%;再室溫保存7 d后,固定化細胞的酶活力下降2.50%,而游離細胞的酶活力大幅下降(降幅51.3%);再室溫保存14 d后,固定化細胞酶活力仍然僅小幅下降,為初始對照的90.76%,而游離細胞的酶活力大幅下降,只有初始對照的29.69%。由此可知,固定化細胞的酶活保留率明顯高于游離細胞,這是因為固定化載體對酶有保護作用[6]。
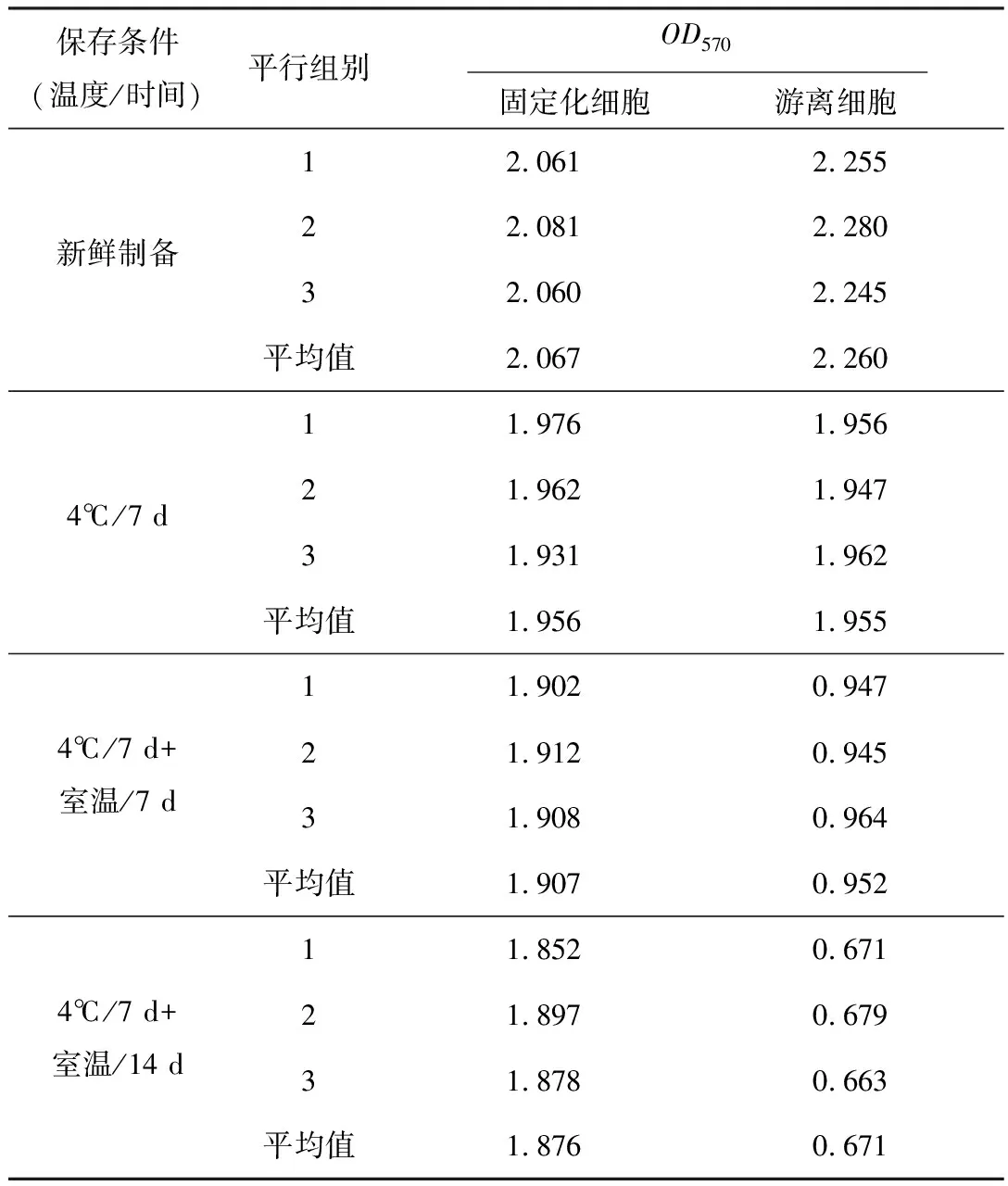
表4 不同保存條件下固定化細胞與游離細胞的OD570測定結果
3 結論
分別以聚乙烯醇(PVA)、海藻酸鈉(SA)及PVA-SA為固定化載體對大腸桿菌氨基酰化酶工程菌進行固定。結果表明,PVA-SA固定化凝膠顆粒具有較好的機械強度和穩定性。確定PVA-SA的最佳包埋條件如下:PVA質量分數為8%,SA質量分數為1%,固定劑為pH值6.7的3%硼酸-1%氯化鈣。此條件下制備的固定化細胞的酶回收率為91.46%。于4℃保存7 d、再室溫保存14 d后,固定化細胞的酶活力為初始對照的90.76%,而游離細胞只有初始對照的29.69%。
參考文獻:
[1] 李峰,呂錫武,嚴偉.聚乙烯醇作為固定化細胞包埋劑的研究[J].中國給水排水,2000,16(12):14-17.
[2] 林海,許平,周虹.聚乙烯醇(PVA)微珠發酵生產木糖醇能力的改進研究[J].四川食品與發酵,2006,42(5):26-31.
[3] Sano K,Yokozeki K,Tamura F,et al.Microbial conversion of DL-2-amino-delta 2-thiazoline-4-carboxylic acid to L-cysteine and L-cystine:Screening of microorganisms and identification of products[J].Appl Environ Microbiol,1977,34(6):806-810.
[4] 周昌平,懷麗華,白鋼,等.酶法轉化DL-ATC合成L-半胱氨酸的酶促反應條件研究[J].生物技術通訊,2006,17(6):911-913.
[5] 王雪梅,于明銳,譚天偉.海藻酸鈉復合載體固定化細胞拆分D,L-泛解酸內酯[J].北京化工大學學報(自然科學版),2006,33(3):28-32.
[6] 鄭迎迎,李大力.殼聚糖載體的制備及脲酶的固定化研究[J].生物技術,2005,15(2):56-59.

