電刺激對紅豆杉懸浮培養(yǎng)細胞產紫杉醇的影響
紫杉醇是紅豆杉屬(Taxusspp.)植物的次生代謝產物之一,可通過促進微管聚合、抑制微管蛋白解聚來抑制腫瘤細胞的有絲分裂,呈現(xiàn)較強的抗癌活性,尤其對卵巢癌、乳腺癌等有良好的療效,臨床應用廣泛。
細胞懸浮培養(yǎng)提供了一種可行的獲得紫杉醇的途徑,但由于植物細胞生長速度緩慢和產生的有效成分含量低,導致生產成本過高,限制了該技術的廣泛應用。因此有必要探索提高懸浮細胞培養(yǎng)產紫杉醇含量的新方法。
電刺激效應對植物愈傷組織的研究始于20世紀80年代[1]。 Rathore等[2]和Goldsworthy等[3]對煙草愈傷組織進行1×10-6A的電流刺激,使生長速率提高70%。王小佳等[4]研究發(fā)現(xiàn)0.67×10-6~2.60×10-6A微電流刺激能促進甘藍 (Brassicaoleraceavar.capitata)愈傷組織分化為芽。250~2000 V的電場脈沖能提高灰大豆、歐洲甜櫻桃[5]、小麥[6]、石防風[7]等作物原生質體生活力和植板率。但電刺激對植物懸浮培養(yǎng)細胞的影響還未見報道。
作者研究了脈沖電刺激及微交流電刺激對處于不同生長時期的紅豆杉懸浮培養(yǎng)細胞的影響,初步探討了電流對紅豆杉懸浮培養(yǎng)細胞的生長及次生代謝的影響,以探索提高紫杉醇產量的新方法。
1 實驗
1.1 材料、培養(yǎng)基及儀器
1.1.1 紅豆杉細胞株
來源于中國紅豆杉(Taxuschinensis)的疏松愈傷組織傳代細胞系,編號C42,自行提供。
1.1.2 培養(yǎng)基
紅豆杉細胞液體懸浮培養(yǎng)基為自行優(yōu)化的MS培養(yǎng)基,簡稱M62培養(yǎng)基[8],其中含NAA 0.5 mg·L-1、6-BA 0.5 mg·L-1、2,4-D 0.08 mg·L-1。
1.1.3 儀器
電極材料為直徑1 mm的不銹鋼絲,電極長5.7 cm、寬0.6 cm,兩電極相距2 cm。電極固定在兩片薄塑料片(可耐高溫、高壓,在培養(yǎng)基中不發(fā)生任何變化)上,一端引出兩條耐高溫滅菌的絕緣導線與儀器的正負極連接,置于250 mL三角瓶中滅菌待用。
Gilson型高效液相色譜系統(tǒng),Waters型高效液相色譜系統(tǒng)。
脈沖電刺激儀器:G6805型治療儀,上海醫(yī)療器械高技術公司;微交流電刺激儀器:FJ-XD11PS型多用信號發(fā)生器,埠陽市應用技術研究所。
1.2 方法
1.2.1 細胞懸浮培養(yǎng)
將M62液體培養(yǎng)基分裝到置有電極的250 mL三角瓶中,每瓶100 mL,121℃ 高壓滅菌25 min。細胞鮮重接種量為10%(質量體積比),于25℃、光照10 h·d-1、120 r·min-1培養(yǎng)。
1.2.2 脈沖電刺激處理紅豆杉懸浮培養(yǎng)細胞
1.2.2.1 脈沖電刺激參數(shù)
脈沖波頻率為100 Hz,即每秒100次;周期10 ms;總峰寬1.56 ms;電場強度25 V·cm-1、75 V·cm-1、125 V·cm-1、175 V·cm-1;刺激時間1 h、3 h、5 h、7 h。
1.2.2.2 不同強度脈沖電刺激處理
紅豆杉懸浮培養(yǎng)細胞生長至第7 d、20 d時,將細胞分為五組,一組為對照組,不進行任何處理;另外四組分別進行不同強度的脈沖電刺激,刺激時間均為3 h,刺激強度分別為25 V·cm-1、75 V·cm-1、125 V·cm-1、175 V·cm-1。研究不同刺激強度下,進行3 h脈沖電刺激處理對紅豆杉細胞的影響。
1.2.2.3 不同時間脈沖電刺激處理
紅豆杉懸浮培養(yǎng)細胞生長至第7 d、20 d時,將細胞分為五組,一組為對照組,不進行任何處理;另外四組分別進行不同時間的脈沖電刺激,刺激強度均為175 V·cm-1,刺激時間分別為1 h、3 h、5 h、7 h。研究不同時間脈沖電刺激處理對紅豆杉細胞的影響。
1.2.3 微交流電刺激處理紅豆杉懸浮培養(yǎng)細胞
在紅豆杉懸浮培養(yǎng)細胞生長的第0 d、7 d、14 d、21 d、28 d,對其進行微交流電刺激,刺激時間為7 d,刺激電流為50 Hz的正弦交流電(用數(shù)字示波器測得其峰值為16.6 V,計算其平均有效電壓為5.8 V)。通過串加不同的電阻,獲得不同強度的刺激電流,分別為18 μA、36 μA、72 μA、126 μA。
1.2.4 細胞生物量的測定
細胞懸浮培養(yǎng)28 d后,收獲細胞并減壓抽濾,稱量細胞質量即為細胞的鮮重(FW);將細胞置于冷凍干燥器中干燥后,其質量為細胞的干重(DW)。
1.2.5 細胞內紫杉醇含量的測定
準確稱取冷凍干燥后細胞100 mg,充分研磨,每次加入3 mL甲醇重復浸提,合并浸提液并減壓抽干,加入氯仿∶水(2∶8)10 mL萃取3次,取氯仿相,減壓除去氯仿,浸膏用1 mL甲醇定容,HPLC測定紫杉醇含量(以每升培養(yǎng)基中紫杉醇的毫克數(shù)表示)。
1.2.6 培養(yǎng)液中紫杉醇含量的測定
取經過抽濾后的細胞培養(yǎng)液20 mL,加入氯仿∶甲醇(1∶1)5 mL,振蕩均勻,靜置后離心,取氯仿相,重復2次,減壓除去氯仿,殘留物質用1 mL甲醇定容,HPLC測定紫杉醇含量(以每升培養(yǎng)基中紫杉醇的毫克數(shù)表示)。
1.2.7 紫杉醇胞外釋放率的計算

2 結果與討論
2.1 脈沖電刺激對紅豆杉懸浮培養(yǎng)細胞生長及產紫杉醇的影響
2.1.1 第7 d脈沖電刺激對紅豆杉懸浮培養(yǎng)細胞生長及產紫杉醇的影響(圖1)
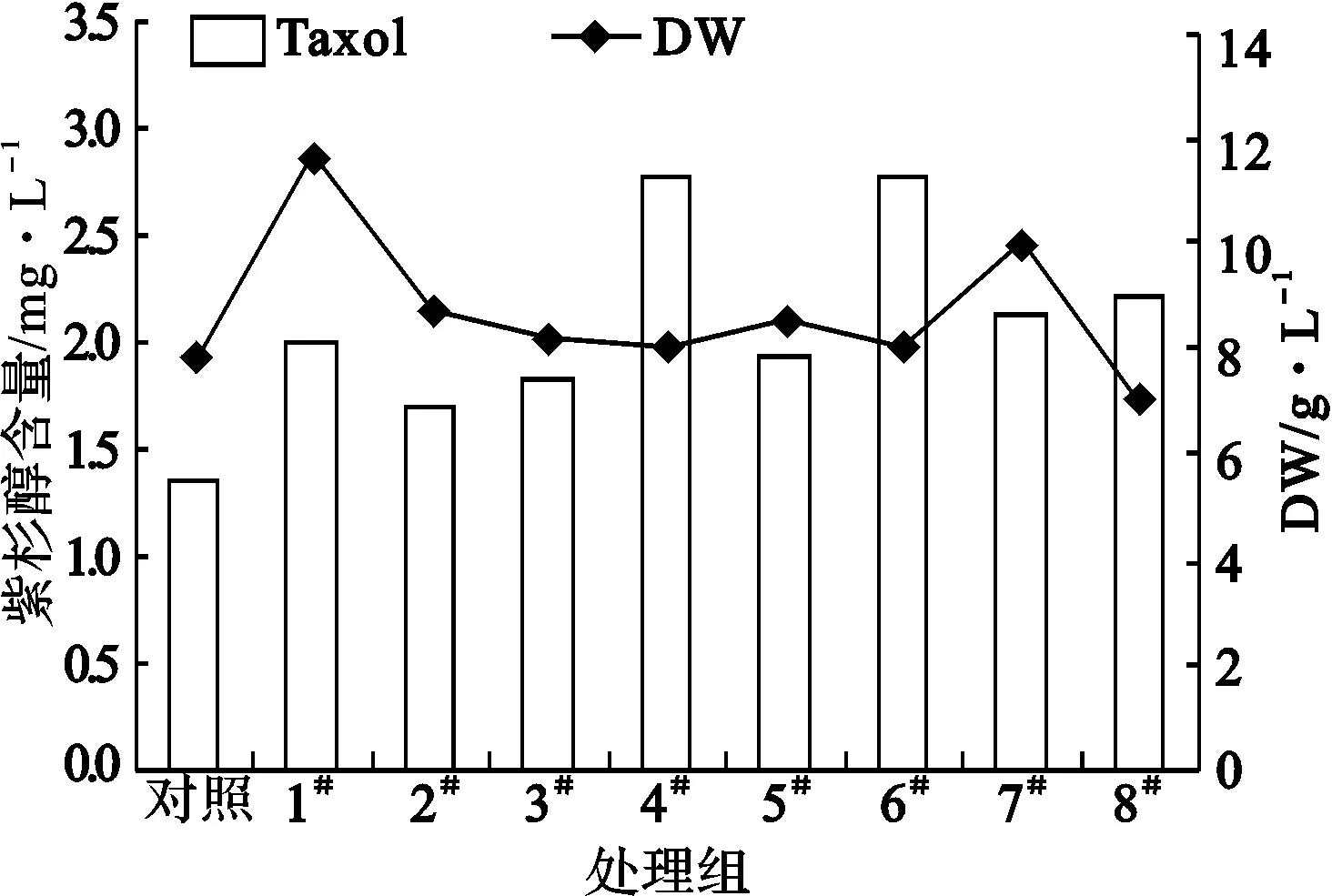
1#.3 h、25 V·cm-1 2#.3 h、75 V·cm-1 3#.3 h、125 V·cm-1 4#.3 h、175 V·cm-1 5#.1 h、175 V·cm-1 6#.3 h、175 V·cm-1 7#.5 h、175 V·cm-1 8#.7 h、175 V·cm-1
由圖1可知,細胞生長第7 d經脈沖電刺激處理后,細胞生物量和紫杉醇含量比對照都有所增加。其中以3 h、175 V·cm-1(4#和6#處理組)處理促進了紫杉醇的產生,含量達到2.82 mg·L-1,是對照的2倍多。
2.1.2 第7 d脈沖電刺激對紅豆杉懸浮培養(yǎng)細胞紫杉醇釋放的影響(表1)
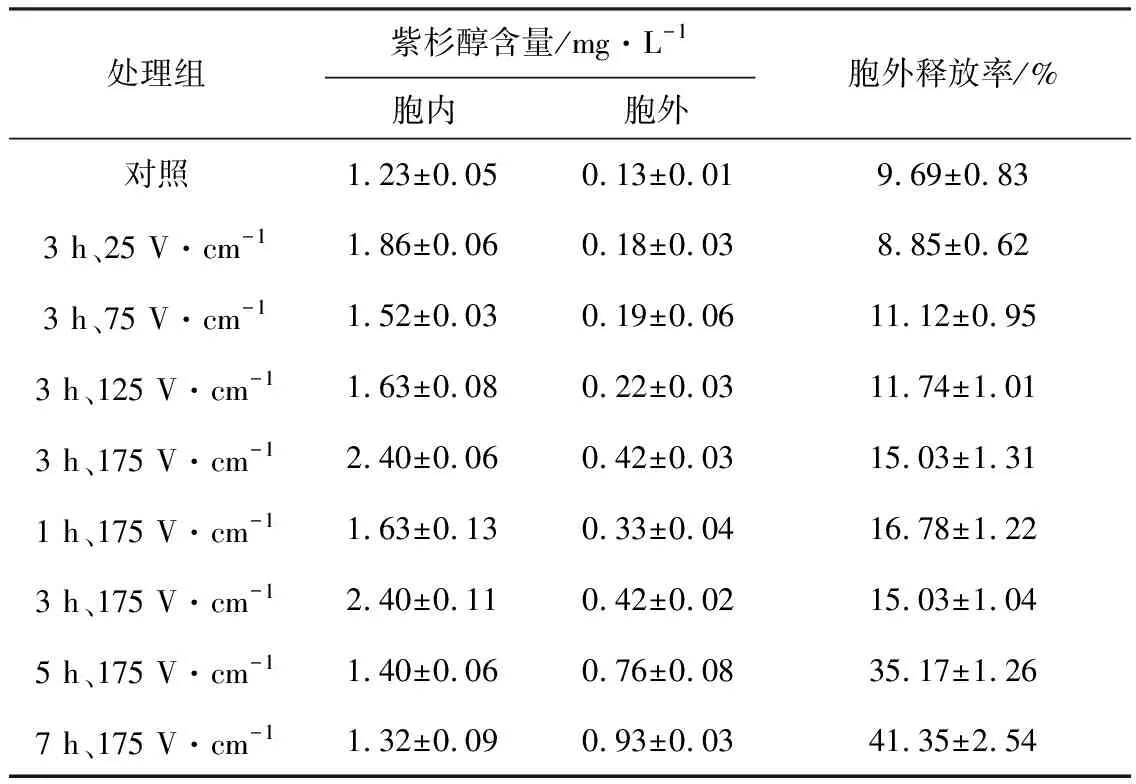
表1 第7 d脈沖電刺激后紫杉醇的胞外釋放率
從表1可以看出,175 V·cm-1下脈沖電刺激處理7 h效果明顯,胞外釋放率達到41%左右,是對照的4.3倍左右。這可能是因為,脈沖電刺激處理使紅豆杉細胞膜相對透性增大,細胞滲透率提高,不但利于紫杉醇的釋放,也增強了對液體培養(yǎng)基中營養(yǎng)物質的利用,經適宜劑量的脈沖電處理后,紅豆杉懸浮培養(yǎng)細胞產紫杉醇由非分泌型轉化為分泌型。
2.1.3 第20 d脈沖電刺激對紅豆杉細胞生長及產紫杉醇的影響(圖2)
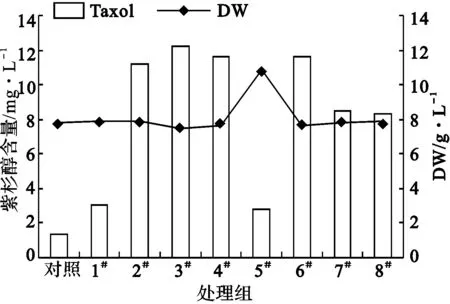
1#.3 h、25 V·cm-1 2#.3 h、75 V·cm-1 3#.3 h、125 V·cm-1 4#.3 h、175 V·cm-1 5#.1 h、175 V·cm-1 6#.3 h、175 V·cm-1 7#.5 h、175 V·cm-1 8#.7 h、175 V·cm-1
由圖2可以看出,各處理組的紫杉醇含量均遠遠高出對照,其中2#、3#、4#、6#處理組細胞紫杉醇含量提高最大,是對照的7~9倍,最高達到12.24 mg·L-1。
2.1.4 第20 d脈沖電刺激對紅豆杉懸浮培養(yǎng)細胞紫杉醇釋放的影響(表2)
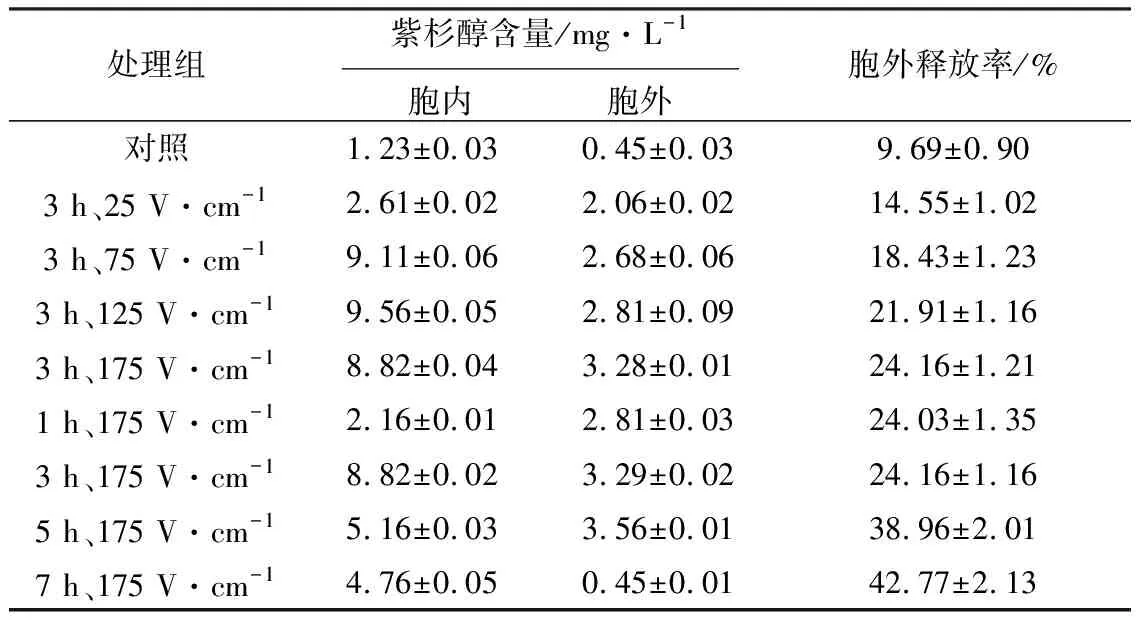
表2 第20 d脈沖電刺激后紫杉醇的胞外釋放率
從表2可以看出,細胞生長到第20 d時進行脈沖電刺激,不同處理均明顯提高了紅豆杉懸浮培養(yǎng)細胞的紫杉醇胞外釋放率,最高可達43%左右,是對照的4.4倍左右,與第7 d相應處理細胞的胞外釋放率類似。
2.2 微交流電刺激對紅豆杉懸浮培養(yǎng)細胞產紫杉醇的影響(圖3)

圖3 微交流電刺激后紅豆杉懸浮培養(yǎng)細胞的紫杉醇含量
由圖3可以看出,在細胞生長的不同時期對細胞進行微交流電刺激,當電流強度低于18 μA時,紅豆杉細胞紫杉醇的含量受電流強度的影響不明顯;當電流強度高于18 μA時,紫杉醇的含量明顯增加,并且不同生長時期微交流電的最佳處理強度不同。在細胞生長的衰亡期(21~28 d)進行微交流電刺激可以大幅提高紫杉醇的含量,最高達5.7 mg·L-1,較未處理細胞提高3倍多。
2.3 討論
目前對電刺激效應機制的認識還處于假說階段,完整的實驗證據(jù)較少,由于所選用的實驗材料和實驗體系不同,各作者的觀點和側重點也不盡相同。就原生質體而言,電刺激的作用可從兩方面考慮,一方面電刺激可能會改變原生質體結構和成分,Ca2+學說認為[3,9]:Ca2+從細胞生長旺盛的一極流入,停留在細胞生長的部位以活化促進生長的酶。另一方面電刺激能改變質膜的滲透性,增強對培養(yǎng)基中各種成分的吸收,導致內源生長激素增加,原生質體生長和分裂加快。對器官培養(yǎng)來說[10,11],電流促進芽分化的實驗說明電控制組織培養(yǎng)中細胞的極性,外加電流通過恢復和加強細胞極性的共調節(jié)作用誘導組織中的器官發(fā)生。
本實驗中,在紅豆杉細胞對數(shù)生長期和穩(wěn)定期,經兩種電刺激處理后的細胞生物量明顯提高,與對照相比,顏色明亮,細胞呈細粉狀,分散性較好,推測是由于細胞與液體培養(yǎng)基的有效接觸面積增大,有利于細胞吸收培養(yǎng)基中營養(yǎng)物質及進行物質能量的交換,從而促進了細胞的生長;紫杉醇胞外釋放率的提高也說明電刺激增加了細胞質膜的通透性。后續(xù)實驗將對電流處理后細胞的相關生理生化指標進行進一步的研究,以明確電刺激對紅豆杉懸浮培養(yǎng)細胞作用的機理。
3 結論
采用脈沖電刺激和微交流電刺激均可促進紅豆杉懸浮培養(yǎng)細胞產紫杉醇,最佳作用時間是在紅豆杉細胞生長的衰亡期,微交流電刺激可使紫杉醇含量提高3倍多,而脈沖電刺激處理組則是對照的7~9倍,最高達到12.24 mg·L-1。說明脈沖電刺激對于促進紅豆杉懸浮培養(yǎng)細胞產紫杉醇更有效。本實驗所用的細胞系屬于非分泌型,經測定培養(yǎng)基中紫杉醇的含量表明,脈沖電刺激可有效提高紫杉醇的胞外釋放率,是對照的4~5倍。
參考文獻:
[1] Dijak M,Smith D L,Wilson T J,et al.Stimulation of direct embryogenesis from mesophyll protoplasts ofMedicagosativa[J].Plant Cell Reports,1986,5(6):468-470.
[2] Rathore K S,Goldsworthy A.Electrical control of growth in plant tissue cultures[J].Nature Biotechnology,1985,3:253-254.
[3] Goldsworthy A,Rathore K S.The electrical control of growth in plant tissue cultures:The polar transport of auxin[J].J Exp Bot,1985,36(7):1134-1141.
[4] 王小佳,王強,宋明,等.甘藍組織培養(yǎng)中微電流刺激效應[J].植物學報,1993,35(S1):56-70.
[5] Rech E L,Ochatt S J,Chand P K,et al.Electro-enhancement of division of plant protoplast-derived cells[J].Protoplasma,1987,141(2-3):169-176.
[6] 戴群,夏光敏,郭光沁.微直流對小麥原生質體形成細胞團的促進作用[J].植物學報,1995,37(2):162-164.
[7] 李忠誼,陳惠民.石防風原生質體再生植株[J].植物學報,1987,29(5):354-356.
[8] 梅興國,董妍玲,潘學武.紅豆杉抗苯丙氨酸細胞系的篩選及懸浮培養(yǎng)特性[J].天然產物研究與開發(fā),2001,13(5):9-12.
[9] 李大輝,施國新,丁小余,等.Cd2+、Hg2+對菱幼苗生長及其超氧化物歧化酶、過氧化物酶活性的影響[J].武漢植物學研究,1999,17(3):206-210.
[10] Jaffe L F.Electrophoresis along cell membranes[J].Nature,1977,265(5595):600-602.
[11] Li Zhongyi,Tanner G J,Larkin P J.Callus regeneration fromTrifoliumsubterraneumprotoplasts and enhanced protoplast division by low-voltage treatment and nurse cells[J].Plant Cell,Tissue and Organ Culture,1990,21(1):67-73.

