伏立康唑治療侵襲性肺曲霉病4例
叢 琳, 張文娟, 李 召, 楊少嬋, 肖 靜
病例資料
病例1,男,48歲。患者 2007年9月因“面色蒼白,乏力1個月余”于2007年10月18日入院。行骨髓穿刺檢查,確診為急性粒單核細胞白血病(AM L-M4)。于10月6日、11月6日和12月6日 先后給予柔紅霉素+阿糖胞苷(DA)、阿克拉霉素+阿糖胞苷(AA)和大劑量阿糖胞苷(Ara-C)方案化療3周期,化療后3 d出現發熱,最高體溫 39.1℃,伴咳嗽、咳痰。中性粒細胞缺乏<0.5×109/L持續時間為18 d。先后給予哌拉西林、頭孢哌酮抗感染。12月7日雙肺CT檢查示右下肺可見密度增高的結節實變影、病灶周圍可見“暈輪征”(halo sign),考慮侵襲性肺曲霉病(見圖1),半乳甘露聚糖(GM)試驗陽性(北京道培醫院檢驗)。給予兩性霉素B抗真菌治療,1周后體溫開始下降,但因嚴重的低血鉀、惡心、嘔吐、食欲不振等不良反應,改為伏立康唑0.2 g每日2次口服,1周后體溫恢復正常,3個月后復查胸部CT,病灶消失。出院診斷:1.AM L-M4;2.侵襲性肺曲霉病。
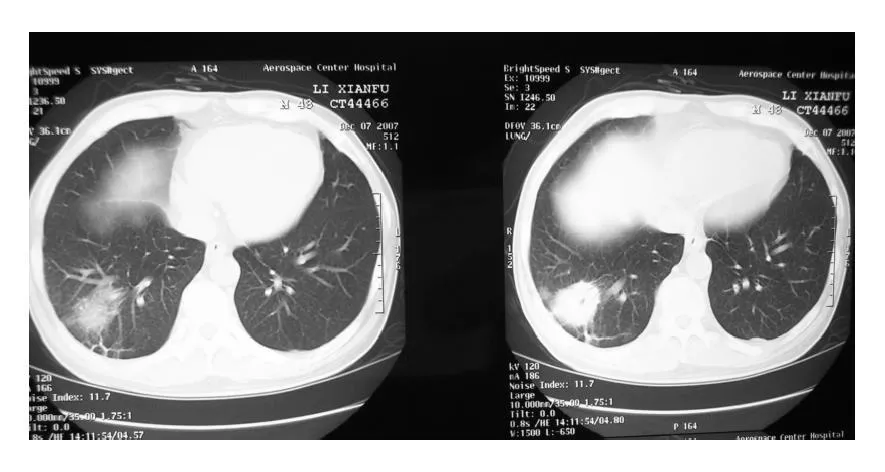
圖1 病例1CT顯示右肺底高密度結節伴暈輪征FIG.1.Case 1.CT scan showed high density node at the bottom of the right lung,with “halo sign” around
病例2,男,40歲。反復感冒發熱病史3個月,伴齒齦腫痛1周于2009年12月30日入血液科。患者既往健康。近3個月有疲勞、乏力、反復感冒發熱史,自服感冒藥物治療,于1周前無明顯誘因再次出現高熱畏寒,體溫達到39.1℃,雙肺未聞及干濕性啰音,腹軟,肝脾未觸及。化驗血白細胞及血小板明顯減低,中性粒細胞絕對值<0.5×109/L,持續時間為21 d。于2009年12月31日、2010年1月5日2次行骨髓穿刺示:胸骨、髂骨增生明顯減低,骨髓小粒中以非造血細胞為主。1月8日骨髓活檢結果:符合再生障礙性貧血。患者的全血細胞進行性下降,中性粒細胞降為0,持續4 d。網織紅細胞絕對值<15×109/L。2010年1月3日胸部CT檢查示:左肺下葉內見一結節狀高密度影,形態欠規整,周圍見磨玻璃影,內密度均勻,大小約18 mm×22 mm。1月5日、8日做血培養、痰培養、尿培養及骨髓培養均為(-)。CMVIgG(-)、EBVIgG和 IgM(-)。初步診斷:①全血細胞減少原因待查。重型再生障礙性貧血(SAA)?急性造血功能停滯?②肺內感染(細菌?真菌?)。給予美羅培南(1.0 g,每8小時1次)、萬古霉素(1.0 g,每12小時1次)、伏立康唑(第1天400 mg,第2~7天 200 mg),丙種球蛋白25 g/d×3 d。粒細胞集落刺激因子300 μ g每日1次,連續3 d后改300 μ g每日 2次靜脈滴注。癥狀明顯好轉,用藥2周體溫開始下降,3周后血象開始好轉,中性粒細胞恢復正常。改為伏立康唑200 mg每日2次口服。于10 d后(1月14日)再次復查胸部CT示:左下肺仍見一圓形高密度影,形態欠規整,周圍見短毛刺影,內密度不均勻,可見低密度氣體影,其大小較前片(1月3日)增大。于1月 25日、3月18日再復查胸部CT示左下葉病變較前明顯縮小(見圖2)。1月25日復查骨髓細胞形態:骨髓增生旺盛,粒、紅、巨核三系均增生良好。修正入院診斷:①急性造血功能停滯;②侵襲性肺曲霉病。目前已停服伏立康唑治療,隨訪中。
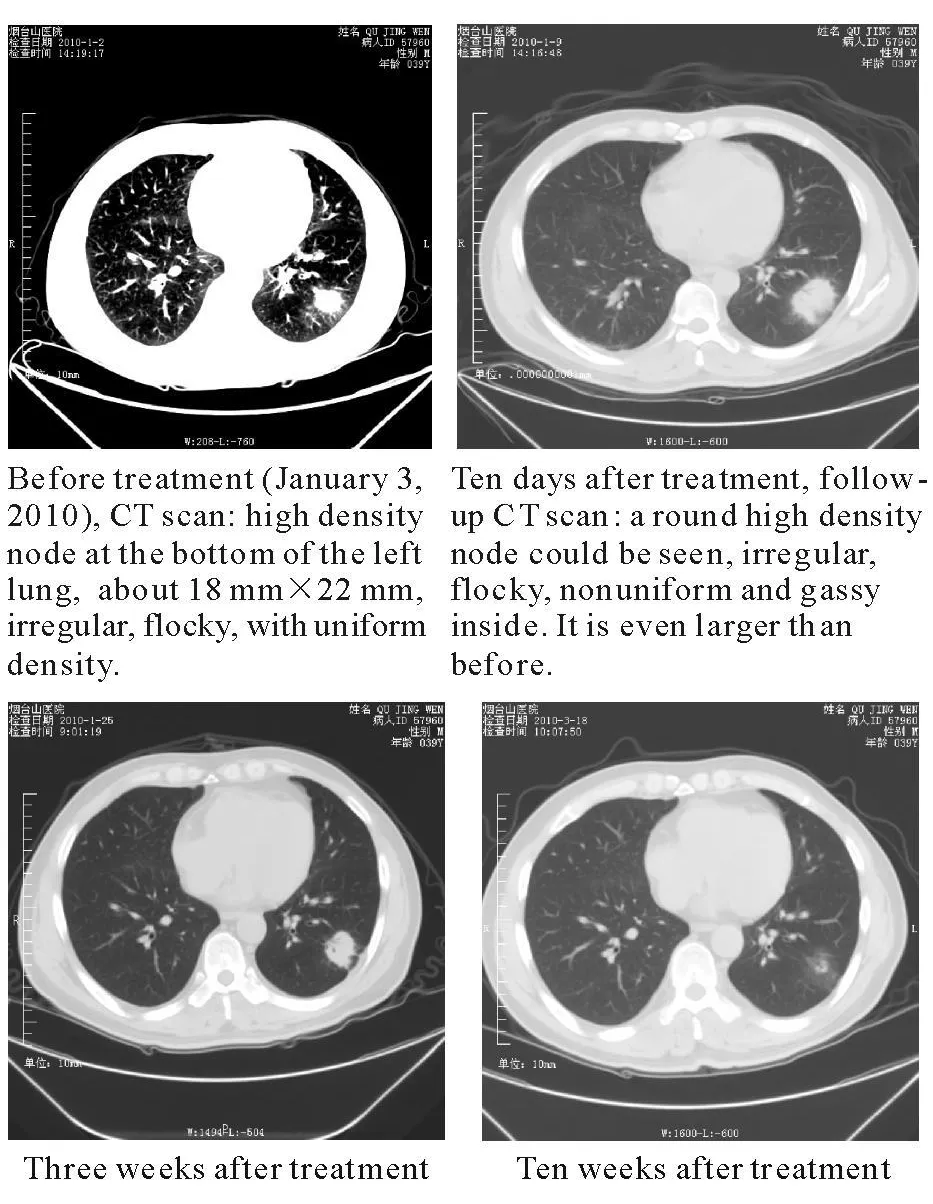
圖2 病例2,治療前及治療3,10周后CT顯示結節,左肺底新月形氣影,較前明顯縮小FIG.2.Case 2.Before and three,ten weeks after treatment,CT scan showed the node,air crescent sign at the bottom of the left lung,much smaller
病例3,女,56歲。因確診急性粒單核細胞性白血病(M4b)8個月,發熱2 d,于2009年8月28日收入血液科病房。于2007年11月曾行化療且有侵襲性真菌感染史。入院前有干咳、少痰,伴左側胸痛。體格檢查 體溫39.5℃ ,全身皮膚黏膜可見散在瘀斑,左上肺呼吸音低。化驗血中性粒細胞絕對值<0.5×109/L,持續10 d,胸部CT檢查示:左肺上葉可見團片狀高密度影,邊緣模糊,其內密度不均。右肺見一類圓形高密度影,內密度不均勻,可見低密度氣體影(見圖3)。于2009年 9月 28日痰培養:曲霉生長。給予伏立康唑第1天400 mg每日2次,第2~14天200 mg每日 2次靜脈滴注,10月7日腹部CT檢查示:脾臟增大,其內見散在斑片狀低密度影,邊界模糊。痰培養有銅綠假單胞菌生長。先后給予亞胺培南、頭孢哌酮-舒巴坦治療,仍反復發熱、左上胸痛,以后又出現腹部疼痛,呼吸困難,血氧飽和度下降,咯血、嘔血,于2009年 11月21日意識不清,呼吸循環衰竭死亡。自發病至死亡共生存13個月。最后診斷:①AM L-M4b;②侵襲性肺曲霉病。
病例4,女,57歲。因診斷再生障礙性貧血10年,發熱10 d于2010年1月2日入院。發熱39℃,雙肺散在干濕性啰音。中性粒細胞絕對值 <0.5×109/L,持續 12 d。入院后先后血培養出銅綠假單胞菌(1月5日)、痰培養出大腸埃希菌(1月20日)。先后給予頭孢哌酮-舒巴坦、亞胺培南抗感染。X線胸片示:兩側肺野透光度減低,雙肺中下野可見片狀密度增高影,邊緣模糊。于1月13日行支氣管鏡檢查見各葉段支氣管開口通暢,未見新生物和狹窄,于左上葉支氣管腔內側壁可見一乳白色不規則物突出,鉗取后基底部可見黏膜壞死樣改變,管腔內可見泡沫樣分泌物,黏膜色澤蒼白。左上葉管腔內不規則物病理檢查:見散在菌絲樣結構,部分菌絲略呈銳角分支(見圖4)。支氣管灌洗液培養有曲霉生長。給予伏立康唑0.2 g每日2次口服治療,癥狀未見明顯緩解,診斷后第28天,因患者極度衰竭,低蛋白血癥、嚴重低氧血癥,家屬放棄治療出院。出院診斷:①再生障礙性貧血;②侵襲性肺曲霉病。

圖3 病例3,CT顯示右肺空氣新月征FIG.3.Case 3.A mass of high density could be seenin upper lobe of right lung,with undefined border and nonuniform inside.And a round mass was seen at the right lung,which was also nonuniform and gassy

圖4 病例4,支氣管鏡檢及病理表現FIG.4.Case 4.Bronchoscopy and pathological exminations
討 論
按照“曲霉病的治療:美國感染病學會臨床實用指南”[1]的診斷標準,即侵襲性肺曲霉病(IPA)的診斷,按確診程度分為確診(proven)、擬診(probable)和疑似(possible)。該指南中IPA僅包括確診和擬診病例。確診病例需要組織病理學依據或自正常無菌部位標本曲霉培養陽性。擬診病例需要宿主因素、臨床依據(癥狀、體征和影像學特征)和微生物特征。微生物檢查滿足以下條件:合格的痰標本涂片找到真菌孢子和菌絲,特別是分隔菌絲,連續2次以上;痰真菌培養曲霉陽性連續2次以上。上述4例均為血液病患者,有嚴重的中性粒細胞缺乏及血小板的減少,故不宜進行經皮肺組織穿刺獲取組織病理學依據。僅病例4行支氣管鏡鉗取左上葉支氣管腔內側壁黏膜壞死組織行病理檢查:見散在菌絲樣結構。按上述診斷標準,4例患者均為擬診病例。均有宿主因素:4例均為血液病患者,其中2例急性粒單核細胞白血病、1例急性造血功能停滯和1例再生障礙性貧血。均有中性粒細胞缺乏、發熱,體溫>38℃以上應用廣譜抗生素治療效果欠佳和長期化療史、免疫力嚴重低下;有臨床依據:咳嗽、咯痰、胸痛及典型的肺CT影像改變(暈輪征和空氣新月征)。除病例1為GM 試驗(+)外,其余 3例患者均未做此項檢測。病例3、病例4分別做痰曲霉和支氣管肺泡灌洗液曲霉培養(+),病例4支氣管腔內壞死物組織病理可見散在菌絲樣結構,部分菌絲略呈銳角分支。
伏立康唑是第二代三唑類抗真菌藥物,對IPA抗菌效力強(平均MIC 0.19~0.58 mg/L),口服制劑生物利用度達96%,推薦劑量為靜脈用藥每次6 mg/kg,每12小時1次,維持4 mg/kg,每12小時1次,14 d后序貫口服200 mg,每日2次。
侵襲性真菌感染(IFI)是一種嚴重的破壞性疾病,在惡性血液病及中性粒細胞絕對值減少(<0.5×109/L)患者中的發生率逐年增加,尤其是曲霉和其他血管侵襲性真菌所致的IFI,盡管積極治療,病死率仍然相當高[2]。究其原因,其一,IFI的早期診斷困難,確診后的IFI病死率高達40%~90%,平均60%;其二,患者對抗真菌治療的耐受性降低,全身狀況差,常同時有多個臟器功能不全;其三,對抗真菌藥物的耐藥性增加[3]。4例患者加之混合其他細菌感染,故早期診斷相當困難。據報道曲霉培養陽性率較低[4]。由于曲霉與支氣管大多不連通,故咳痰不多,痰液檢查曲霉常無陽性發現[5]。有報道患 IPA的 AIDS患者痰培養陽性率12%[6],血培養陽性率低于 5%[7],支氣管肺泡灌洗液(BALF)培養陽性率40%~50%[8]。因此免疫力低下患者,中性粒細胞減少或缺乏的患者,具備使用廣譜抗生素及免疫抑制劑等高危因素,體溫不能控制,高度懷疑IPA[9],應開始經驗性抗曲霉治療。當胸部螺旋CT檢查同時顯示特征性的“暈輪”和“空氣新月征”時則可擬診為IPA,進行臨床診斷性和搶先性抗曲霉治療[1]。
[1] Walsh T J,Anaissie EJ,Denning DW,et al.Treatment of aspergillosis:clinical practice guidelines of the Infectious Diseases Society of America[J].Clin Infect Dis,2008,46(3):327-360.
[2] 周書蕾.深部真菌感染16例分析[J].新鄉醫學院學報,2002,19(5):359-360.
[3] 楊國元.造血系統惡性疾病并發深部真菌感染的診斷和治療[J].華中醫學雜志,2000,24(1):35-36.
[4] Kuhlman JE,Fishman EK,Burch PA,et al.CT of invasive pulmonary aspergillosis[J].Am J Roentgenol,1988,150(5):1015-1020.
[5] 張郭華.曲霉菌病[M]//陳灝珠.實用內科學(下冊).第 12版.北京:人民衛生出版社,2006:1687-1688
[6] Mylonak E,Barlam T F,Flanigan T,et al.Pulmonary aspergillosis and invasive disease in AIDS:review of 342 cases[J].Chest,1998,114(1):251-262.
[7] Ellis M.Invasive fungal infections:evolving challenges for diagnosis and therapeutics[J].M ol Immunol,2002,38(12-13):947-957.
[8] Levy H,Horak DA,Tegmeier BR,et al.The value of bronchoalveolar lavage and bronchial washings in the diag nosis of invasive pulnonary aspergillosis[J].Respir Med,1992,86(3):243-248.
[9] 秦樹林.深部真菌感染的診斷與治療[J].中國臨床醫生,2001,29(7):13-14.

