不同類型殺線劑對甘薯莖線蟲趨化性的影響
何 琪, 邢 驥, 張聲揚, 丁 中*
(1.湖南農業大學生物安全科學技術學院,長沙 410128; 2.湖南農業大學東方科技學院,長沙 410128)
甘薯莖線蟲(Ditylenchusdestructor)又稱馬鈴薯腐爛莖線蟲,屬遷移性內寄生線蟲,在我國主要危害甘薯塊根使其腐爛,引起甘薯莖線蟲病[1]。目前化學防治仍然是綜合防治線蟲病害中重要的手段之一,用于防治該線蟲的化學藥劑主要是非熏蒸類如有機磷類、氨基甲酸酯類、大環內酯類等幾類化合物,由于其施用方法主要是土壤處理,使得一部分殺線蟲劑殘留在土壤環境中。
土壤中的線蟲對環境變化有很高的敏感性[2],具有對環境的各種變化,包括污染脅迫效應做出較迅速的反應等特點[3]。殘留于土壤的低劑量殺線蟲劑將對線蟲的擴散、繁殖、趨化性等行為產生影響。目前,在低劑量殺線蟲劑脅迫下甘薯莖線蟲的趨化性將會受到怎樣的影響鮮有報道。本研究在低劑量涕滅威、甲氨基阿維菌素苯甲酸鹽和丙溴磷脅迫條件下對甘薯莖線蟲的趨化性進行了測定,以期為線蟲的化學防治和綜合治理提供依據。
1 材料與方法
1.1 試驗材料
1.1.1 藥劑
98.6%涕滅威(aldicarb)原藥,華陽農藥化工集團有限公司提供;70.3%甲氨基阿維菌素苯甲酸鹽(emamectin benzoate)原藥,95%丙溴磷(profenofos)原藥,均由湖南大方農化有限公司提供。
1.1.2 供試線蟲
甘薯莖線蟲:采自河北省昌黎市,在PDA培養基上采用半裸鐮刀菌(Fusariumsemitectum)培養40d左右收集備用[4-5]。
1.2 試驗方法
1.2.1 原藥的配制
將涕滅威、甲氨基阿維菌素苯甲酸鹽、丙溴磷原藥分別用溶劑丙酮和乳化劑吐溫80配制1%的乳油,再將藥劑用水稀釋成需要的濃度以備試驗。
1.2.2 測定方法
1.2.2.1 甘薯莖線蟲在含不同濃度藥劑水瓊脂中的趨化性測定
用去離子水配制水瓊脂,加熱溶化,加入各藥液配制成含5、5×10-1、5×10-2、5×10-3μg/mL 4個濃度的1%水瓊脂,待水瓊脂凝固前將25mL水瓊脂倒入9.5cm培養皿。待其凝固后在中心打直徑1cm小孔(線蟲母液滴加處),并在水瓊脂平板上靠近培養皿內緣部分每隔90°分別放置直徑1.5cm的灰霉菌(Botrytiscinerea)、甘薯切塊、半裸鐮刀菌菌餅和馬鈴薯切塊,并在每個引誘物之間放置同樣大小的1%水瓊脂塊(如圖1),并設不加藥劑的空白對照,每個藥劑5個處理,每處理重復3次。
測定前在中心打孔處加入0.2mL線蟲懸浮液(含線蟲800~1 200頭左右),用保鮮膜將培養皿封口放入25℃黑暗恒溫培養箱內培養36h,挖出每個菌餅和切塊及其覆蓋下的水瓊脂塊,用改良的貝爾曼漏斗法分離線蟲并進行計數,計算線蟲與引誘物的親和率。
親和率=引誘出的線蟲頭數/投入線蟲總頭數×100%
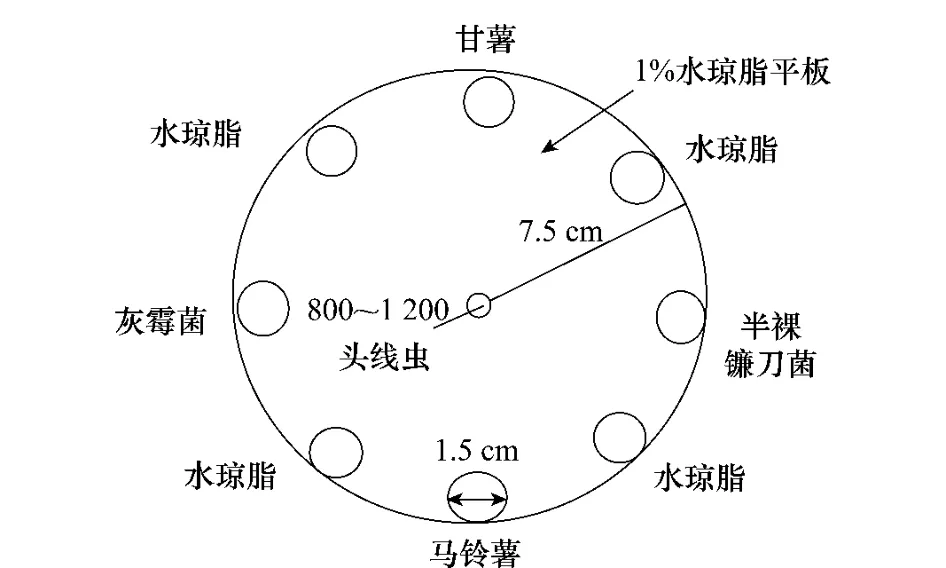
圖1 甘薯莖線蟲趨化性測定方法
1.2.2.2 甘薯莖線蟲經不同濃度藥劑處理后在水瓊脂中的趨化性測定
將分離得到的甘薯莖線蟲浸漬在上述3種藥液中,其濃度分別為10-1、10-2、10-3、10-4μg/mL,24h后用滅菌去離子水清洗并恢復24h,然后滴入1%不含藥劑的水瓊脂平板中央,趨化性測定方法同上。
2 結果與分析
2.1 甘薯莖線蟲在含不同濃度藥劑水瓊脂中的趨化性
2.1.1 甘薯莖線蟲在含不同濃度涕滅威水瓊脂中的趨化性
將甘薯莖線蟲加入含不同濃度涕滅威的1%水瓊脂平板中央,36h后觀察記錄線蟲對不同目標物的趨化性(見表1)。結果表明,在無藥劑水瓊脂平板上甘薯莖線蟲對灰霉菌和半裸鐮刀菌表現出明顯的趨性。在含涕滅威5μg/mL的水瓊脂平板上,由于受到涕滅威的抑制作用,甘薯莖線蟲對引誘物的趨性降低,但隨著涕滅威濃度的降低,其趨性逐漸恢復提高,當水瓊脂培養基上的涕滅威含量為5×10-3μg/mL時,線蟲趨性已恢復到原來的水平。此外,從表1還可以看出,無論涕滅威濃度的高低,其對灰霉菌或半裸鐮刀菌均保持明顯的趨性。
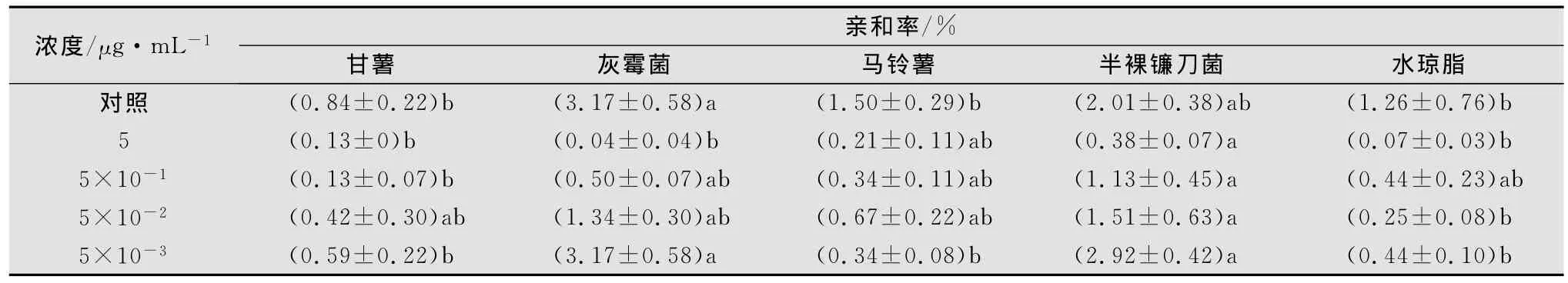
表1 甘薯莖線蟲在含不同濃度涕滅威水瓊脂中的趨化性1)
2.1.2 甘薯莖線蟲在含不同濃度甲氨基阿維菌素苯甲酸鹽水瓊脂中的趨化性
與涕滅威相比較,甲氨基阿維菌素苯甲酸鹽對甘薯莖線蟲的趨化性影響較大(見表2)。在含甲氨基阿維菌素苯甲酸鹽5、5×10-1μg/mL的水瓊脂中,線蟲的趨性受到抑制,與灰霉菌或半裸鐮刀菌的親和率較低,其擴散表現為隨機性。在藥劑濃度為5×10-2μg/mL和5×10-3μg/mL時,則又表現出對真菌的趨性,但與對照相比其親和率仍較低。
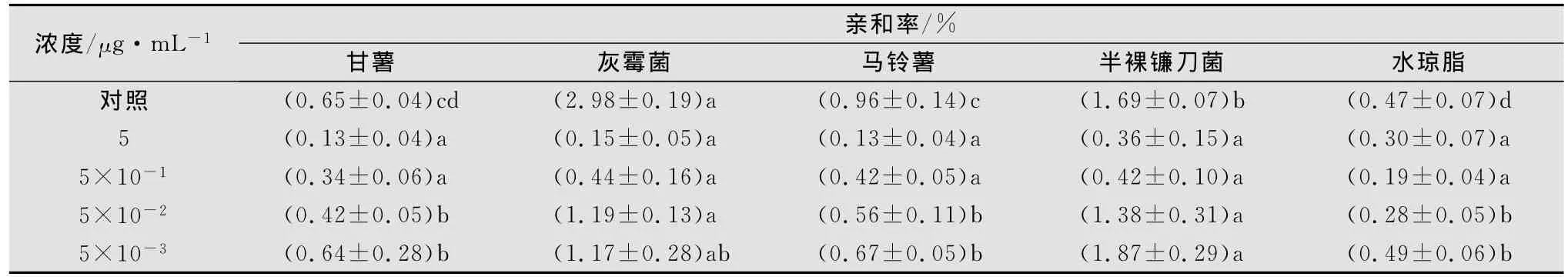
表2 甘薯莖線蟲在含不同濃度甲氨基阿維菌素苯甲酸鹽水瓊脂中的趨化性1)
2.1.3 甘薯莖線蟲在含不同濃度丙溴磷水瓊脂中的趨化性
丙溴磷對甘薯莖線蟲趨化性的影響與甲氨基阿維菌素苯甲酸鹽的相似(見表3)。在含丙溴磷5、5×10-1μg/mL的水瓊脂平板,線蟲與引誘物的親和率明顯低于空白對照,且其擴散也表現出隨機性。然而,值得注意的是,甘薯莖線蟲在含丙溴磷的水瓊脂平板中對甘薯薯塊的趨化性發生了改變,尤其在5×10-3μg/mL時,其對甘薯塊的趨性顯著高于其對馬鈴薯薯塊和半裸鐮刀菌的趨性。
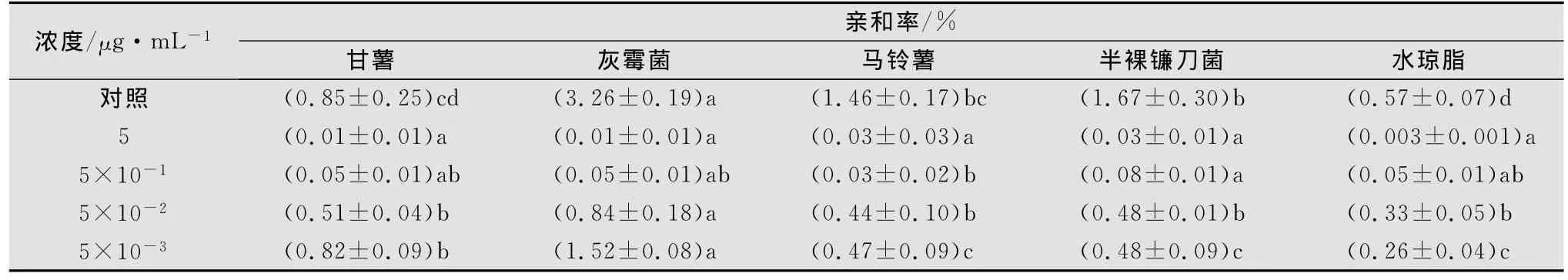
表3 甘薯莖線蟲在含不同濃度丙溴磷水瓊脂中的趨化性1)
2.2 甘薯莖線蟲經不同濃度藥劑處理后在水瓊脂中的趨化性
2.2.1 甘薯莖線蟲經不同濃度涕滅威處理后在水瓊脂中的趨化性
將甘薯莖線蟲浸漬在不同濃度涕滅威藥液中24 h,并用滅菌水清洗且恢復24h后滴入1%水瓊脂平板中央,36h后觀察記錄線蟲對不同目標物的趨化性(見表4)。結果表明,甘薯莖線蟲經涕滅威10-1~10-3μg/mL處理后與灰霉菌或半裸鐮刀菌的親和率較空白對照有所下降,但其趨化性未發生明顯的改變,仍對灰霉菌、半裸鐮刀菌保持明顯的趨性。
2.2.2 甘薯莖線蟲經不同濃度甲氨基阿維菌素苯甲酸鹽處理后在水瓊脂中的趨化性
甘薯莖線蟲經甲氨基阿維菌素苯甲酸鹽藥液10-1~10-3μg/mL處理24h后,其趨性受到很大的影響,且不易恢復,雖與真菌的親和率明顯低于空白對照,但仍然表現出對真菌的趨性(見表5)。甲氨基阿維菌素苯甲酸鹽10-3μg/mL處理對線蟲的運動、趨性無明顯影響。
2.2.3 甘薯莖線蟲經不同濃度丙溴磷處理后在水瓊脂中的趨化性
甘薯莖線蟲經不同濃度丙溴磷藥液處理24h并用滅菌水清洗后恢復24h測定發現,經丙溴磷10-1~10-3μg/mL處理后,線蟲與真菌的親和率降低,并表現出擴散的隨機性。從表6還可以看出,經丙溴磷10-3~10-4μg/mL處理后,線蟲對甘薯薯塊的趨性與對灰霉菌塊、半裸鐮刀菌塊和馬鈴薯塊的趨性無顯著性差異。
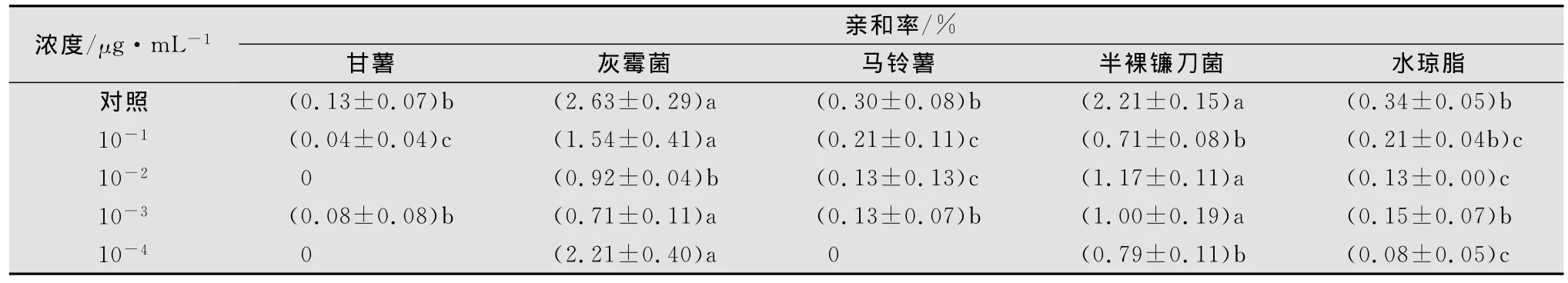
表4 甘薯莖線蟲經不同濃度涕滅威處理后對其趨化性的影響1)
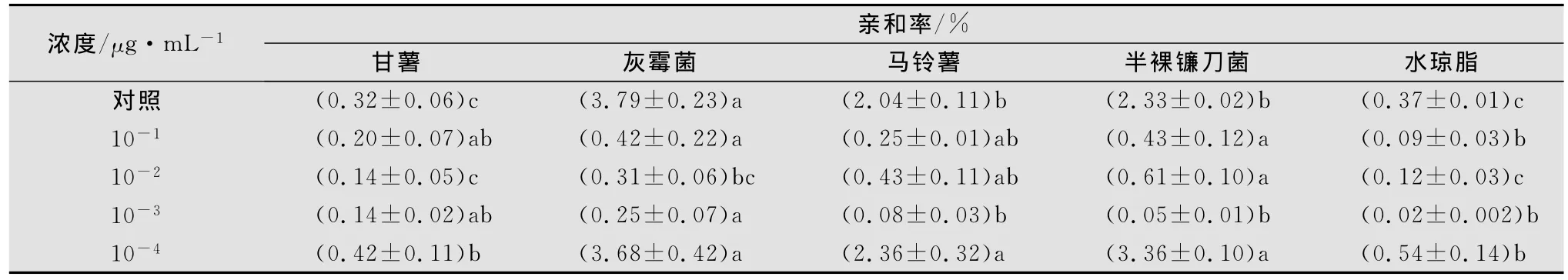
表5 甘薯莖線蟲經不同濃度甲氨基阿維菌素處理后對其趨化性的影響1)
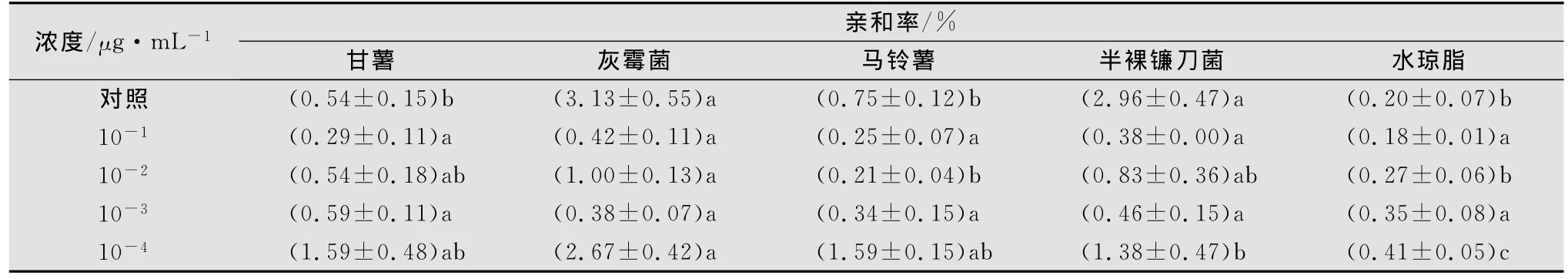
表6 甘薯莖線蟲經不同濃度丙溴磷處理后對其趨化性的影響1)
3 討 論
目前使用的非熏蒸類殺線蟲劑均為神經毒劑,殺線蟲劑不論是通過何種途徑進入線蟲體內,其最終的靶標都是線蟲的神經系統,破壞其正常功能。由于神經系統控制及調節著整個生物機體的功能,當線蟲神經系統的完整性受到破壞后,其生理生化、行為生態等各方面都將受到極大的影響。涕滅威等氨基甲酸酯類殺線蟲劑不僅引起線蟲麻痹、癱瘓或死亡,低劑量的殺線蟲劑還可干擾破壞植物寄生線蟲的化學感應[6-8]。線蟲的感覺器官不發達,植物寄生線蟲僅有位于體表的乳突和蟲體前端的1對側器(amphid),側器是線蟲的化學信號感受器,是加工、傳遞化學信號的器官[9]。一般認為,涕滅威等藥劑在高濃度下可通過線蟲的表皮進入體內[10-11],但在低濃度下可通過線蟲的化感器并經樹突逆向運輸到達作用靶標位點,且認為在較低濃度下藥劑首先通過神經元而不是通過表皮來進行轉移[8]。本研究也證實了線蟲在涕滅威、丙溴磷和甲氨基阿維菌素苯甲酸鹽一定范圍的低濃度環境下或經低濃度藥劑處理后,均可對其趨化性產生影響,且不易恢復。
值得注意的是,甘薯莖線蟲是一種主要侵染甘薯塊根的植物寄生線蟲。甘薯莖線蟲在本試驗中顯示出對灰霉菌、半裸鐮刀菌的高度趨性,而對甘薯薯塊未能表現出趨性,這可能是由于甘薯薯塊不含有吸引線蟲的趨化物質而影響了線蟲的侵入[12]。當然也由于甘薯莖線蟲有食菌的特性,該線蟲能夠在大約40個屬70種真菌上繁殖,常見的有Alternaria,Botrytis,Fusarium,Penicillium,Phoma,Trichoderma,Verticillium和Cylindrocarpon屬等[13],尤其是Fu-sariumsolani[14]和Botrytiscinerea[15]是甘薯莖線蟲培養的良好菌種,其真菌代謝分泌產物中可能含有使線蟲產生趨性的趨化物質。同時作者也發現,甘薯莖線蟲在低濃度(5×10-3μg/mL)有機磷殺蟲劑丙溴磷環境中或經低濃度(10-3~10-4μg/mL)處理后其趨化性發生了改變,表現為對甘薯薯塊具有較高的趨性。這可能是由于不同類型的殺線蟲劑由于其作用機制的差異,對線蟲的化學感應系統產生的影響不同而引起的。在這種情況下田間有可能加重甘薯莖線蟲的危害,在應用該類藥劑時需要引起注意。
[1]林茂松,文玲,方中達.馬鈴薯腐爛線蟲與甘薯莖線蟲病[J].江蘇農業學報,1999,15(3):186-190.
[2]Maurof,Robert D.Meiofauna distribution and mesoscale variability in two sites of the Ross Sea(Antarcica)with contrasting food supply[J].Polar Biology,1999,22:115-123.
[3]梁文舉,聞大中.土壤生物及其對土壤生態學發展的影響[J].應用生態學報,2001,12(1):137-140.
[4]徐進軍,李世東,楊之為.馬鈴薯莖線蟲的培養[J].西北農業學報,2004,13(4):77-80.
[5]丁中,彭德良,何旭峰,等.不同地理種群甘薯莖線蟲對不同類型殺線劑的敏感性[J].農藥,2007,46(12):851-853.
[6]Trett MW,Perry R N.Effects of the carbamoyloxime,aldicarb,on the ultrastructure of the root-lesion nematodePratylenchuspenetrans(Nematoda,Pratylenchidae)[J].Nematologica,1985,31:321-334.
[7]Perry R N.Chemoreception in plant parasitic nematodes[J].Annual Review of Phytopathology,1996,34:181-199.
[8]Winter MD,Mcpherson MJ,Atkinson H J.Neuronal uptake of pesticides disrupts chemosensory cells of nematodes[J].Parasitology,2002,125:561-565.
[9]王明祖.中國植物線蟲研究[M].武漢:湖北科學技術出版社,1998:62-63.
[10]Marks C F,Thomason I J,Castro C E.dynamics of the permeation of nematodes by water,nematocides and other substances[J].Experimental Parasitology,1968,22,321-337.
[11]Ho N F H,Sims S M,Vidmar T J,et al.Theoretical perspectives on anthelmintic drug discovery-interplay of transport kinetics,physicochemical properties,and in-vitro activity of anthelmintic drugs[J].Journal of Pharmaceutical Sciences,1994,83:1052-1059.
[12]漆永紅,李秀花,馬娟,等.馬鈴薯腐爛莖線蟲侵入甘薯部位以及在植株內的種群動態[J].華北農學報,2008,23(增刊):234-237.
[13]Faukner L R,Darling H M.Pathological histology,hosts and culture of the potato rot nematode[J].Phytopathology,1961,5(11):778-785.
[14]Young H K,Seung H O.In vitro culture and factors affecting population changes ofDitylenchusdestructorof ginseng[J].Korean Journal of Plant Pathology,1995,11(1):39-46.
[15]劉斌,鄭經武.腐爛莖線蟲單異活體繁殖方法研究[J].浙江農業學報2006,18(6):445-447.

