快速、準確鑒別產幾丁質酶菌株的新方法
胡 曉, 張 敏, 劉彭強, 鄧秋蕾, 舒 凱
(四川農業大學農學院植物病理系,雅安 625014)
使用幾丁質平板法篩選具有幾丁質酶活性的微生物時,因幾丁質平板本身為乳白趨于透明色,而降解環也為透明色,不易觀察到明顯的抑菌圈,故不易篩選出幾丁質降解菌,而且其準確性往往受到研究人員的影響,不同觀察者可能得出不同的結論。
1977年,Hankin和Anagnostakis首次發現,生長在含有纖維素剛果紅的瓊脂培養基上的纖維素降解菌的菌落周圍可產生降解環[1]。剛果紅是一種染料,它可以與多糖物質形成紅色復合物,但并不和降解后的纖維二糖和葡萄糖發生這種反應。根據此原理,當在含有纖維素的培養基中加入剛果紅時,剛果紅能與培養基中的纖維素形成紅色復合物,當纖維素被纖維素酶分解后,剛果紅-纖維素的復合物就無法形成,培養基中會出現以纖維素分解菌為中心的透明圈。纖維素剛果紅培養基用于快速識別產纖維素酶菌株和初步判定酶活性高低,即產酶愈多,降解環愈大,產酶越快,降解環出現越早[2]。
幾丁質可視為纖維素的類似物,它是通過β-1,4-糖苷鍵連接而成的不分支的2-乙酰氨基-2-脫氧-D-葡萄吡喃糖苷(N-乙酰氨基葡萄糖)的同聚物,相當于纖維素C-2位置上的羥基被乙酸氨基所置換。因此,作者推測它也能替代纖維素而與剛果紅形成紅色復合物,故可使用含剛果紅的幾丁質培養基來鑒別具有幾丁質酶活性的菌株。該方法可能彌補通常采用的幾丁質平板法鑒定含幾丁質酶活微生物的缺點,有助于在微生物的分離中準確地檢測到含有幾丁質酶活性的菌株。
1 材料與方法
1.1 材料
菌株:由本實驗室分離出具有幾丁質酶活性的4株芽胞桿菌菌株,分別為Bacillus514、Bacillus132、Bacillus233、Bacillus515。
幾丁質剛果紅培養基(根據纖維素剛果紅培養基改良):硫酸銨0.2%,硫酸鎂0.05%,磷酸二氫鉀0.1%,氯化鈉0.05%,膠體幾丁質3%,剛果紅0.2%,瓊脂1.5%~2%,p H7.0~7.2[3]。
幾丁質培養基:硫酸銨0.2%,硫酸鎂0.05%,磷酸二氫鉀0.1%,氯化鈉0.05%,膠體幾丁質3%,瓊脂1.5%~2%,p H7.0~7.2。
液體培養基:牛肉膏1%,蛋白胨1%,NaCl 0.5%,p H7.2。
牛肉膏蛋白胨培養基(NA):牛肉膏1%,蛋白胨1%,NaCl 0.5%,瓊脂1.5%~2%,p H7.2。
產酶培養基:磷酸二氫鉀0.1%,硫酸鎂0.05%,膠體幾丁質3%,氯化鈉0.05%,磷酸鈉0.2%,酵母膏1.0%。
剛果紅0.1%染液:剛果紅0.1%。(0.1 g剛果紅溶于100 ML蒸餾水中)。
1.2 方法
1.2.1 菌株活化
將具有幾丁質酶活性的菌株接種于NA斜面上活化。
1.2.2 菌株接種及降解環的觀測
方法1:用接種環分別挑取4株少量菌體接種于幾丁質培養基中央,32℃培養,每24 h取3皿用0.1%的剛果紅染色,染色1 h后用蒸餾水沖洗干凈,直到沒有浮色為止,觀測菌落周圍的降解環,直至降解環不再擴大。
方法2:用接種環挑取少量菌體接種于含剛果紅的幾丁質培養基中央,32℃培養,每24 h取3皿觀測1次,直至降解環不再擴大。
1.2.3 幾丁質酶粗酶液的提取
在250 ML三角瓶內加入30 ML液體培養基,接一環菌種后于250 r/min、32℃搖床培養24 h,然后在250 ML三角瓶中加入25 ML產酶培養基,培養5 d后4 000 r/min離心20 min,上清液即為粗酶液,測定酶活性。
1.2.4 幾丁質酶活力測定
按Joshi[4]方法進行。取0.6 ML粗酶液加到1.0 ML含1% 膠體幾丁質的磷酸緩沖液(p H6.6)中,45℃保溫30 min,加入1.5 ML 3,5-二硝基水楊酸試劑終止反應,并加熱100℃,10 min,冰浴冷卻,離心后取上清液在波長530 nm下測吸光度,計算產生的N-乙酰氨基葡萄糖(NAG)的量。
酶活單位定義:在上述條件下,每分鐘產生相當于1μmol N-乙酰氨基葡萄糖的還原糖所需的酶量,定義為一個酶活力單位(U)。
1.2.5 統計方法
試驗結果經過Excel 2003軟件進行初步統計,幾丁質平板中的降解環大小隨時間的變化函數關系采用SPSS16.0中Nonlinear的對數曲線進行擬合。以p<0.05和p<0.01分別示差異的顯著和極顯著水平。
2 結果與分析
2.1 使用方法1對幾丁質平板染色后觀測到的降解環
如圖1所示,圖a、b、c分別是用方法1接種Bacillus515于幾丁質平板,對其染色后形成的3個重復,形成的降解環直徑大小差異不大,分別為3.6、3.7 cm和3.7 cm。圖1d為未用0.1%的剛果紅染液染色的幾丁質平板,可以看出在菌落周圍有一圈透明的降解環,但邊界不清晰,極不易觀察。圖1e為用方法1染色的未接種平板,整個平板是均一的紅色,未觀察到有透明圈出現。
2.2 使用方法2在幾丁質平板上觀測到的降解環
如圖2所示,圖a、b、c分別是用方法2接種Bacillus515于幾丁質平板,對其染色后形成的3個重復,形成的降解環直徑大小差異不大,分別為3.6、3.8 cm和3.7 cm。圖2e為用方法2染色的未接種的平板,整個平板是均一的紅色,未觀察到有透明圈出現。
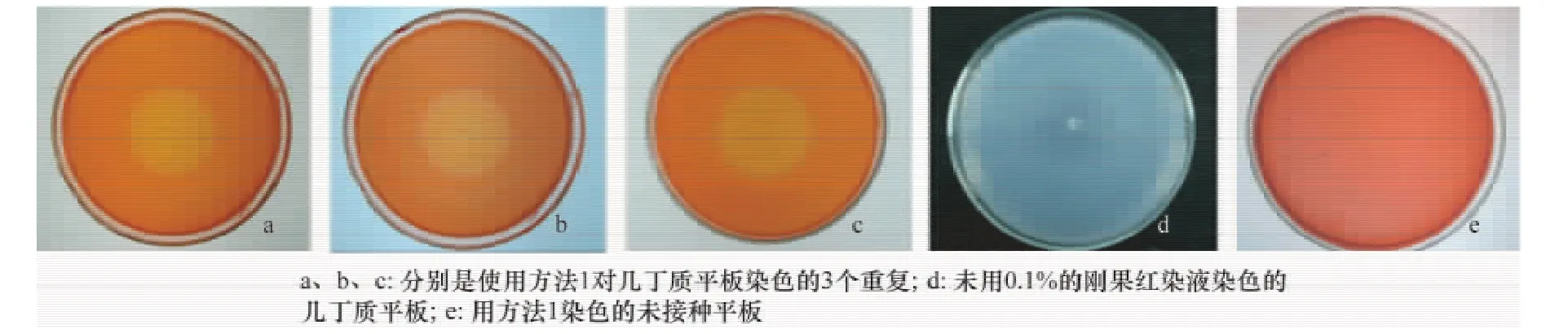
圖1 使用方法1染色形成的降解環
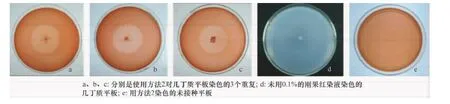
圖2 使用方法2染色形成的降解環
2.3 降解環直徑大小與培養時間的關系
由圖3和圖4可以看出,降解環的直徑大小隨著時間的增加符合微生物的對數生長規律,方法1的R2達到了0.952 2,方法2的R2達到了0.959 8,由此可以推測出,在對數生長期,營養充足,Bacillus515的生長速率快、代謝旺盛、酶系活躍、活細菌數和總細菌數大致接近、細胞的化學組成形態理化性質基本一致,隨著細菌數量的增長,降解幾丁質的物質的分泌也就越多,在42 h內細菌的增長速度較快,降解環迅速擴大,第3天后細菌分泌物的分泌變慢,降解環緩慢擴大,到了第7天,細菌分泌物達到了穩定狀態,降解環的大小也就處于穩定狀態。
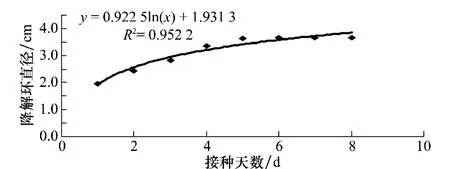
圖3 使用方法1在不同時間形成的降解環直徑
在方法1和方法2的比較中,方法1在第6天產生的降解環直徑就達到了最大,而方法2在第7天產生的降解環直徑達到最大,兩者降解環達到最大直徑的時間基本一致。
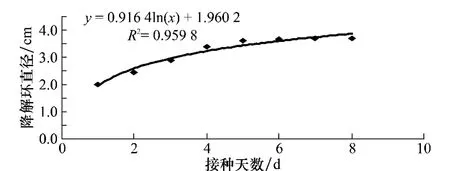
圖4 使用方法2在不同時間形成的降解環直徑
2.4 幾丁質酶活性與降解環大小的關系
使用SPSS16.0軟件對幾丁質酶活性和降解環直徑之間的關系進行相關性分析,其中,在p=0.010的條件下,其R=0.990,即相關性顯著,故降解環的大小可反映酶活大小(表1)。
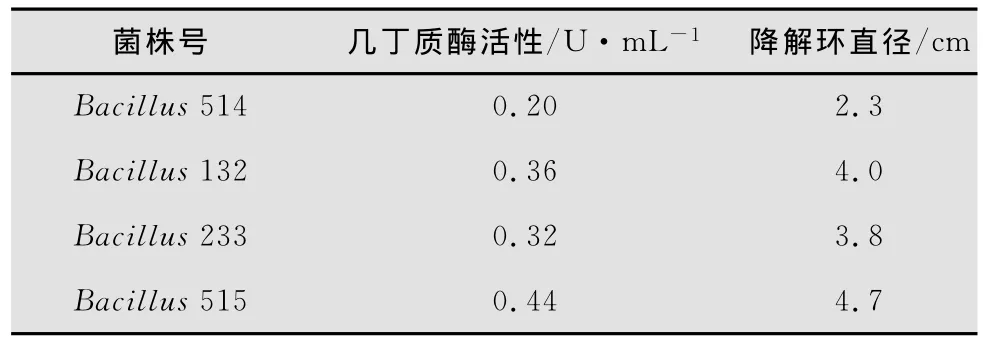
表1 菌株的幾丁質酶活性及降解環大小
3 結論與討論
直接利用微生物防治植物病害是傳統生物防治的主要途徑,其中幾丁質酶的利用是生防的一個重要方向。對植物具有致病能力的真菌的細胞壁是由幾丁質組成的,而具有幾丁質酶活性的微生物通過降解真菌細胞壁從而起到防治真菌病害的作用。幾丁質酶作為一種具有生物活性的物質,不僅可以用來抗真菌,同時對線蟲、昆蟲也具有一定的抗性[5]。因此,快速、有效地篩選具有幾丁質酶活性的菌株具有重要的現實意義。
本文所開發的2種染色方法,具有可重復性,且2種方法形成的降解環的差異不大。在幾丁質平板接種后第7天觀測到菌株的分泌物形成降解環達到最大,與芽胞桿菌生長的對數曲線相一致,推測分泌出的分解幾丁質的物質已不再增多,故第7天為最佳觀測時期。2種方法對幾丁質平板染色后觀測到的降解環為淺紅色,未降解部分為深紅色,因此容易準確地觀察;而未染色的幾丁質平板整個平面呈乳白色,且降解環為透明色,因顏色相近而不易觀測。因此,剛果紅染色后的幾丁質平板比未染色的平板能更好、更直觀、更準確地觀測到降解環。但在試驗過程中,使用方法1也有不足,用蒸餾水沖去浮色時,易沖去菌苔而觀察不全菌落形態,且不能繼續培養菌株(因打開培養皿蓋子而易受污染)來觀察降解環的動態變化,而使用方法2不僅能清晰地觀測到降解環,并能觀察菌落的動態生長情況,因此使用方法2更為科學、準確。
根據 Wood的研究[6-8],推測形成淺紅色的降解環的原因可能是:多糖類物質水解后形成大量含有β-1,4-D吡喃型葡萄糖、β-1,3-D葡聚糖及乳糖-葡甘露糖聚合糖等結構的物質,與剛果紅染料結合形成大量的紅色多聚糖-剛果紅復合物,幾丁質是2-氨基-2-脫氧-β-D-葡萄糖單元的共聚體,水解后與剛果紅染料形成紅色物質,而用具有幾丁質酶活性的細菌降解幾丁質后形成了葡萄糖,不能與剛果紅染料形成紅色物質,故在深紅色的平板上形成了淺紅色的降解環。
本試驗證明被篩選菌的幾丁質酶活性越強,幾丁質剛果紅平板的降解環也越大。因此,可以根據幾丁質平板上降解環的大小來推測菌株的幾丁質酶活性的大小,進而篩選出幾丁質酶活性較強的菌株,這也為菌株的誘變改良提供了直觀、準確的篩選方法,可通過此方法快速篩選出具有幾丁質酶活性的細菌菌株。
這兩種染色方法彌補了通常采用的幾丁質平板法鑒定含幾丁質酶活性芽胞桿菌的缺點,在芽胞桿菌的分離中能快速、有效地檢測到幾丁質酶活性菌株,為篩選具有幾丁質酶活性的芽胞桿菌提供了新方法,但能否用于檢測其他微生物幾丁質酶活性還有待進一步證實。
[1]Hankin L,Anagnostakis S L.Solid mediuMcontaining carboxy methylcellulose to detect Cx cellulase activity of micro-organisms[J].Gen Microbiology,1977,98:109-105.
[2]劉起麗,張建新,徐瑞富.纖維素剛果紅培養基篩選產纖維素酶菌株的影響因素研究[J].西北農業學報,2007,16(5):279-283.
[3]張宇昊,王頡,張偉,等.一種改進的纖維素分解菌鑒別培養基[J].纖維素科學與技術,2004,1(12):33-36.
[4]Joshi S,Kozlowshi M,Rishens S,et al.Chitinase and chitobiase production during fermentation of genetically improvedSerratialiquefaciens[J].Enzyme Microb Technol,1989,11(5):289-296.
[5]韓寶芹,余長纓,劉萬順,等.幾丁質酶研究現狀及展望[J].中國海洋藥物雜志,2001(5):41-43.
[6]Wood P J,Fulcher R G.Interaction of some dyes with cereal β-glucans[J].Cereal Chem,1978,55:952-966.
[7]Wood P J.The interaction of direct dyes with water soluble substituted cellulose and cerealβ-glucans[J].Ind Eng CheMProd Res Dev,1980,19:19-23.
[8]Wood P J.Specificity in the interaction of direct dyes with polysaccharides[J].Carbohydr Res,1980,85:271-287.

