郁金對CCl4急性肝損傷小鼠肝細胞bcl-2及bax表達的影響
韓向北,許 多,郭亞雄,李德龍,程 宏,朱彤彤#,張婉嫻*,趙麗晶,趙麗娟*
(1.吉林大學白求恩醫學院病理生理教研室,吉林長春130021;2.吉林省人民醫院)
郁金作為傳統中草藥,具有來源廣泛、價格低廉、作用多樣且療效確切等優點。現代研究表明,郁金具有調節免疫、抑制中樞神經、抗自由基損傷、改善血液流變學、誘導腫瘤細胞凋亡,抗肝纖維化等作用[1-3]。單味郁金水煎劑對受損肝細胞凋亡及其機制的研究卻少有報道。本實驗通過檢測肝細胞Bcl-2、Bax基因及蛋白水平的表達變化,探討單味郁金水煎劑對CCl4急性肝損傷小鼠肝細胞凋亡的影響及其機制。
1 材料與方法
1.1實驗動物ICR小鼠,體重18-22 g,雌雄各半,由吉林大學實驗動物中心提供。
1.2藥物與主要試劑郁金購于吉林大藥房;甘利欣注射液(連云港正大天晴制藥有限公司,批號20040825)實驗時用10%葡萄糖配制;四氯化碳(武漢市江北化學試劑廠,批號20021112);TUNUL試劑盒、Trizol購自美國invitrogen公司,逆轉錄試劑盒購于MBI公司;bcl-2、bax及GAPDH的PCR引物由上海生工生物科技有限公司合成。抗體購自美國san-ta cruz公司。
1.3動物分組與給藥ICR小鼠48只,雌雄各半,隨機分為6組,每組8只:陽性藥組(甘利欣22.5 mg·kg-1),郁金高 、中 、低劑量組(12g·kg-1、6 g·kg-1、3 g·kg-1),空白對照組及模型組(等體積蒸餾水),灌胃給藥,1次/d,連續給藥7 d。第7 d給藥1 h后造模。
1.4模型制備參照文獻[4],各組(空白對照組除外)小鼠以0.2%CCl4橄欖油溶液10ml·kg-1腹腔注射,禁食不禁水24 h,稱重后眼球取血處死,快速取出肝臟。
1.5血清生化指標檢測按試劑盒方法(賴氏法)測血清丙氨酸氨基轉移酶(ALT),門冬氨酸氨基轉移酶(AST)的含量。
1.6TUNUL染色觀察凋亡細胞參照試劑盒說明進行TUNEL染色,陽性細胞呈綠色熒光,在激光共聚焦顯微鏡下觀察拍照。
1.7RT-PCR法檢測Bcl-2、bax的轉錄情況遵循PCR引物設計原則,根據GeneBank鼠基因cDNA序列,分別設計Bcl-2、bax及Gapdh引物。序列見表1,提取肝組織總RN A,瓊脂糖凝膠電泳鑒定,并根據A260值計算RNA濃度。取4 μ g總RNA行逆轉錄反應,反應體系中加1 μ l隨機引物,加雙蒸水定容至12 μ l,70℃溫育 5 min,冰浴后加入 10 μ MdNTP Mix 2 μ l,5×緩沖液 4 μ l,RNA 酶抑制劑(20 U)1 μ l,25℃溫育5 min,加入逆轉錄酶(200 U)1 μ l,終體系為 20 μ l,25℃、10 min,42℃、60 min,72℃、10 min。而后進行PCR反應,反應體系為:cDNA稀釋液1 μ l,20×SYBR PCR 主反應液 9 μ l;上下游引物各 1 μ l(0.25 μ M);去離子水 13 μ l;總體積 25 μ l;反應條件為:94℃變性 5 min,94℃變性 30 s,55-57℃30 s,72℃延伸45 s,30個循環,最后72℃延伸5 min。以Gapdh作為內參照。每個樣本做三個副管。隨機Rotor-Gene軟件分析,雙標準曲線法計算基因表達量。

Tab.1 Bcl-2、bax and Gapdh
1.8免疫組織化學染色觀察bcl-2及bax蛋白表達變化用一抗檢測肝組織細胞內的抗原,再用顯色物質標記的二抗檢測一抗,放大檢測信號,陽性細胞被染為棕色。肝組織切片脫蠟后水洗,蒸餾水洗,PBS洗。3%H2O210 min后自來水充分水洗,蒸餾水洗,PBS洗。熱抗原修復或消化將切片置入抗原修復液中,用微波爐加熱至沸騰10-20 s。10 min后再加熱一次。再10 min后取出冷卻,至室溫后蒸餾水洗,PBS充分洗。加正常血清封閉20分鐘棄血清后,直接加一抗:兔抗鼠(bcl-2和bax)抗體稀釋比例為1∶50,37℃孵育 1 h。室溫1 h,PBS充分洗。加(羊抗兔)通用型IgG抗體(Fab段)IgG/HRP,室溫30 min。PBS充分洗。滴加DAB顯色劑,在顯微鏡下觀察直至出現棕色細胞。自來水充分洗,蘇木精復染3 min。鹽酸乙醇分化2 s,自來水充分洗。無水乙醇脫水,二甲苯透明,中性樹膠封固,晾干觀察。
1.9統計學處理實驗數據以均數±標準差(s)表示。采用SPSS 11.0統計軟件作 t檢驗和方差分析,檢驗水準α=0.05。
2 結果
2.1血清ALT、AST的檢測結果與空白對照組比較模型組血清ALT、AST水平顯著增高(P<0.01),表明急性肝損傷模型成立。與模型組相比,郁金各劑量組血清ALT、AST水平均明顯降低,且呈劑量依賴性,統計學比較差異顯著(P<0.05,P<0.01),說明郁金可明顯減輕CCl4所致小鼠急性肝損傷,詳見表2。
表2 郁金對CCl4急性肝損傷小鼠血清ALT、AST的影響(s,n=8)

表2 郁金對CCl4急性肝損傷小鼠血清ALT、AST的影響(s,n=8)
與對照組比較**P<0.01;與模型組比較 ▲P<0.05,▲▲P<0.01
組別 劑量 ALT(U·L-1)AST(U·L-1)空白對照組 17.75±4.57 34.87±7.99模型組 75.27±10.31** 99.33±26.99**陽性藥組 22.5 mg·kg-1 28.08±5.07▲▲ 44.87±12.30▲▲郁金大劑量 12 g·kg-1 36.11±6.52▲▲ 50.21±14.25▲▲郁金中劑量 6 g·kg-1 38.65±8.07▲▲ 52.23±13.66▲▲郁金小劑量 3 g·kg-1 48.13±17.91▲ 65.12±13.11▲
2.2TUNUL染色結果如圖1所示:與空白對照組相比,模型組小鼠肝組織TUNUL染色陽性細胞數明顯增多;而郁金給藥組與模型組相比肝組織陽性細胞數卻明顯減少。說明單味郁金水煎劑可阻止肝細胞凋亡,減輕肝損傷。

圖1 TUNUL染色結果(40×)
2.3Bcl-2及bax基因轉錄水平結果表明:與空白對照組比較,模型組Bcl-2基因轉錄水平明顯降低、bax基因轉錄水平明顯增高、Bcl-2/Bax比值下降;與模型組相比,郁金中、低劑量組Bcl-2基因表達明顯上調、而bax基因表達明顯下調、Bcl-2/Bax比值增大。各組間比較統計學差異顯著(P<0.05),詳見表3和圖2。
表3 Bcl-2及bax基因表達情況(s,n=3)

表3 Bcl-2及bax基因表達情況(s,n=3)
*P<0.05**P<0.01,與空白對照組比較;▲P<0.05▲▲P<0.01,與模型組比較
組別 Bcl-2 Bax Bcl-2/Bax空白對照組 0.589±0.049 0.377±0.103 0.335±0.901模型組 0.234±0.046**1.656±0.052**0.024±0.077*郁金中劑量組 0.519±0.100▲ 1.389±0.072▲ 0.057±0.195▲郁金低劑量組 0.526±0.096▲1.292±0.045▲▲0.066±0.226▲

圖2 Bcl-2、bax基因表達情況
2.4Bcl-2及bax蛋白免疫組化染色結果與空白對照組比較Bcl-2蛋白在受損肝組織中表達明顯減弱(胞漿呈棕黃染色的陽性細胞數減少);而郁金中、低劑量組肝細胞Bcl-2蛋白表達陽性細胞數比模型組明顯增多,詳見圖4。與空白對照組相比bax蛋白在受損肝組織中表達增強。而與模型組比較,郁金中、低劑量組Bax蛋白表達陽性細胞數卻明顯減少,這與上述RT-PCR結果相一致,詳見圖3、圖4。
3 討論
本課題組前期實驗結果已表明,單味郁金水煎劑具有明顯改善肝功能;減輕肝組織炎癥反應及肝細胞變性、死亡程度;降低肝組織氧化應激反應;調節肝細胞免疫平衡等作用[4]。為了觀察單味郁金水煎劑是否具有良好的抗肝細胞凋亡作用并探究其機制,特設計本實驗。

圖3 Bcl-2免疫組化染色結果(40×)
本研究仍采用CCL4復制小鼠急性肝損傷病理模型。CCl4進入機體后可引發自由基產生增多而清除不足。自由基對肝細胞發生初步攻擊的同時又可激活肝枯否氏細胞(Kupferps cells),使其釋放細胞因子并進一步活化中性粒細胞等炎性細胞,通過一系列及聯反應活化細胞的防御機制,這種防御反應被不斷放大,就會出現肝細胞凋亡、炎癥反應、粒細胞浸潤等肝組織損傷[5,6]。
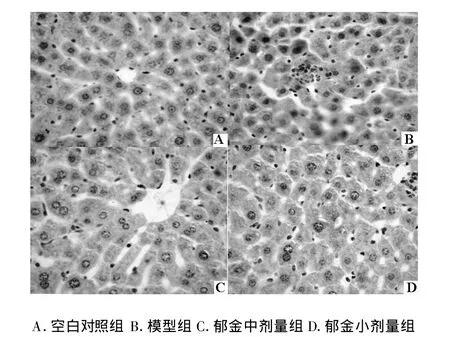
圖4 Bax免疫組化染色結果(40×)
肝細胞損傷是一種由多因素介導的復雜的生物學過程,涉及多種學說和機制,其中肝細胞凋亡是肝損傷的一個基本特征。然而,在所有的凋亡途徑中,線粒體似乎是肝細胞凋亡的中心執行者[7]。線粒體途徑主要由Bcl-2家族蛋白調控,其中Bcl-2、Bax為重要的凋亡調控基因。Bcl-2為凋亡抑制基因,主要通過防止線粒體釋放凋亡因子來發揮抗凋亡作用。bax是一種與Bcl-2相關的蛋白,其功能與bcl-2相反。Bcl-2家族成員的功能也包括它們形成同二聚體或異二聚體的能力,當細胞受到凋亡誘導因子刺激后是否存活取決于bcl-2/bax的比率,當bax增加時,形成bax-bax同二聚體,加速細胞凋亡;當bcl-2表達增強時,形成bcl-2-bax異二聚體,抑制bax-bax同二聚體誘導的細胞凋亡[8]。本實驗TUNEL結果顯示:郁金給藥組與模型組相比肝組織陽性細胞數明顯減少。說明單味郁金水煎劑可阻止肝細胞凋亡,減輕肝損傷;RT-PCR及免疫組化結果顯示:模型組小鼠肝組織Bcl-2基因與蛋白表達均較空白對照組明顯下調,而bax基因與蛋白表達則明顯上調,結果bcl-2/bax比例降低而促進肝細胞凋亡。與模型組相比郁金給藥組小鼠肝細胞bcl-2基因與蛋白表達明顯上調,bax基因與蛋白表達卻明顯下調,bcl-2/bax的比例增高,遏制了肝細胞凋亡。說明單味郁金水煎劑抑制肝細胞凋亡的機制之一可能與調節肝細胞bcl-2/bax的比例有關。
[1]李 潔,張岱州,高麗霞.中藥郁金的現代研究概況[J].內蒙古中醫藥,2001,1:37.
[2]徐 毅,呂 賓,丁志山,等.不同溫郁金提取物抑制胃癌細胞SGC-7901增殖和誘導凋亡的實驗研究[J].浙江醫學,2004,26(7):503.
[3]李凱杰,胡錫敏.姜黃素抗肝纖維化機制的研究進展.中國熱帶醫學,2008,8(2):314.
[4]蘭鳳英,何靜春,趙 穎,等.郁金抗四氯化碳致小鼠急性肝損傷的作用[J].中國康復理論與實踐,2007,13(5):444.
[5]汪 濤,姜 華,陸國才,袁伯俊,佘佳紅.四氯化碳肝臟毒性研究新進展[J].毒理學雜志,2008,22(4):324.
[6]洪 莉,蔡 威.凋亡與肝細胞損傷機制的研究進展[J].臨床小兒外科雜志,2006,5(1):42.
[7]李晶媛,李樹臣,楊維良.TNF-a誘導肝細胞凋亡機制的回顧與展望[J].世界華人消化雜志,2007,15(6):606.
[8]Ogretmen B,Safa AR.Down-regulation of apoptosis-related bcl-2 but not bcl-xL or bax proteins in multidrug-resistant MCF-7/Adr human breast cancer cells[J].Int J Cancer,1996,67(5):608.

