卵巢癌患者PD-L1的表達研究
于曉偉,李春紅,張松靈,張曉霞,何 津,張麗宏,崔滿華
(1.吉林大學第一醫院 婦產科,吉林 長春130021;2.吉林大學基礎醫學院病理教研室,吉林 長春130021;3.吉林大學第二醫院婦產科,吉林 長春130041)
PD-L1、PD-L2是新發現的B7家族共刺激分子配體,二者具有共同的受體PD-l,并通過與受體PD-1結合抑制T細胞的增殖和過度活化,在細胞免疫應答過程中起負調控作用,同時通過影響細胞因子的分泌對體液免疫也發揮了調控作用。PD-Ll、PDL2/PD-1路徑在機體自身免疫耐受和腫瘤細胞逃逸機體免疫監控過程中都發揮著重要作用。目前研究發現許多腫瘤表達PD-Ll。PD-L1在腫瘤細胞上的表達削弱其免疫原性,影響其產生特異性T細胞應答,抑制腫瘤免疫應答的產生。腫瘤細胞表達的PDLl能通過誘導特異性T細胞的凋亡而使腫瘤細胞發生免疫逃逸。
1 材料與方法
1.1 材料
實驗組:卵巢癌癥患者40例,來源于2005年3月-2007年10月期間在吉林大學第一醫院婦產科的住院手術患者,年齡45-70歲,平均年齡(58.3±13.7)歲。卵巢癌患者術前均未行放療、化療。所有病例均經手術病理確診為漿液性上皮性卵巢癌。
對照組:子宮肌瘤患者經病理證實的正常卵巢組織10例,來源于同期在吉林大學第一醫院婦產科行子宮切除術及附件切除術的患者,年齡45-60歲,平均年齡(50.3±4.21)歲。
卵巢癌組織及正常卵巢組織標本固定于10%的福爾馬林固定液中,經取材、脫水、透明、浸蠟、包埋后,切片。切片厚為4 μ m,烤干后備用。
1.2 免疫組織化學法
1.2.1主要試劑及試劑盒 兔抗多克隆抗體PD-L1,濃縮型,購自于Santia公司,工作液為1∶100;
通用型SP試劑盒,及DAB顯色試劑盒購于福州邁新公司
1.2.2具體步驟 (1)石蠟切片常規脫蠟至水洗;(2)檸檬酸鹽95℃熱修復5 min后,室溫冷卻;(3)PBS洗5 min,洗3次;(4)阻斷劑(試劑A)去內源性過氧化酶,室溫15min;(5)PBS洗5 min,洗3次;(6)加封閉液(試劑B)室溫封閉15 min;(7)滴加一抗,4℃過夜;(8)PBS洗5min,洗3次;(9)滴加生物素標記的抗鼠/兔IgG的第二抗體(試劑C),室溫15 min;(10)PBS洗5 min,洗3次;(11)滴加辣根過氧化酶標記的鏈霉菌抗生物素蛋白(試劑D)室溫15 min;(12)PBS洗5 min,洗3次;(13)滴加顯色劑DAB,光鏡下觀察,顯色適當后用水終止;(14)Mayer蘇木素復染細胞核,水洗;(15)弱氨水返藍,水洗;(16)脫水、透明、中性樹膠封片。
1.2.3結果判定 陽性結果:細胞胞漿或(和)胞膜呈棕黃色顆粒。在局部陽性染色區域內評估PD-L1+癌細胞占所有癌細胞的比例。
1.3 統計分析
正態數據采用Microsoft Excel 2003的統計學工具進行統計學處理,結果以s表示,經方差齊性檢驗后,組間比較采用 t檢驗。所有數據均用SPSS10.0 for windows軟件包處理。
2 結果
PD-L1主要表達在卵巢癌上皮細胞的胞漿內或(和)胞膜上(見圖1:a-b);而正常卵巢組織不表達PD-L1。在400×顯微鏡下分析PD-L1表達情況。在局部陽性染色區域內評估PD-L1+癌細胞占所有癌細胞的比例。每400×視野至少200個癌細胞。癌細胞中PD-L1+癌細胞的平均比例51.2±11.0%,范圍12.1-80.1%。
3 討論
在免疫應答的過程中,除了通過APC遞呈MHC處理過的抗原給抗原特異T細胞以提供第一信號外,還需共刺激分子作為輔助信號的協同作用,達到生理閾值后才能使T細胞活化,產生正常的應答反應。目前己知的共刺激分子分為3個家族,即免疫球蛋白超家族、TNF家族和細胞因子家族。其中免疫球蛋白超家族是唯一能從APC單向傳遞信號到T細胞的共刺激分子。PD-L1、PD-L2是新發現的B7家族共刺激分子配體,二者具有共同的受體PD-l,并通過與受體PD-1結合抑制T細胞的增殖和過度活化,在細胞免疫應答過程中起負調控作用,同時通過影響細胞因子的分泌對體液免疫也發揮了調控作用。PD-Ll、PD-L2/PD-1路徑在機體自身免疫耐受和腫瘤細胞逃逸機體免疫監控過程中都發揮著重要作用。
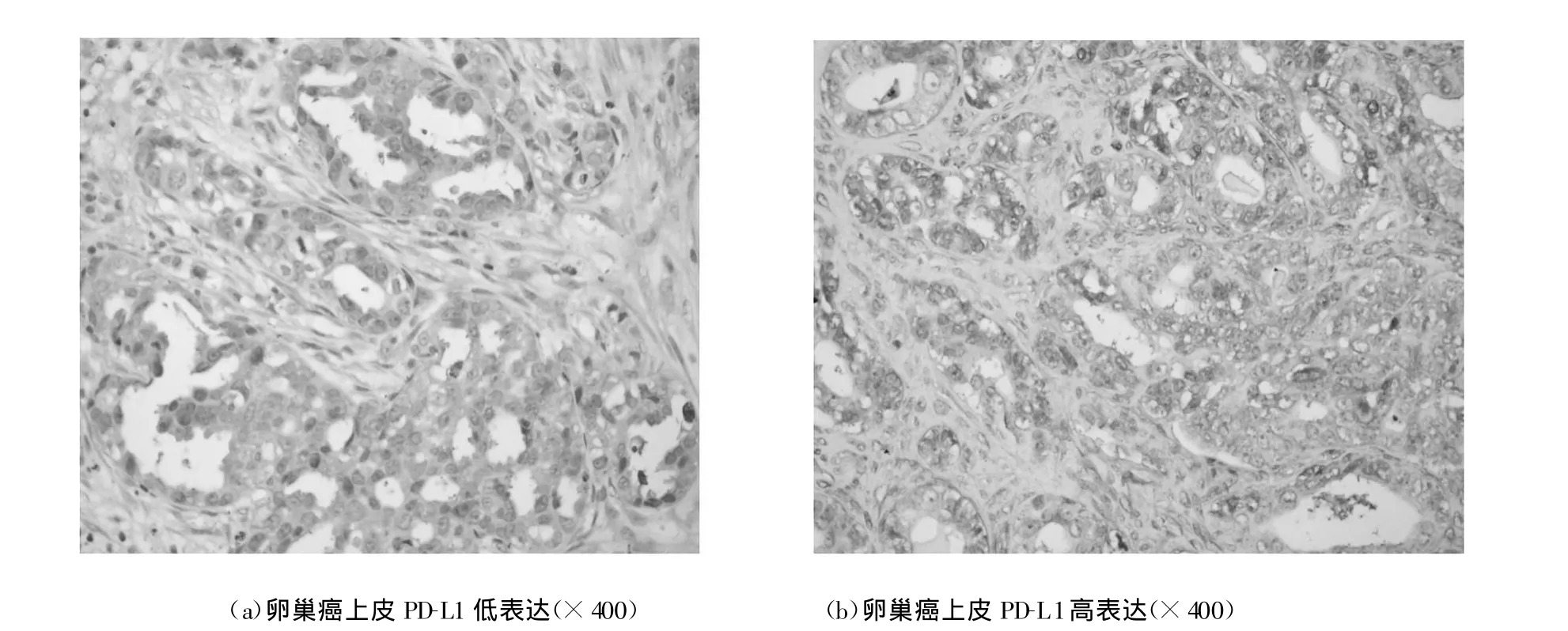
圖1 卵巢癌上皮細胞PD-L1的表達
腫瘤表達的抗原能夠被宿主的T細胞識別,但是腫瘤的清除卻很少。這一失敗的原因部分歸于腫瘤微環境的免疫抑制的存在。例如腫瘤細胞分泌各種免疫抑制分子例如TGF-β和可溶性MHCI類鏈相關分子[1、2]表達免疫抑制性分子Fas配體[3],誘導T細胞表達CTLA-4[4]。
近年來發現免疫抑制性受體PD-1在腫瘤的免疫逃逸中發揮重要作用。PD-1表達在活性T細胞及B細胞上,通過募集酪氨酸磷酸酶SHP-2來抑制它們的活性。T細胞、B細胞、DC、巨噬細胞、間充質干細胞等表達PD-Ll[5]。在非淋巴組織有廣泛表達,胸腺組織高表達 PD-L1,心臟、脾、腎、肝、肺、皮膚、肌肉也有不同程度的中等表達。此外有報道胎盤也表達PD-LI。
表達在抗原提呈細胞上的PD-Ls通過作用于T細胞上的PD-1,誘導T細胞無能或凋亡,因此外周組織表達PD-Ls直接抑制自身反應性淋巴細胞。近來研究發現許多腫瘤表達PD-Ll,包括乳腺癌、肺癌、結腸癌、卵巢癌、黑色素瘤、膀胱癌、肝癌、胃癌、神經膠質瘤、甲狀腺癌等均有報道[6-14]。此外PD-1在腫瘤浸潤淋巴細胞上調,這可能誘導免疫抑制[109]。PD-L1表達于卵巢癌上皮內,而非間質和浸潤CD8+T細胞,提示PD-L1抑制腫瘤內CD8+T細胞的移動[15]。值得注意的是近來研究還發現,表達PD-L1的腫瘤患者預后不好,例如腎癌、卵巢癌、膀胱癌,胃癌、乳腺癌和胰腺癌,此外這些研究提示腫瘤細胞高表達PD-L1的患者臨床分期晚,轉移早。
本研究中所有被檢測的卵巢癌患者腫瘤細胞的胞漿或(和)胞膜均表達PD-L1,癌細胞中PD-L1+癌細胞的平均比例51.2±11.0%,范圍12.1-80.1%。目前研究認為腫瘤細胞表達PD-Ll通過下列方面削弱機體對腫瘤的免疫應答:(1)PD-L1在腫瘤細胞上的表達削弱其免疫原性,影響其產生特異性T細胞應答,抑制腫瘤免疫應答的產生。(2)腫瘤細胞表達的PD-Ll能通過誘導特異性CTL的凋亡而使腫瘤細胞發生免疫逃逸[16]。(3)腫瘤組織中的巨噬細胞分泌的IL-10以及腫瘤細胞產生的VEGF均可上調DC表面PD-L1的表達,直接影響其激發T細胞產生抗腫瘤免疫應答的能力。
與其他腫瘤相比,卵巢癌PD-L1表達要高于其他惡性腫瘤,例如肺癌(50%),食道癌(44%),胃癌(42%),腎癌(37%)等,說明PD-L1可能在卵巢癌的抑制宿主免疫反應中發揮重要作用。Junzo研究發現接近50%卵巢癌患者表達PD-L2,與肺癌和食道癌相近。他還同時分析了PD-Ls與卵巢癌患者預后的關系,發現高表達PD-L1的患者與低表達或不表達PD-L1的患者相比預后差,而且PD-L1的表達與臨床病理分期和腫瘤的病理類型無相關性,和其他的預后指標例如淋巴結轉移及殘余病灶等相比PDL1的表達是獨立的預后指標。在腎癌食道癌及胃癌研究中發現PD-L1的表達也是獨立的預后指標[17-19]。但也有相反報道在肺癌中PD-Ls表達與預后的無相關性[20]。
在有關腫瘤細胞表達PD-Ls抑制CD8+T細胞功能的研究中,Junzo發現卵巢癌上皮內CD8+TIL可以預測患者的預后。卵巢癌PD-L1的表達與卵巢癌上皮內CD8+TIL的計數呈負相關,而PD-L2的表達與卵巢癌上皮內CD8+TIL的計數無關。
腫瘤表達PD-L1誘導腫瘤免疫逃逸,導致腫瘤生長,提示PD-1/PD-L1途徑可以作為腫瘤免疫治療的新靶點。實際上已有各種動物實驗研究發現阻斷PD-1或PD-L1,可以有效地清除腫瘤。
[1]Groh V,Wu J,Yee C,et al.Tumour-derived soluble MIC ligands impair expression of NKG2D and T-cell activation[J].Nature,2002,419(6908):734.
[2]Pardoll DM.Spinning molecularimmunology into successful immunotherapy[J].Nat Rev Immunol.2002(4):227.
[3]Lang K,Entschladen F,Weidt C,et al.Tumor immune escape mechanisms:impact of the neuroendocrine system[J].Cancer Immunol Immunother.2006,55(7):749.
[4]Collins M,Ling V,Carreno BM.The B7 family of immune-regulatory ligands[J].Genome Biol,2005;6(6):223.
[5]Yamazaki T,Akiba H,Iwai H,et al.Expression of programmed death 1 ligands by murine T cells andAPC[J].J Immunol,2002,169(10):5538.
[6]Dong H,Strome SE,Salomao DR,et al.Tumor-associated B7-H1 promotes T-cell apoptosis:a potential mechanism of immune evasion[J].Nat.Med.2002,8(8):793.
[7]Hamanishi J,Mandai M,Iwasaki M,et al.Programmed cell death 1 ligand 1 and tumor-infiltrating CD8+T lymphocytes are prognostic factors of human ovarian cancer[J].Proc.Natl.Acad.Sci.USA,2007,104(9):3360.
[8]Strome SE,Dong H,Tamura H,etal..B7-H1 blockade augments adoptive T-cell immunotherapy fors quamous cell carcinoma[J].Cancer Res,2003,63(19):6501.
[9]Inman BA,Sebo TJ,Frigola X,et al.PD-L1(B7-H1)expressionby urothelial carcinoma of the bladde rand BCG-induced granulomata:asso-ciations with localized stage progression[J].Cancer,2007,109(8):1499.
[10]Konishi J,Yamazaki K,Azuma M,et al.B7-H1 expression on nonsmall cell lung cancer cells and its relationship with tumor-infiltratin glymphocytes and their PD-1 expression.Clin[J].Cancer Res,2004,10(15):5094.
[11]Nakanishi J,Wada Y,Matsumoto K,et al.Over expression of B7-H1(PD-L1)significantly associates with tumor grade and postoperative prognosis in human urothelial cancers[J].Cancer Immunol Immunother,2007,56(8):1173.
[12]Nomi T,Sho M,Akahori T,Hamada K,et al.Clinical significance and therapeutic potential of the programmed death-1 ligand/programmeddeath-1 pathway in humanpancreatic cancer[J].Clin CancerRes,2007,13(7):2151.
[13]Thompson RH,Gillett MD,Cheville JC,et al.Costimulatory B7-H1 in renal cell carcinoma patients:indicator of tumor aggressiveness and potential therapeutic target[J].Proc.Natl.Acad.Sci.USA,2004,101(49):17174.
[14]Wu C,Zhu Y,Jiang J,et al.Immunohistochemical localization of programmed death-1ligand-1(PD-L1)ingastric carcinoma and its clinical significance[J].Acta Histochem,2006,108(1):19.
[15]Hamanishi J,Mandai M,Iwasaki M,et al.Programmed cell death 1 ligand 1 andt umor-infiltrating CD8 T lymphocytes are prognostic factors of humanovarian cancer[J].Proc.Natl.Acad.Sci.USA,2007,104(9):3360.
[16]Hirano F,Kaneko K,Tamura H,et al.Blockade of B7-H1 and PD-1 by monoclonal antibodies potentiates cancer therapeutic immunity[J].Cancer Res,2005,65(3):1089.
[17]Thompson RH,Kuntz SM,Leibovich BC,et al.Tumor B7-H1 is associated with poor prognosis in renal cell carcinoma patients with long-term follow-up[J].Cancer Res,2006,66(7):3381.
[18]Ohigashi Y,Sho M,Yamada Y,et al.Clinical significance of programmed death-1 ligand-1 and programmed death-1 ligand-2 expression in human esophageal cancer[J].Clin Cancer Res,2005,11(8):2947.
[19]Wu C,Zhu Y,Jiang J,et al.Immunohistochemical localization of programmed death-1 ligand-1(PD-L1)in gastric carcinoma and its clinical significance[J].Acta Histochem.2006;108(1):19.
[20]Konishi J,Yamazaki K,Azuma M,et al.B7-H1 expression on non-small cell lung cancer cells and its relationship with tumor-infiltrating lymphocytesand their PD-1 expression[J].Clin Cancer Res,2004,10(15):5094.

