水產抗氧化肽研究進展
謝寧寧,陳小娥,方旭波,余 輝
(浙江海洋學院食品與藥學院、醫學院,浙江舟山 316004)
近年來,抗氧化劑在國內外發展很快,用途也越來越廣。1956年HARMAN[1]提出了衰老的自由基理論(free radical theory of aging)之后,越來越多的人認識到人體內氧化產生的自由基與人的衰老和許多疾病有關。因此,許多抗氧化劑被用作功能因子開發,應用于保健食品及醫藥等行業。另外,抗氧化劑能延緩含脂肪食物的腐敗變質,它也被運用于食品保鮮儲藏工業。
抗氧化劑的種類很多,其中已經被廣泛使用的多為化學合成類抗氧化劑,由于其具有毒、副作用,各國政府紛紛對其強制規定了ADI值,控制其添加量[2]。1991年PROKORNY[3]提出,一些抗氧化肽和蛋白水解產物能降低自動氧化速率和脂肪的過氧化物含量,之后,尋找和制備高活性的蛋白源抗氧化劑,成為新的研究焦點。
在水產品加工工業中,不可避免地產生了許多廢棄低值蛋白,采用生物酶工程和發酵工程等手段,它們可以作為制備抗氧化肽的優良備選原料。同時,開發利用水產副產物中蛋白資源,有利于提高水產品的經濟附加值,降低環境污染。已經有許多研究者從多種水產品中制備出具有抗氧化性的活性肽,本文將針對這方面的研究與進展進行綜述。
1 氧化作用的危害及防治
很多證據顯示,活性氧(ROS)和自由基在許多退行性疾病如癌癥、動脈硬化及糖尿病等中起重要作用[4],它們的形成是呼吸過程中不可避免的。這些自由基非常地不穩定,它們能迅速地同機體中的其它基團或物質發生反應,導致細胞或組織的氧化損傷。生物機體依靠多種由酶系(SOD、GSH-Px、CAT、GST等)和非酶系(葡萄糖、維生素、氨基酸類等)物質組成的抗氧化體系,對抗活性氧及自由基。但是,這些防御體系并不能阻止所有氧化損傷。生物體通過補充含有抗氧化物質的成分,可以有效地減少氧化損傷對機體的危害。同樣,在食品工業中,由于脂質過氧化,導致食品產生異味、發臭和潛在的毒性物質等不良后果,容易造成不少經濟損失[5]。通過在食品中添加抗氧化劑,可以有效地對抗脂質過氧化,防止食物腐敗變質,避免浪費。
2 水產品抗氧化肽的原料
許多研究者對魚類、甲殼類、軟體動物進行了抗氧化活性的研究。AMAROWICZ和SHAHIDI[6]通過分離毛鱗魚Mallotus villosus蛋白水解液,得到一種在β-胡蘿卜素-亞油酸模型體系內具有穩定抗氧化活性的組分。SACHINDRA和BHASKAR[7]采用乳酸發酵蝦Penaeus mondon的廢棄物,制得的產物含有低分子量的蛋白類物質,并且其具有清除多種自由基和促滅單線態氧形成的作用。BINSAN等[8]以不同比例混合的去離子水和乙醇為介質,對白蝦Litopenaeus vannamei頭胸部提取出的抗氧化肽的活性和穩定性進行了研究。QIAN等[9]通過消化牡蠣Crassostrea gigas蛋白,獲得一種由13個氨基酸殘基組成的抗氧化肽段。
3 水產品抗氧化肽的制備
3.1 制備方法
3.1.1 蛋白酶水解法
通過酶水解蛋白制備抗氧化肽是目前普遍采用的一種方法。酶促水解反應具有條件溫和、易于控制,專一性較強、副反應產物少等優點。目前報道中許多水產品抗氧化肽的制備就是采用蛋白酶水解的方法。其中,由于底物的不同,制備抗氧化肽所選用的蛋白酶也不同。表1列舉了部分研究者制備水產品抗氧化肽所選用的酶。

表1 制備水產抗氧化肽選擇用酶Tab.1 The selection of proteolytic enzymes to prepare aquatic antioxidant peptides
另外,除采用外源蛋白酶外,有學者利用魚類含有的內源性蛋白酶,制備出水產抗氧化肽。SAMARANAYAKA和CHAN[19]利用太平洋鱈魚Merluccius productus肉中感染寄生蟲Kudoa paniformis產生的蛋白酶水解活性,制備鱈魚肉抗氧化肽,其中E-1h FPH組分在亞油酸自氧化體系中的抗氧化活性高于BHA和α-生育酚。JE等[20]采用自制的“鮐魚腸天然酶(MICE)”水解狹鱈Theragra chalcogramma魚排蛋白,魚排蛋白水解產物(APH)被分成5種分子量大小不同的組分,其中分子量最小的APH-V組分具有最高的抗氧化活性,通過純化之后的多肽樣品濃度為53.6 μmol/L時,羥自由基清除率為35%。
3.1.2 發酵法
許多水產品經發酵后,在微生物和內源酶的作用下,有機物質轉變成了小分子物質如肽類、氨基酸類和其它含氮化合物。其中的多肽和氨基酸不僅對發酵產物的風味起重要貢獻,而且對產品的抗氧化功效起到貢獻作用。發酵法與酶解法相比,能將微生物產酶和酶水解兩步合一,省去酶的分離和提純步驟,減少生產工序,降低成本。
RAJAPAKSE等[21]通過分離純化紫貽貝Mytilus edulis發酵液,制備出具有重復序列“HFGBPFH”的多肽,經檢測其具有較高的自由基清除能力、Fe2+螯合能力及提高氧化損傷細胞成活率的作用。PERALTA等[22]研究了菲律賓傳統食鹽發酵的蝦Acetes spp醬的抗氧化性,結果證明通過適當延長發酵時間,在有效地增加自由氨基酸含量的同時,也提高了蝦醬的抗氧化能力。
3.2 分離純化及結構鑒定
從目前報道的水產品抗氧化肽來看,分子量多集中在1 000 Da左右,氨基酸殘基的數目一般在20個以內,而且,在抗氧化肽粗品中,肽的種類較多,活性肽組分對外界環境條件也比較敏感,因此,分離純化較困難,通常采用單一的分離純化手段不能達到理想的分離效果。目前,普遍采用多種分離技術聯用的手段。一般的分離純化流程如圖1所示。
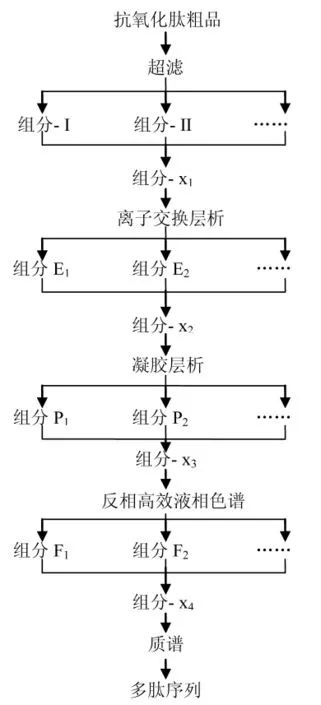
圖1 分離純化流程圖Fig.1 The flow chart of isolation and purification
超濾(UF)是膜分離技術的一種,實踐證明膜技術具有耗能低、設備小、操作管理方便和質量好等優點。近年來,超濾技術已經被應用于水產品抗氧化肽的分離純化。MENDIS等[13]采用10 kDa,5 kDa和3 kDa 3種膜截留魷魚皮明膠水解產物,初步篩選出小于3 kDa分子量的抗氧化活性最強組分。
離子交換色譜(IEC)是多肽分離純化過程中經常采用的方法,它是以離子交換劑為固定相,根據流動相中組分離子與交換劑上平衡離子進行可逆交換時,結合力大小差異而進行分離的一種層析方法。很多的研究者采用SP-Sephadex C-25陽離子交換色譜分離水產品抗氧化活性組分。如狹鱈Theragra chalcogramma魚排[20]、巨魷魚Dosidicus gigas肉[14]超濾活性組分等。
凝膠層析(GC)又稱凝膠排阻色譜、分子篩層析和凝膠過濾等,是利用分子大小和形狀差異進行分離的一種溫和、高效的方法。Sephadex G-25凝膠柱層析是分離小分子量水產抗氧化肽采用的最多的一種,如乳酸發酵蝦Penaeus mondon廢棄物[7]。另外,有學者采用Superdex Peptide10/300 GL凝膠柱純化牛蛙Rana catesbeiana Shaw[12]皮和草魚Ctenopharyngodon idellus[15]水解物。
為了獲得活性最高的多肽純化物,通常采用高效液相色譜(HPLC)法進行分離純化驗證。高效液相色譜是近年來肽的分離純化中廣泛應用的技術,主要用于10 kDa以下的極性小分子肽的分離純化。RAJAPAKSE等[21]采用nucleosil 100-7 C18 HPLC柱和Zorbax SB C18 HPLC柱兩步分離,制得962 Da的活性最高抗氧化肽純品。KIM等[16]將離子交換層析后的活性最高組分進一步經HPLC分離,分別采用了1次Capcell Pak C18UG-120柱和2次Synchropak RPP-100 RP-HPLC analytical柱,制得抗氧化肽純品。對最終制得的高純度抗氧化肽,通常采用質譜(CM)進行分子量的測定,推測其氨基酸序列。
4 水產抗氧化肽活性評估方法
評估水產抗氧化肽的活性,一般采用自由基清除能力、抗脂質自氧化能力、金屬離子螯合能力、協同抗氧化能力等多種評價方法進行體外活性實驗評估。經篩選出的具有抗氧化活性的物質可通過體內試驗進一步檢驗評估。
4.1 清除自由基
自由基是指一類可以獨立存在的含有未配對電子的物質,包括分子、原子、原子團或離子。主要包括超氧陰離子(O2-·)、過氧化氫(H2O2)、羥自由基(OH·)、單線態氧(1O2)等,這些自由基具有不穩定性和高反應性。抗氧化劑可以有效地將泄漏出來的、多余的活性氧等清除掉,從而保護細胞、組織免遭氧化損傷。
目前抗氧化肽的自由基清除效果,普遍采用自由基清除率來表示。二苯代苦味酰肼自由基 (1,1-diphenyl-2-picrylhydrazyl,簡稱DPPH)是一種較穩定的自由基。當有自由基清除劑存在時,DPPH自由基的單電子被分配而使其顏色變淺,利用分光光度法可以檢測自由基清除情況,從而評價樣品抗氧化能力。羥自由基是化學性質最活潑的活性氧自由基,它帶有1個不成對的電子,是對人體毒性最大的自由基,它反應速度極快,可以與活細胞中的大分子如蛋白和DNA發生反應而造成損害[23]。因此,較多的研究者選用以上2種自由基的清除率來評估水產蛋白水解產物的抗氧化性。
除此之外,超氧陰離子自由基[24]、過氧化氫自由基[25]等的清除率也被一些學者作為綜合評價水產多肽抗氧化能力的選擇方法。
4.2 抑制脂質自氧化
脂類的自氧化是造成食品質量下降最主要的化學因素之一。尤其是富含不飽和脂肪酸的食品,很容易氧化生成過氧化脂質,再經過分解、聚合等反應產生腐敗直至出現毒性。另一方面,在生物體內,癌癥的發生以及衰老也都與體內脂肪的氧化有關。因此,脂類常作為被氧化的底物用來檢測樣品的抗氧化能力。
水產抗氧化肽抑制脂質自氧化的效果,一般采用以亞油酸為氧化底物的亞油酸模型系統。亞油酸通過吸收空氣中的氧進行自動氧化反應,產生脂肪酸氫過氧化物。水產抗氧化肽的添加,可以抑制自氧化反應。通過比較兩種情況下的氫過氧化物的含量,來評估抑制脂類自氧化的效果。很多報道均采用硫氰酸鐵法[26]檢測氫過氧化物的含量。該法的原理是亞鐵離子可被氫過氧化物氧化成高鐵離子,其反應為Fe2++2H++O→Fe3++H2O,然后加入硫氰酸銨與Fe3+形成紅色的絡合物,其在540 nm處有強吸收值,通過比色即可測出氫過氧化物的含量。
4.3 金屬離子螯合能力
過渡態金屬離子如Fe2+和Cu2+能催化不飽和脂質氧化過程中自由基的形成[27],而水解產生的多肽的羧酸基團和氨基基團具有金屬離子螯合能力,因此,能夠削弱脂質的氧化。由于水解過程中多肽的斷裂,導致了肽片段濃度的增加,從而有助于清除羥自由基中的金屬離子,產生抗氧化性。
DONG等[10]研究了鰱魚蛋白水解物的金屬離子螯合活性。隨著水解時間的增加,水解產物的螯合活性增強。其中,在任何時間段時,堿性蛋白酶的水解產物的活性均比風味蛋白酶高。經堿性蛋白酶水解6 h的水解物的金屬離子螯合活性最高,達92.97%。并且螯合活性和水解度(DH)之間存在線性關系。結果證明低分子量的水解產物具有較高的金屬離子螯合活性。
4.4 協同抗氧化性
在水產品水解物中也有協同抗氧化活性肽的報道。這類抗氧化肽本身的抗氧化能力比較低,但是在與其它一些抗氧化劑同時使用時,具有很強的抗氧化效果。JE等[20]研究了狹鱈魚排的水解產物,經超濾膜過濾后的5種組分中,僅APH-Ι無協同抗氧化性,其它組分在亞油酸模型系統中均具有同α-生育酚的協同抗氧化性。
4.5 細胞損傷模型
最近幾年,越來越多的研究者采用細胞損傷模型評估抗氧化活性。氧化作用在細胞的損傷死亡中扮演重要角色,通過添加抗氧化劑對抗細胞中產生的氧化作用,能夠提高細胞的成活率。MENDIS等[13]通過建立人工培養的人類肺臟纖維細胞模型,采用MTT法,檢測t-BHP介導的氧化損傷細胞的成活率,結果顯示,在與天然抗氧化劑α-生育酚相比時,魷魚皮明膠多肽能顯著提高細胞成活率。
4.6 體內實驗
通過體內實驗驗證樣品的抗氧化性,是活性評估中最重要的一環。通常將受試物連續飼喂大鼠或小鼠1-3月,然后處死,測定其血或組織(如肝、腦)中MDA、單胺氧化酶(MAO-B)及抗氧化酶SOD、谷胱甘肽過氧化物酶(GSH-Px)及過氧化氫酶(CAT),同對照組比較,若 MDV、MAO-B 降低,SOD、GSH-Px、CAT 等升高,則說明受試物具有抗氧化能力。
林琳和李八方[28]研究了具有清除自由基作用的魷魚多肽的體內抗氧化活性。采用D-半乳糖致衰的小鼠模型,結果表明分子量小于2 kDa的多肽組分,能夠提高小鼠血液及皮膚中SOD和GSH-Px的活力,降低MDA含量,并提高小鼠皮膚中Hyp的含量。
5 影響水產抗氧化肽活性的因素
5.1 水解過程因素
通過水解制備出的抗氧化肽的活性與底物原料、酶的種類、酶解溫度、酶解時間、酶的加入量、pH、以及酶解產物的水解度(DH)等許多因素有關。
KLOMPONG等[18]采用堿性蛋白酶和風味蛋白酶水解黃斑紋鲹魚蛋白制得2種水解產物分別為HA和HF。采用不同的酶,活性宜有變化。當水解度增加時,HA的DPPH自由基清除活性和還原能力增強,HF并無此現象。HA和HF的金屬離子螯合能力均隨著水解度的增加而增強。并且,在相同的水解度時,HF的金屬離子螯合能力通常比HA高。在低水解度(DH=5%)時,HA的DPPH自由基清除活性較好,同時,在高的水解度(DH=25%)時,HF的還原能力較好。也有研究者研究了堿性蛋白酶處理的鰱魚蛋白水解產物,羥自由基清除活性和亞油酸過氧化抑制率分別在水解時間為1.5 h和2.0 h時達到最大值,證明鰱魚水解蛋白抗氧化能力是與水解度和水解時間相關[10]。
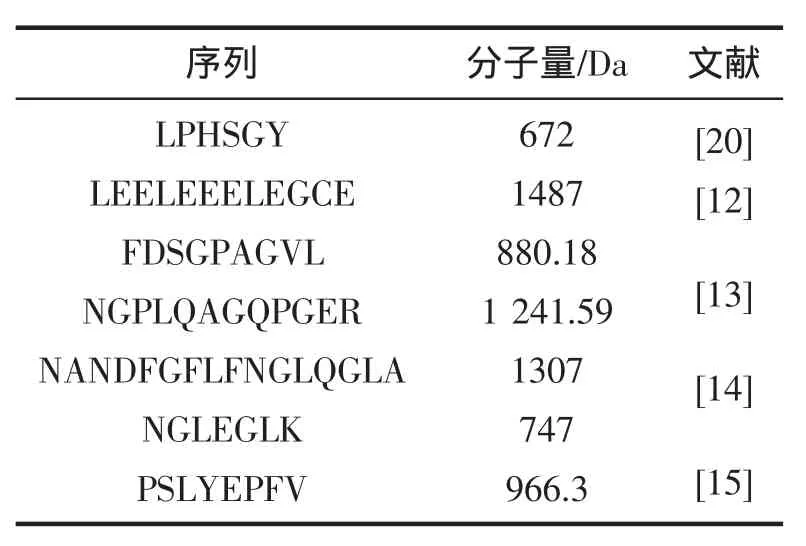
表2 水產抗氧化肽的序列結構及分子量Tab.2 The peptide sequence and molecular weight of aquatic antioxidant peptides
5.2 肽的化學結構
抗氧化肽的功能特性較多地受分子結構和分子量的影響[29,30]。MURASE等[31]認為,抗氧化肽的疏水性增強了它的抗氧化性和乳化效果,并且,這類多肽在同非肽類抗氧化劑協同時具有比較強的協同效果。CHEN等[32]認為組氨酸含量較高的多肽,具有金屬離子螯合作用。另外,一些其它的氨基酸,比如,組氨酸、脯氨酸、丙氨酸和亮氨酸,被報道對自由基清除有貢獻作用[33]。SUETSUNA等[30]報道了亮氨酸出現在C端具有抗氧化性,并認為在多肽結構中芳香族氨基酸的酚羥基基團能夠作為有效的電子供體。MENDISA等[13]報道了魷魚皮明膠抗氧化肽P1和P2的抗氧化性來源于序列中富含間隔的“親水-疏水”序列,同時,由于分子量較低,P1比P2具有更高的抗氧化特性。表2為部分水產抗氧化肽的序列結構及分子量。
另外,除以上兩方面外,抗氧化肽所處的pH、溫度等外界條件同樣影響活性的發揮。BISAN等[8]研究表明,白蝦抗氧化肽,在pH 2~11,溫度為25~100℃范圍內,FARP、TBARS和DPPH 3種活性仍然高于80%。活性肽在100℃加熱30 min時,3種活性稍微降低,30~120 min時,3種活性維持在80%左右,120~150 min時,DPPH活性稍微降低。
6 水產抗氧化肽研究展望
我國是水產品加工大國,每年都會產生大量的低值水產品下腳料蛋白資源,開發利用水產抗氧化肽將具有不菲的經濟效益和社會意義。水產抗氧化肽能有效地清除體內的活性氧自由基,保護細胞和線粒體的正常結構和功能,同時防止食品脂質過氧化變質,在醫藥和食品領域具有廣泛的應用前景。但水產抗氧化肽的研究中仍有不少問題需要解決。第一、有關抗氧化能力的測定方法很多,但是通用的方法很少,使得各種實驗缺乏可比性,需統一抗氧化能力測定標準;第二、水產抗氧化肽單一組分和不同組分協同作用的機制等還有待深入研究;第三、有關水產抗氧化肽的活性研究大多缺乏臨床試驗,體內抗氧化機理還需要進一步深入研究;第四、對于水產抗氧化肽在濃縮干燥過程中的活性損失,還缺乏系統性的深入研究;第五、在抗氧化肽分離純化的研究中,鹽的存在一定程度上會影響抗氧化活性的測定,但是脫鹽問題一直沒能得到很好的解決;第六、目前的分離純化手段很難純化得到分子量很小、由2~3個氨基酸組成的肽段,這也是大多數研究報道所得到的抗氧化肽分子量都大于500 Da的原因之一。
[1]HARMAN D.Aging:a theory based on free radical and radiation chemistry[J].Journal of gerontology,1956,11(3):298-300.
[2]GB 2760-1996食品添加劑使用衛生標準[S].
[3]PROKORNY J.Natural antioxidants for food use[J].Trends Food Sci Technol,1991,2(9):223-227.
[4]BECKMAN K B,AMES B N.The free radical theory of aging matures[J].Physiological Reviews,1998,78(2):547-581.
[5]MAILLARD M N,SOUM M H,BOIVIN P,et al.Antioxidant activity of barley and malt:Relationship with phenolic content[J].Food Science and Technology,1996,29(3):238-244.
[6]AMAROWICZ R,SHAHIDI F.Antioxidant activity of peptide fractions of capelin protein hydrolysates[J].Food Chemistry,1997,58(4):355-359.
[7]SACHINDRA N M,BHASKAR N.In vitro antioxidant activity of liquor from fermented shrimp biowaste[J].Bioresour Technol,2008,99(18):9 013-9 016.
[8]BINSAN W,BENJAKUL S,VISESSANGUAN W,et al.Antioxidative activity of Mungoong,an extract paste,from the cephalothorax of white shrimp(Litopenaeus vannamei)[J].Food Chemistry,2008,106(1):185-193.
[9]QIAN Z J,JUNG W K,BYUN H G,et al.Protective effect of an antioxidative peptide purified from gastrointestinal digests of oyster,Crassostrea gigas against free radical induced DNA damage[J].Bioresource Technology,2008,99(9):3 365-3 371.
[10]DONG S Y,ZENG M Y,WANG D F,et al.Antioxidant and biochemical properties of protein hydrolysates prepared from silver carp(Hypophthalmichthys molitrix)[J].Food Chemistry,2008,107(4):1 485-1 493.
[11]YANG J L,HO H Y,CHU Y J,et al.Characteristic and antioxidant activity of retorted gelatin hydrolysates from cobia(Rachycentron canadum)skin[J].Food Chemistry,2008,110(1):128-136.
[12]QIAN Z J,JUNG W K,KIM S K,et al.Free radical scavenging activity of a novel antioxidative peptide purified from hydrolysate of bullfrog skin,Rana catesbeiana Shaw[J].Bioresource Technology,2008,99(6):1 690-1 698.
[13]MENDIS E,RAJAPAKSE N,BYUN H G,et al.Investigation of jumbo squid(Dosidicus gigas)skin gelatin peptides for their in vitro antioxidant effects[J].Life Sciences,2005,77(17):2 166-2 178.
[14]RAJAPAKSE N,MENDIS E,BYUN H,et al.Purification and in vitro antioxidative effects of giant squid muscle peptides on free radical-mediated oxidative systems[J].The Journal of Nutritional Biochemistry,2005,16(9):562-569.
[15]REN J Y,ZHAO M M,SHI J,et al.Purification and identification of antioxidant peptides from grass carp muscle hydrolysates by consecutive chromatography and electro spray ionization-mass spectrometry[J].Food Chemistry,2008,108(2):727-736.
[16]KIM S,JE J,KIM S.Purification and characterization of antioxidant peptide from hoki(Johnius belengerii)frame protein by gastrointestinal digestion[J].The Journal of Nutritional Biochemistry,2006,18(1):31-38.
[17]JE Y J,QIAN Z J,BYUN H G,et al.Purification and characterization of an antioxidant peptide obtained from tuna backbone protein by enzymatic hydrolysis[J].Process Biochemistry,2007,42(5):840-846.
[18]KLOMPONG V,BENJAKUL S,KANTACHOTE D,et al.Antioxidative activity and functional properties of protein hydrolysate of yellow stripe trevally(Selaroides leptolepis)as influenced by the degree of hydrolysis and enzyme type[J].Food Chemistry,2007,102(4):1 317-1 327.
[19]SAMARANAYAKAA A G P,CHAN E C Y L.Autolysis-assisted production of fish protein hydrolysates with antioxidant properties from Pacific hake(Merluccius productus)[J].Food Chemistry,2008,107(2):768-776.
[20]JE J Y,PARK P J,KIM S K.Antioxidant activity of a peptide isolated from Alaska Pollack(Theragra chalcogramma)frame protein hydrolysate[J].Food Research International,2005,38(1):45-50.
[21]RAJAPAKSE N,MENDIS E,JUNG W K,et al.Purification of a radical scavenging peptide from fermented mussel sauce and its antioxidant properties[J].Food Research International,2005,38(2):175-182.
[22]PERALTE E M,HATATE H,KAWABE D,et al.Improving antioxidant activity and nutritional components of Philippine saltfermented shrimp paste through prolonged fermentation[J].Food Chemistry,2008,111(1):72-77.
[23]CACCIUTTOLO M A,TRINH L,LUMPKIN J A,et al.Hyperoxia induces DNA damage in mammalian cells[J].Free Radic Biol Med,1993,14(3):267-276.
[24]GUO Q,ZHAO B,SHEN S,et al.ESR study on the structure-antioxidant activity relationship of tea catechins and their epimers[J].Biochimica et Biophysica Acta(BBA)-General Subjects,1999,1 427(1):13-23.
[25]HIRAMOTO K,JOHKOH H,SAKO K I,et al.DNA breaking activity of the carbon-centered radical generated from 2,2-azobis-(2-amidinopropane)-hydrochloride(AAPH)[J].Free Radic Res,1993,19(5):323-332.
[26]OSAWA T,NAMIKI M.Natural antioxidants isolated from eucalyptus leaf waxes[J].Journal of Agriculture and Food Chemistry,1985,33(3):777-780.
[27]STOHS S J,BAGEHI D.Oxidative mechanisms in the toxicity of metal ions[J].Free Radical Biology and Medicine,1995,18(2):321-336.
[28]林 琳,李八方.魷魚皮膠原蛋白水解肽抗氧化活性研究[J].中國海洋藥物雜志,2006,25(4):48-51.
[29]JEON Y J,BYUN H G,KIM S K.Improvement of functional properties of cod frame protein hydrolysates using ultra filtration membranes[J].Process Biochemistry,1999,35(5):471-478.
[30]SUETSUNA K,UKEDA H,OCHI H.Isolation and characterization of free radical scavenging activities peptides derived from casein[J].Journal of Nutritional Biochemistry,2000,11(3):128-131.
[31]MURASE H,NAGAO A,TERAO J.Antioxidant and emulsifying activity of N-(long-chain-acyl)histidine and N-(longchainacyl)carmnosine[J].Journal of Agricultural and Food Chemistry,1993,41(3):1 601-1 604.
[32]CHEN H M,MURAMOTO K,YAMAUCHI F,et al.Antioxidative properties of histidine-containing peptides designed from peptide fragments found in the digests of a soybean protein[J].Journal of Agricultural and Food Chemistry,1998,46(1):49-53.
[33]KIM S K,KIM Y T,BYUN H G,et al.Isolation and characterization of antioxidative peptides from gelatin hydrolysate of Alaska Pollack skin[J].Journal of Agricultural and Food Chemistry,2001,49(4):1 984-1 989.

