1-[18F]氟代乙基-L-色氨酸的半自動化合成
孫 婷,王世真,唐剛華,李兆隴
(1.中國醫學科學院北京協和醫學院,北京協和醫院核醫學科,北京 100730;2.中山大學附屬第一醫院 核醫學科,廣東廣州 510080;3清華大學 化學系,北京 100084)
18F-氟脫氧葡萄糖(18F-FDG)是目前臨床應用最廣泛的一種PET顯像劑,它可以反映體內葡萄糖代謝。但18F-FDG PET顯像的特異性不高,不是所有腫瘤細胞對18F-FDG都有攝取,而且有時炎癥也出現陽性,難以區分炎癥和腫瘤[1,2]。
腫瘤細胞的生長除了需要大量攝取葡萄糖,還需要大量氨基酸,尤其是必需氨基酸。腫瘤濃集氨基酸的主要原因是腫瘤細胞氨基酸代謝高于正常組織,表現在氨基酸需要量增加和氨基酸轉運增加兩個方面[2]。根據這一特點,設計新型氨基酸類似物,尋找新的 PET顯像劑,彌補FDG顯像的不足,特別是對炎癥和腫瘤的鑒別。最近 Lee等研究核素標記的酪氨酸18F-FET與18F-FDG在小鼠炎癥和腫瘤模型對比顯像,發現18F-FET在區分炎癥腫瘤方面有可能克服FDG的不足[3],并在腦腫瘤顯像方面日益顯示出一定的潛力[4]。
幾乎所有的氨基酸都可進行11C標記,如甘氨酸、丙氨酸、纈氨酸、半胱氨酸、天冬氨酸、絲氨酸、酪氨酸、苯丙氨酸、脯氨酸、賴氨酸和環丁氨酸等[5]。但11C的半衰期只有20 min,使其應用受到限制;18F的半衰期為110 min,可用于較長時間、復雜的放化合成標記,是較理想的標記用同位素。18F標記方法分為親核反應和親電反應兩種[6]。用分子態氟(18F·F)進行的親電反應對設備要求高,副產物多,分離純化復雜,因此,其推廣應用深受限制。目前國內的18F標記研究多采用離子態氟(18F-)進行親核氟化,但只有少數具有活潑基團的氨基酸才能夠采用這種親核氟化標記方法。
已用18F標記的氨基酸有酪氨酸[4,7-8]、蛋氨酸[9]、亮氨酸[10]、3,4-二羥苯基-L-丙氨酸(L-多巴)[11]等,其中臨床應用最廣泛的氟標記氨基酸是L-多巴[11]。最近李瑞芬等[12]合成了一種新型5-羥基色氨酸衍生物5-18FEHTP。上述標記的氨基酸大多數是含有酚羥基或巰基等活潑基團的氨基酸。而色氨酸既是必需氨基酸,又是體內唯一含有吲哚環的氨基酸,但它不含有酚羥基或巰基,標記困難,國內外均未見到直接在吲哚環上進行18F標記的報道。
本研究擬采用親核氟化方法及18F-FET的合成思路,使用多功能合成模塊,設計并合成新的PET顯像劑1-[18F]氟代乙基-L-色氨酸(1-[18F]FETrp),期望用于炎癥和腫瘤的鑒別。
1 實驗設計及合成路線
根據色氨酸結構特點,除了功能團外,在吲哚環的N-H鍵用氟乙基取代,形成1-FETrp,具有化學反應的可行性,步驟簡單,符合放射化學合成的要求[13]。但吲哚環上的氮不活潑,必須先將氨基和羧基保護,才能夠與1-氟-2-對甲苯磺酰基乙烷(FCH2 CH2 OTs)反應,最后脫掉氨基和羧基保護。合成路線示于圖1。
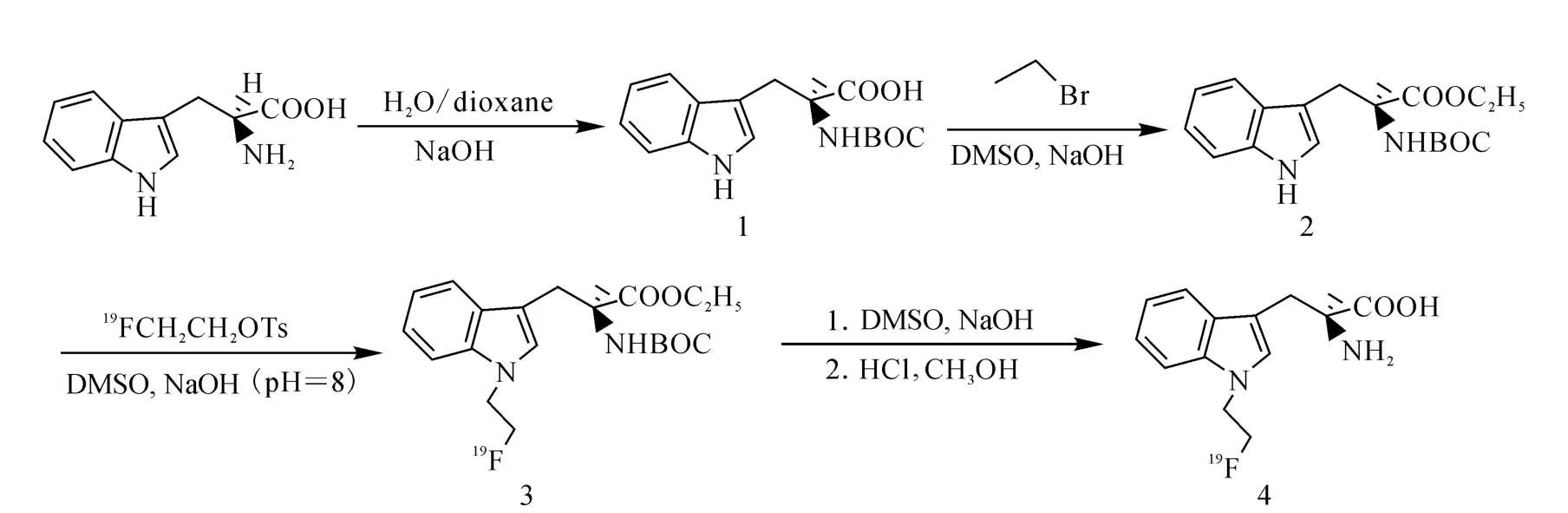
圖1 1-[19 F]FETrp的合成路線
2 實驗方法
2.1 儀器與試劑
JOEL JNM-ECA 300型核磁共振波譜儀:清華大學產品;Bruker Esquire-LC/MSn型質譜儀:Bruker Daltonics公司產品;高效液相層析紫外檢測器:配1200Series二元泵,安捷倫科技有限公司產品;Finpak SIL C-18S HPLC分析柱(4.6 mm×150 mm),日本JASCO產品;放射性檢測器:美國BIOSCAN產品;計算機控制化學合成模塊(CPUC):北京PET公司產品;固相萃取柱(Sep-Pak):Waters公司產品。
無水 DMSO、無水乙腈、無水 K2 CO3、氨基聚醚K2.2.2購于Sigma-A ldrich;1,2-對甲苯磺酰基乙烷購于 Tokyo KASEI,其他試劑購于北京化學試劑公司。
2.2 1-[19 F]FETrp的合成
2.2.1 1-氟-2-對甲苯磺酰基乙烷(19FCH2 CH2OTs)的合成
將3.15 g(10 mmol)四正丁基氟化銨三水合物溶于30m L無水乙腈中,在N2保護下加熱至90℃,蒸干溶劑。再加入30 m L無水乙腈,蒸干溶劑,重復3次,得到黃色油狀物,然后在N2保護下加入30 m L溶有3.7 g(10 mmo l)TsOCH 2 CH 2OTs的無水乙腈,90℃下反應6 h,蒸干溶劑,產物用硅膠柱分離,洗脫劑為V(石油醚)∶V(乙酸乙酯)=10∶1。所得產品為淡黃色油狀物,0.76 g,產率60%,熔點21~22 ℃[14]。
2.2.2 N-BOC-L-色氨酸(1)的合成
L-色氨酸4.08 g(20 mmol)置于200m L圓底燒瓶,加入100 m L水和1,4二氧六環的混合物(體積比為 1∶1)和 1 mol/L氫氧化鈉(NaOH)20 m L,然后緩慢滴入 4.36 g(20 mm ol)二碳酸二叔丁酯。室溫下攪拌24 h,用1 mol/L鹽酸將反應液pH調至2.4,用乙酸乙酯萃取2次,每次40 m L,干燥、減壓蒸干得到白色固體 4.56 g。產率 75%,熔點 136~138 ℃[15]。
2.2.3 N-BOC-L-色氨酸乙酯(2)的合成
將3.04 g(10 mm ol)N-BOC-L-色氨酸溶于30 m L無水二甲基亞砜(DM SO)中,加入0.48 g(12 mm ol)NaOH,加熱到 40℃,攪拌20 m in。加入2.16 g(20mm ol)溴乙烷,再快速攪拌2 h,此后加入120 m L去離子水,析出淡黃色固體,過濾、干燥,得到固體3.1 g。分別采用硅膠柱和雙相重結晶方法對產品進行分離。硅膠柱分離:所得粗品溶于少量二氯甲烷,過硅膠柱;洗脫劑為石油醚與乙酸乙酯,洗脫梯度依次為10∶1、8∶1和6∶1;得到2.39 g化合物2,白色固體,產率72%,熔點168℃。雙相重結晶分離:將所得粗品加熱溶于10 m L乙酸乙酯,加入6倍體積的石油醚,靜置5 h,出現針狀白色晶體,過濾、干燥得到化合物2。此法操作簡單,適合大量制備,但產率只有60%,低于硅膠柱分離法。
2.2.4 N-BOC-1-氟乙基-L-色氨酸乙酯(3)的合成
0.996 g(3mmol)化合物2溶于6m L無水DMSO,加入NaOH 0.12 g(3mm ol),室溫下攪拌 5 min,加入19FCH2 CH2 OTs 0.654 g(3mmol),繼續攪拌20min,產物中加入30m L去離子水,用乙酸乙酯萃取3次,每次10m L,合并有機相,以無水MgSO4干燥。蒸干溶劑,得到0.685 g產物。將所得產物溶于少量二氯甲烷,用硅膠柱分離;按照石油醚與乙酸乙酯濃度比為20∶1、18∶1、15∶1、12∶1和 10∶1依次洗脫。最后得到0.325 g化合物3。產品為白色固體,產率30%,熔點99~101℃。
2.2.5 1-[19F]FETrp(4)的合成
0.225 g化合物3溶于3m L無水DMSO,加入1 m ol/L NaOH 0.72 m L(1.2 equiv),室溫下攪拌15 m in。加入17 m L去離子水,乙酸乙酯萃取后,用1 mo l/L鹽酸將水相調pH至2.4,用乙酸乙酯萃取3次,每次10 m L,合并有機相,干燥、減壓蒸干溶劑,得到淡黃色固體。在該物質中加入10 m L飽和鹽酸甲醇溶液,室溫下攪拌30min,減壓蒸干溶劑,得到的產物用乙酸乙酯洗3次,每次5 m L,干燥,得到化合物4的鹽酸鹽形式,為白色固體,久置后呈淡黃色。產率80%,留樣備用,作為合成1-[18F]FETrp的標準品。
2.2.6 HPLC分析
將上述各種中間產物及1-[19F]FET rp進行HPLC分析,檢測波長為254 nm。配制不同的流動相,根據產物保留時間的長短,選擇適合的流動相和流速。
2.3 自動化合成
多功能合成模塊主要包括18F-分離、氟化水解和HPLC分離等部分。它是由氣體傳輸系統、真空泵、反應瓶、貯液瓶、接收瓶、廢物瓶、閥門、分離小柱,HPLC、電加熱、管路及計算機控制系統等組成。
2.3.1 C1-[19F]FETrp的半自動化合成
24 mg19FCH2CH2OTs和24 mg N-BOCL-色氨酸乙酯前體溶解在1m L無水DMSO/NaOH(pH=9)中,在反應瓶中通入氮氣攪拌,加熱至100℃,反應10min,反應液中加入1m L 8 mol/L鹽酸,水解 10 min,此后加入 1 m L 8m ol/L NaOH 中和,用 HPLC分析,檢測波長254 nm。
2.3.2 1-[18F]FET rp的半自動化合成
采用18O(p,n)F核反應生成F-,應用2m L H2O[18O]富氧水(95%)靶,在回旋加速器上用16.5 MeV、25μA的質子束流連續轟擊20m in,得到反應所需要的18F-富氧水溶液。富集在QMA離子交換樹脂柱上的18F-用1.5 m L K2.2.2溶液洗脫至反應瓶,通入氮氣,在116℃下蒸干。加入2m L乙腈除去殘留水,加入1m L溶有8 mg(NH2OTs)2的無水乙腈,95℃反應5min。冷卻,加入10 m L無水乙醚,過硅膠小分離柱(Silica Sep-Pak,Waters公司),蒸除乙醚。加入溶有8 mg N-BOC-L-色氨酸乙酯的無水DMSO/NaOH(pH=9)1m L,120℃攪拌反應15 min。加入 1 m L 8 m ol/L HCl水解,100℃密閉反應10min,最后加入1m L 8 mol/L NaOH中和。
酵母菌與人類的生產生活關系密切。在史前時期,酵母菌就幫助人類的祖先釀酒,人類才開始有甘潤醇香的美酒享用。約在6 000年前,酵母菌開始幫助人類發面,人類開始有松軟的饅頭、面包享用。
3 結果與討論
3.1 標準品1-[19 F]FETrp的合成與鑒定
1-[19F]FET rp的合成雖然比較復雜,國內外均未見到有關報道,但是從化學反應機制考慮,反應可以進行。1-[19F]FETrp標準品的合成采用有機合成方法,以色氨酸為原料,經七步反應,每一步都分離純化,得到目標產物。采用ESI-MS、1H NMR和13C NMR對各個中間產物和終產物進行結構鑒定。
(1)19FCH2CH2OTs的鑒定結果。ESIMS:m/z=241[M+Na]+;1H NMR(300 MHz,CDCl3):δ7.75(d,2H,J=7.9),7.31(d,2H,J=7.9),4.17(s,1H),4.53(d t,2H,JH-F=47.0 Hz,JH-H=4.80 Hz),4.21(dt,2H,JH-F=27.5 H z,JH-H=4.80 H z),2.40(s,3H)[13]。
(2)N-BOC-L-色氨酸鑒定結果。ESI-MS:m/z=327[M+Na]+;1H NMR(CDCl3):δ 8.13(br,1H,Ind-NH),7.61(d,1H,J=7.6H z,Ind-7-H),7.37(d,1H,J3=8.1Hz,Ind-4-H),7.15~7.11(m,2H,Ind-5,6-H),7.03(s,1H,Ind-2-H),5.06(br,1H,NHBoc),4.68~4.64(m,1H,C*H),3.37~3.31(m,2H,NH2)1.43(s,9H,CH3)。
(3)N-BOC-L-色氨酸乙酯鑒定結果。ESIMS:m/z=355[M+Na]+;1H NMR(300 MHz,CDCl3):δ8.12(s,1H),7.55(d,1H,J=8.01 H z),7.33(d,1H,J=7.89 H z),7.07~7.21(m,2H),6.99(s,1H),5.08(br,1H),4.62(br,1H),4.11(m,2H),3.28(br,2H),1.41(s,9H),1.16(t,3H);13C NMR(75 MHz,CDCl3):δ172.4、155.4、136.2、127.8 、122.8、122.2、119.6、118.9、111.2、110.4 、79.9 、61.4 、54.4 、28.4 、14.2 。
(4)N-BOC-1-氟乙基-L-色氨酸乙酯鑒定結果。ESI-MS:m/z=401[M+Na]+;1H NMR(300 MHz,CDCl3):δ7.59(d,1H,J=7.53 Hz),7.18~7.32(m,2H),7.13(t,1H,J=7.21 H z),6.96(s,1H,J=7.53 H z),4.64(dt,2H,JH-F=47.0 Hz,JH-H=4.80 H z),4.64(m,1H),4.30(dt,2H,JH-F=26.1 Hz,J H-H=4.80 H z),4.29(m,2H),3.29(br,2H),1.45(s,9H),1.20(t,3H,J=7.20 Hz);13C NMR(75 MH z,CDCl3):δ172.2、155.3、136.2、128.5 、126.8、121.9、119.4、119.1、109.7、109.1 、82.3(J=172.5 Hz),79.7 、61.3 、54.3 、46.4(J=22.5 H z),28.3 、27.9 、14.0 。
(5)1-[19F]FETrp鑒定結果。ESI-MS:m/z=273[M+Na]+;1H NMR(300 MHz,D2O):δ7.46(d,1H,J=8.01 Hz),7.18(d,1H,J=8.01 Hz),6.96~7.14(m,3H),4.51(dt,2H,JH-F=46.95 Hz,JH-H=4.80 H z),4.04~4.30(m,3H),3.19(m,2H);13C NMR(75 MHz,D2O):δ171.7 、136.4 、128.6 、127.2 、122.2 、119.7 、118.5 、110.0 、106.2 、83.5(J=165 Hz),53.2 、45.9(J=15 Hz),25.5。
1-[19F]FET rp合成過程中,最關鍵的一步反應是吲哚環氟乙基化,反應能否進行,取決于強堿能否順利將吲哚環N上的氫奪下[16]。實驗發現,在奪氫這步反應中,盡量保證無水條件和較快的攪拌速率,可以加快反應進程并提高產率。這步反應原料用的是保護的氨基酸,酯鍵在堿性條件下極易水解,因此堿的選用非常關鍵。強堿會使酯鍵水解,弱堿奪氫困難,反應速度慢,產率低,不適合放化反應的要求。工作中曾用氫氧化鈉、叔丁醇鉀、碳酸鉀三種堿奪氫,但叔丁醇太強,碳酸鉀太弱。溶劑的選用也比較重要,曾使用的多種溶劑中,只有用DMSO時發生反應。用NaOH和 DMSO,氟乙基化反應產率為30%,水解的產率為 80%,這 2步的總產率為24%。
3.2 1-[19 F]FETrp的 HPLC分析
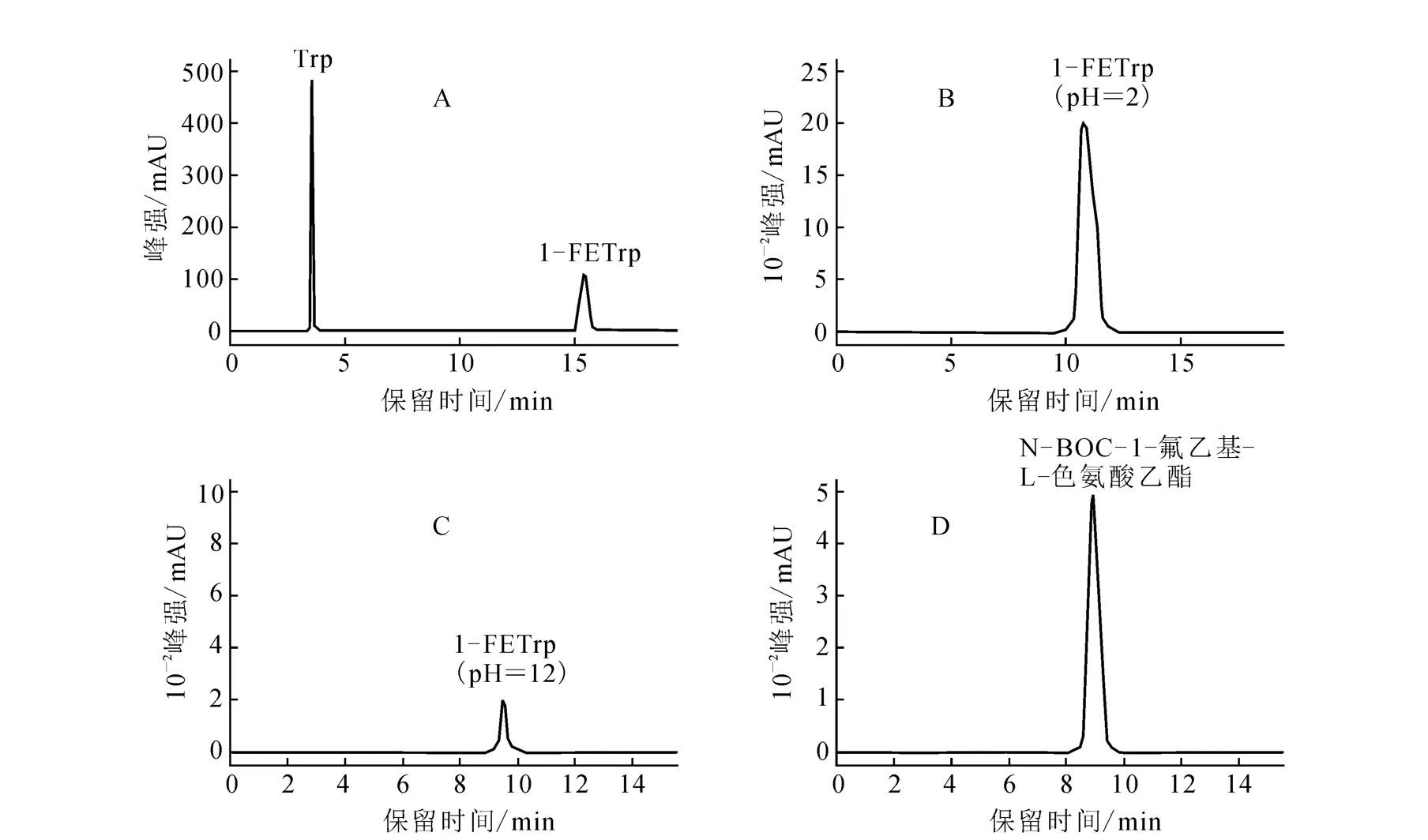
圖2 中間產物各標準品紫外吸收峰
3.3 1-[19 F]FETrp的半自動化合成
冷實驗反應條件不適于微量的放射化學合成,因此將此反應路線半自動化,尋找適合放化合成的反應條件。根據本實驗室現有設備,以及合成自動化加藥的限制,只能將奪氫反應與親核反應一步完成,先將強堿溶于溶劑,制備DMSO/NaOH溶液。尋找合適的堿強度,以及反應溫度、時間。通過多次實驗,結果發現,在反應液pH為7時,加熱到100℃,反應10 min已經有產物生成,但是產率很低。隨著pH的升高,產率逐漸增加,但是pH過高時,由于酯鍵的水解加速,形成了羧基,使得氟乙基與羧基鹽反應,不與吲哚N反應,產物也將減少,甚至得不到產物。因此,將反應液pH調為8,在100℃下反應10m in,此條件下可以得到少量的產物。水解反應已經比較成熟,只要反應液中鹽酸濃度達到4 m ol/L,100℃10min即可大部分水解。
3.4 1-[18F]FETrp的半自動化合成
3.4.1 半自動化合成條件的確定
本工作使用親核氟化方法標記了新型色氨酸類似物1-[18F]FET rp。1-[18F]FET rp的放化合成需要三步反應,因此采用二鍋法實現自動化操作。第一步是合成18FCH 2 CH 2OTs,第二步是N-BOC-L-色氨酸乙酯的氟乙基化反應,第三步是水解脫BOC和脫酯。合成最關鍵的一步是氟烷基化反應,這步反應的標記率決定了總的放化產率。
與冷實驗相比,氟烷基化熱實驗反應條件苛刻,要求高,產率低;需要更強的堿性、更高的溫度和更長的反應時間。實驗結果表明,18FNH2NH2OTs的放化產率約為30%~35%,整個合成過程大約需要 20 min;第二步反應中,18FCH2CH2OTs在堿性條件下,極易水解成18F-,使放化產率很低。在冷實驗的基礎上分別測試了反應溫度、時間、pH等因素對合成的影響,結果表明,只有當兩種前體的質量比為1∶1、pH達到9時,100℃下反應 20 m in,才能生成少量的N-BOC-1-[18F]氟乙基-L-色氨酸乙酯,將反應溫度升高到120℃,反應時間可縮短至15min。
3.4.2 各步產物的HPLC分析
對第一步反應產物進行HPLC分析,流動相為V(乙腈)∶V(水)=50∶50,流速2 m L/min,結果示于圖 3。由圖 3 可見,18FCH2CH2OTs保留時間為2.8 min;反應前體N-BOC-L-色氨酸乙酯保留時間為5.0m in。在9.3 m in處出現新放射峰,與標準品N-BOC-1-氟乙基-L-色氨酸乙酯保留時間一致(圖2D),由此可推斷新放射峰為N-BOC-1-氟乙基-L-色氨酸乙酯的放射峰。反應投入148 MBq的18F-,得到 51.8 MBq18FCH2CH2OTs,放化產率35%;氟乙基化得到 N-BOC-1-[18F]氟乙基-L-色氨酸乙酯 3.8 MBq,這步反應產率僅為8.6%。于是增加投入252 MBq的18F-,經過水解得到3.7 MBq 1-[18F]FETrp,對該步反應的產物進行 HPLC分析,流動相 0.1 mol/L NaH2PO4-5%EtOH,流速 2 m L/min,分析結果示于圖4。圖4中新出現的放射性吸收峰保留時間為9.1min,與標準品1-[19F]FETrp在pH值為12時的保留時間(圖2C)一致。由圖4放射吸收峰的積分面積計算可得,該步反應的產率為1.5%。經過至少 20 min的 HPLC分離純化,根據半衰期計算產率,終產物放化產率不到1%,因此,未繼續加大放射性投入量進行進一步分離純化實驗。
1-[18F]FET rp的放化產率很低,與冷實驗條件下所得結果不符合,與反應本身的特點有關。反應前體N-BOC-L-色氨酸乙酯在堿性條件下極易發生酯鍵水解,使氟乙基與羧基反應,不與吲哚的N反應。反應中吲哚N基團不活潑,存在酯鍵競爭反應,只有酯鍵水解的速度明顯低于吲哚奪氫的速度,才能夠得到目標產物。要提高產率,盡量提高18FCH2CH2OTs的投入量,至少要使兩種原料的比例適合,在冷實驗中,投入的氟乙基量和色氨酸前體的量大致相等,因此,反應產率較高,反應容易進行。放化合成反應屬于微量反應,計算的產率是放化產率而不是產物的劑量。18FCH2CH2OTs的質量是可估算的,遠遠小于色氨酸前體的質量,致使產率較低。從反應結果推測,在第二步親核取代反應過程中,產生大量的18F-,使產率較低。另外,放化合成時,第一步親核反應結束,18FCH2CH2OTs中可能存在少量分離不完全的TsOCH2CH2OTs參與第二步親核反應,使反應復雜,副產物增多,產率降低。
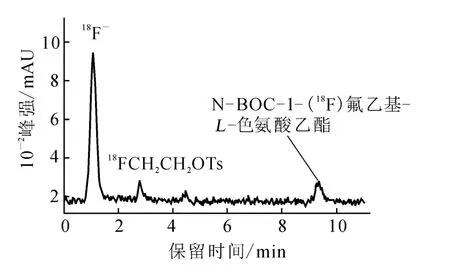
圖3 第一步反應產物的HPLC分析
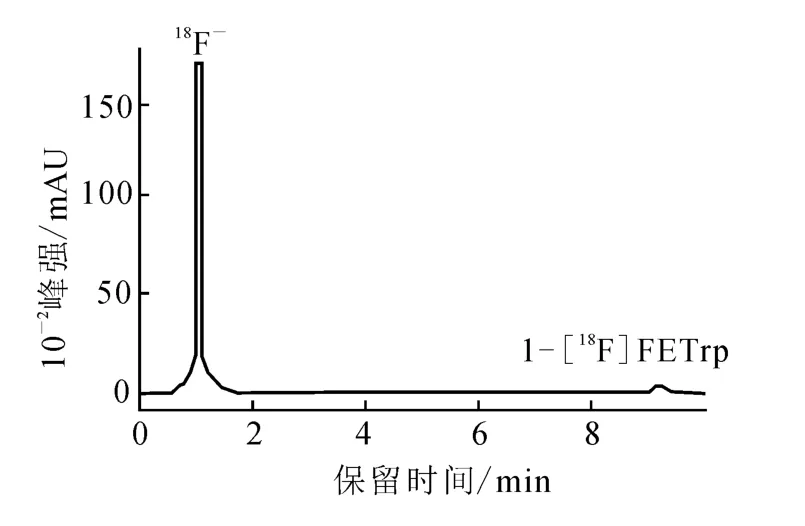
圖4 第二步合成產物的HPLC分析
4 結 論
本實驗采用半自動化法合成了新型氟標記色氨酸類似物1-[18F]FETrp,總合成時間為50 min,分離純化前,總放化產率1.5%;由于放化產率低,合成時間長,目前尚不適合推廣應用,今后需要嘗試其他堿性試劑或者尋找新的合成路線。
致謝:感謝中科院化學研究所博士生郝鵬、申淼,清華大學化學系博士生嚴曉宇、廖騫、研究生劉蘊東、陸文超在實驗中給予的熱心幫助;感謝中山大學附屬第一醫院核醫學科易暢在實驗中給予的幫助;感謝滕寶在論文書寫方面給予的指導和幫助。
[1] 屈婉瑩,周前.PET在腫瘤學中的應用前景[J].中華核醫學雜志,2003,23(增刊):1-3.
[2] Jager PL,Vaalburg W,Pruim J,et al.Radiolabeled am ino acids:basic aspects and clinical app lications in onco logy[J].J Nucl Med,2001,42(3):432-445.
[3] Lee TS,Ahn SH,Moon BS,et al.Comparison of18F-FDG,18F-FET and18F-FLT for differentiation between tumor and inflammation in rats[J].Nucl Med Biol,2009,36(6):681-686.
[4] Fedorova OS,Kuznetsova OF,Shatik SV,et al.18F-labeled ty rosine derivatives:synthesis and experimental studies on accumulation in tumors and abscesses[J].Bioorg Khim,2009,35(3):334-343.
[5] Jager PL,de Korte MA,Lub-de Hooge MN,et al.Molecular imaging:what can be used today[J].Cancer Imaging,2005,23(5):S27-S32.
[6] Elsinga PH.Radiopharm aceutical chem istry for positron em ission tomography[J].Methods,2002,27(3):208-217.
[7] Tang Gang-hua,Wang Ming-fang,Tang Xiao-lan,et a l.Synthesis and evaluation of O-(3-[18F]fluorop ropy l)-L-ty rosine as an onco logic PET trace[J].Nucl Med Biol,2003,30(7):733-739.
[8] 黨永紅,王世真,程欣,等.O-(2-[18F]氟代乙基)-L-酪氨酸的合成及臨床實驗[J].中國醫學科學院學報,2002,(4):370-372.
[9] Tang Gang-hua,Wang Ming-fang,Tang Xiao-lan,et al.Full automated synthesis modu le for preparation of S-(2-[18F]fluoroethy l)-L-methionine by direct nucleophilic exchange on a quaternary 4-aminopyrid nium resin[J].Nuclar Medicine and Bio logy,2003,30:509-512.
[10]Nye JA,Schuster DM,Yu W,et al.Biodistribution and radiation dosimetry o f the synthetic nonmetabolized amino acid analogue anti-18F-FACBC in humans[J].J Nucl Med,2007,48(6):1 017-1 020.
[11] Hardy OT,Hernandez-Pampaloni M,Saffer JR,etal.A ccuracy of[18F]fluorodopa positron emission tomography for diagnosing and localizing focal congenital hyperinsu linism[J].JClin Endocrinol Metab,2007,92(12):4 706-4 711.
[12]李瑞芬,吳戰宏,王世真,等.O-(2-[18F]氟代乙基)-5-羥基-L-色氨酸的合成、生物分布及 Micro-PET顯像[J].同位素,2009,22(2):65-70.
[13]Thomas SR,Mohr D,Stocker R.Nitric oxide inhibits indo leam ine 2,3-dioxygenase activity in interferon-gamma primed mononuclear phagocytes[J].J Biol Chem,1994,269(20):14 457-14 464.
[14]H eiss P,Mayer S,HerzM,et al.Investigation of transportmechanism and up take kinetics of O-(2-[18F]fluorop ropy l)-L-ty rosine in vitro and in vivo[J].JNucl Med,1999,40:1 367-1 373.
[15]H e Yong-bing,Qin Hai-juan,Xu Kuo-xi,et al.Enantioselective recognition by optically active chira l fluorescence sensors bearing amino acid units[J].Tetrahedron:Asymmetry,2005,(16):3 042-3 048.
[16]Pascal Marchand,Marcle Le Borgne,Young Min NA,et al.Synthesis and Antileishmanial A ctivity of 3-(a-Azo ly lbenzy l)indoles[J].Journal o f Enzyme Inhibition and Medicinal Chemistry,2002,17(6):353-358.

