豬血多肽鐵螯合鹽的制備工藝*
汪學榮,鄭炯,闞建全
1(西南大學動物科學系,重慶,402460) 2(西南大學食品科學學院,重慶,400715)
豬血多肽鐵螯合鹽的制備工藝*
汪學榮1,鄭炯2,闞建全2
1(西南大學動物科學系,重慶,402460) 2(西南大學食品科學學院,重慶,400715)
研究了豬血多肽與鐵鹽進行螯合反應的條件,并測定了豬血多肽鐵螯合鹽的成分。試驗表明:氯化亞鐵適合作為多肽與鐵進行螯合反應的鐵源,豬血多肽鐵螯合鹽的最佳制備工藝條件為,pH值5、多肽與亞鐵鹽質量比4∶1、多肽溶液濃度3.0%,豬血多肽鐵螯合鹽的主要成分是多肽和鐵,其質量分數分別為70.02%和12.23%。
豬血多肽,鐵,螯合鹽,制備
鐵是生物體必需的重要營養元素,缺鐵會產生多種疾病。WHO報道,世界上男性缺鐵性貧血的平均發病率為10%,女性為20%,孕婦達40%,兒童高達52%。我國各類人群缺鐵性貧血的平均發病率為20%,其中婦女和兒童的發病率較高,育齡婦女缺鐵性貧血的發病率高達35%,兒童為30%~50%。為了防止缺鐵性貧血的發生,就需要經常從食物中補鐵。目前補鐵劑主要有無機鐵、有機鐵、氨基酸鐵和生物鐵四類。早在20世紀70年代,有研究者發現氨基酸和小肽具有促進鐵吸收的作用[1-2],并且氨基酸和肽的金屬螯合物具有吸收率高,口感好,無鐵銹味,無胃腸道刺激,添加到食品中不影響食品性質,而且不易分解等優點,因此研究具有雙重功能的補鐵劑——多肽鐵螯合鹽具有十分重要的意義。有研究者對脫脂豆粕多肽、酪蛋白酶解多肽、低值魚蛋白多肽與鐵離子進行螯合制備多肽鐵螯合鹽進行過報道[3-4],本文以豬血多肽為原料,研究其與鐵鹽制備豬血多肽鐵螯合鹽的工藝條件,篩選出最佳的制備工藝參數,以期為豬血多肽鐵螯合鹽的工業化制造提供有益借鑒和參考。
1 材料與方法
1.1 原輔料
豬血多肽粉,實驗室自制。
氯化亞鐵、硫酸亞鐵、抗壞血酸、無水乙醇、鄰菲羅啉、鹽酸羥胺、氫氧化鈉、HCl,均為分析純試劑。
1.2 主要儀器與設備
752型紫外分光光度計,上海精密科學儀器有限公司;SHZ-Ⅲ循環水真空泵,上海亞榮生化儀器廠;HH-S數顯恒溫水浴鍋,江蘇省金壇市富華儀器有限公司;DZF-6021型真空干燥箱,上海齊欣科學儀器有限公司;ESJ120-4型電子分析天平,沈陽龍騰電子有限公司;PHS-3C+智能酸度計,四川成都世紀方舟科技儀器有限公司離心機。
1.3 試驗方法
1.3.1 測試指標
(1)鐵含量:鄰菲羅啉比色法[5]。
(2)鐵螯合率/%=(m1/m0)×100
式中:m1,螯合物中鐵的量(mg);m0,加入反應體系中鐵的總量(mg)。
式中:m1,多肽鐵螯合鹽總量(mg);m0,反應物總重量(mg)。
(4)水分:直接干燥法[6]。
(5)多肽:微量凱氏定氮法[7]。
(6)氯化鈉:容量法[8]。
1.3.2 豬血多肽鐵的螯合方法
(1)分別準確稱取3.0 g豬血多肽于5個錐形瓶中,將其配制成溶液濃度為30g/L,待多肽完全溶解后,加入1.0%的抗壞血酸,然后加入1.0 g氯化亞鐵(多肽與鐵的質量比為3∶1),用質量分數20%的NaOH或HCl溶液分別調pH值至3、4、5、6、7,充N2,于室溫下混合反應10 min,冷卻后將反應液在4000 r/min下離心20 min,上清液用無水乙醇處理得到沉淀,抽濾,收集濾渣,并反復洗滌抽濾2~3次,最后真空干燥得多肽螯合鐵,測定鐵含量。以上試驗重復3次,取算術平均值。
(2)分別準確稱取豬血多肽1.0、2.0、3.0、4.0、5.0 g于5個錐形瓶中,加蒸餾水溶解,使多肽溶液濃度為3.0%,待多肽完全溶解后,加入1.0%的抗壞血酸,然后分別加入1.0 g氯化亞鐵,使多肽與鐵的質量比分別為1∶1,2∶1,3∶1,4∶1,5∶1,用質量分數20%的 H Cl溶液調 p H值為5,充 N2,于室溫下混合反應10 min,冷卻后將反應液在4000 r/min的轉速離心20 min,上清液用無水乙醇處理得到沉淀,抽濾,收集濾渣,并反復洗滌抽濾2~3次,最后真空干燥得多肽螯合鐵,測定鐵含量。以上試驗重復3次,取平均值。
(3)分別準確稱取3.0 g豬血多肽于5個錐形瓶中,加蒸餾水溶解,使多肽溶液濃度分別為1.0%、2.0%、3.0%、4.0%、5.0%,待多肽完全溶解后,加入1.0%的抗壞血酸,然后分別加入1.0 g亞鐵鹽(多肽與亞鐵鹽質量比為3∶1),用質量分數20%的 H Cl溶液調 p H值為5,充 N2,于室溫下混合反應10 min,冷卻后將反應液在4000 r/min的轉速離心20 min,上清液用無水乙醇處理得到沉淀,抽濾,收集濾渣,并反復洗滌抽濾2~3次,最后真空干燥得多肽螯合鐵,測定鐵含量。以上試驗重復3次,取平均值。
(4)分別準確稱取3.0 g豬血多肽于5個錐形瓶中,加蒸餾水溶解,使多肽溶液濃度為3.0%,待多肽完全溶解后,加入1.0%的抗壞血酸,然后分別加入1.0 g氯化亞鐵,用20%的 H Cl溶液調 p H值為5,充N2,分別在15、25、35、45、55℃下混合反應10 min,冷卻后將反應液在4000 r/min的轉速下離心20 min,上清液用無水乙醇處理得到沉淀,抽濾,收集濾渣,并反復洗滌抽濾2~3次,最后真空干燥得多肽螯合鐵,測定鐵含量。以上試驗重復3次,取平均值。
(5)分別準確稱取3.0 g豬血多肽于5個錐形瓶中,加蒸餾水溶解,使多肽溶液濃度為3.0%,待多肽完全溶解后,加入1.0%的抗壞血酸,然后分別加入1.0 g氯化亞鐵,用20%的 H Cl溶液調 p H值為5,充氮氣,于25℃下混合反應10、20、30、40、50 min,冷卻后將反應液在4000 r/min的轉速下離心20 min,上清液用無水乙醇處理得到沉淀,抽濾,收集濾渣,并反復洗滌抽濾2~3次,最后真空干燥得多肽螯合鐵,測定鐵含量。以上試驗重復3次,取平均值。
2 結果與分析
2.1 亞鐵鹽種類的選擇
多肽螯合鐵在乙醇等有機溶劑中的溶解度極小,如果選擇能夠溶解于有機溶劑中的亞鐵鹽作為鐵源與多肽進行螯合反應,反應完成后用有機溶劑進行處理,剩余的游離鐵和多肽就能夠溶解于有機溶劑中,而生成的多肽螯合鐵則從有機溶劑中沉淀析出,這樣就可以使螯合鐵和游離鐵分離,從而得到純凈的多肽螯合鐵。室溫下,比較了硫酸亞鐵和氯化亞鐵在不同體積分數乙醇溶液中的溶解情況,結果見表1。
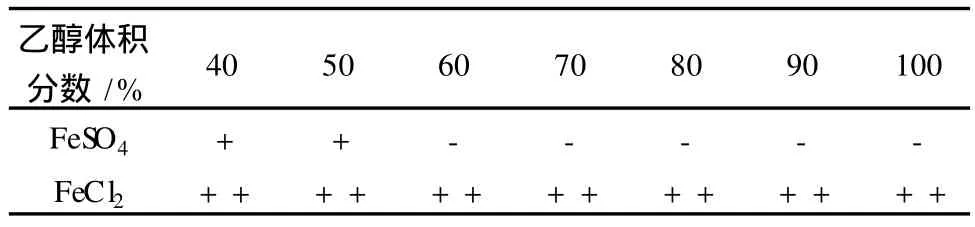
表1 兩種亞鐵鹽在乙醇溶液中的溶解情況
從表1中可看出,硫酸亞鐵在體積分數40%~50%的乙醇溶液中只有部分溶解,在60%~100%的乙醇溶液中,硫酸亞鐵的溶解度幾乎完全不溶解。因此,若將硫酸亞鐵作為鐵源用于合成多肽螯合鐵,螯合反應完成后不能使游離金屬離子和螯合物分離。由于氯化亞鐵能完全溶于不同濃度的乙醇溶液中,同時試驗研究表明三氯化鐵也能溶于乙醇溶液中,因此可以用乙醇處理反應液,游離的Fe2+或Fe3+溶解在乙醇中,而多肽螯合鐵在乙醇溶液中沉淀析出。因此,將氯化亞鐵作為鐵源,可以實現有機鐵和無機鐵的分離,進而提高產品純度。
2.2 豬血多肽鐵螯合鹽的制備工藝研究
2.2.1 pH值對螯合反應效果的影響
以鐵螯合率和多肽鐵螯合鹽得率為測試指標,研究pH值對螯合反應效果的影響,結果見圖1。
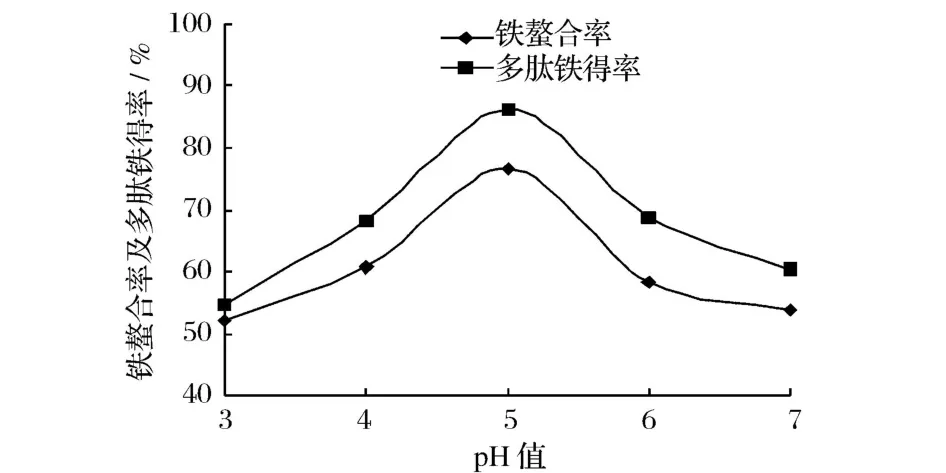
圖1 pH值對螯合反應效果的影響
由圖1可知,隨著pH值的升高,鐵螯合率和多肽鐵螯合鹽得率均先增加后降低,當pH值為5時,二者均達到最大值。這是因為在pH較低的酸性條件下,H+將與金屬離子競相爭奪供電子基團,從而不利于金屬螯合物的形成;隨著pH的升高,意味著溶液中OH-增加,游離鐵離子與OH-結合形成羥合Fe2+(氫氧化亞鐵)的機會增加,也不利于螯合鐵鹽的生成[9]。因此可初步確定螯合反應的較適pH為5。
2.2.2 豬血多肽與亞鐵鹽質量比對螯合反應效果的影響
以鐵螯合率和多肽鐵螯合鹽得率為測試指標,研究豬血多肽與亞鐵鹽質量比對螯合反應效果的影響,結果見圖2。
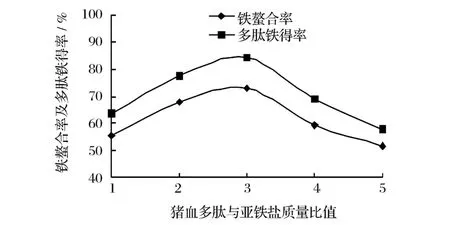
圖2 豬血多肽與亞鐵鹽質量比對螯合反應效果的影響
豬血多肽與亞鐵鹽的質量比是影響螯合反應的一個重要因素,質量比太小,不能形成穩定的環狀結構,螯合物不穩定;質量比太大,會造成多肽的浪費[10]。從圖2可看出,隨著豬血多肽與亞鐵鹽質量比的增加,鐵螯合率和多肽鐵螯合鹽得率均先增加后降低。因此可初步確定豬血多肽與亞鐵鹽的較適質量比為3∶1。
2.2.3 豬血多肽溶液濃度對螯合反應效果的影響
以鐵螯合率和多肽鐵螯合鹽得率為測試指標,研究多肽溶液濃度對螯合反應效果的影響(見圖3)。
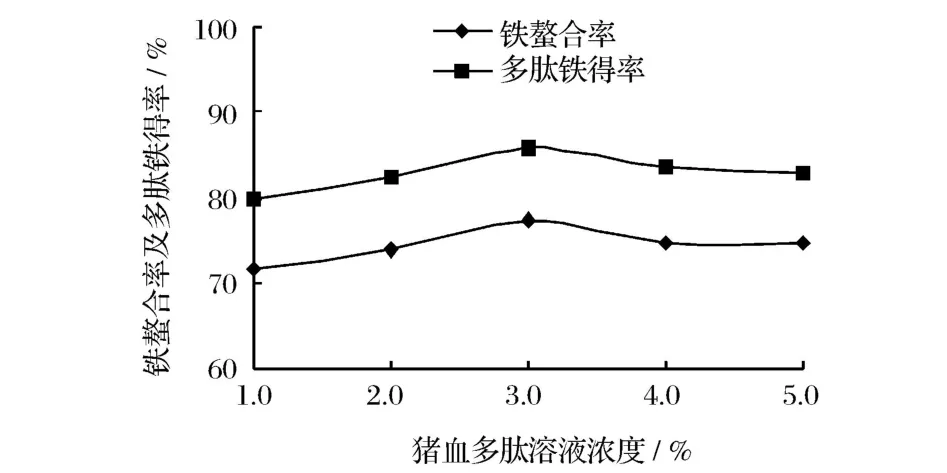
圖3 豬血多肽溶液濃度對螯合反應效果的影響
由圖3可知,隨著豬血多肽溶液濃度的升高,鐵螯合率和多肽鐵螯合鹽得率均逐漸升高,但是當多肽溶液濃度大于3.0%時,鐵螯合率和多肽鐵螯合鹽得率有所降低,這可能是隨著多肽溶液濃度的升高,多肽溶液的溶解性降低,從而導致鐵螯合率和多肽鐵螯合鹽得率降低。因此,多肽溶液濃度以3.0%為宜。
2.2.4 溫度對螯合反應效果的影響
以鐵螯合率和多肽鐵螯合鹽得率為測試指標,研究溫度對螯合反應效果的影響,結果見圖4。
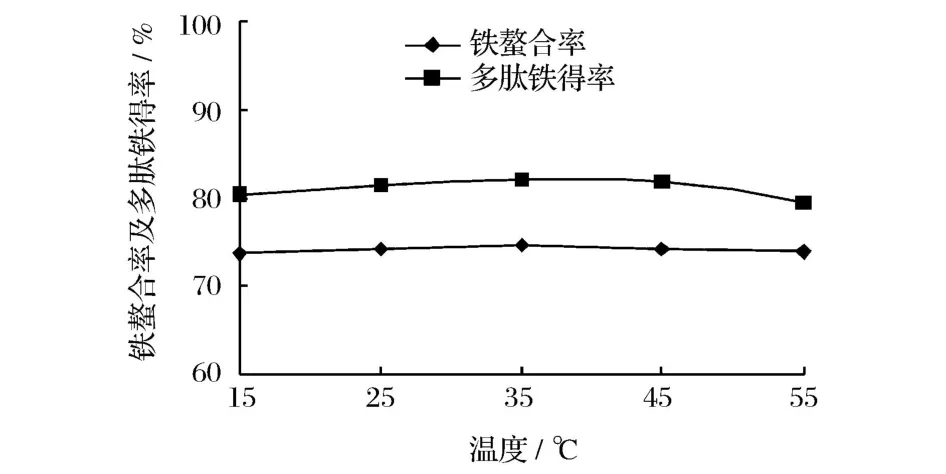
圖4 溫度對螯合反應效果的影響
從圖4可以看出,不同溫度條件下,鐵螯合率和多肽鐵螯合鹽得率基本相同,說明反應溫度對螯合反應效果的影響不大,多肽與鐵的螯合反應在室溫條件下就可以完成。此結果與文獻[11]的報道一致。因此,螯合反應在25℃(室溫)條件下反應即可。
2.2.5 時間對螯合反應效果的影響
以鐵螯合率和多肽鐵螯合鹽得率為測試指標,研究時間對螯合反應效果的影響,結果見圖5。
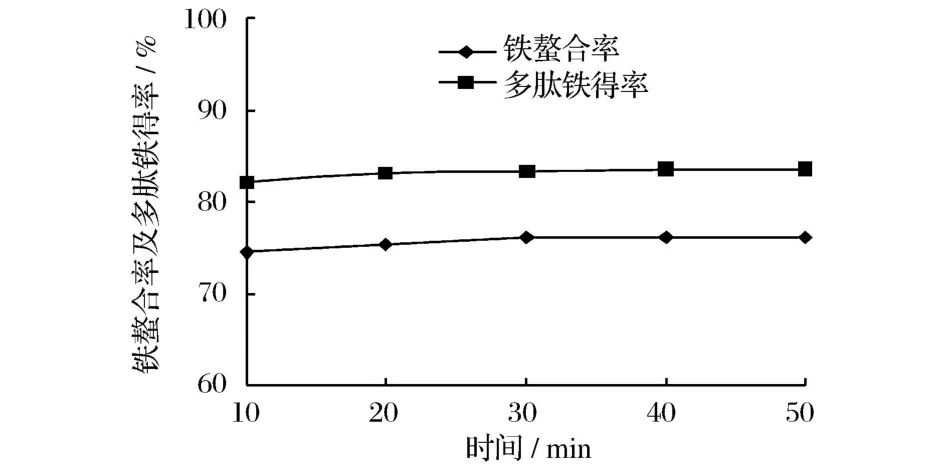
圖5 時間對螯合反應效果的影響
由圖5可知,不同的反應時間,鐵螯合率和多肽鐵螯合鹽得率基本相同,說明時間對螯合反應效果的影響不大,多肽與鐵鹽的螯合反應是一個快速反應。此結果與文獻[12]的報道一致。因此,選取反應時間為30 min。
2.2.6 豬血多肽鐵螯合鹽制備工藝條件的優化
在上述單因素試驗的基礎上,以pH值、多肽與亞鐵鹽質量比和多肽溶液濃度為試驗因素,以鐵螯合率為測試指標,擬通過L9(34)正交試驗篩選出豬血多肽鐵螯合鹽制備的最佳工藝參數,因素水平見表2,正交試驗結果與極差分析見表3,方差分析見表4。

表2 因素水平表
由表3極差分析可知,對螯合反應效果影響因數由主至次依次為pH值,多肽與亞鐵鹽質量比,多肽溶液濃度,豬血多肽鐵螯合鹽制備的最佳工藝參數為pH值5,多肽與亞鐵鹽質量比4∶1,多肽溶液濃度3.0%。從表4方差分析可看出,pH值對螯合反應效果有極顯著影響,多肽與亞鐵鹽質量比對螯合反應效果有顯著影響,多肽溶液濃度對螯合反應效果無顯著影響。
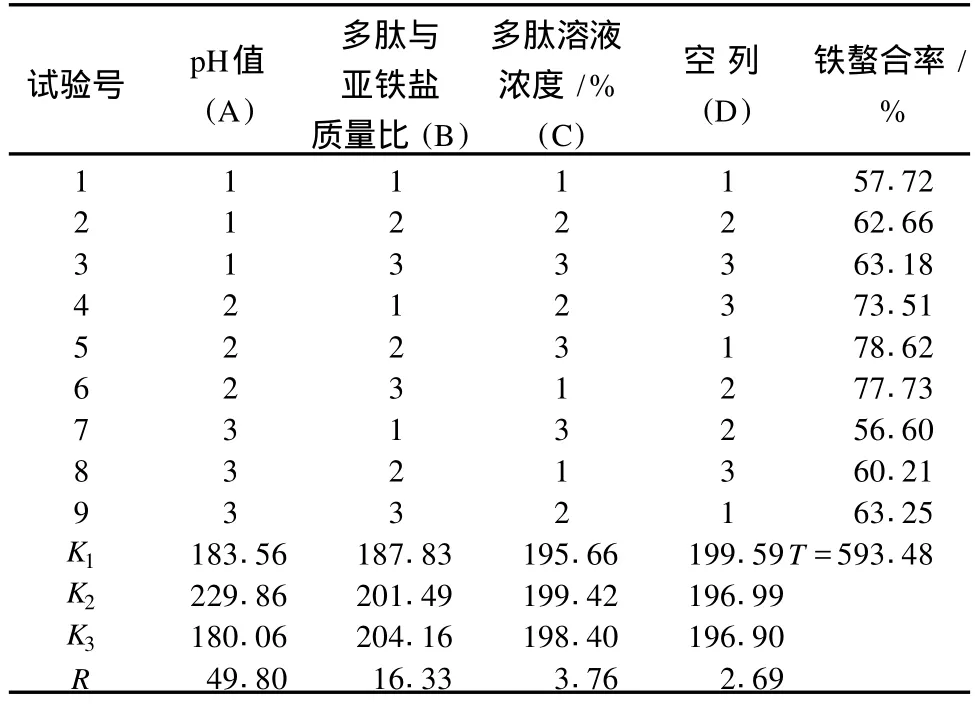
表3 L9(34)正交試驗結果與極差分析表
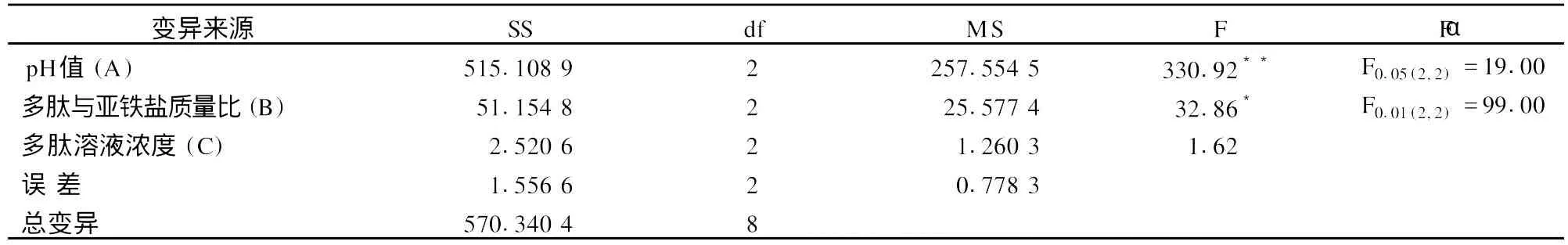
表4 方差分析表
2.3 豬血多肽鐵螯合鹽的成分分析
對以上試驗確定的最佳制備工藝條件下制得的豬血多肽鐵螯合鹽進行成分分析,分析結果見表5。
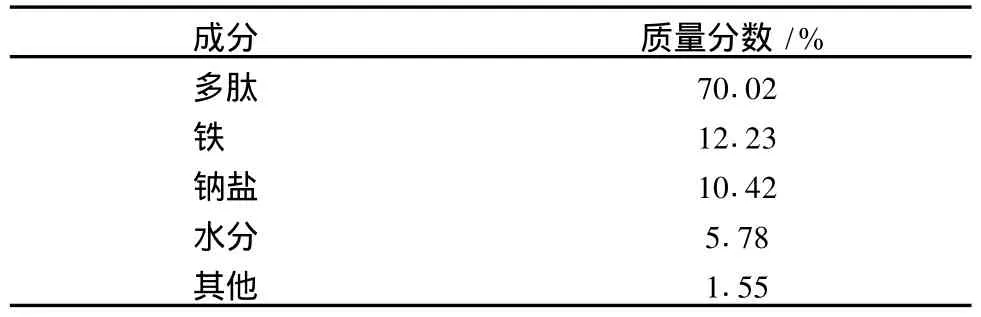
表5 豬血多肽鐵螯合鹽的成分
從表5可以看出,實驗所制得的豬血多肽鐵螯合鹽中主要成分是多肽和鐵,但是其中還有較多的鈉鹽存在,這主要是由于調節pH值時加入的NaOH或HCl所致,在后續研究中可以通過透析、超濾等方法進一步純化產品。
3 結論
(1)通過硫酸亞鐵和氯化亞鐵在不同體積分數乙醇中溶解性的比較得知,氯化亞鐵更適合作為多肽與鐵進行螯合反應的鐵源。
(2)豬血多肽鐵螯合鹽的最佳制備工藝條件為:pH值5,多肽與亞鐵鹽質量比4∶1,多肽溶液濃度3.0%。
(3)豬血多肽鐵螯合鹽的主要成分是多肽和鐵,其質量分數分別為70.02%和12.23%。
[1]Oscar Pineda H,DeWayne Ashmead.Effectiveness of treatment of iron-deficiency anemia in infants and young children with ferrous bis-glycinate chelate[J].Nutrition,2001,17(5):381-384.
[2]Fernando Pizarro,RaúlUicich,ManuelOlivares.et al.I-ron absorption of ferric glycinate is controlled by iron stores[J].Nutrition Research,1998,18(1):3-9.
[3]張亞麗,徐忠.脫脂豆粕多肽絡合亞鐵食品添加劑的制備及應用研究[J].食品工業科技,2004,25(4):120-122.
[4]鄧尚貴,楊燊,秦小明.低值魚蛋白多肽—鐵(Ⅱ)螯合物的酶解制備及其抗氧化、抗菌活性[J].湛江海洋大學學報,2006,26(4):54-58.
[5]黃偉坤.食品檢驗與分析[M].北京:中國輕工業出版社,1981:225-226.
[6]食品安全國家標準.GB 5009.3-2010.食品中水分的測定[S].
[7]食品安全國家標準.GB 5009.5-2010.食品中蛋白質的測定[S].
[8]GB/T 12457-2008.食品中氯化鈉的測定[S].
[9]éric Ansoborlo,Badia Amekraz,Christophe Moulin,et al.Review of actinide decorporation with chelating agents[J].Comptes Rendus Chimie,2007(10/11):1010-1019.
[10]Ramon Burgada,Théodorine Bailly,Thierry Prangé,et al.Synthetic strategy of new powerful tris-bisphosphonic ligands for chelation of uranyl,iron,and cobalt cations[J].Tetrahedron Letters,2007,48(13):2315-2319.
[11]王麗霞,劉安軍,王穩航.多肽-Fe抗貧血保健功能的研究[J].食品研究與開發,2006(27)7:179-181.
[12]徐志固.現代配位化學[M].化學工業出版社,北京:1987:175-183.
ABSTRACTThe chelating reaction condition was studied be tween pig blood polypeptide andmolysite.The ingredients of pig blood polypeptide-iron were also determined.The results showed that ferric chloride was suitable as iron source in chelatingwith pig blood polypeptide;the best condition was pH 5,the ratio of polypeptide and iron was 4∶1,solution concentration of polypeptide was 3.0%.The main contents of pig blood polypeptide-iron were polypeptide and iron with mass percents 70.02%and 12.23%,respectively.
Key wordspig blood polypeptide,iron,chelation,preparation
Study on Preparation of Pig Blood Polypeptide-iron
Wang Xue-rong1,Zheng Jiong2,Kan Jian-quan2
1(Animal Science Department of RongChang Campas of SouthwestUniversity Chongqing 402460,China)
2(Food Science Institute of SouthwestUniversity,Chongqing 400715,China)
博士,副教授(闞建全教授為通訊作者)。
*現代農業產業技術體系建設專項資金資助;西南大學博士基金資助(09BSr07)
2009-12-18,改回日期:2010-04-13

