鐵促進黃銅礦浸出的研究進展
王翠紅,張衛民
(東華理工大學土木與環境工程學院,江西撫州 344000)
鐵促進黃銅礦浸出的研究進展
王翠紅,張衛民
(東華理工大學土木與環境工程學院,江西撫州 344000)
綜述了鐵促進黃銅礦浸出機理及影響因素的研究狀況,指出鐵是一種有效的助浸劑,其作用效果與氧化還原電位、鐵離子濃度、p H以及介質類型等因素有關。
黃銅礦;鐵離子;浸出
黃銅礦是銅礦資源的主體礦物,也是銅礦開采最多的礦物。促進黃銅礦浸出一直是國內外多年來的一個重要熱點課題。Naoki Hiroyoshi,et al.[1]的研究表明,添加助浸劑,如,Ag+離子、表面活性劑、鐵粉、活性炭粉等,是一種提高浸出率和浸出速度的有效方式,但生產成本較高,難于在實踐中推廣。
通常認為,在硫酸溶液中,黃銅礦被 Fe3+和溶解氧溶解并釋放出 Fe2+。當有氧化亞鐵硫桿菌(thiobacillus f errooxidans)等鐵氧化細菌存在時,Fe2+被迅速氧化成 Fe3+,Fe3+繼續參與黃銅礦的溶解作用。在整個浸出過程中,Fe2+只起到提供Fe3+的作用。近年來,有研究表明:在酸性溶液中,高濃度的Fe2+的存在有助于溶解氧對黃銅礦的氧化浸出。盡管眾說紛紜,但都支持鐵可以提高黃銅礦浸出效率這一觀點。黃銅礦的浸出受多種因素影響,本文介紹了國內外對鐵促進黃銅礦浸出機理及影響因素的研究狀況。
1 鐵促進黃銅礦浸出的機理
根據Naoki Hiroyoshi,et al.[1-3]關于 Fe2+促進黃銅礦浸出模型的觀點:在含有適度銅離子的溶浸液中,Fe2+能夠加速銅的浸出。Fe2+能夠將黃銅礦還原生成Cu2S,Cu2S具有更好的可溶性,比黃銅礦更容易被三價鐵或氧氣氧化。不同硫化銅礦物(黃銅礦和輝銅礦)在不同介質中有不同的電化學行為。在硫酸溶液中,黃銅礦的浸出取決于由Fe3+/Fe2+決定的氧化還原電位,當氧化還原電位比較低(低于某一臨界電位)時,黃銅礦的浸出過程分2步進行:首先黃銅礦先被 Fe2+還原為中間產物輝銅礦(Cu2S)(反應(1)),然后輝銅礦被 Fe3+或 O2氧化釋放出 Cu2+(反應(2)、(3)),輝銅礦的氧化速率比黃銅礦更快,因此當電位低于某臨界電位時,銅的浸出更快;當氧化還原電位比較高(高于某一臨界電位)時,黃銅礦直接被 Fe3+或O2氧化釋放出 Cu2+,但 Cu2+從黃銅礦中浸出的速度很慢(反應(4)、(5))。
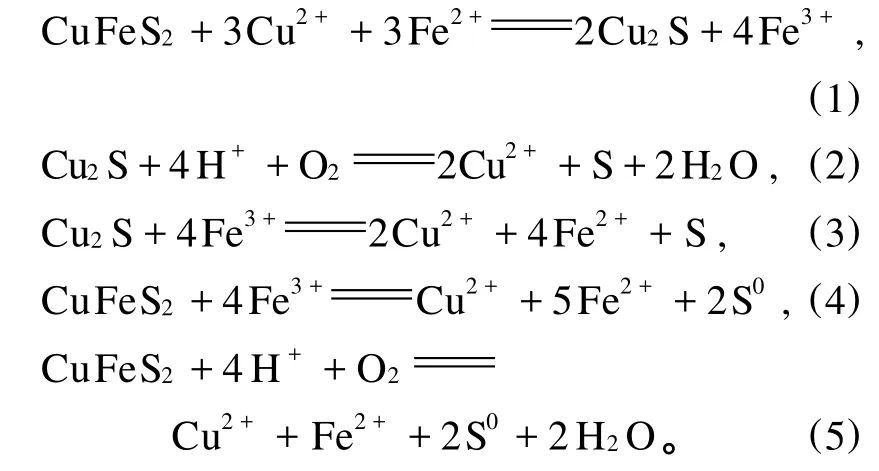
2 鐵促進黃銅礦浸出的影響因素
2.1 氧化還原電位的影響
早在1910年,V.Gottschalk,et al.[4]研究發現,加入白鐵礦、黃鐵礦可以加速一些硫化礦物的氧化速度,氧化速度提高的原因是由于氧的存在,鐵的硫化礦物被氧化形成鐵鹽和硫酸。M.J.Nicol,et al.[5]對 Fe、Cu、Pb在酸性環境中還原黃銅礦的原電池效應的研究結果表明:當加入 Fe、Cu、Pb等金屬時,Cu2+的浸出率明顯提高。黃鐵礦和黃銅礦的電對效應可加速銅礦石的分解[6-7]。
硫化銅礦的浸出過程是電極腐蝕過程。在陽極,礦物中的低價金屬離子被氧化為高價離子,或硫離子被氧化為元素硫或硫酸根;在陰極,氧化劑O2、Fe3+等接受電子被還原。伴隨著電子的轉移,有價金屬離子從固相轉移入浸出介質中,其反應式為:
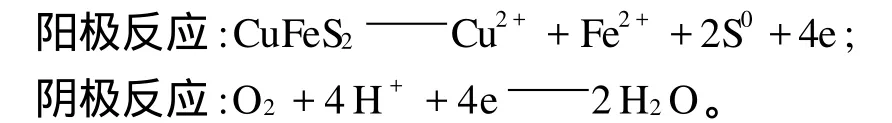
具有半導體特性的天然硫化礦物在浸出介質中都有其相應的電極電位。一般情況下,浸出體系中含有多種金屬硫化礦物,而各種硫化礦物的靜電位不同。常見的硫化礦物的靜電位由高到低的順序為黃鐵礦>黃銅礦>方鉛礦>閃鋅礦。在多組分混合硫化礦物體系中,電位不同的2種礦物相接觸時形成原電池,靜電位低的礦物被加速溶解,靜電位高的礦物受到陰極保護而不溶[8-9]。如,將黃鐵礦和黃銅礦的純礦物粉混合時,在硫酸介質中,銅的溶解量比黃銅礦單獨浸出時增大4.6倍,電化學反應在黃銅礦的加速溶解過程中起了作用,用電鏡觀察浸出的黃銅礦電極對時發現,由于電化學反應作用,與黃鐵礦緊密接觸的黃銅礦被加速腐蝕,而黃鐵礦作為陰極受到保護。
張杰等[10]通過熱力學分析認為:無氧條件下,含有一定濃度Fe3+的溶浸液將與黃鐵礦發生下列反應:
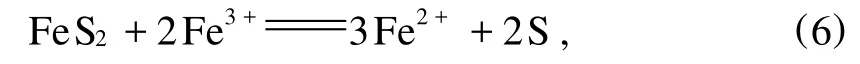
反應所需的溶液電位范圍覆蓋了Fe2+促進黃銅礦浸出的電位范圍,從而可以肯定,在黃鐵礦和黃銅礦共存的溶浸液環境中,反應(1)、(3)和(4)是能夠同時進行的。他們的研究還表明:有黃鐵礦存在時,黃銅礦的浸出速率明顯大于無黃鐵礦存在時的浸出速率,浸出的前12 d,兩者Cu2+濃度最大時相差1 mmol/L左右;浸出30 d后,有黃鐵礦存在的浸出體系中,銅的浸出率約為56%,而不加黃鐵礦的浸出體系中,銅的浸出率為42%。同時,他們認為,黃鐵礦的參與加速了 Fe3+與Fe2+濃度之比值的降低和電位降低,進而促進了黃銅礦的浸出。
2.2 鐵離子濃度的影響
根據反應(4):隨著溶液中Fe3+濃度的增大,浸出的銅增多。但有研究表明:當 Fe3+的濃度大于0.01 mol/L后對黃銅礦的浸出影響不明顯[11]。Tomas Havlik,et al.[12]的研究結果表明,黃銅礦的浸出依賴于 Fe3+的濃度:當 Fe3+匱乏時,黃銅礦浸出動力學明顯較慢;當 Fe3+濃度達到0.5 mol/L時,它可以為浸出反應的進行提供充足的Fe3+,從而使浸出反應不受外部擴散的限制;而當Fe3+濃度超過0.5 mol/L后,對浸出反應的進行影響不大。
Javier Vilcáez,et al.[13]的研究表明 :在 65℃、初始p H=1時,硫酸鐵介質中加入200 mg/L Fe3+時,黃銅礦的最終浸出率明顯提高。如,針對Atacama精礦和 Hanaoka礦石,不加 Fe3+時,浸出12 d,銅浸出率分別為92%和75%;而加入Fe3+后,浸出僅7 d,銅浸出率分別達到了100%和80%。為了證明過量 Fe3+的存在,即使在p H=1時對黃銅礦D浸出的負面影響,他們對Fe3+質量濃度分別為0.2,1.0,6.0和12.0 g/L的Hanaoka礦石進行了研究,結果表明:當 Fe3+質量濃度達到1.0 g/L時,銅浸出率明顯增大;而當Fe3+濃度超過這個值時,浸出率明顯下降。
張衛民等[14]認為:不僅Fe3+對黃銅礦的浸出起到催化作用,Fe2+同樣也在一定條件下起催化作用。在活性炭、Ag+、Fe2+組合的浸礦體系中,隨著初始Fe2+濃度的增加,銅浸出速度和浸出率不斷增大。但當初始Fe2+濃度達到8.0 g/L以后,隨初始Fe2+濃度的增加,銅浸出率增加不明顯,浸出168 h后,銅浸出率為83%,比不加 Fe2+時提高了 32%;浸出 321 h后,浸出率達到93.5%,比不加 Fe2+時提高了22%。
張德誠等[15]研究了在低溫(15℃)條件下,Fe2+起始濃度對細菌浸銅工藝的影響。Fe2+是氧化亞鐵硫桿菌獲得生命所需能量的主要物質之一,所以,選擇適當的起始 Fe2+濃度是必須的。但Fe2+濃度過高會產生過多的Fe3+,以致形成過多的沉淀,影響浸出效果。研究表明:在整個浸出過程中,初始 Fe2+質量濃度為6 g/L時,銅浸出率始終大于其他3個水平(2 g/L,4 g/L,8 g/L),最終浸出率可達到65%以上,而其他3個水平的浸出率均未超過35%;在前30 d的浸出過程中,初始Fe2+質量濃度為6 g/L時,平均Fe2+質量濃度下降相對較快,銅浸出速率也相對較快,說明Fe2+初始質量濃度為6 g/L時可能會刺激細菌適應新的生存環境,加速銅的浸出速率。原因可能在于加入過多的Fe2+時,細菌會優先利用Fe2+而較少利用黃銅礦,而加入的 Fe2+過少時,則有可能影響到Fe2+的氧化耗酸和鐵礬產酸過程。
Z.Sadowski,et al.[16]研究表明,在細菌浸出黃銅礦時,添加2 g/L的Fe2+可以增大黃銅礦的最初浸出速率,浸出48 h時,銅浸出率急劇增加到60%;此后,浸出速度減緩,在浸出312 h時,銅浸出率為86%;但當Fe2+質量濃度增大至9 g/L時,黃銅礦的浸出卻明顯受阻。
Naoki Hiroyoshi,et al.[3]研究表明:在氮氣環境下,500 mL燒瓶中加入250 mL浸出液和25 g黃銅礦,水浴溫度303 K,振幅40 mm,振動速度120次/min,不加 Fe2+和 Cu2+時,27 d后,黃銅礦的浸出率只有10%;而向含有Fe3+的溶液中只加入Fe2+時,銅浸出率在浸出初期時與不加Fe2+時的情況幾乎一樣,4 d之后,銅浸出率增大,27 d后,銅浸出率約為75%。
2.3 pH的影響
黃銅礦的浸出過程耗酸,因此,隨著浸出反應的進行,體系p H增大。p H增大會使鐵離子發生水解沉淀,使浸出反應發生鈍化。浸出過程中,可以加入過量的硫酸來避免浸出反應的鈍化(反應(7))。但是,黃銅礦細菌浸出過程中,由于大多數嗜熱細菌無法適應p H低于1的環境,因此,雖然加入過量的硫酸可以阻止鐵離子的水解沉淀(如黃鉀鐵礬的水解沉淀),但一般不這樣做。J.E.Dutrizac,et al.[17]指出:酸的作用是控制 Fe3+的水解。溶液中的鐵在一定p H范圍內會生成鐵礬,鐵礬的生成對浸出極為不利,因此,選取合適的p H范圍非常重要。
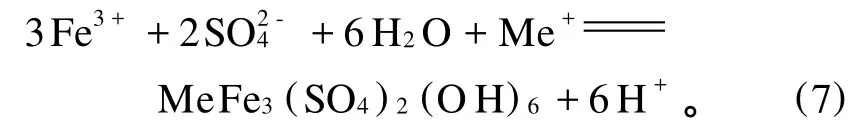
T omas Havllk,et al.[12]的研究表明:在70℃下,加入0.5 mol的 Fe3+,鹽酸濃度分別為0.25,0.5,0.75,1 mol/L,對黃銅礦浸出動力學幾乎沒有影響。
Naoki Hiroyoshi,et al.[2]研究了初始p H=1.8、浸出168 h對銅浸出率的影響。結果表明:當加入硫酸亞鐵溶液(0.04 mol/L)后,銅浸出率在很大程度上依賴于p H并隨p H的降低而增大,銅最終浸出量為0.41×10-3mol/g礦石。
舒榮波等[18]研究了在30℃下、加入8 g/L Fe2+時,p H值對黃銅礦浸出效果的影響。試驗結果表明:隨p H從1.5降到1.0,銅浸出率增大。由于p H越低,H+濃度越高,H+與礦物表面接觸發生反應的幾率越大,也就越有利于黃銅礦的溶解,這一現象與反應式(5)吻合。
Javier Vilcáez,et al.[13]研究表明:在不加細菌和鐵離子條件下,控制體系溫度為65℃,出人意料的是,隨pH從1.5降到1.0時,銅浸出量明顯增加。
2.4 浸出介質的類型
J.D.Sullivan,et al.[19]研究表明:與硫酸鐵相比,在黃銅礦浸出過程中,氯化鐵是最好的介質,而且在高溫條件下作用更明顯。J.E.Dutrizac,et al.[17]研究發現:溫度在50~100 ℃范圍內,鹽酸介質中,黃銅礦的浸出率曲線為直線,而在硫酸介質中為拋物線。隨后的進一步研究表明:溫度高于50℃時,在硫酸鐵介質中,氯離子的增加會加速黃銅礦的溶解,而在低溫條件下沒有這種現象[20]。H.Majima,et al.[21]研究認為:在硫酸鐵介質中,黃銅礦的浸出率低于在氯化鐵介質中的浸出率,因為氯化鐵介質中形成的硫元素比硫酸鐵介質中形成的更具有多孔性。氯化物系統中鹽酸作為浸出劑,阻止了起催化作用的FeCl3的水解,反應(8)代表了氯酸鐵介質中黃銅礦的溶解[22]。對比硫酸鐵介質中黃銅礦的浸出,氯化鐵介質中的浸出更快,反應更強烈,氯化鐵可以再生而且黃鐵礦不被侵蝕。
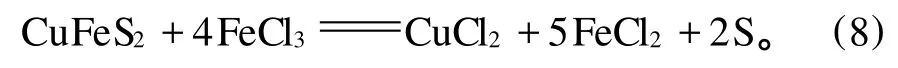
在黃銅礦浸出體系中,氯化鐵比硫酸鐵具有更大的氧化能力,但是,有以下幾個因素限制了氯化鐵在工業上的應用:氯離子與很多元素具有親和力,使得從溶液中分離銅的過程更復雜;氯化溶液具有很大的腐蝕性;鹽酸比硫酸更昂貴。
3 結論
總之,鐵能很好地提高黃銅礦的浸出,但它要受到氧化還原電位、離子濃度、p H以及介質類型的影響。一般情況下,靜電位較低的礦物優先溶解,因此可以加入靜電位高于黃銅礦的礦物來加速黃銅礦的浸出;黃銅礦的浸出速率隨鐵離子濃度的增加而增大,但當濃度高于某一值時,對黃銅礦的浸出幾乎沒有影響;p H控制了溶浸液中黃鉀鐵礬的形成,進而影響了黃銅礦的浸出,一般情況下,黃銅礦浸出最佳p H范圍為1.0~1.5;鹽酸溶液雖然較硫酸溶液更有利于黃銅礦的浸出,但從經濟上考慮選擇硫酸更合適。因此,了解并人為控制黃銅礦浸出的影響因素,可為工業生產降低成本提供有力的科學依據。
[1]Naoki Hiroyoshi,Hajime Miki,Tsuyoshi Hirajima,et al.A Model for Ferrous-promoted ChaIcopyrite Leaching[J].Hydrometallurgy,2000,57(1):31-38.
[2]Hiroyoshi N,Hirota M,Hirajima T,et al.A Case of Ferrous Sulfate Addition Enhancing Chalcopyrite Leaching[J].Hydrometallurgy,1997,47(1):37-45.
[3]Hiroyoshi N,Mild H,Hirajima T,et al.Enhancement of Chalcopyrite Leaching by Ferrous Ions in Acidic Ferric Sulfate Solutions[J].Hydrometallurgy,2001,60(3):185-197.
[4]Gottschalk V,Buehler H.Oxidation of Sulfides[J].Econ Geol,1910,10(5):28-35.
[5]Nicol M J.Mechanism of Aqueous Reduction of Chalcopyrite by Copper Iron and Lead[J].Trans Min Metall,1975,84(12):C206.
[6]Brierley J A,Brierley C L.Present and Future Commercial Applications of Biohydrometallurgy[J].Hydrometallurgy,2001,59(2):233-239.
[7]Mehta A P,Murr L E.Kinetic Study of Sulfide Leaching by Galvanic Interaction Between Chalcopyrite,Pyrite and Sphalerite in the Presence of T.Ferroxidans and Thermophilic Micro-organism[J].Biotech Bioeng,1982,24(4):919-940.
[8]Elsa M Arce,Ignacio González.A Comparative Study of Electrochemical Behavior of Chalcopyrite,Chalcocite and Bornite in Sulfuric Acid Solution[J].Int J Miner Process,2002,67(1):17-28.
[9]李宏照,劉曉榮.黃鐵礦和鎳黃鐵礦混合細菌浸出過程的原電池效應[J].有色金屬,2002,54(4):47-55.
[10]張杰,吳愛祥.排土場黃鐵礦促進黃銅礦浸出研究[J].金屬礦山,2008,381(3):38-41.
[11]Dutrizac J E.The Dissolution of Chalcopyrite in Ferric Sulfate and Ferric Chlorite Media[J].Metallurgical Transactions,1981,B12B,371-378.
[12]Tomas Havlik,Milan hrobian,Peter Balaz,et al.Leaching of Chalcopyrite Concentrate With Ferric Chloride[J].Int J Miner Process,1995,43(1/2):61-72.
[13]Javier Vilcáez,Ryoichi Yamada,Chihiro Inoue.Effect of pH Reduction and Ferric Ion Addition on the Leaching of Chalcopyrite at Thermophilic Temperatures[J].Hydrometallurgy,2009,96(1/2):62-71.
[14]張衛民,谷士飛,孫占學.催化劑組合對低品位原生硫化銅礦細菌浸出的催化效應[J].礦業開發與研究,2008,29(2):46-48.
[15]張德誠,羅學岡.較低溫度下細菌浸出黃銅礦工藝影響因素研究[J].金屬礦山,2007,377(11):65-68.
[16]Sadowski Z,Jazdzyk E,Karas H.Bioleaching of Copper Ore Flotation Concentrates[J].Minerals Engineering,2003,16(1):51-53.
[17]Dutrizac J E,MacDonald R J C,Ingraham T R.The Kinetics of Dissolution of Synthetic Chalcopyrite in Aqueous Acidic Ferric Sulfate Solutions[J].Trans Metall Soc,1969,245:955-959.
[18]舒榮波,阮仁滿,溫建康.低電位化學浸出云南大紅山黃銅礦[J].礦產綜合利用,2008(4):3-5.
[19]Sullivan J D.Chemical and Physical Features of Copper Leaching[J].Trans Am Inst Min Metall,1933,106:515-546.
[20]Dutrizac J E,MacDonald R J C.The Effect of Sodium Chloride on the Dissolution of Chalcopyrite Under Simulated Dump Leaching Conditions[J].Metall Trans,1971(2):2310-2312.
[21]Majima H,Awakura Y,Hirato T,et al.The Leaching of Chalcopyrite in Ferric Chloride and Ferric Sulfate Solution[J].Can Metall Q,1985,24(4):283-291.
[22]O’Malley M L,Liddell K K.Leaching of CuFeS2by Aqueous FeCl3,HCl and NaCl:Effects of Solution Composition and Limited Oxidant[J].Metall Trans,1987,18B:505-510.
Abstract:The article summarizes the mechanisms and influencing factors on chalcopyrite leaching,points out that iron is an effective infusion,but its effect is relation to oxidation-reduction potential,iron ion concentration,p H,media types and other factors.
Key words:chalcopyrite;iron ion;leaching
Research Progress on Promoted Leaching of Chalcopyrite by Iron Ion
WANG Cui-hong,ZHANG Wei-min
(School of Civil and Environmental Engineering,East China Institute of Technology,Fuzhou,Jiangxi 344000,China)
TF803.21
A
1009-2617(2010)02-0067-04
2009-12-19
王翠紅(1984-),女,陜西西安人,碩士研究生,主要研究方向為溶浸水文地質。

