雨生紅球藻培養過程中色素動態變化與光合生理特性研究
王 群,桑 敏,李愛芬,張成武
暨南大學水生生物研究中心,廣州 510632
雨生紅球藻培養過程中色素動態變化與光合生理特性研究
王 群,桑 敏,李愛芬*,張成武
暨南大學水生生物研究中心,廣州 510632
以雨生紅球藻Haem atococcus pluvialisCG-06為實驗材料,分析測定在正常培養周期內藻細胞主要色素的變化動態、光合生理特性,以及培養基中硝態氮的含量。結果表明,雨生紅球藻在綠色細胞階段的主要色素包括:葉綠素、葉黃素、β-胡蘿卜素,培養至紅色細胞階段增加了角黃素、海膽酮、蝦青素單酯及雙酯等次生類胡蘿卜素。硝態氮濃度在培養初期下降迅速,第 3 d降至 4.875 mg/L,下降了 85.3%,至第 7 d下降為 0.169 mg/ L。雨生紅球藻培養至第 7 d時,細胞中開始檢測出蝦青素,含量為 0.159 mg/g,此時蝦青素合成速度較快,至第11 d蝦青素含量上升為 1.68 mg/g,在蝦青素合成初期β-胡蘿卜素的含量下降。藻細胞的光合速率、呼吸速率和NPQ在培養前期比較穩定,第 7 d細胞光合速率開始下降,而呼吸速率和NPQ則上升,在整個培養周期中,藻細胞的 Fv/Fm變化不明顯。
雨生紅球藻;蝦青素;類胡蘿卜素;氮素;光合特性
蝦青素,一種次生類胡蘿卜素,具有很強的著色及抗氧化作用,可廣泛應用于食品、保健品、化妝品及養殖業[1],是一種具有高附加值和開發潛力的生物活性物質。單細胞淡水綠藻雨生紅球藻 (Haem atococcus pluvialis)在生活史中的紅色細胞階段能大量積累蝦青素,研究報道蝦青素含量可達藻體干重的 2%~5%[2],是理想的天然蝦青素來源。
目前,利用雨生紅球藻生產蝦青素普遍采用兩步培養法,即首先在適宜條件下高密度培養雨生紅球藻以獲得最大生物量,然后通過改變培養條件誘導細胞積累蝦青素。因此,關于雨生紅球藻培養條件的優化[3-5]和蝦青素積累的誘導條件[6,7]等方面做了大量工作。研究證實高光強、高鹽和缺氮等脅迫條件有利于雨生紅球藻積累蝦青素,其中氮素對雨生紅球藻的生長和蝦青素積累有著顯著影響。Lee等的研究表明,雨生紅球藻蝦青素的積累發生在細胞快速分裂和生長期[8],殷明焱和劉建國研究報道,當培養基中氮濃度降低至 50μmol以下雨生紅球藻細胞開始積累蝦青素[9]。微藻培養體系中氮素的消耗是一個動態變化過程,隨著藻細胞密度的不斷提高,培養基中的氮素濃度將隨之下降。因此,本文以雨生紅球藻 CG-06藻株為研究對象,分析在正常培養條件下雨生紅球藻色素組成與含量的變化規律,探討其色素組成變化與氮素濃度以及藻細胞生理活性之間的關系,初步確定培養液氮素缺乏誘導蝦青素的適宜脅迫閾值等。這對于進一步闡明雨生紅球藻蝦青素積累機制具有一定的理論價值,同時為利用雨生紅球藻高效生產蝦青素技術提供參考。
1 材料與方法
1.1 藻種
雨生紅球藻Haem atococcus pluvialisCG-06,由暨南大學水生生物研究中心藻種室提供。
1.2 培養條件
選用BBM培養基,培養溫度為 23±1℃,整個培養周期的光照強度為 80 mol photo·m-2·s-1,采用 6 cm管徑的柱狀反應器,24 h通氣 (VCO2:V空氣= 0.5∶95.5)培養。
1.3 實驗方法
1.3.1 培養液中硝態氮的測定
采用全自動連續流動化學分析儀 (Bran-Luebbe AutoAnalyzer3,德國)測定硝態氮濃度。
1.3.2 生物量的測定
定期取一定體積藻液抽濾,于 80℃烘至恒重,冷卻后稱量獲得干重。
1.3.3 色素的提取
取 1 mL藻液,3500轉離心 5 min,將離心得到的藻泥用二甲基亞砜反復震蕩萃取至藻渣無色,用丙酮定容至 10 mL,萃取好的樣品經 0.22μm濾膜過濾后用于 HPLC分析。
1.3.4 色素的分析與測定
采用Agilent100檢測系統,DAD檢測器,Kromasil C18柱 (250×4.6 mm),柱溫 25℃,洗脫條件同文獻[10],流速為 1 mL/min,狹縫為 1 nm。三種標樣的檢測波長分別為 663 nm(葉綠素 a)、476 nm(蝦青素)、450 nm(β-胡蘿卜素)。葉綠素a、β-胡蘿卜素、蝦青素根據標準樣品的出峰時間確定,其它類胡蘿卜素的定性參考文獻[10],根據出峰時間進行比對。葉綠素a、β-胡蘿卜素、蝦青素用外標法進行定量,其它類胡蘿卜素的定量根據峰面積比進行換算。
1.3.5 呼吸速率和光合速率的測定
用 Clark氧電極 (Hansatech Oxygraph,英國)測定。反應體系的溫度由超級恒溫水浴 (Grant,英國)控制。光合速率和呼吸速率用μmo lO2mg Chl-1h-1來表示,直接讀取溶解氧的變化值 (mg/L),計算藻的放氧速率。公式如下:
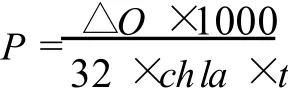
式中:P代表凈光合放氧速率;ΔO代表單位時間內氧濃度變化值;chl a代表葉綠素 a的濃度;t為每兩次溶解氧濃度讀數間的間隔時間。
1.3.6 活體葉綠素熒光的測定
采用 XE-PAM脈沖調制式葉綠素熒光儀(Walz,德國)測定,測量前將藻液暗適應 20 min,葉綠素熒光參數 Fv/Fm和NPQ可通過葉綠素熒光儀直接讀出。
2 結果分析
2.1 培養液氮素含量的變化與雨生紅球藻的培養特征
在正常條件下隨著培養時間的不斷延長,培養基中硝態氮濃度的變化如圖 1所示。由圖中看出,硝態氮的含量隨培養時間而逐漸降低,其中在培養初期下降迅速,至第 3 d已降至 4.875 mg/L,比原初培養基降低了 85.3%,從第 3 d至 11 d,氮濃度下降平緩,培養基在第 11 d的硝態氮含量降為 0.0214 mg/L,僅占原初培養基的 0.06%。細胞干重隨著硝態氮含量的下降而不斷上升,在培養初期藻細胞干重增長迅速,隨著氮濃度的下降,細胞干重增長變緩,培養的第 11 d,細胞干重又出現增長,可能是與藻細胞體積增大有關。隨著培養液氮素的不斷消耗,雨生紅球藻的培養特征亦隨之變化。前 5 d的藻液顏色為綠色,此時的藻細胞為綠色游動細胞。此后藻液逐漸變為黃褐色,鏡檢觀察大多數細胞仍為游動細胞,但細胞中央有紅色色素積累,并隨著紅色色素面積的增大,藻液逐漸變為深褐色。至 11 d左右藻液變為棕紅色,細胞進入紅色孢子階段,最終藻液變為紅色。
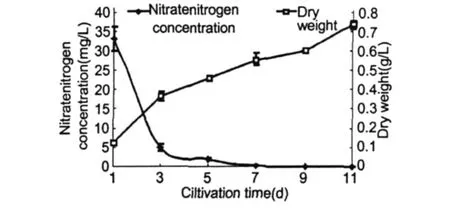
圖 1 培養液中硝態氮濃度及H.pluvialisCG-06細胞干重的變化Fig.1 The change of nitrate nitrogen concentration in culture and the dryweight ofH.pluvialisCG-06
2.2 雨生紅球藻培養周期內的主要色素組成
圖 2是雨生紅球藻紅綠兩種細胞階段的主要色素組成。根據 HPLC圖譜,分析雨生紅球藻綠色細胞的主要色素組成有:葉綠素、葉黃素、β-胡蘿卜素(圖 2a,培養的第 3 d),與綠色細胞相比,紅色細胞(圖 2b,培養的第 19 d)還增加了角黃素、海膽酮、蝦青素單酯及雙酯等類胡蘿卜素。表 1是兩種細胞內的色素與峰號的對應關系(檢測波長為 476 nm)。
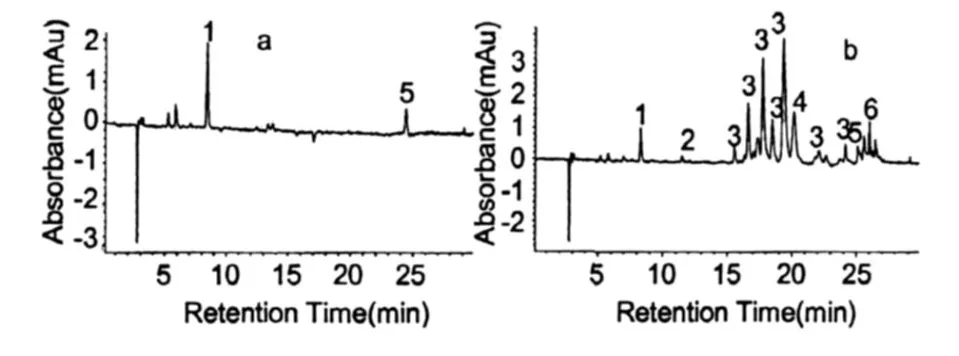
圖 2 雨生紅球藻 CG-06(a為綠色細胞,b為紅色細胞)色素提取液的 HPLC圖譜Fig.2 HPLC chromatogram of Pigment Extract fromH.pluvialis.CG-06(a:Green Cell,b:Red Cell)
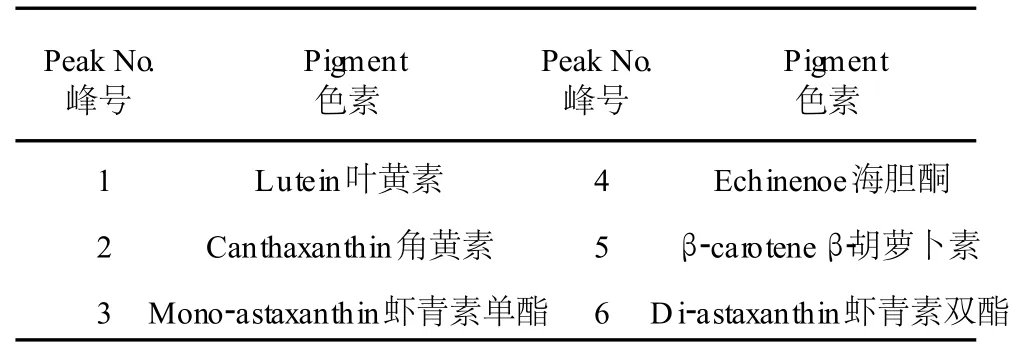
表 1 雨生紅球藻色素與峰號對應關系Table 1 The relationship between the pigment ofH.pluvialisCG-06 and the peak number
2.3 雨生紅球藻主要色素的動態變化
圖 3反應的是雨生紅球藻細胞葉綠素 a含量的變化動態。可以看出在培養的前 9 d,葉綠素含量逐漸上升,第 9 d最高為 10.95 mg/g,此時培養基中硝態氮含量為 0.0335 mg/g。此后葉綠素含量開始下降,第 21 d的含量比初始值下降了 21.2%。
類胡蘿卜素的變化趨勢如圖 4所示。β-胡蘿卜素和葉黃素的周期變化相似,培養初期它們的含量逐漸上升,第 7 d達到最大,分別為 0.533 mg/g和1.191 mg/g。此時培養基中的硝態氮含量下為0.169 mg/g。從圖 4可以看出,藻細胞培養至第 7 d時開始積累次生類胡蘿卜素,主要有海膽酮、角黃素和蝦青素。蝦青素和海膽酮的含量隨著培養時間的延長一直升高,第 21 d的含量分別為 1.033 mg/g和 2.547 mg/g。其中蝦青素的合成在前 4 d增長迅速,第 11 d時已達到 1.68 mg/g。角黃素含量一直比較穩定,且含量遠小于海膽酮和蝦青素。
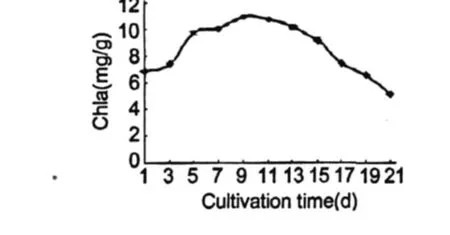
圖 3 雨生紅球藻 CG-06葉綠素 a含量的變化Fig.3 The change of content for Chla ofH.pluvialisCG-06
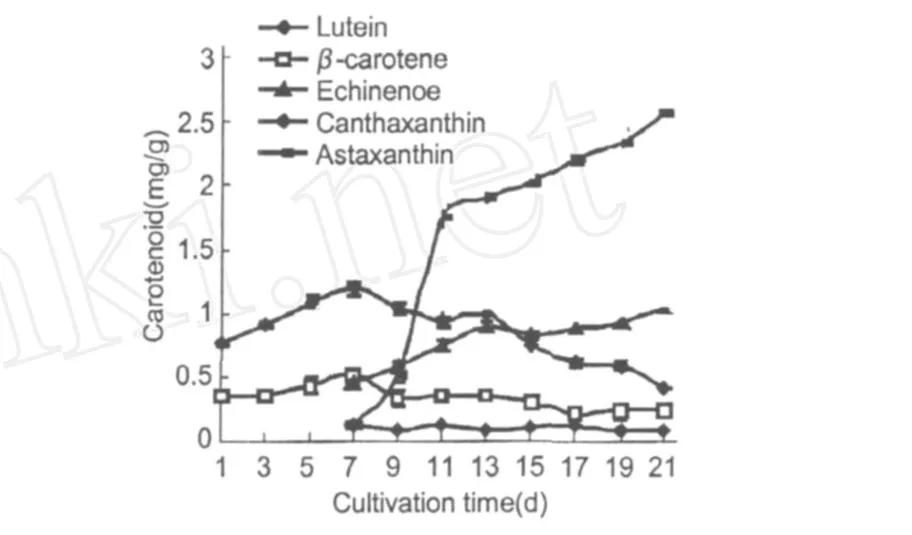
圖 4 雨生紅球藻CG-06類胡蘿卜素含量的變化Fig.4 The change of content for Carotenoid ofH.pluvialisCG-06
2.4 雨生紅球藻培養周期內的生理特性
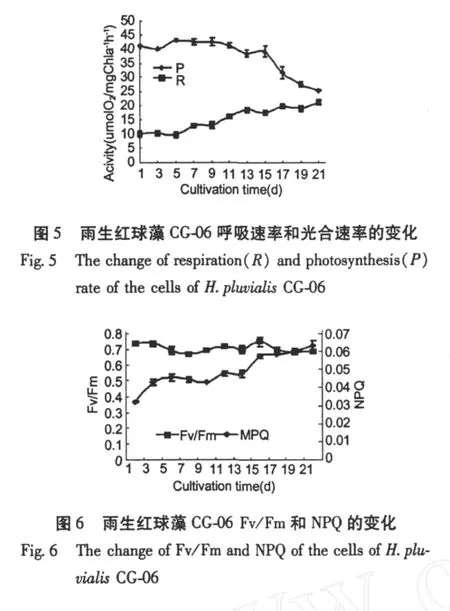
圖 5是雨生紅球藻在培養周期內光合與呼吸速率的變化。可以看出,藻的光合作用水平在前 11 d比較穩定,第 9 d的光合速率最高,為 42.63μmol O2(mg Chla)-1h-1,隨后光合速率逐漸下降,到第 21 d為 25.14μmol O2(mg Chla)-1h-1,下降了 41.1%。藻細胞的呼吸速率在培養的前 5 d變化不明顯,第 5 d為 10.19μmolO2(mg Chla)-1h-1,隨后細胞呼吸加強,第 21 d的呼吸速率為 21.09μmol O2(mg Chla)-1h-1,是第 5 d的 2.1倍。Fv/Fm是 PSⅡ的最大光化學量子產量,反映 PSⅡ的最大光能轉換效率,從圖 6中可以看出,整個培養周期中藻細胞活體Fv/Fm比較穩定,一直持續在 0.7左右。NPQ反映的是 PSⅡ天線色素吸收的光能以熱的形式耗散掉的部分,NPQ值在前 7 d變化不大,到 9 d時開始上升,13 d以后增長速度變緩 (圖 6)。
3 討論
氮是藻類等植物生長所必須的大量元素,對其生長和發育有著重要的作用。隨著藻細胞密度的提高,培養基中的氮濃度消耗加大,最終將導致氮素營養的缺乏。本實驗測得培養至第 11 d時培養基中的硝態氮已基本檢測不出。
藻類細胞的色素組成及其動態變化與培養基的氮素含量有一定關系(表 2)。氮是組成葉綠素的基本元素,同時氮含量不足會影響蛋白質的合成,從而導致葉綠素含量下降。Boussiba等研究報道,氮源缺乏引起雨生紅球藻細胞葉綠素含量下降[11]。從本實驗分析得到的數據可以看出,隨著培養時間的延長,培養基中的氮素急劇下降,到第 9 d時培養基中硝態氮含量只有 0.0335 mg/L,從此葉綠素含量開始下降。這一結果與 Young等對杜氏鹽藻的報道一致[12]。Fabregas等的研究證實,培養液中氮完全消耗時雨生紅球藻才有明顯地蝦青素積累[13],殷明焱和劉建國的研究也表明,當培養液的氮濃度降低至 50μmol以下時才有蝦青素的積累[8]。本實驗結果證實,當培養液的硝態氮含量降至 0.169 mg/L時,雨生紅球藻細胞開始有蝦青素等次生類胡蘿卜素的合成,這個結果與上述文獻報道是一致的。蝦青素在開始合成的前 4 d積累速度很快,當培養基中硝酸鹽含量降至 0.024 mg/L以后其合成速度減慢,這可能是因為蝦青素的積累需要蛋白質的連續合成,而氮濃度已不足以合成蝦青素積累所需的蛋白質[14]。次生類胡蘿卜素的積累清除細胞內因為缺氮生成的氧自由基,從而保護細胞。由于次生類胡蘿卜的積累使初生類胡蘿卜素β-胡蘿卜素含量的下降,β-胡蘿卜素含量的下降又引起葉黃素含量的下降[15]。
細胞的生理特性與培養基中氮素含量也有密切的聯系(表 2)。本實驗在第 7 d培養基中硝酸鹽含量降至 0.169 mg/L,光合速率明顯下降,而呼吸速率上升。光合速率下降是因為氮含量降到一定程度,一方面影響了葉綠素的合成,另外,光合作用碳循環中各種酶及電子傳遞體的合成受到影響。有許多研究表明,缺氮可限制藻細胞光合作用[16]。Hagen等認為,脅迫條件下細胞代謝所需能量增加,呼吸作用顯著增強[17,18]。Fv/Fm是 PSⅡ的最大光化學量子產量,反映 PSⅡ的最大光能轉換效率,雨生紅球藻在整個培養周期中 Fv/Fm值的變化并不明顯,這與 Erica在氮限制 3 d后研究杜氏鹽藻的結果不盡一致[19]。NPQ在培養后期有所上升,說明PSⅡ天線色素吸收的光能以熱的形式耗散部分增加。這個結果與金月梅研究的綠色巴夫藻、小球藻、微綠球藻等 8株微藻的結果一致[20]。
細胞的生理特性與色素積累也有密切聯系 (表2),當硝態氮含量下降到一定的程度,光合效率下降,呼吸速率、NPQ上升,使細胞內能量減少,細胞生長減緩,以應對脅迫條件。同時蝦青素積累以清除細胞內氧自由基,對細胞有一個被動的保護作用。葉綠素含量的下降和蝦青素含量的上升又加劇了光合速率的下降,蝦青素的積累也是呼吸速率上升的原因之一。光抑制和呼吸作用增強導致細胞內氧自由基的大量積累,進而導致蝦青素的合成及其它生理反應[17,18],細胞呼吸速率、NPQ的上升及光合速率的下降均說明細胞 PSⅡ活性下降[17,21]。雨生紅球藻在氮脅迫條件下積累蝦青素和細胞 PSⅡ活性下降是對環境的一種適應。
1 Martin G,Mark E.Haem atococcusastaxanthin:applications for human health and nutrition.Trends B iotechnol,2003,21 (5):210-216.
2 Lorenz RT,Cysewski GR.Commercial potential forHaem atococcus pluvialisas a natural source of astaxanthin.Trends B iotechnol,2000,18:160-167.
3 Lu F,Vonshak A,Boussiba S.Effect of temperature and irradiance on growth ofHaematococcus Pluvialis(Chlorophyceae).J Phycol,1994,30:829-833.
4 Harker M,Young AJ.Inhibition of astaxanthin synthesis in the green alge,Haematococcus pluvialis.Eur J Phycol,1995, 30:179-187.
5 Geng YH(耿予歡),Li L(李琳),Wei D(魏東).Growth and production of astaxanthin inChlamydom onas nivaliscultured in variousmedia.Nat Prod Res Dev(天然產物研究與開發),2009,21:641-644.
6 Harker M,Tsavalos AJ,Young AJ.Autotrophic growth and carotenoid production of Haematococcus pluvialis in a 30 liter air-lift photobioreactor.J Fer m ent B ioeng,1996,82:113-118.
7 OrosaM,Franqueira D,Cid A,et al.Analysis and enhancement of astaxanthin accumulation inHaem atococcus pluvialis. B ioresour Technol,2005,96:373-378.
8 Lee YK,Soh CW.Accumulation of astaxanthin inHaem atococcus lacusiris(Chlrophyta).J Phycol,1991,27:575-577.
9 YinMY(殷明焱),Liu JG(劉建國),ZhangJP(張京浦),et al.Review of studies ofHaeam tococcus pluvialisand its astaxanthin.Trans Oceanol Limnol(海洋湖沼通報),1998, 2:53-62.
10 Li FS(李福生).Changes of pigments components ofHaeamtococcus pluvialisin cultivation proccess.GuangZhou:Jinan Univ(暨南大學),PhD.2009.
11 Boussiba S,Wang B,Yuan JP,et al.Changes in pigments profile in the green algaHaeam tococcus pluvialisexposed to environmental stresses.B iotechnol Lett,1999,21:601-604.
12 Young EB,Beardall J.Photosynthetic function inDunaliella tertiolecta(Chlorophyta)during anitrogen starvation and recovery cycle.J Phycol,2003b,39:897-905.
13 Fábregas J,Otero A,Maseda A,et al.Two stage cultures for the production of astaxanthin fromHaem atococcus pluvialis.J B iotechnol,2001,89:65-71.
14 Boussiba S,Fan L,Vonshak A.Enhancement and determination of astaxanthin accumulation in green algaeHaem atococcus pluvialis.M eth Enzym ol,1992,213:386-391.
15 Grunewald K,Hirschberg J,Hagen C.Ketocarotenoid biosynthesis outside of plastids in the unicellular green alagHaematococcus pluvialis.J B iol Chem,2001,276:6023-6029.
16 Liang Y(梁英),Jin Y M(金月梅),Tian CY(田傳遠). Effects of different nitrogen and phosphorus concentrationson the growth and chlorophyll florescence parameters ofPavloca V iridis.Trans Oceanol Lim nol(海洋湖沼通報),2008,1: 120-126.
17 Hagen C,BrauneW,Bjêrn LO.Functional aspects of secondary carotenoids inHaem atococcus lacustris(volvocales).III. Action as a“sunshade”.J Phycol,1994,30:241-248.
18 Qin S(秦山),Liu GX(劉國祥),Hu ZY(胡鄭宇).The accumulation of astaxanthin and the response of photosynthetic activity inScenedesm us obliquus.Acta Hydrobiol Sci(水生生物學報),2009,33:509-515.
19 Erica B,Beardall J.Rapid ammonium-and nitrate-induced perturbations to chla fluorescence in nitrogen-stressedDunaliella tertiolecta(Chlorophyta).J Phycol,2003,39:897-905.
20 Jin Y M(金月梅).Effects of nitrogen and phosphorus limitation on the hlorophyll fluorescence and growth of eight microalga strains.Qingdao:OUC (中國海洋大學 ),PhD. 2008.
21 Boussiba S.Carotenogenesis in the green algaHaem atococcus pluvialis:cellular physiology and stress response.Physiol Plantarum,2000,108:111-117.
The Dynam ic Change of Pigments and Photosynthetic Physiological Characteristics ofHaem atococcus pluvialisCultures
WANGQun,SANGMin,L IAi-fen*,ZHANG Cheng-wu
Institute of Hydrobiology?,Jinan University,Guangzhou 510632,China
The dynamic change of pigments,photosynthetic physiological characteristics and nitrate uptake ofHaem atococcus pluvialisCG-06 were investigated.The main pigmentsof green vegetative cellswere composed of chlorophyll,lutein andβ-carotene,however,except above pigments,astaxanthin、echinenone and canthaxanthin were detected in red immobile cells.H.pluvialisassimilated nitrate quickly during exponential growth stage.The nitrogen concentration declined to 4.875 mg/L in 3rdday and decreased to 0.169 mg/L in the 7thday.The astaxanthin inH.pluvialiscultureswas detected on day 7,its content in red cells increase dramatically,which increased from 0.159 mg/g to 1.68 mg/g from 7thday to 11thday accompanying with the dropdown ofβ-carotene.The results also demonstrated that the photosynthetic rate, respiration rate and NPQ remained stable at initial stage,and then the photosynthetic rate declined,while the respiration rate and NPQ increased on day 7.During the whole culture,the Fv/Fm ofH.pluvialisdid not appear obvious variation.
Haem atococcus pluvialis;astaxanthin;carotenoid;nitrate nitrogen;photosynthetic characteristic
1001-6880(2010)05-0850-05
Q949.21;Q17
A
2010-04-28 接受日期:2010-07-06
珠海市科技局項目(PC20081008)
*通訊作者 Tel:86-20-85224366;E-mail:tiger@jnu.edu.cn

