不同取代度N-馬來酰低聚殼聚糖的抗氧化活性的研究
孫 濤,銀旭紅,甘建紅,賴克強,周冬香
上海海洋大學食品學院,上海 201306
不同取代度N-馬來酰低聚殼聚糖的抗氧化活性的研究
孫 濤*,銀旭紅,甘建紅,賴克強,周冬香
上海海洋大學食品學院,上海 201306
低聚殼聚糖(COS)酰化得到三種取代度(DS)不同的N-馬來酰低聚殼聚糖衍生物NMCOSA、NMCOSB和NMCOSC,其 DS分別為 0.25、0.67和 0.89。對其結構進行紅外表征。并考察了 NMCOSA、NMCOSB和NMCOSC對羥基自由基(·OH)、1,1-二苯基苦基苯肼(DPPH)的清除活性以及還原能力。結果表明:N-馬來酰衍生物有明顯的抗氧化活性,隨著取代度的升高,N-馬來酰衍生物清除 DPPH的能力以及還原能力增強,即NMCOSC>NMCOSB>NMCOSA;清除·OH的活性順序為NMCOSB>NMCOSA>NMCOSC,即取代度為0.67的表現出最強的活性。這可能與氨基和羥基的數目、取代基團的性質以及清除自由基的機理不同有關。
低聚殼聚糖;N-馬來酰低聚殼聚糖衍生物;取代度;抗氧化
自由基是獨立存在的帶有未成對電子的原子或基團。當機體內自由基過多時,它可以通過氧化作用攻擊生物大分子,產生氧化損傷,從而引起蛋白質損傷、酶失活、膜質過氧化等,導致疾病,加速衰老[1-3]。因此尋找能清除自由基的天然抗氧化劑有著重要的意義。
隨著對多酚和黃酮類物質抗氧化作用的深入研究,天然多糖的抗氧化作用也日益受到廣泛的關注[4,5]。甲殼素是自然界儲量極為豐富的可再生天然多糖,其脫乙酰產物殼聚糖由于分子量大,結構緊密,水溶性差,應用受到限制。而低聚殼聚糖分子量低,水溶性好,理化性質均得以改善[6]。近年來,低聚殼聚糖及其衍生物的抗氧化性日益受到關注[7]。研究表明,低聚殼聚糖醚化衍生物,季銨鹽衍生物都有明顯的抗氧化活性[8,9]。但是對低聚殼聚糖酰化衍生物的抗氧化活性尚未有研究報道。本文通過對低聚殼聚糖進行酰化,制備了不同取代度的N-馬來酰低聚殼聚糖,并研究了其抗氧化活性,為低聚殼聚糖的化學改性進一步研究及其產物在食品及醫藥領域中的應用奠定了基礎。
1 實驗部分
1.1 材料與儀器
低聚殼聚糖,購自浙江金殼生物化學有限公司(凝膠色譜測定其分子量為 5000 Da);魯米諾,DPPH,購自 Sigma公司;其余試劑均為分析純。
磁力攪拌器;pH計;分光光度計;EQUNOX55傅立葉紅外-拉曼光譜儀;流動注射化學發光分析儀(IFF M-D,中國西安制造)。
1.2N-馬來酰低聚殼聚糖衍生物的制備及表征
稱取 5.0 g低聚殼聚糖加入 100.0 mL蒸餾水攪拌溶解,稱取一定量的馬來酸酐,用 20.0 mL丙酮溶解,然后緩慢加入反應器,在室溫下攪拌反應 15 h,然后用丙酮沉淀,過濾,產物用丙酮反復洗滌,最后在 60℃烘干,得到N-馬來酰低聚殼聚糖衍生物[10]。
紅外光譜在 EQUNOX55傅立葉紅外-拉曼光譜儀上進行,采用 KBr壓片法制樣,測定波數范圍為500~4000 cm-1,分辨率為 0.8 cm-1。
1.3 取代度的測定
準確稱量N-馬來酰低聚殼聚糖 0.1000 g置500 mL燒杯內,準確加入 0.1038 mol/L HCl標準溶液 20.00 mL溶解樣品,再加入去離子水 200 mL稀釋、混勻,用 0.4685 mol/L NaOH標準溶液返滴,測定電導率值。做電導率-氫氧化鈉體積關系圖,添加趨勢線,求其回歸方程,從而計算N-馬來酰低聚殼聚糖的取代度[11]。
1.4 DPPH自由基的清除
在裝有 2 mL的濃度為 1×10-4mol/L DPPH無水乙醇溶液的比色管中,加入不同濃度的樣品溶液2.0 mL,搖勻,33℃避光靜置半小時,在 517 nm處測量吸光度Ai。用去離子水代替樣品溶液,得吸光度A0,無水乙醇代替 DPPH,得吸光度 Aj。清除率=[1-(Ai-Aj)/A0]×100%[12]。
1.5 還原能力的測定
還原能力根據文獻測定并稍做改進[13]。取2.0 mL不同濃度的樣品,加入 pH=6.60的 0.2 mol/L磷酸緩沖液 1%及鐵氰化鉀溶液各 2.5 mL,混勻,50℃水浴 20 min后迅速冷卻,加入 2.5 mL 10%三氯乙酸溶液,混勻后在 3000 r/min下離心 10 min,取上清液 2.0 mL,加入 2.5 mL去離子水和 0.5 mL 0.1%的三氯化鐵溶液,靜置十分鐘后在 700 nm處測定吸光度,高吸光度表明高還原能力。
1.6 羥基自由基·OH的清除
用 pH=7.40的 0.05 mol/L KH2PO4-NaOH緩沖溶液分別配制濃度為 6.4×10-4mol/L的魯米諾溶液、0.012 mol/L H2O2和 0.8 mg/mL亞鐵氰化鉀溶液。以緩沖液作為溶劑,配制成系列不同濃度的樣品溶液。用流動注射化學發光分析儀依次測定從稀到濃的樣品溶液,讀出峰面積。清除率 =(A0-Ai)/A0×100%。式中A0為空白溶液峰面積;Ai為樣品溶液峰面積。經 SOD,過氧化氫酶及甘露醇檢測,該體系產生的自由基為羥基自由基·OH[14]。
2 結果與討論
2.1 結構表征
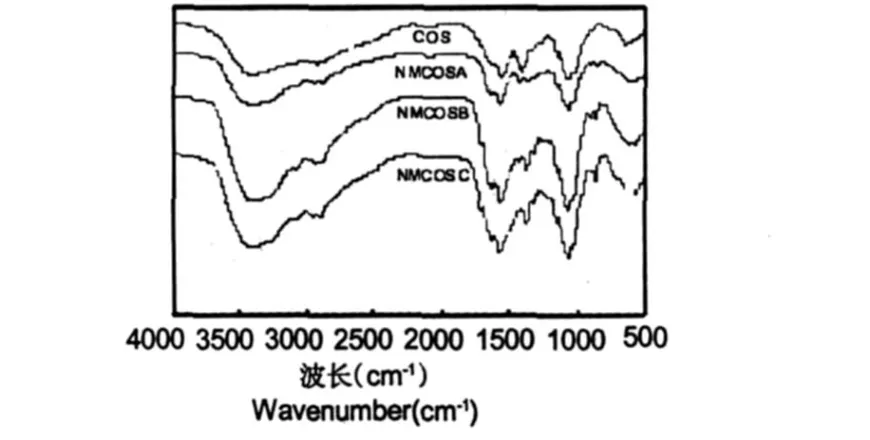
圖1 COS、NMCOSA、NMCOSB和NMCOSC的紅外光譜Fig.1 FTIR spectra of COS、NMCOSA、NMCOSB and NMCOSC
圖 1是 COS以及其N-馬來酰衍生物的紅外光譜圖。四種物質在 3400,1560,1155,1071,1030,894 cm-1附近都有強吸收峰,其中 3400 cm-1附近的吸收峰是殼聚糖分子中的-NH2與-OH的伸縮振動合并峰;1560 cm-1是酰胺Ⅱ的吸收峰;1157 cm-1附近及894 cm-1附近的吸收峰是殼聚糖的β-(1,4)糖苷鍵的特征吸收峰。1073 cm-1和 1023 cm-1處分別是 C3仲羥基和 C6伯羥基的 C-O的伸縮振動吸收峰[18]。
與低聚殼聚糖相比,N-馬來酰低聚殼聚糖有以下幾點變化:(1)3400 cm-1附近的吸收峰發生馬來酰化后變窄,且取代度越高越向低波數方向位移,這由于低聚殼聚糖中-NH2被馬來酸酐取代,-NH2數目減少;(2)1630 cm-1附近出現為共軛烯烴的 C=C振動吸收峰,且取代度越大,吸收峰越強;(3)1707 cm-1附近出現為不飽和羧基因共軛作用的 C=O振動吸收峰;(4)860 cm-1附近為雙建中 C-H面外振動吸收峰,在低聚殼聚糖中未見此吸收峰。這些吸收峰證實了衍生物中馬來酸酐的存在[10]。而衍生物中 1073 cm-1和 1023 cm-1處的 C3仲羥基和 C6伯羥基的 C-O的伸縮振動吸收峰與低聚殼聚糖相比沒有明顯變化,說明衍生物是發生-N位馬來酰化。用電導滴定法測得NMCOSA、NMCOSB和NMCOSC的取代度分別為 0.25、0.67和 0.89。
2.2 DPPH的清除活性

圖2 COS A、NMCOS B和NMCOSC對DPPH自由基的清除Fig.2 Scavenging effect of NMCOSA、NMCOSB and NMCOSC on DPPH radical
DPPH體系是一種廣泛用于評價抗氧化劑自由基清除能力的方法。其主要原理為DPPH接受自由基清除劑提供的電子或氫從而形成穩定分子。圖 2是N-馬來酰衍生物清除 DPPH的曲線圖。所有樣品對DPPH的清除能力隨著濃度的升高而增強。NMCOSA、NMCOSB和NMCOSC對DPPH的半抑制濃度 I C50(清除率達到 50%時所需自由基清除劑的濃度)依次是 0.70、0.64和 0.54 mg/mL。N-馬來酰衍生物清除DPPH的活性大小次序依次為NMCOSC>NMCOSB>NMCOSA,即取代度升高,清除DPPH的活性增強。
2.3 還原能力
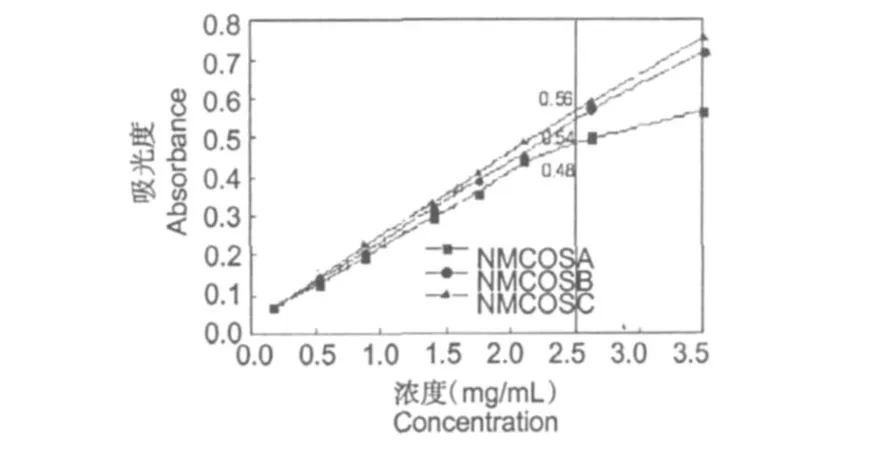
圖3 NMCOSA、NMCOSB和NMCOSC的還原能力Fig.3 Reducing power of NMCOSA、NMCOSB and NMCOSC
還原能力和抗氧化活性之間有著密切的關系[15]。抗氧化物質通過提供電子可阻斷 Fe2+向Fe3+的轉變,表現出一定的還原能力,同樣也可以通過提供電子和自由基反應,表現出抗氧化活性。
圖 3是N-馬來酰低聚殼聚糖衍生物的還原能力曲線圖。由圖可以看出,隨著濃度的升高,所有樣品的還原能力增強。在濃度為 2.5 mg/mL時, NMCOSA、NMCOSB和NMCOSC的吸光值依次是: 0.48、0.54和 0.56。N-馬來酰低聚殼聚糖衍生物的還原能力隨著取代度的升高而增強,即NMCOSC>NMCOSB>NMCOSA。
2.4 羥基的清除活性
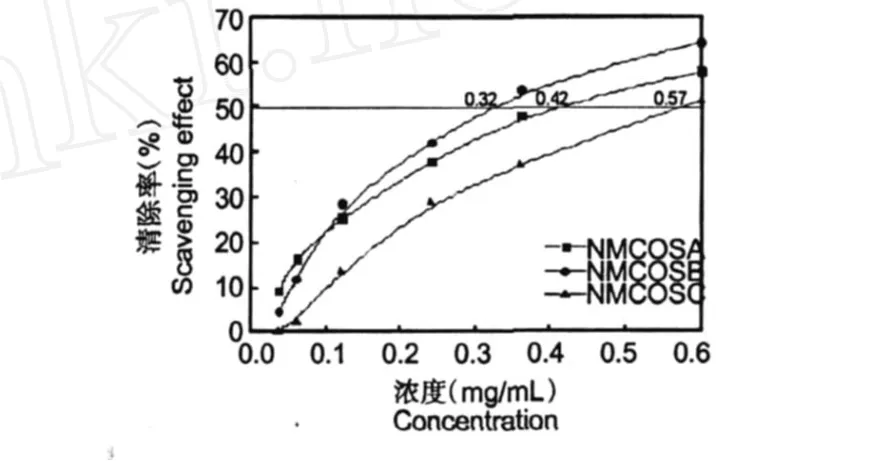
圖4 NMCOSA、NMCOSB和NMCOSC對羥基自由基的清除Fig.4 Scavengingeffects of NMCOSA、NMCOSB and NMCOSC on hydroxyl radical
圖 4是N-馬來酰衍生物對羥基自由基·OH的清除能力曲線圖。從圖上可以看出,隨著樣品濃度升高,NMCOSA、NMCOSB和NMCOSC對·OH的清除能力逐漸增強。NMCOSA、NMCOSB和NMCOSC對·OH的半抑制濃度 IC50分別為 0.42、0.32和0.57 mg/mL。他們清除·OH的活性順序依次是NMCOSB>NMCOSA>NMCOSC。三種N-馬來酰低聚殼聚糖衍生物中,取代度為 0.67的 NMCOSB表現出最強的活性。
N-馬來酰低聚殼聚糖衍生物的對自由基的清除能力及還原能力均受到下面幾個因素的影響:(1)氨基和羥基的數目。在N-馬來酰低聚殼聚糖中,部分氨基被馬來酸酐取代,與 COS相比,氨基數目減少;使抗氧化活性下降。(2)取代基團的性質。低聚殼聚糖引入馬來酰基-COCH2=CH2COO-是吸電子基團,吸電子基團對于自由基的清除起著雙重作用。一方面,它能降低 COS分子中電子云密度,從而降低了分子內、分子間的成鍵幾率,釋放出更多的氨基和羥基與自由基反應;同時,也會使N-H和OH鍵更易斷裂,使氨基和羥基的活性提高,從而有利于清除自由基。(3)-COCH2=CH2COO-會增加氨基和羥基與自由基反應的空間位阻,從而不利于清除自由基。此外,不同的反應機理也會影響N-馬來酰殼聚糖的抗氧化活性。
當取代度從 0.25上升到 0.67,繼而上升到0.89時,N-馬來酰低聚殼聚糖對DPPH的清除活性依次增強,這可能是由于隨著取代度的增大,盡管氨基數目減少,但-COCH2=CH2COO-吸電子作用占主導地位。且DPPH是一種很穩定的自由基,因此受空間位阻的影響不大,故對 DPPH的清除能力隨取代度的上升而增強。同樣,還原能力主要受-COCH2=CH2COO-吸電子作用的影響,故表現出與 DPPH相同的規律。而·OH是一種非常活波的自由基,它對空間位阻很敏感。在對·OH的清除過程中,當取代度從 0.25升高到 0.67,-COCH2=CH2COO-吸電子作用占主導地位,故對·OH的清除能力增大,即NMCOSB>NMCOSA;當取代度繼續升高至0.89時,氨基數目的下降和空間位阻的增加占主導地位,故對 ·OH的清除能力急劇下降,導致NMCOSC<NMCOSA.
3 結論
本實驗通過對低聚殼聚糖進行酰化,制備了三種不同取代度的N-馬來酰低聚殼聚糖,并考察了其抗氧化活性。結果表明:隨著取代度的增加,N-馬來酰低聚殼聚糖清除 DPPH的活性以及還原能力增強;而清除羥基的活性的順序依次為:NMCOSB>NMCOSA>NMCOSC,其中取代度為 0.67的NMCOSB表現出最強的活性。這可能與氨基和羥基的數目、取代基團的性質以及清除不同自由基的機理不同所致。本實驗對殼聚糖衍生物的開發為尋找和應用天然抗氧化劑提供了新的思路。
1 Nordberg J,Arner ESJ.Reactive oxygen species,antioxidants,and the mammalian thioredoxin system.Free Radic B iol and M ed,2001,31:1287-1312.
2 Joshua AS,John CB,Mark AL,et al.Free radical-mediated damage to brain in alzheimer’s disease and its transgenic mouse models.Free Radic B iol and M ed,2008,45:219-230.
3 Sanjeev Sh,Sanjay G.ApigeniN-induced prostate cancer cell death is initiated by reactive oxygen species and p53 activation.Free Radic B iol&M ed,2008,44:1833-1845.
4 Chen Y,XieMY,Nie ShP,et al.Purification,composition analysis and antioxidant activity of a polysaccharide from the fruiting bodies ofGanoder ma atrum.Food Chem,2008,107: 231-241.
5 Yuan QF,Zhang ZQ,Fan ZC,et al.Antioxidant effects and cytotoxicity of three purified polysaccharides fromLigusticum chuanxiongHort.Carbohydr Polym,2008,74:822-827.
6 Peng YQ(彭益強),Zhu LP(朱麗萍),Liu X(劉雯),et al.Study on preparation and ant imicrobial activity of chitosan oligomers.Food Sci(食品科學),2007,28:98-101.
7 Yao Q(姚倩),Sun T(孫濤),Xu YX(徐軼霞).Preparation of chitosan oligosaccharide derivatives and their antioxidant activity.Nat Prod Res Dev(天然產物研究與開發),2008, 20:530-533.
8 Sun T,Yao Q,Zhou DX.Antioxidant activity ofN-carboxymethyl chitosan oligosaccharides.B ioorg&M ed Chem Lett, 2008,18:5774-5776.
9 Guo ZY,Xing RG,Liu S,et al.Synthesis and hydroxyl radicals scavenging activity of quaternized carboxymethyl chitosan.Carbohydr Polym,2008,73:173-177.
10 Wang ZY(王周玉),Jiang ZJ(蔣珍菊),Hu XQ(胡星琪). Synthes is of water-solubleN-maleoyl chitosan.Chin J Applied Chem(應用化學),2002,19:1002-1004.
11 Huo XY(霍秀穎),Zhang XH(張小華),Wu Q(吳清).Determination of substitution degree ofN-succinyl-chitosan by conductometric titration.J Beijing Univ Tradit Chin M ed(北京醫藥大學學報),2007,30:700-702.
12 Lu ZG(陸占國),Guo HZ(郭紅轉),Feng D(封丹). Study on chemical constituent of coriander leaf essential oil and scavenging capacity against the DPPH radical.Food Fer m Indus(食品與發酵工業),2006,32:24-27.
13 Yen GC,Chen HY.Antioxidant activityof various tea extracts in relation to their antimutagenicity.J Agric Food Chem, 1995,43:27-32.
14 Sun T,XieWM,Xu PX.Superoxide anion scavenging activity of graft chitosan derivatives.Carbohydr Polym,2004,58:379-382.
15 Duh PD,Du PC,Yen GC.Action of methanolic extract of mung bean bulls as inhibitors of lipid peroxidsation and noN-lipid oxidative damage.Food and Chem Tox,1999,37:1055-1061.
Antioxidant Activity ofN-Maleoyl Chitosan O ligosaccharide with D ifferent Substituting Degrees
SUN Tao*,YIN Xu-hong,GAN Jian-hong,LA I Ke-qiang,ZHOU Dong-xiang
College of Food Science,Shanghai Ocean University,Shanghai 201306,China
N-maleoyl chitosan oligosaccharides(NMCOSA,NMCOSB and NMCOSC)with different substituting degrees (DS were 0.25,0.67 and 0.89,respectively)were prepared by chemical modification of chitosan oligosaccharide (COS).The chemical structures of the chitosan oligosaccharides derivatives were characterized by FTIR.Their antioxidant activitieswere evaluated by the scavengingof hydroxyl radical(·OH),1,1-Diphenyl-2-picrylhydrazyl radical2,2-Diphenyl-1-(2,4,6-trinitrophenyl)hydrazyl(DPPH)and reducing power.The results indicated that theN-maleoyl chitosan oligosaccharides derivatives have obvious antioxidant activity,the scavenging effects on DPPH and the reducing powerwere all increased with the increasing of the substituting degree:the orders of their scavenging effects on·OH wasNMCOSB>NMCOSA>NMCOSC,the NMCOSB showed the best scavenging effects on·OH.That may be related with the number of the amino and hydroxyl groups,the properties of the substituting groups and the different scavenging mechanis ms against free radicals.
chitosan oligosaccharide;N-maleoyl chitosan oligosaccharide;substituting degree;antioxidant
Q946.91;R285;TS202.3
A
1001-6880(2010)05-0890-04
2009-04-30 接受日期:2009-06-17
上海市教育委員會科研項目 (07zz134);上海市教委重點學科建設項目專項基金 (J50704)
*通訊作者 Tel:86-21-61900363;E-mail:taosun@shou.edu.cn

