鹽酸阿扎司瓊注射液與輸液配伍的穩定性研究
王德旺,王永慶 ,馬坤芳 ,張培培,李子艷
(1.南京醫科大學第一附屬醫院藥劑科,江蘇 南京 210029; 2.南京醫科大學藥學院,江蘇 南京 210029)
鹽酸阿扎司瓊(azasetron hydrochloride)是一種高效、高選擇性的5-HT3受體拮抗劑,1994年在日本率先上市,2001年國產阿扎司瓊被批準在國內上市,臨床主要用于細胞毒類藥物化學治療引起的嘔吐。近年來,國內有大量關于阿扎司瓊用于預防手術麻醉、術后鎮痛所致惡心、嘔吐(PONV)的報道。其注射液說明書要求用40 mL 0.9%氯化鈉注射液稀釋后靜脈注射,而臨床使用時常常為了方便而采用靜脈滴注給藥。鹽酸阿扎司瓊注射液用于預防術后靜脈自控鎮痛(PCIA)引起的PONV時,靜脈持續給藥的效果優于靜脈注射[1]。在我院臨床使用中,曾發生數次在輸液配置后藥液變色的現象。本品為有機堿類藥物的鹽酸鹽,見光易分解,國內尚未見關于鹽酸阿扎司瓊注射液與輸液配伍的穩定性的文獻報道。筆者對鹽酸阿扎司瓊注射液分別在5%葡萄糖注射液和0.9%氯化鈉注射液中不同條件下的穩定性進行了考察,旨在為臨床合理應用提供理論依據,現報道如下。
1 儀器與試藥
2010型高效液相色譜儀(日本島津);LC Solution色譜工作站;Milli-Q Gradient A10型超純水器(Millipore Inc,USA);Delta 320-S型pH計(梅特勒-托利多儀器<上海>有限公司);Storius BP-21d1型電子天平。鹽酸阿扎司瓊對照品(批號為100782-200401,中國藥品生物制品檢定所);鹽酸阿扎司瓊注射液(規格為2 mL∶10 mg,批號為200090202,南京制藥有限公司);5%葡萄糖注射液(規格為100 mL,批號為 S0904056)、0.9%氯化鈉注射液(規格為 100 mL,批號為S0906011)均為上海百特制藥有限公司產品;水為重蒸餾水,其余試劑均為分析純。
2 方法與結果
2.1 含量測定
2.1.1 色譜條件
色譜柱:Shim -pack VP -ODS柱(250 mm ×4.6 mm,0.5 μm);流動相:0.03 mol/L磷酸二氫鈉(用磷酸調pH=3)-乙腈-甲醇(63 ∶17 ∶20);流速:1.0 mL/min;檢測波長:330 nm;進樣量:20 μL。
2.1.2 對照品溶液配制
精密稱取鹽酸阿扎司瓊對照品0.004 19 g,渦旋溶解于4 mL甲醇中,得質量濃度為1.19 g/L的對照品溶液,避光冷藏。
2.1.3 方法學考察
標準曲線制備:精密量取對照品溶液適量,用流動相依次稀釋成質量濃度為 5,10,50,100,200 μg/mL 的溶液,每個質量濃度各取20 μL進樣,按外標法以峰面積(Y)對鹽酸阿扎司瓊質量濃度(X)進行線性回歸,得回歸方程 Y=5 168.1 X+414.96,r=0.999 9(n=5)。結果表明鹽酸阿扎司瓊質量濃度在5~200 μg/mL范圍內與峰面積線性關系良好。
精密度試驗:精密量取對照品溶液適量,用流動相稀釋成質量濃度為10,50,200 μg/mL的溶液,每個質量濃度分別重復進樣5次。結果各質量濃度峰面積的 RSD分別為0.37%,0.46%,0.42%(n=5)。
加樣回收試驗:精密量取對照品溶液適量,用流動相稀釋成質量濃度為10,50,200 μg/mL的溶液,分別加入到已知質量濃度的樣品溶液中,按上述色譜條件依法測定。結果低、中、高質量濃度溶液的回收率分別為 98.7%,99.6%,100.1%,RSD 分別為 0.56%,0.48%,0.45%(n=5)。
2.2 配伍液穩定性試驗
2.2.1 配伍液配制
按照臨床常用量,將鹽酸阿扎司瓊注射液10 mg分別加入到0.9%氯化鈉注射液、5%葡萄糖注射液100 mL中,搖勻,即得質量濃度為100 μg/mL的兩種配伍液。
2.2.2 試驗方法
將上述兩種配伍液分別在室溫(25℃)光照(自然光)、室溫避光、水浴(35 ℃)避光、冷藏(4 ℃)避光條件下放置。于 0,0.5,1.0,2.0,4.0,8.0,24.0 h 時觀察其外觀變化并測定 pH 與含量。
2.2.3 外觀與 pH
兩種配伍液在室溫避光、水浴(35℃)避光、冷藏(4℃)避光條件下,24 h內均呈無色澄明狀,顏色無明顯變化,未見沉淀產生;室溫(25℃)光照(自然光)下,25 min開始出現肉眼可見的淡紅色,顏色逐漸加深至粉紅色。避光條件下配伍液pH變化較小;光照條件下pH顯著下降,0.9%氯化鈉與5%葡萄糖配伍液在4 h內pH分別由 4.93 和 4.40 下降至 4.11和 3.95。pH 變化見圖 1。
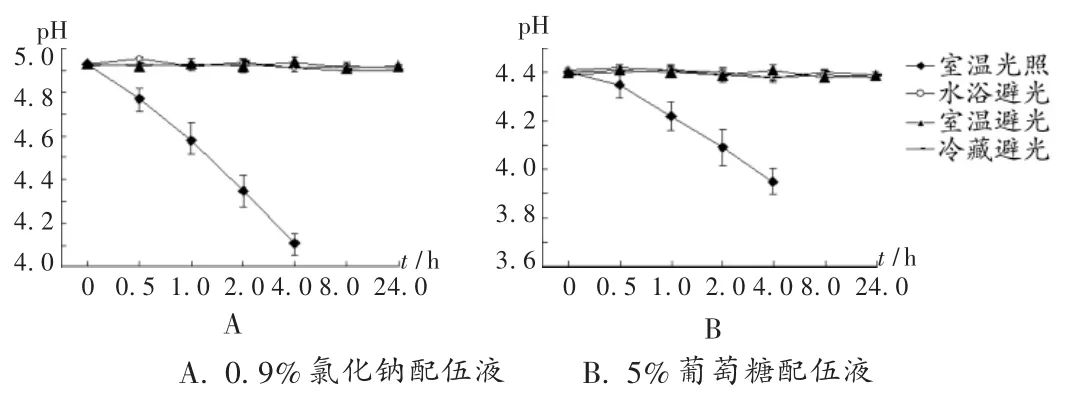
圖1 不同條件下pH變化圖(n=3)
2.2.4 主藥含量測定
配伍后,分別在 0,0.5,1.0,2.0,4.0,8.0,24.0 h 時測定樣品溶液含量,并將測定結果與0 h比較,計算相對百分含量。結果光照條件下,兩種配伍液0.5 h時色譜圖出現雜質峰,雜質峰隨時間推移越來越大,阿扎司瓊主峰越來越小,表明有降解產物產生(見圖2);而其他條件下的色譜圖未出現雜質峰。室溫光照條件下含量下降較快,0.5,1.0,2.0,4.0 h 時 0.9% 氯化鈉配伍液的相對百分含量分別為 77.1% ,61.5% ,45.6% ,30.5% ,5% 葡萄糖配伍液的相對百分含量分別為 76.9% ,63.0% ,45.5% ,34.0%;其他條件下 24 h內含量變化較小,室溫避光、水浴(35℃)避光、冷藏(4℃)避光條件下24 h0.9%氯化鈉配伍液的相對百分含量分別為99.1%,99.1%,98.7%,5%葡萄糖配伍液的相對百分含量分別為99.8%,99.1%,100.0%。結果見圖 3。
3 討論
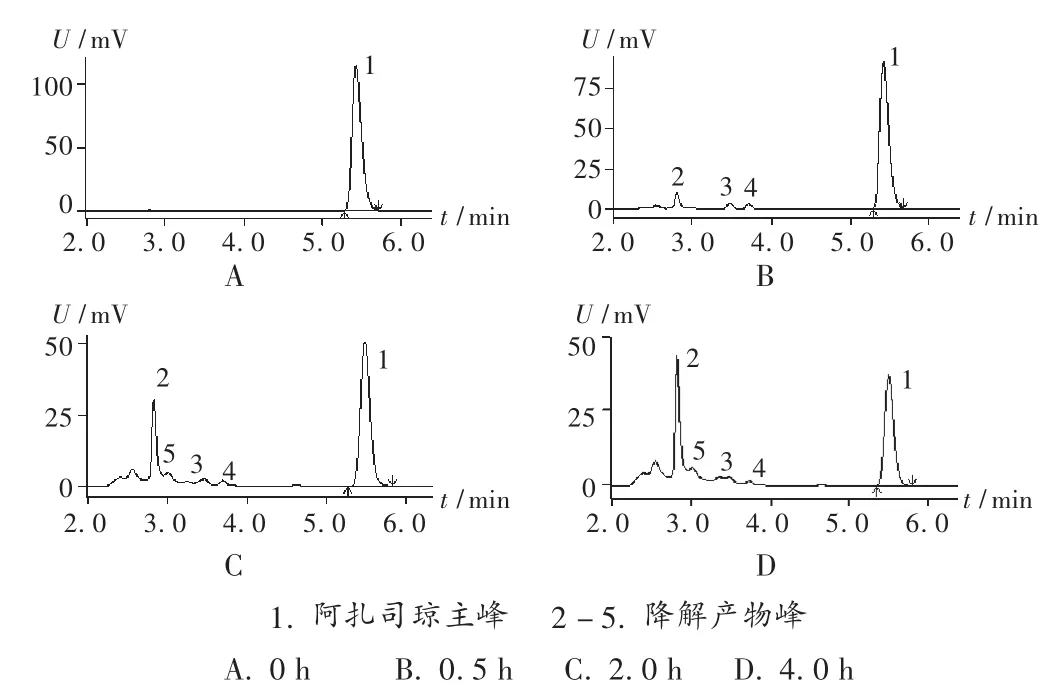
圖2 光照條件阿扎司瓊色譜圖
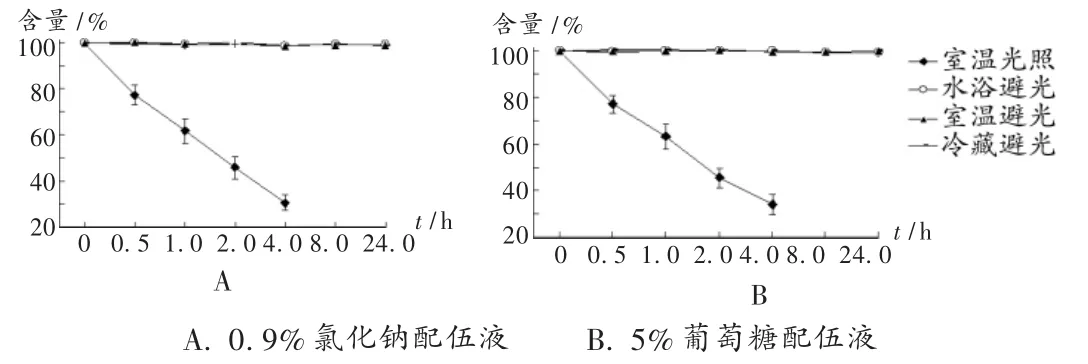
圖3 不同條件下的主藥含量變化(n=3)
鹽酸阿扎司瓊在國內上市較晚,其含量測定方法國內文獻報道較少。文獻[2]報道,采用C18色譜柱測定,色譜峰容易產生拖尾,因而選用氰基鍵合硅膠柱。本研究參照文獻[3]中的色譜條件,采用C18色譜柱測定,在流動相為0.03 mol/L磷酸二氫鈉-甲醇(63∶37,磷酸調pH=3)時,阿扎司瓊的保留時間為7.3 min,但峰形不好;加入適當比例的乙腈后,保留時間縮短為5.4 min,且峰形對稱,分離度也較好。
由文中圖1至圖3可以看出,室溫避光、水浴(35℃)避光、冷藏(4℃)避光條件下,本品在24 h內pH及含量變化較小,表明在4~35℃范圍內,溫度對鹽酸阿扎司瓊在兩種輸液中的穩定性影響較小,且避光條件下24 h內穩定性較好;室溫光照(自然光)條件下,鹽酸阿扎司瓊在兩種輸液中含量下降很快,同時pH、顏色均發生明顯改變,表明鹽酸阿扎司瓊對光照極不穩定。
查閱文獻,未找到有關阿扎司瓊光照降解產物的報道。由于條件的限制,未能對阿扎司瓊的降解產物作進一步分析研究。根據其結構特點及試驗中產生的化學變化分析,其結構中酰胺鍵易斷裂,光照下顏色加深,pH下降,推測主要降解產物可能為胺和羧酸。
臨床使用中曾發生藥液變色的現象,分析原因可能是使用過程中未避光或避光不夠嚴密。由本試驗數據可知,鹽酸阿扎司瓊注射液可與5%葡萄糖注射液、0.9%氯化鈉注射液配伍使用。單從穩定性角度考慮,可以采用靜脈滴注方式給藥,但整個過程必須嚴格避光。
[1]鮑升學,王焱林,張廣雄,等.阿扎司瓊不同給藥方式預防術后靜脈自控鎮痛惡心嘔吐的臨床觀察[J].醫學新知雜志,2006,16(6):340-342.
[2]王 彥.鹽酸阿扎司瓊的HPLC測定[J].中國醫藥工業雜志,1999,30(7):15.
[3]熊 雯,黃毅嵐,張 丹.HPLC測定鹽酸阿扎司瓊氯化鈉注射液的含量及有關物質[J].華西藥學雜志,2008,23(1):96-97.