淺析BDNF改善癡呆老齡鼠記憶障礙CA1區GrayⅠ型突觸結構相關參數的變化
王麗萍,王靖宇,姜長斌
(1.大連大學附屬中山醫院,大連 116001;2.大連醫科大學實驗動物中心,大連 116001 3.大連醫科大學第二臨床醫院,大連 116027)
淺析BDNF改善癡呆老齡鼠記憶障礙CA1區GrayⅠ型突觸結構相關參數的變化
王麗萍1,王靖宇2,姜長斌3
(1.大連大學附屬中山醫院,大連 116001;2.大連醫科大學實驗動物中心,大連 116001 3.大連醫科大學第二臨床醫院,大連 116027)
目的 探討BDNF(Brain derived neurotrophic factor)改善癡呆老齡鼠記憶障礙的機制。方法 利用Morris迷宮試驗觀察腦內微量注射BDNF對癡呆小鼠自發活動和記憶鞏固過程的影響,應用透射電鏡和形態計量學分析癡呆老齡鼠海馬GrayⅠ型突觸的突出結構參數的變化。結果 BDNF使癡呆小鼠在新異環境中的自發活動和探究行為明顯增多;并顯著延長電擊后24 h的步入潛伏期(STL);BDNF使癡呆老齡鼠海馬CA1區GrayⅠ型突觸的體積密度、面積密度、比表面和面數密度較治療前增大,突觸平均面積增大;突出界面曲率、突出間隙寬度、突出后致密物質均較治療前增大,而較正常對照組減小。結論 突觸結構的變化和突出數量的減少是癡呆發病的病理機制之一;BDNF能夠促進突觸重建,改善癡呆老齡鼠的學習記憶。
老年性癡呆;腦源性神經營養因子;海馬 ;突觸
腦源性神經營養因子是神經生長因子家族中的一員;是神經生長和功能活動必須的多肽類因子,存在于神經系統,且能夠在腦內選擇性作用于前腦膽堿能神經元。它對老年性癡呆(Alzheimer's disease)的防治作用受到國內外學者的關注。我們以往的實驗證明[1],NGF可以改善癡呆老齡鼠的學習記憶功能,考慮到學習記憶與神經元突觸改變有關,本工作進一部觀察了BDNF改善癡呆老齡鼠記憶障礙同時,探討相關區域神經突觸的變化。對揭示BDNF在癡呆治療的相關形態學變化中的作用具有重要意義。
1 材料和方法
1.1 實驗對象
本工作選用18月齡90只(SPF)級 ICR小鼠,在大連醫科大學實驗動物中心進行相關實驗[生產許可證號:SCXK(遼)2008-0002使用許可證號:SYXK(遼)2008-0002]。體重48±3.5 g。室溫,自由進食飲水,12 h晝夜。
1.2 實驗方法
以Morris水迷宮試驗測試小鼠空間學習記憶,證實存在智能障礙,并分為用藥組和對照組。
1.3 腦內微量注射
按文獻[2]報道方法進行定位 ,以微量泵進行海馬內注射。
1.4 電鏡樣品制備
取治療組、對照組和正常組各20只,用脊髓離斷法將小鼠處死,使腦組織充分固定取腦。行常規電鏡包埋與軸鉛雙染色,每份標本觀察3張銅網,每張銅網由左上向右下移動,并隨機拍攝5張10000倍顯微照片,在經光學放大至30000倍。
1.5 形態計量方法
在放大30000倍條件下,按鄭富盛方格點陣計數及截距法[2]和龔云等[3]方法對 GrayⅠ型突觸的體積密度(Vv)、面積密度(Sv)、比表面(δ)平均面積(ā)面數密度(NA),突觸界面曲率、突觸間隙寬度及突觸后致密物厚度等結構參數進行計量分析,用 SPSS軟件包統計,求得平均值,標準差,行 t檢驗。
2 結果
2.1 逃避潛伏期比較
行為空間記憶兩組癡呆老齡鼠用藥后自發運動減少,食欲不振,對外界刺激反應遲鈍。治療組術后48 h死亡3只,對照組術后48 h內死亡2只,治療前各組潛伏期延長。治療后對照組無明顯改變。BDNF組治療后潛伏期縮短。表1結果顯示治療組及對照組與正常組比較小鼠均存在空間記憶障礙(P <0.01),海馬注入 BDNF后,行為空間記憶狀況好轉。與對照組及治療前比較相應指標有明顯變化(P <0.01)。

表1 Morris水迷宮檢測癡呆老齡鼠平均逃避潛伏期比較Tab.1 Result of average escape latency(s)in each group of Morris labyrinth test
2.2 癡呆老齡鼠相關突觸參數變化
癡呆老齡鼠海馬CA1區Gray通過表2我們可以看出,突觸的體積密度(Vv)、面積密度(Sv)、比表面(δ)面數密度(NA)較對照均減小,平均面積(ā)較對照組增大。表2結果說明癡呆老齡鼠相關突觸參數,在治療前與正常組比較明顯降低(P<0.01),既突觸丟失。而GrayⅠ型突觸平均面積ā增大,可能癥狀改善的主要原因。

表2 海馬CA1區GrayⅠ型突觸結構參數Tab.2 Intrahippocampal CA1 area GrayⅠ
2.3 突觸結構相關參數的變化
癡呆老齡鼠海馬CA1區GrayⅠ型突觸結構相關參數;治療后突觸界面曲率無明顯變化,突觸間隙變窄,突觸后膜致密物質增加(表3)。學習記憶減退時突觸間隙增大[6]本實驗在癡呆老齡鼠海馬CA1區GrayⅠ型突觸的突觸間隙變寬(圖1),治療后突觸數量增加同時突觸間隙變窄(P<0.01)(圖2)(圖1~2見彩插5)。

表3 小鼠海馬CA1區突觸結構參數的變化Tab.3 Changes of structural parameter of synaptic interface in CA1 in rat
3 討論
BDNF對周圍和中樞神經元有廣泛的作用[4]。BDNF通過與突觸后膜受體結合能促進背根節、三叉神經節、節狀節、三叉神經中腦核等感覺神經元的存活和突起的生長。BDNF通過不同的途徑分別促進不同的基因表達或蛋白合成,發揮著不同的作用[5]。BDNF主要促經胞體的發育與相關報道一致[6]。因此,BDNF對神經元損傷修復與再生起重要作用,具有廣泛的臨床應用價值.BDNF被認為是一種由感覺神經元釋放的順行性營養信息因子來影響NGF和調節感受傷害信息的反應.它可能具有改善智能的作用[7]。外源性 BDNF可以減少脊髓內運動神經元的死亡[8]。BDNF有可能通過其受體而發揮存活與再生效應。
學習記憶功能減退是腦老化的一個重要表現,BDNF與中樞神經系統突觸的結構和功能的可塑性密切相關[2]。衰老時突觸數量減少,結構異常及長時程突觸后電位增強(LTP)的快速衰減,在Alzheimer病患者某些腦區也發生突出數量減少等改變[7]。突觸是神經元之間結構和功能的接觸點,它的結構和功能的完整對于保證神經元獲得信息傳遞、加工和貯存的順利進行是非常重要的。突觸丟失是癡呆學習記憶減退的神經機制之一。突觸平均面積增大,一方面殘留的突觸細胞通過增加自身面積(平均增加40.20%)增加其與受體結合的功能,另一方面胞體增加導致其表面積增加,最終學習記憶狀況得以改善。與正常組比較BDNF組相關突觸結構參數無明顯差異性(P<0.05)說明海馬GrayⅠ區突觸結構明顯改變,從而只能得以改善,BDNF治療癡呆可能會達到治本的目的。
本試驗提示癡呆老齡鼠海馬突觸面數密度、面積密度和體密度下降(P<0.01)與衰老和Alzheimer病腦組織突觸的結構參數變化結果是一致的。突觸界面曲率是突觸結構可塑性的一個重要參數,較大的突觸曲率可擴大接觸面,保證其釋放的遞質到達靶部位,減少向周圍間隙擴散,提高突觸傳遞效應[8]。癡呆老齡鼠突觸界面曲率減小,減少了神經元的接觸面,大大降低了神經信息傳遞的有效性,從而導致學習記憶能力下降。而治療后,曲率變化明顯(P<0.05)胞體增大。受體增加,癥狀改善。
突觸后膜致密物質衰老使海馬CA1突觸后膜致密物厚度減小,提示突觸后膜上受體與離子通道等發生變化,從而在功能上影響突觸傳遞的效率,學習記憶能力減退。BDNF治療癡呆的作用機制可能與其增加突觸結構及相應參數有關,而治療后與正常組比較無顯著差異性說明BDNF對癡呆的治療有效。
我們以往的研究表明,BDNF可以使皮層、海馬區域酶活性恢復[9]。結合本次試驗結果,是否可以推測BDNF可以改善突觸結構,使相應受體與NGF結合,從而發揮生物學作用。另外,本次試驗還提示GrayⅠ型突觸內部分子結構可能發生變化,因此對于進一步在分子水平探討老年癡呆學習記憶障礙的神經病理機制有重要意義。
[1]邱澤文,王麗萍,姜春玲,等.外源性NGF對癡呆老齡鼠P物質與 ChAT-IR表達的影響[J].中國比較醫學雜志,2006,16(12):720-722.
[2]鄭富盛.細胞形態立體計量學[M].北京:北京醫科大學中國協和醫科大學聯合出版社,1990:16.
[3]龔云,馮慎遠.鋅對大鼠學習記憶的影響及其與海馬CA3區和大腦皮質感覺運動區突觸界面結構的相關性研究[J].解剖學雜志,2000,23(1):441.
[4]James RT,Rory C,Vivien W,et al.Axotomy upregulates the anterograde transport and expression of brain-derived neurotrophic factor by sensory neurons[J]Neurosci,1998,18(11):4374-4383
[5]Hyman RA,Hofer M,Barde YA,et al.BDNF is a neurotrophic factor for dopamintergic neurons of substantia nigra[J].Nature,1991,350:230.
[6]劉麗敏,黃海霞.BDNF和NT-3對胚胎大鼠脊髓神經元生長發育的影響[J].首都醫科大學學報,2002,23(3):201-205.
[7]Geinisman Y.Structural synaptic modifications associated with hippocampal LTP and behavioral learning[J].Cerebral Cortex,2000,10(10):952-962
[8]Martone ME,Hu BR,Ellisman MH.Altcrations of hippocampal postsynaptic densitics following transient ischemia[J].Hippocampus,2000,10(5):610.
[9]王麗萍,王海霞,姜長斌,等.腦源性神經生長因子對老齡鼠智能影響的探討[J].中國比較醫學雜志,2007,8:481.
Analyses of the Effects of BDNF on Memory Ability in Dementia Senile Mice’s GrayⅠof CA1 Area
WANG Li-ping1,WANG Jing-yu2,JIANG Chang-bin3
(1.Affiliated Zhong-shan Hospital of the Dalian University,Dalian 116001,China;2.Laboratory Animal Center of the Dalian Medical University,Dalian 116027,China;3.The Second Affiliated Hospital of Dalian Medical University,Dalian 116027,China)
Objective To explore the mechanism of the BDNF on senile dementia mice.Method The senile dementia mice were tested by Morris water maze.The changes of the hippocampus synaptic structural parameters and Gray typeⅠwere studied with transmission electron microscope and morph metric analysis.Result The spontaneous activity and exploratory behavior in the new and abnormal environment were obviously increased.The step-through latency(STL)was prolonged significantly after electrical stimulation.After treatment by BDNF the volume density on area of Gray typeⅠsynapses in CA1 sector of hippocampus were increased significantly,the parameters were decreased compared with the normal mice.Especially,the curvature of synaptic interface,the width of synaptic cleft and the thickness of postsynaptic density were increased compared with the control group,while the parameters were decreased compared with the normal mice.Conclusion The change of the synaptic structure and decrease in the synaptic number is one of the reasons on dementia pathological mechanism.BDNF can promote synaptic reconstruction and improve the memory of senile dementia mice.
Alzheimer’s disease;Brain derived neurotrophic factor(BDNF);Hippocampus;Synaptic
R-33
A
1671-7856(2010)06-0026-03
2010-03-05

圖1 對照組癡呆老齡鼠GrayⅠ型突觸間隙變寬 (電鏡×15000×2)
Fig.1 Synaptic active zone(nm)Was broaden in GrayⅠ (Electric microscope×15000×2)
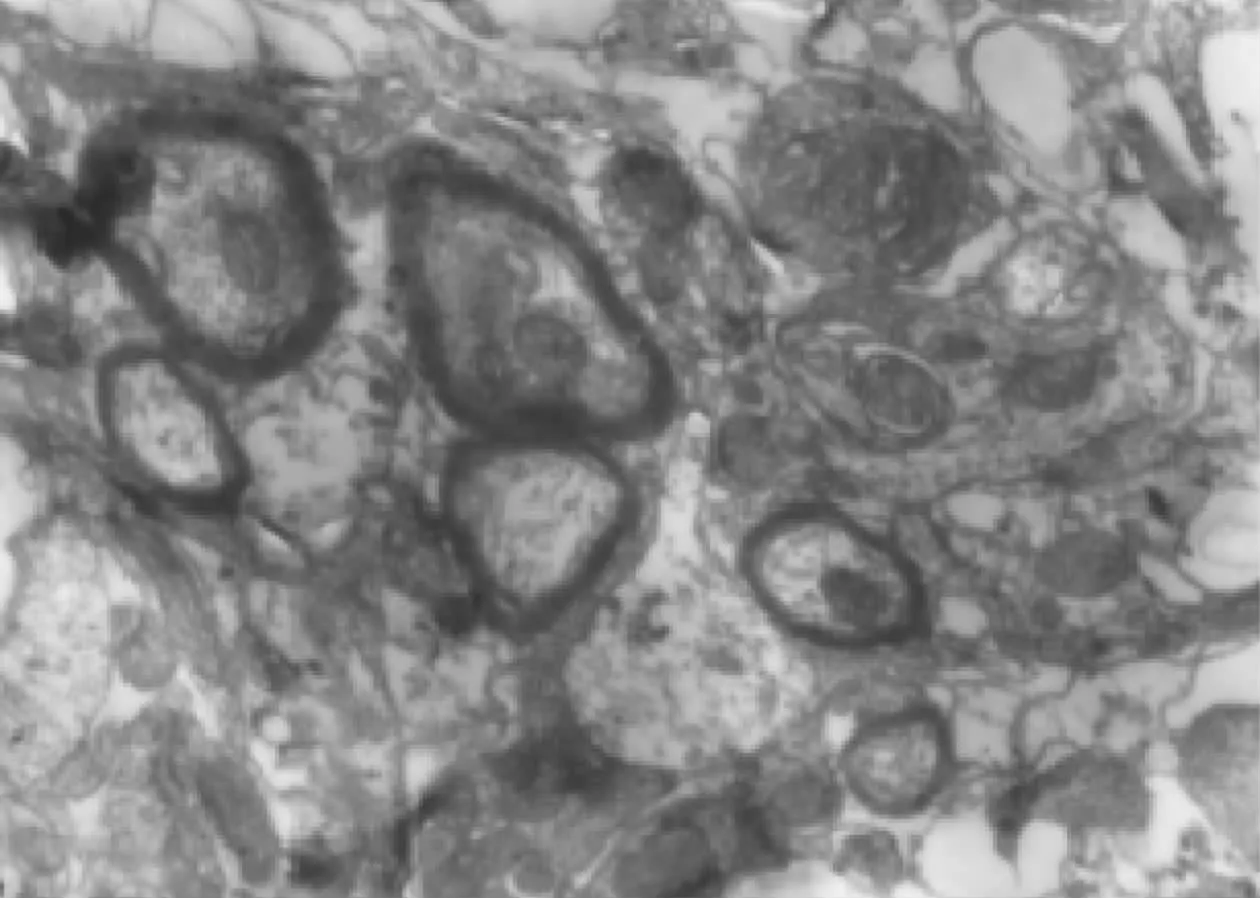
圖2 治療后突觸數量增加同時突觸間隙變窄 (電鏡×15000×2)
Fig.2 Synaptic active zone(nm)Was narroW doWn and synaptic increased in GrayⅠ(Electric microscope×15000×2)
遼寧省科技計劃項目(20054080020大連市科技計劃項目(2005E11SF006)。
王麗萍(1968-),碩士,神經內科副教授,副主任醫師。

